心肌缺血预适应大鼠循环血微囊泡中miRNAs表达谱分析
赵俊玉,祝倩,尚曼,李烨仪,刘淼,王艺璐,吴艳娜,刘艳霞,宋君秋
(天津医科大学基础医学院药理学系,天津 300070)
心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤是导致缺血性心脏病(ischemic heart disease,IHD)患者心肌组织损伤加重的主要原因,缺血预适应(ischemic preconditioning,IPC)被认为是减轻心肌I/R损伤的一种有效治疗策略[1]。研究发现,IPC 能够诱导损伤的心脏细胞释放细胞微囊泡(microvesicles,MVs)和外泌体等细胞外囊泡(extracellular vesicles,EVs),介导IPC 抗心肌I/R 损伤的心脏保护作用[2]。MVs 是细胞受到组织缺氧、氧化损伤等外来刺激后,以出芽的方式从质膜脱落后形成的具有脂质双分子层结构的囊泡,直径100~1 000 nm,主要通过携带 蛋 白 质、 细 胞 因 子、RNAs 和 microRNAs(miRNAs)等物质到靶细胞,发挥细胞间通讯的作用[3]。研究表明,循环血中的miRNAs 主要富集在MVs 等EVs 中,而MVs 作为载体运输miRNAs 时,不仅可以促进miRNAs 在细胞间的信息传递,而且可以保护miRNAs 免受细胞外RNA 酶的降解,提高miRNAs 的稳定性[4]。前期研究已经证明缺血预适应循环血中MVs(IPC-MVs)可能通过抑制心肌细胞内质网应激(endoplasmic reticulum stress,ERS)信号通路,发挥抗心肌I/R 损伤的保护作用[5]。但在基因水平上,IPC-MVs 抗心肌I/R 损伤的作用机制还未完全阐明。本研究利用Microarray 分析IPC-MVs 中含有的miRNAs,并利用生物信息学分析并筛选核心靶基因,拟从miRNAs 水平初步探讨IPC 抗心肌I/R损伤的作用机制。
1 材料和方法
1.1 材料 实验动物:健康雄性Wistar 大鼠,8~10周,体重(230±12)g,由北京维通利华实验动物技术有限公司提供[批号:11400700316046,生产许可证号:SCXK(京)2016-0006]。实验试剂:枸橼酸钠(天津市光复科技发展有限公司),Gene Expression Wash Pack(Agilent),miRNA complete Labeling and Hyb Kit(24×)(Agilent)。仪器:BL-420E 生物功能实验系统及HX-100E 型小动物呼吸机(成都泰盟科技有限公司),Optima L-100XP 制备型超速离心机(Beckman Coulter),HT 7700 透 射 电 子 显 微 镜(transmission electron microscope,TEM,HITACHI 公司),杂交炉(Agilent G2545A),PCR 仪(ABI 9700)。
1.2 方法
1.2.1 大鼠心肌IPC 模型的建立 采用简单随机抽样方法将大鼠随机分为两组:Sham-MVs 组和IPC-MVs 组,每组4 只,麻醉后取仰卧位固定,连接心电图仪,颈动脉插管监测平均动脉压(MAP),而后行开胸处理。(1)Sham-MVs 组:于冠状动脉左前降支(LAD)下穿线后旷置45 min,立即自腹主动脉取血。(2)IPC-MVs 组:LAD 下穿线后稳定15 min,再行缺血5 min/再灌注5 min 的处理,循环3 次后立即自腹主动脉取血。
1.2.2 循环血中MVs 的提取及形态鉴定 上述两组血液样本经枸橼酸钠抗凝,室温条件下,采用两步离心法收集无血小板血浆(platelet-free plasma,PFP):2 600×g 离心15 min;取上清,10 000×g离心5 min。将PFP 置于超速离心管中,4℃,100 000×g离心148 min,弃去上清,获得沉淀即为MVs。用无菌生理盐水重悬沉淀,BCA 法测定蛋白质浓度;分装,-80℃冷冻保存。采用TEM 对MVs 进行形态学鉴定。
1.2.3 MVs 中总RNA 的提取与纯化 采用miRNeasy kit(Qiagen,German),参照说明书标准操作流程提取MVs 中总RNA,利用NanoDrop ND-2000(Thermo Scientific)定量,通过Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA 完整性。
1.2.4 miRNAs 芯片分析 采用Agilent Rat miRNAs,Release 21.0(8*15K,Design ID:070154)芯片进行实验。具体操作如下:分别取两组总RNA 100 ng,定容至2 μL,去磷酸化后,加入DMSO 使其变性,随后用Cyanine-3-CTP(Cy3)进行荧光标记,RNA 纯化后和芯片杂交,55℃,20 r/min,滚动杂交20 h。杂交完成后在洗缸中洗脱。利用Agilent Scanner G2505C(Agilent Technologies)进行图像扫描,获得芯片结果。
芯片结果分析:采用Feature Extraction 软件(version10.7.1.1,Agilent Technologies)处理原始图像提取原始数据。Genespring 软件(version14.8,Agilent Technologies)进行quantile 标准化和差异miRNAs 筛选,上调或者下调倍数变化值(FC)绝对值≥2.0 且P≤0.05 纳入标准。
1.2.5 荧光定量PCR(qRT-PCR)验证差异表达的miRNAs 采用qRT-PCR 技术验证芯片检测结果的可靠性。使用miScript 逆转录酶试剂盒(Qiagen,Germany)进行逆转录,使用QuantiFast® SYBR®Green PCR Kit(Qiagen)对miRNAs 进行定量。PCR扩增条件:95℃变性10 min,95℃变性10 s,60℃退火20 s,72℃延伸15 s,30~45 个循环。每个样品重复3 次。以U6 作为内参,采用ΔΔCt 法进行相对分析。
ΔΔCt=(CtTargetmiRNAs-CtU6)IPC-MVs -(CtTargetmiRNAs-CtU6)Sham-MVs。
1.2.6 差异表达miRNAs 的生物信息学分析 通过TargetScan、miRWalk 和microRNA.org 数据库预测差异表达miRNAs 的潜在靶基因,利用Cytoscape 软件(version3.1.1)建立miRNA-mRNA 调控网络图,分析差异表达miRNAs 与潜在靶mRNA之间的关系。通过DAVID 网站对差异表达miRNAs 的潜在靶基因进行基因本体研究会数据库(GO)、生物学过程(BP)、细胞组分(CC)、分子功能(MF)分析和KEGG富集分析,预测差异表达miRNAs 主要影响的生物学功能或通路。
1.3 统计学处理 采用SPSS17.00 进行统计学分析,符合正态分布的计量数据采用±s 表示,两组间比较采用配对t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 IPC-MVs 的形态学鉴定及RNA 含量分析 通过低温超速离心法可在大鼠循环血中成功提取得到IPC-MVs。负染法处理IPC-MVs 后,于TEM 下观察,IPC-MVs 呈圆形或椭圆形的膜性结构,平均直径100~1 000 nm,其内容物中未见明显的细胞器结构(图1A)。
RNA 定量结果显示,IPC-MVs 组中含有的总RNA 浓度为(1.13±0.06)g/ L,其中miRNAs 的含量占其总RNA 的(57.00±4.24)%,Sham-MVs 组中含有的总RNA 浓度为(1.88±1.00)g/L,miRNAs 的含量占总RNA 的(53.00±2.05)%(图1B)。
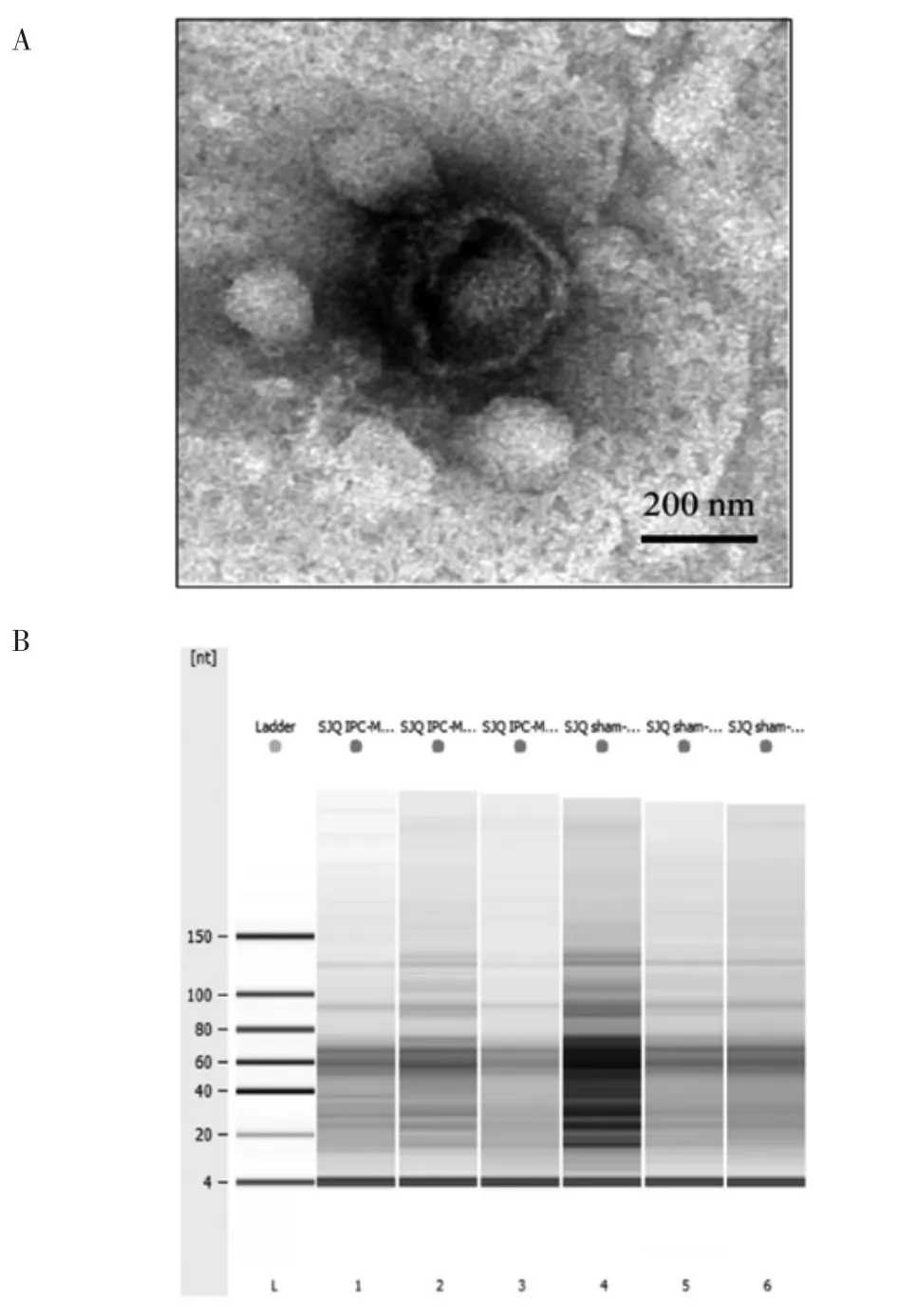
图1 IPC-MVs 的形态学鉴定及RNA 含量分析Fig 1 Identification of morphology and RNA content analysis of IPC-MVs
2.2 循环血MVs 中差异表达miRNAs 的筛选及qRT-PCR 验证 采用Microarray 筛选循环血IPCMVs 组和Sham-MVs 组中差异表达的miRNAs。选取P<0.05,差异倍数(Fold change)绝对值≥2 且具有统计学意义的miRNAs 定义为显著性差异表达的miRNAs。聚类分析结果显示,与Sham-MVs 组相比,IPC-MVs 中有5 个表达差异显著的miRNAs(P<0.01,FER<0.05)(图2A),其中miR-1-3p、miR-378b、miR-133a-3p 和miR-133b-3p 表达显著上调,miR-702-3p 表达显著下调(图2B)。
qRT-PCR 结 果 显 示,miR-1-3p、miR-378b、miR-133a-3p、miR-133b-3p 和miR-702-3p 在IPC-MVs 组和Sham-MVs 组中均有表达。与Sham-MVs 组相比,miR-1-3p(t=3.194)、miR-133a-3p(t=3.002)、miR-133b-3p(t=3.389)显著上调,表达趋势与芯片结果一致。但miR-378b、miR-702-3p表达与芯片结果趋势相反,表现为miR-378b(t=4.455)下调,miR-702-3p(t=6.443)上调(图2C)。芯片检测与qRT-PCR 共同验证的结果表明,循环血MVs 中差异表达显著的miRNAs 共3 个:miR-1-3p、miR-133a-3p 和miR-133b-3p,且其在IPC-MVs 中的表达量均显著高于Sham-MVs。
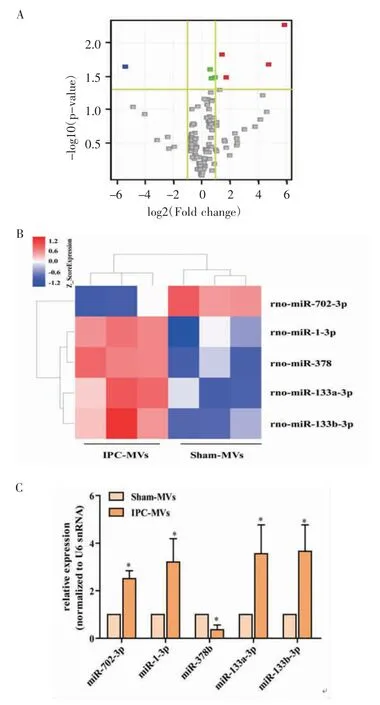
图2 循环血中MVs 差异表达miRNAs 的筛选及qRT-PCR 验证Fig 2 Screening and qRT-PCR validation of miRNAs differentially expressed in MVs of circulating blood
2.3 差异表达miRNAs 的靶基因预测 通过TargetScan、miRWalk 和microRNA.org 网站对差异表达显著上调的3 个miRNAs 进行靶基因预测,共得到86 个潜在靶基因(图3A)。为进一步探究这些潜在靶基因与疾病的关系,利用Cytoscape 软件建立miRNA-mRNA 网络调控图(图3B),通过度值(Degree)大小筛选核心靶基因,并利用STRING 数据库构建靶基因之间的PPI 网络,Cytoscape 可视化分析结果显示度值排名前10 的核心靶基因为:Ntrk2、Rasd2、Igf1、Vamp2、Eif4a1、Gnai3、Sumo1、Cacna1b、Camk4、Bcl2l1(图3C)。其中Ntrk2、Igf1、Gnai3、Bcl2l1 均与心肌I/R 损伤密切相关,而且与miR-1-3p、miR-133a-3p、miR-133b-3p 均有潜在的靶向关系。
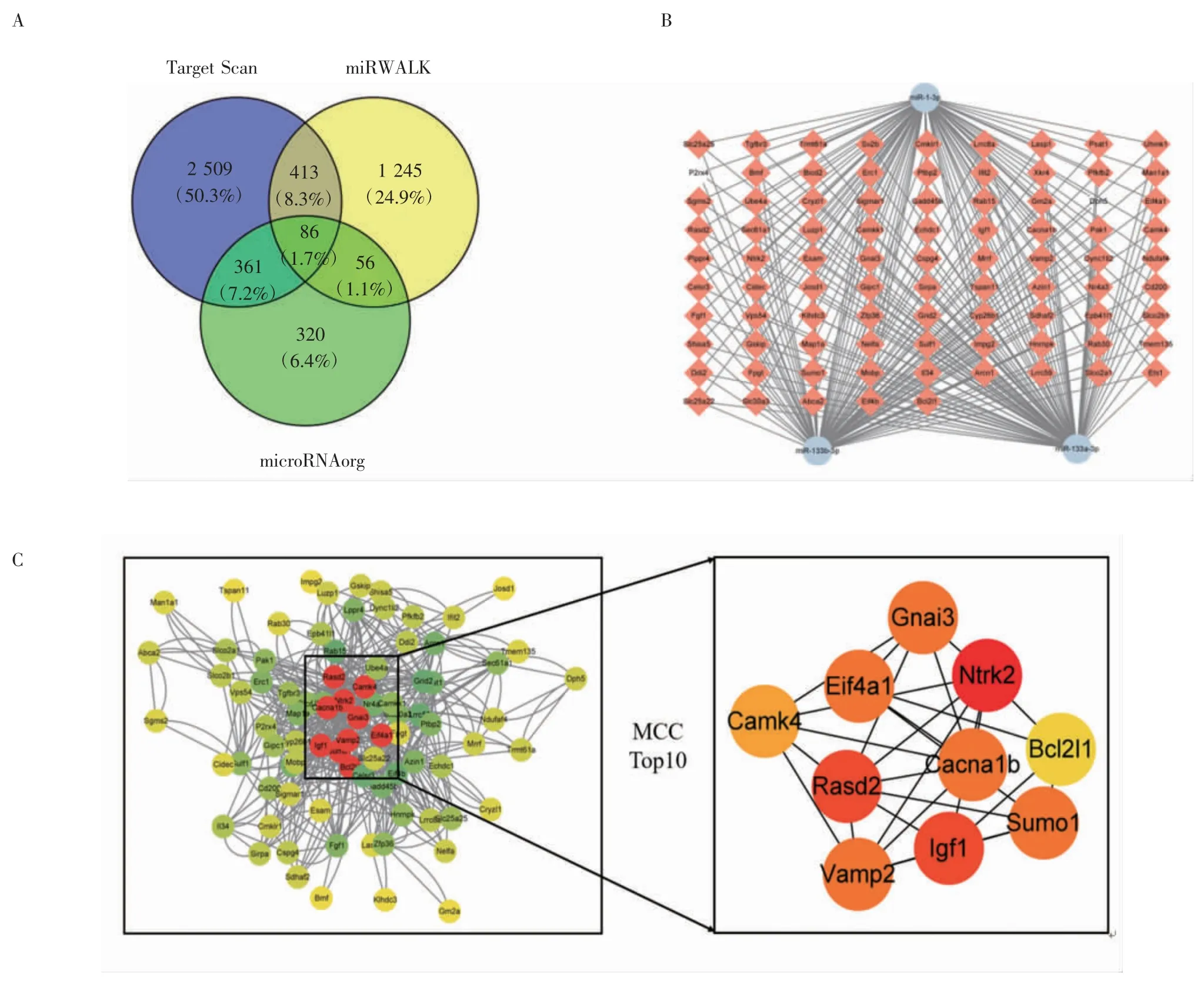
图3 差异表达的miRNAs 靶基因预测Fig 3 Target genes prediction of differentially expressed miRNAs
2.4 GO 和KEGG 通路富集分析 进一步对筛选出的86 个潜在靶基因进行生物学功能分析。GO 分析结果显示,这些靶基因主要参与33 个生物学过程(图4A)、25 个细胞成分的组成(图4B)和11 个分子功能(图4C)。其中前10 个核心靶基因的生物学过程主要富集在细胞增殖的正向调节、小GTP 酶介导的信号转导、蛋白质运输、应对缺氧反应和细胞对胰岛素刺激的反应等;细胞成分主要富集在细胞质、膜、细胞外泌体、胞质和细胞连接等。分子功能主要富集在蛋白结合、肌凝蛋白结合、钙调蛋白结合和蛋白激酶结合中。KEGG 信号通路富集结果显示,这些差异表达的miRNAs 靶基因显著富集在丝裂原活化蛋白激酶(MAPK)信号通路和Ras 信号通路(图4D)。其中MAPK 信号通路涉及核心靶基因Ntrk2、Cacna1b,Ras 信号通路涉及核心靶基因Igf1、Bcl2l1。
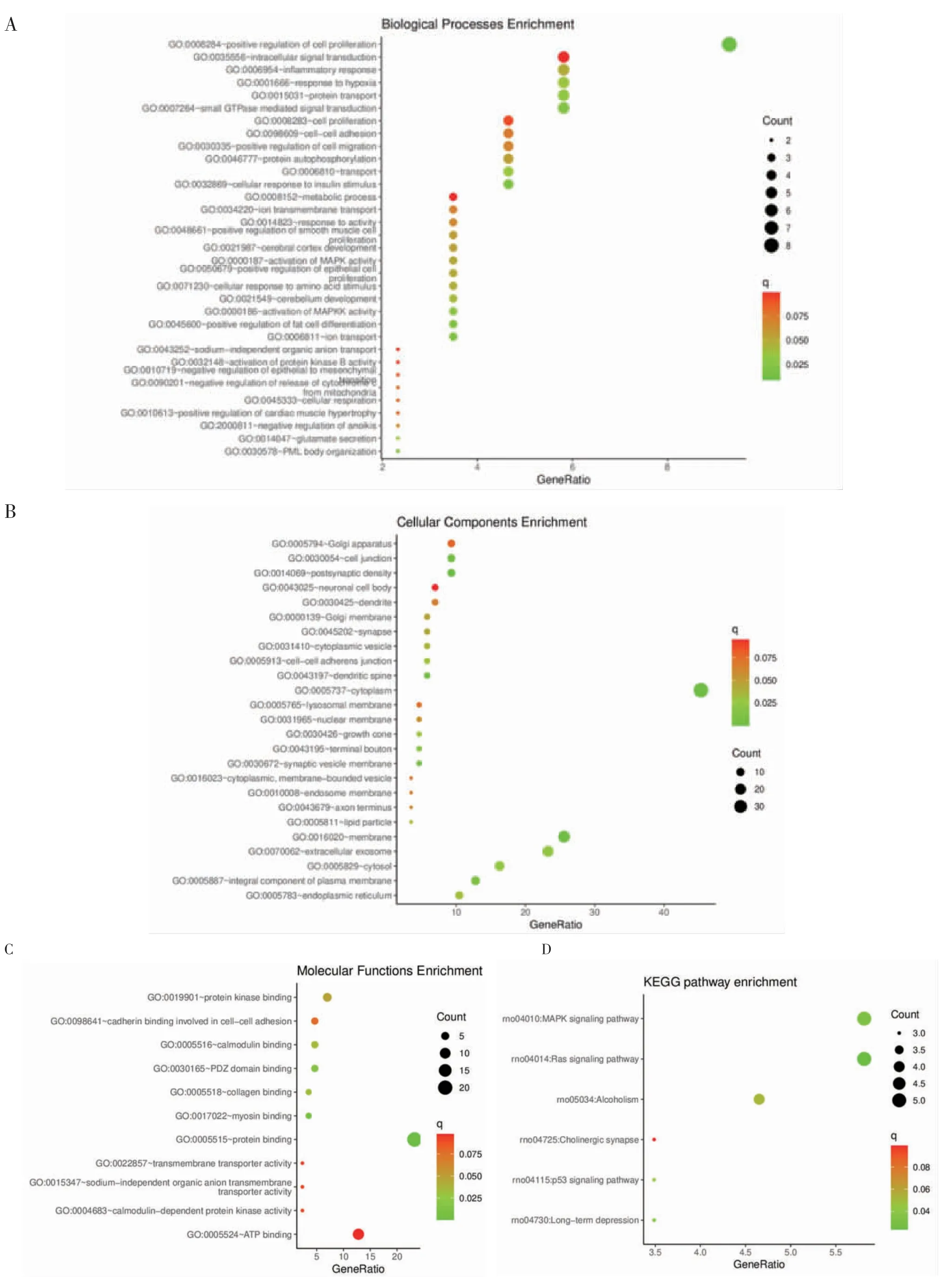
图4 差异表达的miRNAs 靶基因GO 和KEGG 分析Fig 4 GO and KEGG analysis of differentially expressed miRNAs target genes
3 讨论
近年来研究发现,MVs 参与调控IPC 的心脏保护作用。MVs 从细胞质膜脱落过程中会携带许多母体细胞的活性物质,而不同的细胞类型、不同的刺激因素,MVs 释放时所携带的活性物质组成有所不同。在心肌缺血或缺氧期间,心肌组织中某些特定miRNAs(如miR-1、miR-133、miR-139、miR-208 等)的表达迅速受到干扰,干预心肌缺血性损伤的诊断和治疗[6]。作为有效载体,在缺血性心脏病患者循环血中的MVs 可以将具有生物学功能的miRNAs 转运至内皮细胞、心肌细胞、平滑肌细胞或成纤维细胞内,通过与靶细胞受体结合而发挥生物学效应[7]。本实验采用梯度差速离心法,成功地从循环血样本中提取到IPC-MVs 和Sham-MVs,TEM 观察到MVs呈现圆形或椭圆形的双层膜囊泡样结构。提取两组MVs 中总RNA,结果显示IPC-MVs 和Sham-MVs 中均含有一定浓度的RNA,其中miRNAs 的含量平均占总RNA 的50%以上,表明IPC-MVs 可以是miRNAs的运输载体,为IHD 提供了一种新的治疗策略。
为进一步探究IPC 处理对循环血MVs 中miRNAs 表达的影响,采用Microarray 对IPC-MVs 及Sham-MVs 中所含miRNAs 进行初步差异筛选。结果显示,两组MVs 中5 种miRNAs 表达有显著差异。与Sham-MVs 相比,IPC-MVs 中miRNAs 显著上调4 个:miR-1-3p、miR-133a-3p、miR-133b-3p、miR-378b,下调1 个:miR-702-3p。为进一步分析Microarray 结果的可靠性,本研究采用qRT-PCR 进行验证,结果显示,IPC-MVs 中miR-1-3p、miR-133a-3p、miR-133b-3p 相对表达量显著升高,与Microarray 结果一致。由于miR-378b 和miR-702-3p 芯片检测与qRT-PCR 验证结果不一致,可能因为这两个miRNAs 在循环血MVs 中含量较低,导致检测结果的不稳定性,暂不纳入本实验的后续研究。研究显示,这些差异表达显著上调的miRNAs 均与心血管疾病的发生、发展有一定的关联。MiR-133a-3p 和miR-133b-3p 是心肌组织中特异性表达的miRNAs,具有调节心肌细胞分化、增殖和成熟的作用。当发生缺血性损伤时,心肌内miR-133a-3p和miR-133b-3p 显著降低。心脏祖细胞中过表达的miR-133a-3p 可以促进新生血管的形成和心肌细胞的增殖,显著改善心肌梗死大鼠的心脏功能[8];通过抑制巨噬细胞迁移因子来上调急性心肌梗死大鼠模型中miR-133a-3p,间充质干细胞来源的外泌体可有效促进血管生成、抑制细胞凋亡、减少心肌纤维化面积和改善心脏功能[9]。彭兴等[10]体外和体内研究表明,增加I/R 损伤大鼠或H/R 心肌细胞中miR-133b-3p 的表达,可以显著抑制心肌细胞凋亡和活性氧簇积累。表明miR-133a-3p 和miR-133b-3p 的过表达在心肌I/R 损伤中具有较高的治疗价值。心肌特异性miR-1-3p 在心肌细胞生长中发挥关键的调节作用。促进miR-1-3p 的释放可以有效增强间充质干细胞(MSC)的心脏分化能力,恢复梗死心肌功能[11]。但也有研究显示,miR-1-3p 具有促心肌细胞凋亡的作用,显著降低I/R 处理大鼠心脏中抗凋亡蛋白Bcl-2,增加心肌损伤[12]。因此,miR-1-3p 的过表达是否可以作为IPC-MVs 心肌I/R 损伤的治疗靶标有待进一步研究。本实验发现,与Sham-MVs 组相比,IPC-MVs 组中miR-133a-3p、miR-133b-3p 及miR-1-3p 表达显著升高,显示了IPC 处理产生的IPC-MVs 通过携带这些特异性的miRNAs 作用于靶细胞,升高损伤心肌组织中的miRNAs 水平,从而减轻心肌I/R 损伤的可能性。
靶基因预测结果显示,miR-1-3p、miR-133a-3p、miR-133b-3p 的潜在靶基因共86 个,利用Cytoscape 软件筛选出4 个与心肌I/R 损伤相关的共同核心靶基因:Ntrk2、Igf1、Gnai3 和Bcl2l1。生物学功能分析显示,这些潜在靶基因的表达产物主要富集在细胞质中,参与细胞增殖的正向调节、小GTP酶介导的信号转导、蛋白质运输、应对缺氧反应和细胞对胰岛素刺激的反应等生物学过程,主要参与MAPK 信号通路和Ras 信号通路,与心血管疾病的发生和发展密切相关。Ntrk2 又称为原肌球蛋白相关激酶B(tropomyosin-related kinase B,TrkB),是神经营养酪氨酸受体激酶家族的成员之一,通过调节MAPK、Ras、磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(Akt)和钙信号通路,在IHD 中发挥重要的作用。Gong 等[13]研究显示,过表达心肌保护蛋白Caveolin-3,可以激活下游TrkB 信号通路,减轻糖尿病引起的心肌I/R 损伤。激活TrkB 信号通路,可以有效抑制H2O2诱导的H9c2 细胞线粒体过度分裂,从而增加细胞活力,减少细胞凋亡[14]。Igf1 是一种多功能生长因子,可以激活PI3K/Akt 信号通路促进细胞增殖和存活[15]。通过抑制Igf1 降解,骨髓间充质干细胞以缺氧诱导因子-1α 依赖机制,显著增加梗死心肌血管的生成,改善心脏功能,提高急性心肌梗死后干细胞治疗的有效性[16]。Gnai3 是多种跨膜信号通路的调制者和转导者,参与调节细胞内Ca2+信号级联反应,改善心力衰竭大鼠的心脏重塑[17]。Bcl2l1 是位于线粒体外膜的抗凋亡蛋白Bcl-2 家族成员之一,具有控制线粒体活性氧的产生和细胞色素C 释放的生物学功能,在I/R 诱导的心肌损伤中发挥抗凋亡作用[18]。本实验前期研究表明,IPC-MVs 主要通过上调心肌组织中Bcl-2 的表达,下调Bax 和降低caspase-3 的活力,减轻I/R 大鼠心肌损伤[19]。表明IPC-MVs 通过抑制心肌细胞内I/R 诱导的细胞凋亡通路,发挥心脏保护作用。因此,在IPC-MVs 中表达显著升高的miRNAs(miR-1-3p、miR-133a-3p、miR-133b-3p)可能通过调控Ntrk2、Igf1、Gnai3、Bcl2l1 的表达,影响心肌细胞的增殖、存活和血管生成等生物学进程,进而发挥抗心肌I/R 损伤的保护作用。本研究发现,循环血IPC-MVs 与Sham-MVs 携带的miRNAs 确实存在明显的差异表达,差异表达的miRNAs 与I/R损伤时心肌保护作用相关,这为IPC-MVs 通过转运miRNAs 治疗心肌I/R 损伤提供了理论依据,深入的机制还需进一步研究。

