CD24 通过调节肝内Ly6Clo 巨噬细胞亚群中PDGF-B 的分泌抑制肝纤维化进程
靳悦,汪河,李明威,张学军
(天津医科大学基础医学院免疫学系,天津 300070)
肝纤维化是肝脏损伤后细胞外基质过度沉积与异常分布的修复反应,是各种慢性肝病向肝硬化发展过程中的关键阶段[1]。研究证明肝内巨噬细胞是肝纤维化进程及转归的重要免疫细胞[2-3],单核来源巨噬细胞被招募到受损的肝脏后,可通过分泌转化生长因子-β(transforming growth factor-β,TGF-β)等促纤维化因子介导的肝星状细胞活化、分化和增殖,进而促进慢性纤维化进程[4]。
血小板衍生生长因子(platelet derived growth factor,PDGF)是一种促进肝星状细胞分裂和增殖的生长因子,分为PDGF-A、B、C 和D 4 种不同亚型[5-6],其中PDGF-B 是促进纤维化和HSC 增殖的关键细胞因子,它的主要受体PDGFR-β 在活化的HSC 上显著上调[7-8]。在近几年的纤维化机制研究中,PDGF信号通路已被认为是与HSC 活化和纤维化进展相关的重要通路[9-10]。
CD24 是一种糖基磷脂酰肌醇锚定分子[11],由多种免疫细胞表达[12]。CD24 也是一种重要的炎症负反馈分子,在肝损伤和抗肿瘤先天免疫反应中发挥重要作用[13-14]。本研究利用阻塞性胆汁淤积引起的肝纤维化动物模型探讨了CD24 分子是否通过调节肝内巨噬细胞分泌PDGF-B 进而延缓纤维化进程。
1 材料和方法
1.1 材料
1.1.1 实验对象及分组 C57BL/6J 小鼠(购自北京斯贝福生物技术有限公司) 与CD24 基因敲除(CD24-/-)小鼠在天津医科大学实验动物中心共同饲养。各基因型均采用6~8 周龄,体重18~20 g 的雌性小鼠。各基因型均分为造模组与假手术组,每组5 只,造模组进行胆总管结扎(BDL)诱导小鼠纤维化,假手术组和造模组处理相同但不结扎胆总管,作为对照组,术后饲养于相同的环境,术后7 d 处死小鼠。
1.1.2 主要试剂和仪器 石蜡切片机购自leica,QPCR 仪LightCycler96 购自Roche 公司,Trizol 购自美国Invitrogen 公司,反转录酶试剂盒购自美国Promega公司,SYBR Green 购自Genstar,Percoll 购自英国GE Healthcare 公司,Ⅳ型胶原酶购自Sigma,流式抗体购自美国eBioscience公司,Western印迹抗体购自SantaCruz。
1.2 实验方法
1.2.1 BDL 小鼠模型的构建 手术组按照4 μL/g腹腔注射10%水合氯醛溶液进行麻醉,之后刮去腹壁周围绒毛暴露皮肤,消毒后使用手术刀沿腹中线切开腹壁,暴露腹腔,找到胆总管用消毒后的手术线结扎,最后缝合腹壁。术后小鼠饲养于消毒后的笼子里,置于温暖的环境中。
1.2.2 肝组织的病理染色 冷PBS 灌注肝脏,取下的肝脏在10%甲醛溶液中固定至少24 h,依次进行不同浓度梯度的酒精脱水,浸蜡6~8 h 后包埋。用石蜡切片机进行5 μm 厚度的切片,60℃烤片1 h 后进行HE和天狼星红染色,其中,苏木素染色3 min,分化液30 s,伊红1 min,天狼星红染色1 h,染色完成后中性树胶封片,在Nikon 90i 显微镜下拍照,每张片子选取5 个视野,用image J 软件统计阳性区域面积进行比较。
1.2.3 免疫印迹 将液氮速冻的肝组织加入适量裂解液,置于冰上,使用手持组织破碎仪将组织打成匀浆,再经超声破碎仪对组织匀浆进行超声破碎,超声15 s,停10 s,循环3 次。将超声后的样品离心后转移上清至新的EP 管,加入Loading buffer 后5 min,100℃变性。加载等量的蛋白通过10%SDS-PAGE 分离,然后转移到PVDF 膜上,300 mA 转膜2 h,用含5%BSA 的TBST 缓冲液封闭1 h,然后用相应的抗体孵育过夜。用对应的二抗室温孵育1 h,洗膜3~5 遍。α-SMA(1∶500),β-actin(1∶500),辣根过氧化物酶标记的二抗(1∶5 000),通过化学发光液检测抗体条带。
1.2.4 定量-PCR 将液氮速冻后的肝组织加入1 mL Trizol 裂解,培养皿中的细胞加入600 μL Trizol裂解,异丙醇沉淀法提取RNA,用分光光度计测定RNA 浓度后,每个样品取1~2 μg,用反转录试剂盒(Promega)进行反转录。将得到的cDNA 进行10 倍稀释,按照cDNA 4.5 μL,引物0.5 μL,SYBR Green 5 μL 的体系使用LightCycler96 运行程序。具体的程序为:预变性:95℃,300 s;设置50 个循环:变性:95℃,15 s;退火:60℃,30 s;延伸:72℃,30 s;溶解:95℃,10 s,65℃,60 s,97℃,1 s;冷却:37℃,30 s。以Actin 基因为内参,用2-ΔΔCt计算结果,所有用到的引物序列见表1。反转录后的样品加入SYBR Green 嵌合荧光染料并使用LightCycler96 进行QPCR 检验。

表1 定量-PCR 所用引物序列Tab 1 Primer sequence used for Q-PCR
1.2.5 制备肝内巨噬细胞与星状细胞 肝组织依次灌注EGTA 溶液、链酶蛋白酶溶液和Ⅳ型胶原酶溶液,将肝脏在消化液中剪碎,37℃、160 r/min 消化15 min,将消化好的肝脏通过70 μm 的筛网过滤,4℃,50×g,3 min,多次离心去除肝细胞。4℃,500×g,8 min 离心2 遍弃上清,用1×PBS 与预先配置的Percoll 原液混合成50%和25%的Percoll,用25%Percoll重悬细胞后缓慢滴加到50%Percoll 上,2 000 r/min,制动0 离心30 min,取Percoll 中间层细胞即为肝内巨噬细胞。将滤过的单细胞悬液4℃,580×g,离心10 min,弃上清到10 mL,加120 μLDNaseⅠ重悬,补GBSS/B 至50 mL,4℃,580×g,离心10 min,弃上清至10 mL加120 μL DNaseⅠ,将细胞悬液平均分到两个15 mL管中,加GBSS/B 至8 mL,再加入4 mL Nycodenz,混匀后在细胞悬液上加1.5 mL GBSS/B,制动0,1 380×g,4℃,离心17 min,取白膜层即为肝星状细胞。
1.2.6 制备肝非实质细胞(NPCs)悬液 步骤同提取肝内巨噬细胞,弃上清留底部沉淀后,将10×PBS与预先配置的Percoll 原液混合成30%Percoll 并重悬细胞,450×g,20 min 离心留下最底层细胞,冷ACK进行红细胞裂解,裂解完成后洗两遍重悬计数。
1.2.7 流式细胞术检测 制备肝非实质细胞悬液后,每管取1×106个细胞,用CD16/32 抗体4℃封闭15 min,之后再进行细胞表面染色30 min。所用抗体如下:Apc-cy7 Anti-mouse CD45、FITC Anti-mouse Ly6G、Percp-cy5.5 Anti-mouse CD11b、APC Antimouse F4/80、PE-cy7 Anti-mouse Ly6C、PE Antimouse CD24。使用BD FACS CantoⅡ流式分析仪进行检测。Flowjo 10.6.2 软件对实验结果进行分析。
1.2.8 巨噬细胞亚群分选 制备肝非实质细胞悬液后,将悬液转移到无菌流式管中,4℃,500×g,离心5 min,冰上封闭15 min,再用标记抗体Apc-cy7 Anti-mouse CD45、FITC Anti-mouse Ly6G、Percp-cy5.5 Anti-mouse CD11b、APC Anti-mouse F4/80、PE-cy7 Anti-mouse Ly6C 染色30 min,用流式PBS 洗两遍后用FACS AriaⅡ流式分选仪分选巨噬细胞亚群,收集到无菌管中。
1.2.9 共培养 将提取的原代星状细胞种于6 孔板,于37℃,5%CO2的细胞培养箱中培养。将提取的巨噬细胞亚群加入提前架好的Transwell 培养小室的6 孔板中,培养条件相同。在原代星状细胞培养两天贴盘稳定后,将Transwell 小室放置于培养原代星状细胞的6 孔板上,共培养3 d,提取RNA 用于Q-PCR 检测。
1.3 统计学处理 使用Graphpad Prism8 进行数据汇总、分析、制图,数据服从正态分布,以±s 表示,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 BDL 诱导的CD24-/-小鼠肝纤维化程度加重 首先建立了BDL 诱导的小鼠纤维化模型,HE 结果显示,在造模组中,与WT 小鼠相比,CD24-/-小鼠肝组织炎性细胞浸润增多,汇管区增生更加明显,而假手术组中两种基因型小鼠的肝脏则没有明显病理改变(图1A)。天狼星红染色结果显示,造模组CD24-/-小鼠的肝纤维化程度更严重(P<0.01),而假手术组无明显差别(P>0.05,图1B)。Q-PCR 结果显示,造模组CD24-/-小鼠的肝纤维化指标α-SMA(P<0.05)、Col1α1(P<0.01)和Timp-1(P<0.000 1)与WT 小鼠相比有显著升高,假手术组无明显差别(P>0.05,图1C)。Western 印迹结果显示,肝纤维化标志物α-SMA 在CD24-/-小鼠的肝组织中表达明显高于WT 小鼠(图1D),上述结果提示,CD24-/-小鼠的肝损伤和肝纤维化程度明显加重。
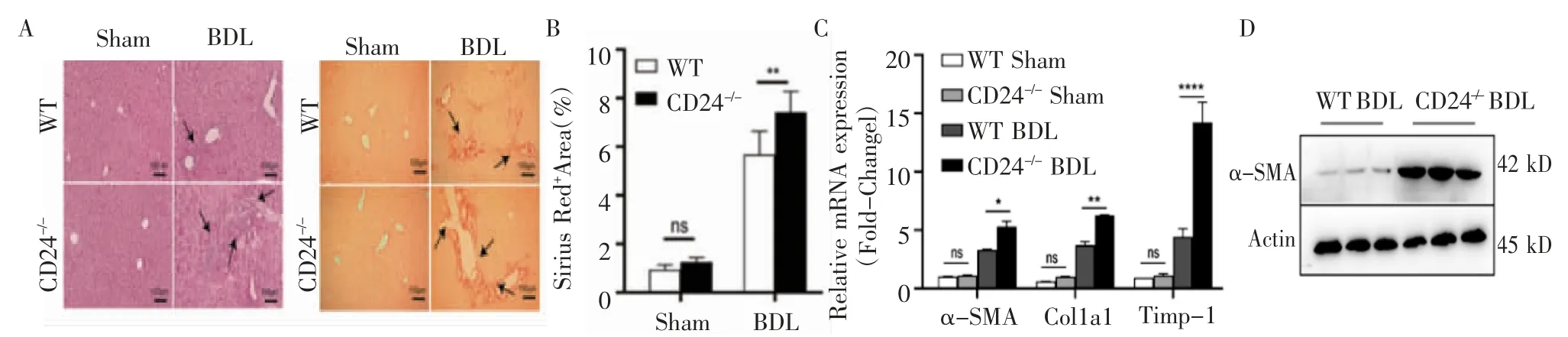
图1 CD24 基因敲除后BDL 诱导的小鼠肝纤维化加重Fig 1 BDL-induced liver fibrosis in mice aggravated after CD24 geng knockout
2.2 CD24-/-小鼠肝纤维化加重 与WT 小鼠相比,CD24-/-小鼠造模后肝脏中定居的巨噬细胞(CD11bhiF480hi) 比例与数量都没有明显差别(P>0.05),募集巨噬细胞群(CD11bhiF480int)比例明显增加(P<0.001),数量也有增加(P<0.05,图2A)。进一步分析Ly6Chi和Ly6Clo两种肝内募集型巨噬细胞亚群,结果发现CD24-/-小鼠造模后的Ly6Clo巨噬细胞亚群比例高于WT 小鼠(P<0.05),数量也高于WT 小鼠(P<0.01),而Ly6Chi巨噬细胞亚群比例和数量均无明显差异(P>0.05,图2A)。分析CD24分子在肝内不同的巨噬细胞亚群中的表达发现,CD24 分子在Ly6Clo巨噬细胞亚群中高表达且造模前后差异明显(P<0.05,图2B)。分选肝内巨噬细胞亚群与提取的原代星状细胞共培养后检测星状细胞的纤维化指标,结果发现,造模后的CD24-/-小鼠肝内Ly6Clo群巨噬细胞亚群对星状细胞的活化作用较强,纤维化指标表达明显升高(图2C)。
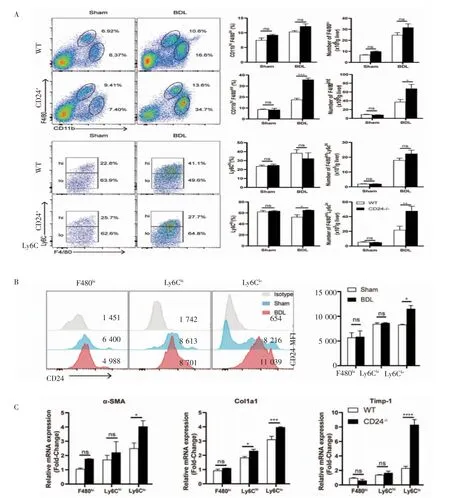
图2 CD24-/-小鼠肝纤维化加重可能与Ly6Clo 巨噬细胞亚群相关Fig 2 The aggravation of liver fibrosis in CD24-/-mice was related to Ly6Clo macrophages subset
2.3 CD24-/-小鼠纤维化与Ly6Clo巨噬细胞分泌PDGF-B 因子有关 在造模组中,与WT 小鼠相比,CD24-/-小鼠肝组织中PDGF-A 和PDGF-B mRNA表达较高且有显著差异(P<0.05,P<0.01),而PDGFC 和PDGF-D 表达低且无差异(P>0.05,图3A)。提取肝内巨噬细胞检测发现,Q-PCR 显示PDGF-A 与PDGF-Bm RNA 在CD24-/-小鼠造模后的肝内巨噬细胞上表达均有显著升高,其中以PDGF-B mRNA表达最为明显(P<0.01,P<0.000 1,图3B)。进一步分析肝内不同巨噬细胞亚群PDGF-A 和PDGF-B mRNA 表 达,结 果 发 现,PDGF-B 在CD24-/-小 鼠 的Ly6Clo巨噬细胞亚群上高表达(P<0.000 1,图3C)。用巨噬细胞上清与肝星状细胞共培养观察星状细胞上PDGF-B 受体的表达,结果发现,与CD24-/-小鼠肝内Ly6Clo巨噬细胞共培养后,肝星状细胞PDGFR-β 受体mRNA 表达量显著上调(P<0.000 1,图3D)。
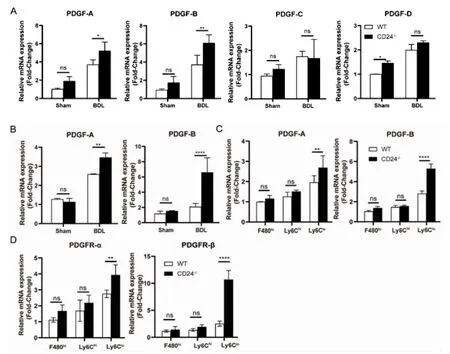
图3 CD24 小鼠纤维化与Ly6Clo 巨噬细胞分泌PDGF-B 因子密切相关Fig 3 CD24 mouse fibrosis closely related to the secretion of PDGF-B factor by Ly6Clo macrophages
3 讨论
在BDL 诱导的纤维化中,巨噬细胞与纤维化发展密切相关[15],在不同的巨噬细胞亚群中,单核衍生的Ly6C 巨噬细胞亚群可在纤维化的不同阶段发挥重要作用[16-17]。PDGF-B 被认为是巨噬细胞分泌的促纤维化因子,可促进星状细胞的增殖分化以控制肝纤维化的发展[18]。
在WT 鼠和CD24-/-小鼠经过胆总管结扎术造成纤维化后,初步发现CD24-/-小鼠的纤维化情况较WT 小鼠严重。在研究机制的过程中发现CD24-/-造模小鼠中募集群巨噬细胞显著增多,CD24 分子在Ly6Clo群巨噬细胞上高表达且在造模前后有明显差异,提示CD24 分子可能通过Ly6Clo群巨噬细胞来调节肝纤维化。
为了探究巨噬细胞分泌的相关纤维化因子,首先应用Q-PCR 检测筛选了与纤维化密切相关的PDGFs 家族成员的mRNA 表达变化,结果发现,PDGF-A 和PDGF-B 在CD24-/-小鼠肝纤维化组织中表达显著升高且与WT 小鼠有明显差异,PDGFC 和PDGF-D 表达低且无明显差异,该结果初步排除PDGF-C 和PDGF-D 的作用。进一步检测肝内巨噬细胞,结果发现,PDGF-A 和PDGF-B 在造模后的CD24-/-小鼠肝内巨噬细胞上表达升高,尤其是PDGF-B 表达显著升高,因此PDGF-A 和PDGF-B与CD24 敲除后肝纤维化加重有关。深入分析巨噬细胞亚群发现,PDGF-A 和PDGF-B 在CD24-/-小鼠Ly6Clo巨噬细胞亚群上高表达且与WT 小鼠有显著差异,并且PDGF-B 的表达差异更大,因此,CD24主要通过Ly6Clo巨噬细胞亚群分泌PDGF-B 来调节纤维化的发展。巨噬细胞分泌的PDGFs 等促纤维化因子是通过调节肝星状细胞表达的相应受体来实现的[19],为了验证上述结果,首先将不同巨噬细胞亚群与星状细胞共培养,检测星状细胞上的相应受体的变化,结果发现,与CD24-/-小鼠来源的Ly6Clo巨噬细胞亚群共培养后的星状细胞上PDGFR-β 受体表达显著升高,而PDGFR-β 是主要与PDGF-B相结合的配体[20],因此,共培养实验进一步验证了PDGF-B 是CD24 通过Ly6Clo巨噬细胞亚群调节纤维化的重要因子。综上所述,CD24 分子可通过影响Ly6Clo巨噬细胞PDGF-B 的分泌来调节纤维化。

