髓系特异性SOCS3 基因敲除小鼠的构建及应用
纪辰燕,李星晨,陈桂冬,于津浦
(天津医科大学肿瘤医院肿瘤分子诊断中心,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津恶性肿瘤临床医学研究中心,天津市肿瘤免疫与生物治疗重点实验室,天津 300060)
髓系来源抑制细胞(MDSCs)是由不同分化阶段的髓系细胞构成的一群异质性细胞[1]。MDSCs 可以通过抑制抗肿瘤免疫反应,促进肿瘤的免疫逃逸[2]。同时,MDSCs 可以通过分泌血管内皮生长因子(VEGF)等生长因子,促进肿瘤局部血管生成[3];或通过促进肿瘤细胞发生上皮间充质转化(EMT),升高肿瘤干细胞(CSCs)的比例等途径,直接促进肿瘤的生长和转移[4-5]。根据表型差异,MDSCs 可分为单核MDSCs(M-MDSCs)、多形核MDSCs(PMN-MDSCs)和早期MDSCs(eMDSCs)。eMDSCs 是一种新发现的亚群,具有不成熟表型Lin-HLA-DR-CD33+[1],可分化为M-MDSCs[6]。eMDSCs 已被证实在肾细胞癌、头颈部癌、黑色素瘤和卵巢癌中存在,但是其免疫抑制功能尚未被证实,目前缺乏针对肿瘤eMDSCs 研究的荷瘤鼠模型[7-8]。前期研究中,笔者在构建的4T1 乳腺癌小鼠模型中发现一群表型特征为CD11b+Gr-1-F4/80-MHCII-的eMDSCs。与经典MDSCs 相比,这群eMDSCs 具有更强的免疫抑制功能,且能转变成经典CD11b+Gr-1+MDSCs。且笔者研究发现,SOCS3 基因表达降低能影响髓系祖细胞的分化,促进eMDSCs 的产生[9-10]。基于上述机制,笔者利用Cre-loxP 系统构建髓系特异性SOCS3 基因敲除小鼠,并对其接种乳腺癌E0771 细胞、肺癌Lewis 细胞、黑色素瘤B16 细胞,构建3 种eMDSCs 高浸润的荷瘤鼠模型,为研究eMDSCs 促进肿瘤的分子机制和探索针对eMDSCs 的靶向药物提供了重要的实验平台。
1 材料与方法
1.1 材料
1.1.1 实验动物 7 只SPF 级SOCS3fl/-杂合子小鼠(4 雄3 雌),6~8 周龄,18~22 g,1 只SPF 级雄性Lyz2-Cre 鼠,7 周龄,20 g,均购于广州赛业生物技术有限公司[SCXK(苏)2020-0006],两种小鼠遗传背景皆为C57BL/6J。SPF 级野生型C57BL/6J 小鼠雌、雄各3 只,6~8 周龄,18~22 g,购自斯贝福(北京)生物技术有限公司[(SYXK(京)2019-0010)]。所有引进小鼠饲养于天津医科大学肿瘤医院实验动物中心[(SYXK(津)2017-0005)],按照SPF 级标准饲养,室温(23±3)℃,12 h 光照/黑暗循环,自由取食、饮水,动物实验经天津医科大学肿瘤医院动物实验伦理委员会批准(AE-2021013),并按照《实验动物护理与指南》进行。
1.1.2 细胞系 本研究中使用的小鼠乳腺癌E0771细胞株购自中国医学科学院,小鼠肺腺癌LLC(Lewis lung cancer)细胞株购自广州赛库生物技术有限公司,小鼠黑色素瘤B16(B16 melanoma)细胞株购自ATCC,皆用含10%胎牛血清(FBS)的DMEM 培养基于37℃、5%CO2恒温培养箱培养。
1.1.3 实验材料 快速DNA 提取扩增套装(天根生化科技有限公司),DNATrziol(Invitrogen 有限公司),RT Response Kit、SYBR Premix Ex Taq Ⅱ(TaKaRa),CD11b Micro Beads、Anti-Gr-1 antibodies、Anti-Biotin MicroBeads(美天旎生物有限公司),红细胞裂解液(碧云天),GAPDH 抗体、SOCS3 抗体(CST),羊抗鼠IgG 单克隆抗体、羊抗兔IgG 单克隆抗体(中杉金桥),Percp-anti-CD45 抗体、PE-anti-Gr-1 抗体、PE-anti-F4/80 抗体、FITC-anti-CD11b 抗体、FITC BrdU Flow Kit、Apoptosis Detection Kit(BD 有限公司),APC anti-CD3 抗体(Biolegend 公司),Dynabeads®mouse T-Activator CD3/CD8(Gibio,美国),T Cell Isolation Kit(MiltenyiBiotec,美国);荧光定量PCR仪(AB7500,Applied Biosystems,中国),普通PCR仪(BIO-RAD,美国),化学发光凝胶成像分析仪(BIO-RAD,美国)。
1.2 方法
1.2.1 SOCS3fl/-小鼠的构建 通过生物信息学分析验证小鼠基因组中SOCS3 基因的DNA 序列,并根据该序列构建敲除载体和基因打靶策略。酶切线性化载体,通过电穿孔法将上述线性化载体转入胚胎干细胞(ES 细胞),并通过药物进行抗药性筛选。通过PCR 鉴定同源重组ES 细胞克隆,并通过Southern 印迹分析进行确认。通过显微注射将同源重组ES 细胞移植到囊胚中,后将囊胚移植入代孕母鼠的子宫内获得子代嵌合体小鼠,将其与flp 工具鼠交配,获得去除抗药基因的SOCS3fl/-小鼠。
1.2.2 SOCS3fl/-小鼠的鉴定 SOCS3fl/-小鼠基因型鉴定方法如下。区域一上游引物F1(5′-GAAGATCC CTGATTCCCGTCATACTC-3′)和下游引物R1(5′-ATGGGGAGAGACACAAGAGCCCTA-3′)用于首次PCR 筛选,来自重组等位基因的240 bp 片段代表阳性小鼠。区域二上游引物F2(5′-CTGGGAAAACAGC CATCTATTCATCC-3′)和下游引物R2(5′-GTTGTTG CGTCTGCCCCAAACT-3′)用于PCR 再次确认,从阳性小鼠中扩增出来自重组等位基因的324 bp 片段。
1.2.3 髓系特异性SOCS3 基因敲除小鼠的繁育SOCS3fl/-小鼠自交,PCR 鉴定F2 代小鼠,筛选出SOCS3fl/fl小鼠。将SOCS3fl/fl小鼠与Lyz2-Cre 工具鼠杂交获得F3 代SOCS3fl/-LysM-Cre+/-小鼠。F3 代小鼠进行自交,获取髓系特异性SOCS3 基因敲除小鼠(SOCS3fl/flLysM-Cre+/+小鼠,SOCS3KO鼠)。
1.2.4 髓系特异性SOCS3 基因敲除小鼠的鉴定
1.2.4.1 DNA 提取 取鼠尾至无酶EP 管,将其打碎处理为细胞悬液,10 000 r/min 离心1 min,弃上清后加入200 μL 裂解缓冲液,震荡至彻底悬浮。加入20 μL蛋白酶K,混匀,56℃1 h,后95℃5 min 灭活蛋白酶K,12 000 r/min 离心5 min,取上清至新的无酶EP 管,4℃冰箱放置备用。
1.2.4.2 PCR 扩增 PCR 体系为20 μL,内含模板DNA 1μL,2×PCR Reagent 10 μL,正反向引物各0.5 μL,DEPC 水8 μL。使用PCR 扩增仪循环扩增,反应条件:预变性94℃,3 min;变性94℃,30 s;退火55℃,30 s,重复40 个循环;延伸72℃6 min。
1.2.4.3 琼脂糖电泳 取PCR 扩增后产物8 μL 进行琼脂糖凝胶电泳,检测产物大小。
1.2.4.4 SOCS3KO鼠基因组鉴定 首先对F4 代小鼠进行SOCS3fl/fl小鼠鉴定,然后取上述SOCS3fl/fl小鼠进行Cre 的鉴定,即LysM-Cre+/+小鼠鉴定,最后取SOCS3fl/flLysM-Cre+/+小鼠的髓系细胞进行SOCS3 基因敲除鉴定。SOCS3fl/fl小鼠基因组鉴定结果判断:上游引物F2 和下游引物R2 用于鉴定SOCS3fl/fl小鼠。PCR 结果判定:(1)只有一个条带,大小为324 bp,为SOCS3fl/fl小鼠。(2)只有一个条带,大小为186 bp,为野生型小鼠。(3)两个条带,分别为324、186 bp,为SOCS3fl/-小鼠。Cre 基因的鉴定:取F4 代SOCS3fl/fl小鼠进行Cre 基因的鉴定,PCR 结果判定:只有一个条带,大小为204 bp,为LysM-Cre+/+小鼠。Cre 基因鉴定的上游引物序列为5′-GAACGCACTGATTTCGACCA-3′,下游引物序列为5′-GCTAACC AGCGTTTTCGTTC-3′。最后取SOCS3KO鼠的髓系细胞进行鉴定,PCR 结果判定:(1)只有一个条带,大小为324 bp,Cre 基因表达不成功。(2)只有一个条带:520 bp,SOCS3KO鼠。髓系细胞SOCS3 基因鉴定的引物为上游引物F3、上游引物F2 和下游引物R2,F3序列为5′-ACTTCACGGCTGCCAACATCTG-3′。
1.2.5 Western 印迹 使用含有蛋白酶抑制剂的蛋白裂解液分离总蛋白。蛋白质提取物通过10%聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,并湿转至PVDF 膜,用5%脱脂牛奶封闭1 h,并在SOCS3 抗体稀释液中4℃孵育过夜。然后在室温下加入辣根过氧化物酶(HRP)标记的鼠或兔二抗,室温孵育1 h,用Chemiluminescent HRP Substrate 显影液显影,利用Image J 软件定量分析SOCS3 蛋白的相对表达量(内参为GAPDH)。
1.2.6 流式细胞术 取小鼠骨髓,用70 μm 滤网过滤后裂解红细胞,再次用70 μm 滤网过滤,PBS 清洗并按5×105个/100 μL 重悬,流式管加100 μL 骨髓细胞悬液备用。肿瘤组织充分研磨后进行过滤,PBS 清洗后按5×105个/100 μL 重悬,流式管加100 μL 肿瘤细胞单细胞悬液备用。在每管中分别加入Percp-anti-CD45 抗体、FITC-anti-CD11b 抗体、PEanti-Gr-1 抗体、PE-anti-MHC II 抗体、PE-anti-F4/80 抗体各2.5 μL,震荡均匀后室温孵育20 min,PBS 清洗,流式细胞仪检测。
1.2.7 Annexin V 检测T 细胞凋亡 将T 细胞与CD11b+Gr-1-的骨髓细胞、SOCS3KO鼠eMDSCs、肿瘤原位eMDSCs 按照1∶3 比例共培养,培养过程中加CD3/CD8 抗体刺激T 细胞活化。72 h 后收集T 细胞,PBS 清洗,结合缓冲液按2×105个细胞/100 μL重悬,取100 μL 悬液于流式管中备用。加入2.5 μL APC-anti-CD3 抗体,室温避光孵育20 min,PBS 清洗后用100 μL 结合缓冲液重悬,加入5 μL Annexin V 和5 μL 7-AAD,室温避光孵育15 min,使用流式细胞仪检测。
1.2.8 Brdu 检测T 细胞增殖 将T 细胞与CD11b+Gr-1-髓系细胞、SOCS3KO鼠骨髓中的eMDSCs、肿瘤原位eMDSCs 按照1∶3 比例共培养,培养过程中加CD3/CD8 抗体刺激T 细胞活化。72 h 后收集T 细胞,PBS 清洗,结合缓冲液按2×105个细胞/100 μL重悬,取100 μL 悬液于流式管中备用。加入2.5 μL APC-anti-CD3 抗体,室温孵育20 min,PBS 清洗。加入100 μL Cytofix/Cytoperm Buffer,4℃避光孵育20 min,Perm/wash buffer 清洗。加入Cytofix/Cytoperm Buffer Plus 100 μL,4℃避光孵育10 min 后,Perm/wash buffer 清洗。加入100 μL Cytofix/Cytoperm Buffer,4℃避光孵育5 min,Perm/wash buffer 清洗。加入Dnase,37℃水浴孵育1 h,Perm/wash buffer清洗。加入稀释的Brdu 抗体50 μL,室温避光孵育20 min,Perm/wash buffer 清洗,重悬细胞后上机检测。
1.2.9 动物实验 将处于对数生长期的E0771 细胞按照2×106/(120 μL·只),皮下接种野生型C57BL/6J小鼠(WT 鼠)和SOCS3 敲除小鼠(雌性,6~8 周龄,18~22 g)第4 乳腺脂肪垫上,将LLC 按1×106/(120 μL·只)、B16 按照5×105/(120 μL·只),皮下接种野生型小鼠和SOCS3KO小鼠(雌性,6~8 周龄,18~22 g)腹股沟,每3 d 观察肿瘤的生长状况,测量肿瘤长短径,连续进行3 周,计算肿瘤体积,绘制肿瘤生长曲线。公式:体积=ab2/2(a 为长径,b 为短径)。
2 结果
2.1 SOCS3fl/-小鼠的构建 SOCS3fl/-小鼠构建方式如图1 所示。将上述小鼠与flp 工具鼠交配,获得去除抗药基因的SOCS3fl/-小鼠7 只。
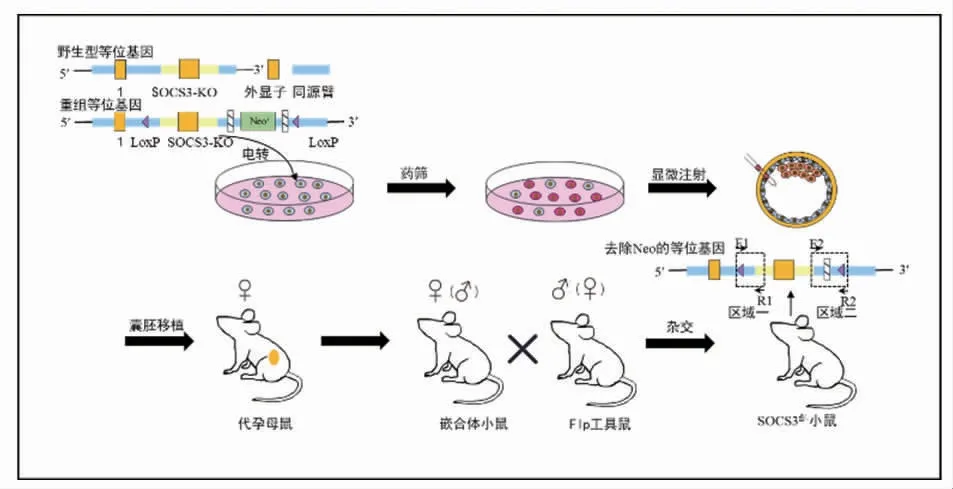
图1 SOCS3fl/-小鼠构建方式及鉴定位点Fig 1 Construction methods and identification sites of SOCS3fl/-mice
2.2 PCR 鉴定SOCS3fl/-小鼠结果 二步法鉴定SOCS3fl/-小鼠,通过PCR 对区域一进行鉴定,取上述鉴定结果为阳性的小鼠,对其区域二再次鉴定,最终获得SOCS3fl/-小鼠。如图2 所示,F1 代SOCS3fl/-小鼠区域一的扩增产物为240 bp 和166 bp 两条DNA片段,区域二的扩增产物为324 bp 和186 bp 两条DNA 片段,与预期结果一致,而WT 小鼠区域一的扩增产物为一条166 bp 的DNA 片段,区域二的扩增产物为一条186 bp 的DNA 片段。
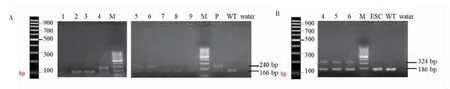
图2 SOCS3fl/-小鼠DNA PCR 鉴定Fig 2 Results of genotype identification in SOCS3fl/-mice by PCR
2.3 髓系特异性SOCS3 基因敲除小鼠的繁育 髓系特异性SOCS3 基因敲除小鼠的繁育方式如图3 所示。将SOCS3fl/-小鼠自交,取获得的子代小鼠进行PCR 鉴定,筛选出SOCS3fl/fl小鼠。将SOCS3fl/fl小鼠与Lyz2-Cre 工具鼠杂交获得F3 代SOCS3fl/-LysM-Cre+/-小鼠。将F3 代小鼠进行自交获取髓系特异性SOCS3基因敲除小鼠(SOCS3fl/flLysM-Cre+/+小鼠,SOCS3KO鼠)。
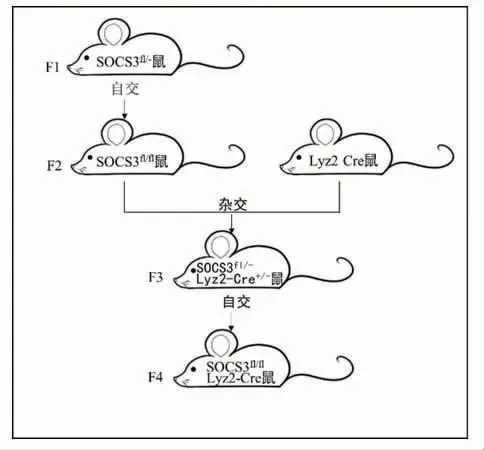
图3 髓系特异性SOCS3 基因敲除小鼠的构建Fig 3 Construction of myeloid-specific SOCS3 gene knockout mice
2.4 SOCS3KO小鼠的鉴定结果 SOCS3KO小鼠为携带Cre 基因的SOCS3fl/fl小鼠,其基因型为SOCS3fl/flLysM-Cre+/+。取F4 代小鼠鼠尾进行PCR 鉴定,其中SOCS3fl/fl小鼠扩增产物为一条324 bp 的DNA 片段,对上述SOCS3fl/fl小鼠的Cre 基因进行进一步鉴定,扩增产物为一条204 bp DNA 片段的小鼠即为SOCS3KO小鼠,见图4A、4B。SOCS3KO小鼠的SOCS3基因在髓系细胞中被特异性敲除,其基因型如图4C所示。通过PCR 对F4 代SOCS3KO小鼠的髓系细胞进行了鉴定,与预期一致,扩增产物出现一条520 bp的DNA 片段,见图4D。结果显示,与Cre 工具鼠相比,SOCS3KO小鼠髓系细胞中SOCS3 蛋白表达显著降低,而肠组织、皮肤和肝脏中SOCS3 蛋白表达无显著变化,见图4E。
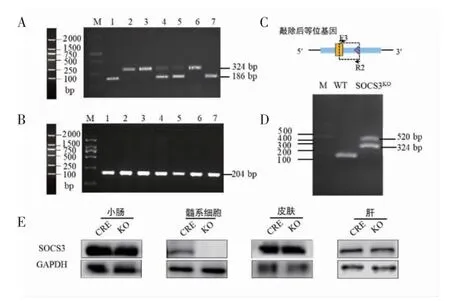
图4 SOCS3KO 小鼠鉴定Fig 4 Identification of SOCS3KO mice
2.5 髓系SOCS3 基因的敲除促进eMDSCs的生成和免疫抑制活性 如图5A 所示,在敲除SOCS3 基因后,小鼠骨髓中表型为CD11b+Gr-1-F4/80-MHCII-的eMDSCs 比例显著升高[(10.54±0.50)%vs.(40.5±2.85)%,t=17.94,P<0.001]。与CD11b+Gr-1+细胞相比,肿瘤原位eMDSCs(t-eMDSCs)可显著抑制T 细胞增殖[(18.80±0.76)% vs.(9.54±0.67)%,t=15.95,P<0.001)],促进T 细胞凋亡[(8.33±0.75)% vs.(18.69±0.61)%,t=18.48,P<0.001)]。SOCS3KO小鼠骨髓中分选的eMDSCs 免疫抑制活性与肿瘤原位eMDSCs 相似,也可显著抑制T 细胞增殖[(18.80±0.76)%vs.(9.95±0.77)%,t=14.21,P<0.001],促进T细胞凋亡[(8.33±0.75)% vs.(16.9±0.79)%,t=13.53,P<0.001],见图5B、5C。
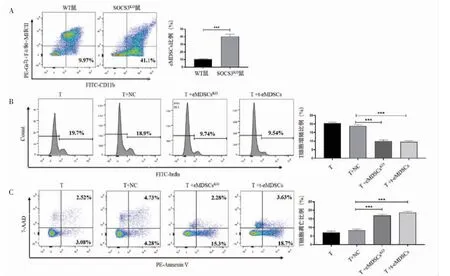
图5 特异性SOCS3 基因敲除对eMDSCs 的生成和免疫抑制功能的影响Fig 5 Effects of specific SOCS3 gene knockout on the production and immunosuppressive function of eMDSCs
2.6 髓系SOCS3 基因的敲除促进肿瘤生长和eMDSCs 的浸润 为构建eMDSCs 高浸润的荷瘤鼠模型,分别将B16、E0771 与LLC 细胞接种到WT 小鼠和SOCS3KO小鼠皮下。结果显示,SOCS3KO组的黑色素瘤[(931.40±145.50)mm3vs.(293.60±96.16)mm3,t=6.90,P<0.001]、乳腺癌[(377.9±36.12)mm3vs.(139.60±20.42)mm3,t=12.84,P<0.001]、肺癌[(512.40±82.58)mm3vs.(240.20±28.14)mm3,t=6.98,P<0.001]体积显著高于WT 组,见图6A、6B、6C。且流式结果表明,与WT组相比,SOCS3KO组黑色素瘤[(51.40±2.40)% vs.(88.80±1.20)%,t=24.14,P<0.001]、乳腺癌[(19.10±0.90)% vs.(38.8±1.06)%,t=24.56,P <0.001]、肺 癌[(27.55±2.03)% vs.(46.90±0.95)%,t=14.93,P<0.001]中的eMDSCs 比例显著升高,见图6D、6E、6F。
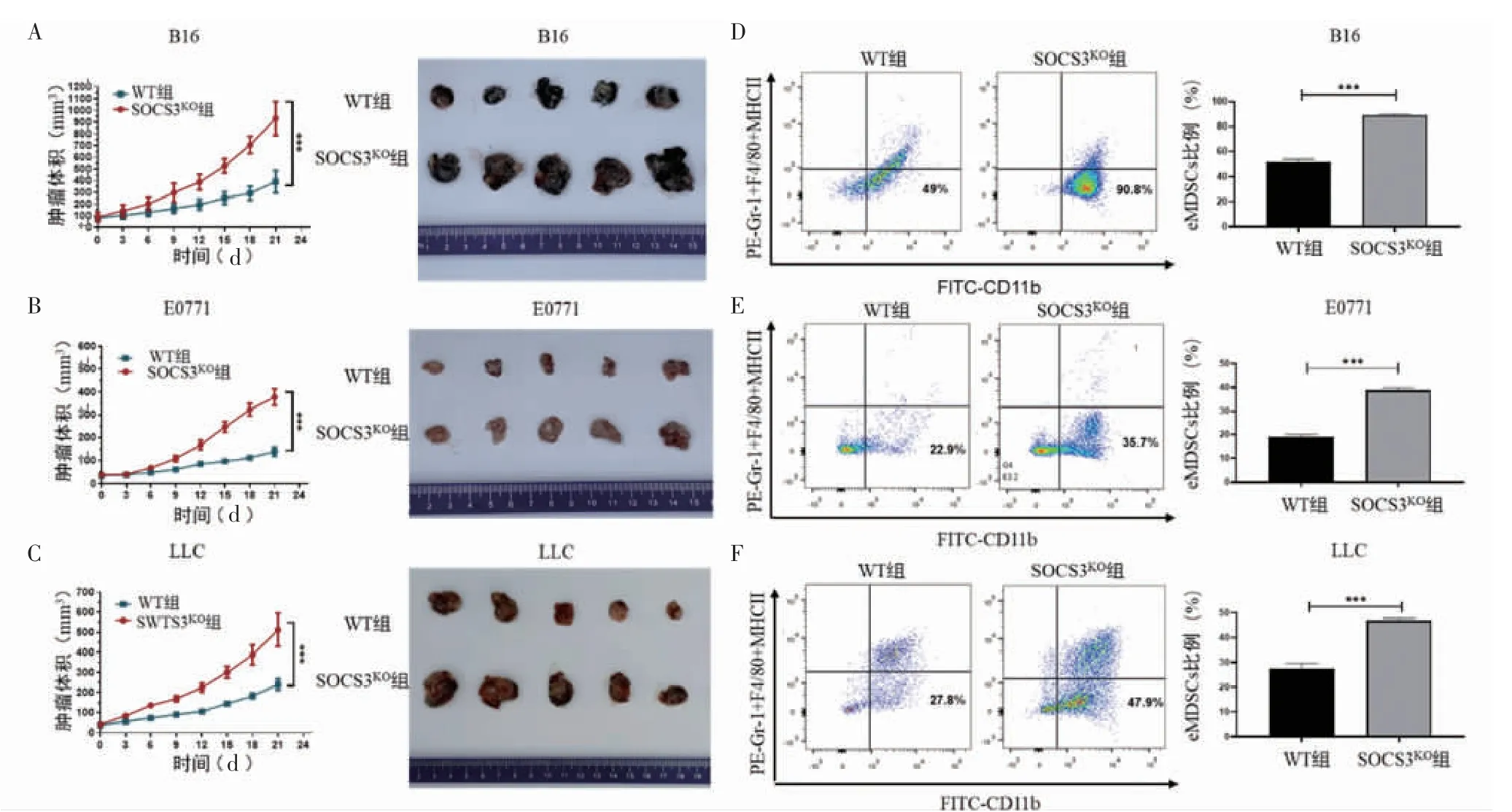
图6 髓系SOCS3 基因敲除对肿瘤生长和eMDSCs 浸润的影响Fig 6 Effect of SOCS3 gene knock-out on tumor growth and infiltration of eMDSCs
3 讨论
具有促肿瘤作用的MDSCs 最早发现于荷瘤鼠,后在肿瘤患者体内陆续被发现[11]。同时Lang 等[12]分析实体瘤患者外周血中MDSCs 的比例与患者总生存率的关系时发现,MDSCs 比例的增高降低了患者的总生存率,至此MDSCs 成为肿瘤研究的又一焦点。研究证实肿瘤组织中的MDSCs 促进了肺癌和结肠癌的远处转移[13-14]。临床试验,证实针对MDSCs的靶向治疗能抑制肿瘤生长,延长患者的生存期[15],且抑制MDSCs 可以提高免疫检查点抑制剂的疗效[16-17]。总之,MDSCs 在肿瘤的发生、发展过程中起着重要作用。
MDSCs 由髓系祖细胞分化发育而来。正常情况下,髓系祖细胞可分化成为单核细胞、中性粒细胞、巨噬细胞,而在肿瘤患者体内,髓系祖细胞受到肿瘤细胞分泌的可溶性因子的调控,出现分化障碍,成为具有免疫抑制能力的MDSCs[18]。目前研究MDSCs时对其的获取主要包括3 个途径,一是直接从荷瘤小鼠的脾脏或肿瘤组织中分离MDSCs,二是通过白细胞介素-6(IL-6)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等细胞因子诱导髓系细胞增殖分化成MDSCs,三是直接建立MDSCs 干细胞系。上述方法各有其局限性,利用流式分选或磁珠分选从荷瘤鼠脾或肿瘤组织中获得的MDSCs 虽然得到纯化,但数量很少;而肿瘤细胞在体外培养或体内接种过程中会出现优势生长,干扰实验结果;体外诱导法存在MDSCs 分化效率低的问题[19-20]。因此,MDSCs 相关研究受到现有方法的限制。
本研究发现MDSCs 的亚群eMDSCs 的生成受肿瘤源性IL-6 影响。正常生理状况下,IL-6 引起一过性Janus 激酶/信号转导和转录激活因子(JAK/STAT3)通路激活,但肿瘤源性IL-6 可诱导髓系细胞中SOCS3 的缺失,导致JAK/STAT3 通路持续激活,从而促进了eMDSCs 的生成和扩增[9-10]。本研究利用Cre-loxP 系统成功构建了髓系特异性SOCS3基因敲除小鼠,对其进行基因型鉴定和蛋白水平上的敲除效果验证,确认SOCS3 基因在髓系细胞中特异性敲除。流式细胞学技术比较髓系特异性SOCS3基因敲除小鼠与野生型小鼠骨髓中eMDSCs 数量的结果显示,前者eMDSCs 数量显著升高,可达到髓系细胞的40%,且该群eMDSCs 具有与肿瘤原位eMDSCs 相似的免疫抑制功能,无肿瘤细胞污染,使得直接从小鼠骨髓中分离eMDSCs 的新获取方法成为可能。同时,本研究将乳腺癌细胞E0771、肺癌细胞LLC、黑色素瘤细胞B16 接种到髓系特异性SOCS3 基因敲除小鼠皮下,通过流式细胞学技术比较髓系特异性SOCS3 基因敲除小鼠与野生型小鼠所形成的3 种不同瘤子中eMDSCs 比例,结果显示前者显著高于后者,证实3 种eMDSCs 高浸润的荷瘤鼠模型构建成功。
综上所述,本研究以特异性敲除小鼠髓系细胞中SOCS3 基因的方式,模拟肿瘤源性IL-6 对髓系细胞的调控作用,促进骨髓中的eMDSCs 的生成和扩增,为MDSCs 的获取提供了新的有效方法,为eMDSCs相关实验研究提供了稳定的细胞来源。且本研究在髓系特异性SOCS3 基因敲除小鼠的基础上首次构建了3 种eMDSCs 高浸润的荷瘤鼠模型,可以模拟临床上高eMDSCs 的肿瘤患者,为体内探索eMDSCs的促肿瘤机制,寻找新型靶向药物提供了有力的动物模型。

