基于细胞纯化和芯片技术的结肠癌化疗耐药分子分型建立和临床验证
郭志平, 折 桐, 王晓峰, 花晓燕, 马 硕, 于 东, 吴泽华, 姜 韬
(1.宁夏中卫市人民医院肿瘤科,中卫 755000; 2.宁夏医科大学总医院结直肠外科,银川 750004;3.青岛大学附属医院胃肠外科,青岛 266000)
结肠癌是临床上常见的恶性肿瘤,全球范围内发病率居恶性肿瘤第三位,死亡率居第二位[1]。结肠癌化疗耐药新型治疗靶标筛选鉴定是目前肿瘤研究的热点领域之一[2]。对于Ⅲ期和具有复发转移危险因素的Ⅱ期患者需追加术后辅助化疗,以减少肿瘤的复发及转移[3]。作为一种遗传异质性疾病,并非所有患者都能从以氟尿嘧啶为基础的辅助化疗中受益,约30%的患者最终会发生术后复发及转移[4-5]。积极筛选及鉴定新型结肠癌化疗耐药相关靶标基因,对于进一步阐明结肠癌化疗耐药的分子机制及改善预后具有重要的意义。
microRNA(miRNA)是长度为20~24 个核苷酸的小RNA,在细胞分化及疾病发生、发展过程中发挥巨大作用。miRNA 调控人类约三分之一的基因,在肿瘤研究中可作为生物学标志物及药靶,给人类疾病治疗提供新的手段[6]。本文建立基于激光捕获显微切割(laser capture microdissection,LCM)-Agilent miRNA 芯片技术的结肠癌化疗耐药基因表达谱,筛选结肠癌化疗耐药相关靶标基因,结合患者临床病理指标、治疗效果和预后信息进行分析,最终形成结肠癌化疗耐药分子分型体系。
1 材料与方法
1.1 一般资料
本文所选的10 例Ⅲ期结肠癌患者均于我科行腹腔镜辅助根治性(或扩大)右半结肠癌根治术,手术遵循全结肠系膜切除(complete mesocolic excision,CME)的基本原则,术后病理淋巴结数目均大于12 枚。术后免疫组化分型均为MSI-L,遵循NCCN 指南方案,予以追加mFOLFOX6 方案(术后3 周开始,总疗程6 个月)辅助化疗。对随诊过程中发生复发/未复发(5∶5)的肿瘤实质细胞进行LCM,细胞纯化后运用基因表达谱芯片检测两种细胞中的基因表达情况,根据差异表达倍数和功能预测筛选结肠癌化疗相关靶标基因。
1.2 LCM
1)将上述结肠癌组织蜡块行病理切片,切片厚度为7~8 μm。2)将切片于56 ℃烘烤过夜,二甲苯及梯度乙醇(95%,75%)脱蜡脱水,RNasefree 水2 min,苏木素(Dako Mayer’s)染色30 s,RNase-free 水2 min,梯度乙醇(75%,95%,100%)脱水,二甲苯透明5 min,待二甲苯挥发完全后,启动Veritas,轻压Tension lever,置入玻片,置入收集盖,放置Unload Station,加载样品窗口后捕获切割肿瘤细胞。3)激光显微切割完成后,在0.5 mL Eppendorf 管内加入miRNA 抽提试剂盒里的第一步试剂,再将捕获细胞后的Cap 置于EP管上,盖紧,倒置,按试剂盒说明书行miRNA 抽提实验。
1.3 Agilent miRNA 芯片实验
1.3.1 RNA 抽提和纯化 采用mirVanaTMmiRNA Isolation Kit(Ambion,Austin,美国),按照生产厂商提供的标准操作流程进行样品的total RNA 抽提,抽提所得经Agilent Bioanalyzer 2100(Agilent Technologies,Santa,CA,美国)电泳质检合格后备用。RNA 质控标准:2100 RIN≥6.0 并且28S/18S≥0.7。
1.3.2 样品RNA 标记 样品RNA 采用Agilent miRNA 芯片配套的试剂盒:miRNA Complete Labeling and Hyb Kit(Agilent Technologies,CA,美国),按照标准操作流程对miRNA 分子进行荧光标记。1.3.3 芯片杂交及扫描 芯片为Agilent human miRNA(8×60K)V19.0 芯片。结果采用Agilent Microarray Scanner(Agilent Technologies,CA,美国)进行扫描。均委托上海伯豪生物技术有限公司完成。
1.4 qRT-PCR 检测
应用RNA 提取试剂盒(QIAGEN,上海,中国)提取总RNA 并行浓度纯度的检测。合格样品使用PrimerScriptTMRT Master Mix(Takara,日本)进行逆转录,并使用SYBR ? Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(Takara,日本)进行qRTPCR 反应。引物序列如下:miR-194-3p,上游,5'-CGTCGCCGCCGTACACGGACCTGCGA-3',下游,5' -TTGCATGCTGATCATGCGCTTAGCTAGA -3'。GAPDH,上游,5'-TGCACCACCAACTGCTTAGC-3',下游,5'-GGCATGGACTGTGGTCATAG-3'。
2 结果
2.1 LCM 行细胞纯化
LCM 分离出5 例Ⅲ期结肠癌化疗后复发以及5 例未复发的肿瘤实质细胞,细胞纯化后运用基因表达谱芯片检测两种细胞中的基因表达情况,根据差异表达倍数和功能预测筛选结肠癌化疗相关靶标miRNA,见图1。
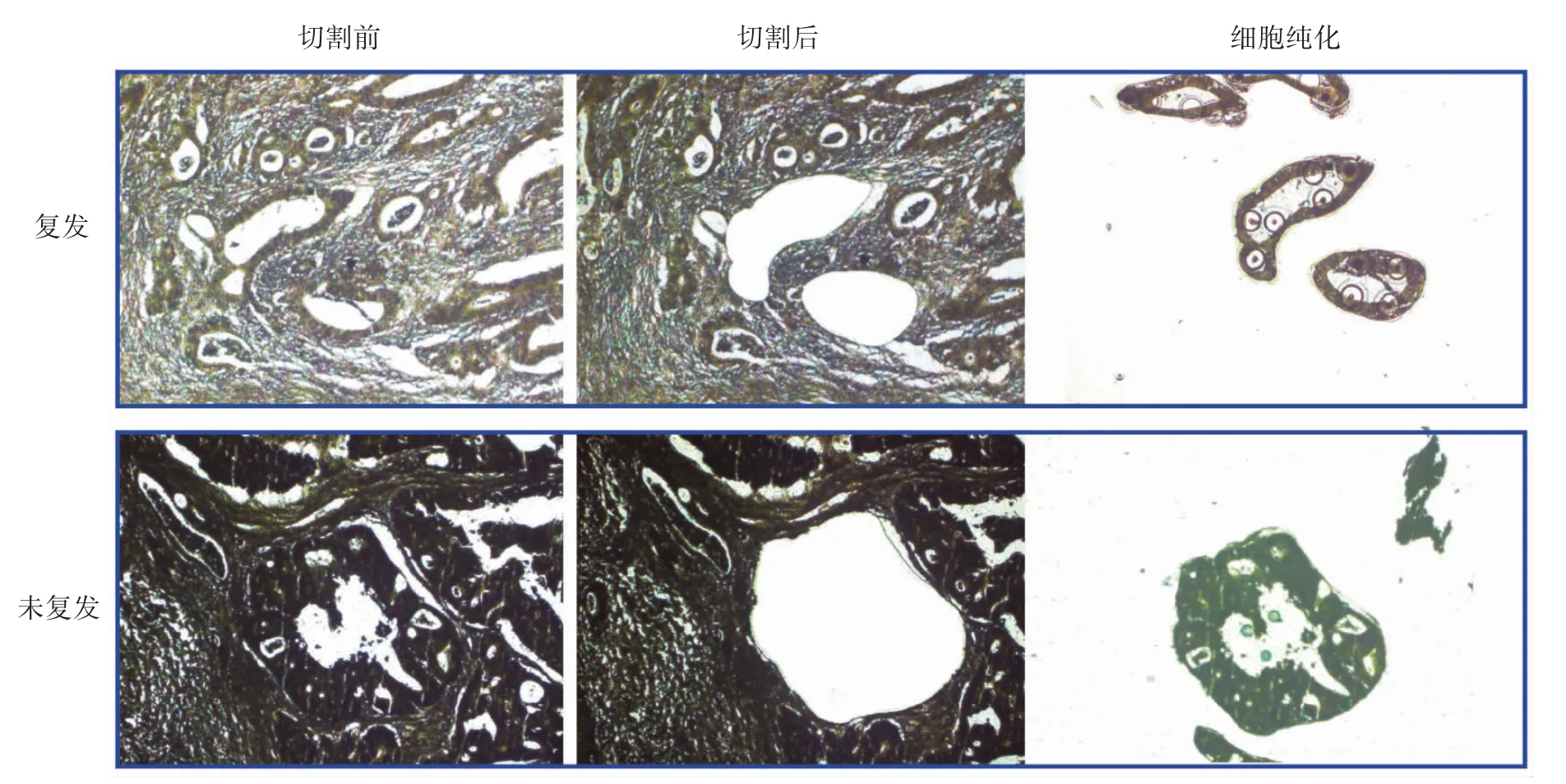
图1 LCM 行肿瘤细胞纯化(苏木素染色×20)
2.2 Agilent miRNA 芯片筛选结肠癌化疗耐药靶标
建立基于LCM-Agilent miRNA 芯片技术的结肠癌化疗耐药miRNA 表达谱,筛选结肠癌化疗耐药相关靶标。结果显示,包括miR-194-3p,miR-3607,miR-887,miR-424-5p,miR-1237 等16 个miRNA 为差异基因,是潜在靶标,Agilent 单荧光芯片组间t 检验分析得到P 值与Fold Change值两个因素共同绘制火山图,显示两组样品差异有统计学意义,见图2。
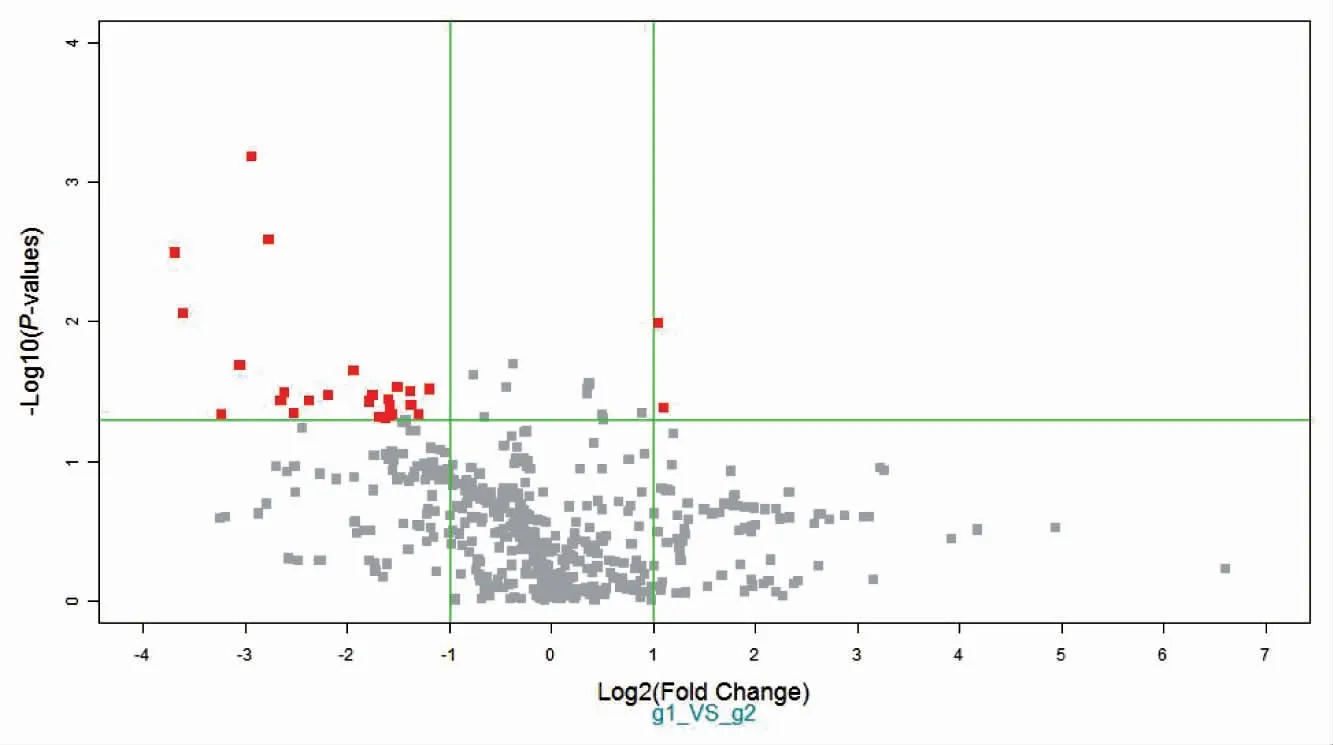
图2 火山图
2.3 miR-194-3p 的临床样本验证
根据芯片结果,选择差异性最显著的miR-194-3p 行临床样本验证。通过检测miR-194-3p在60 例Ⅱ/Ⅲ期结肠癌化疗后复发/未复发样本中的表达。qRT-PCR 结果显示,相对于结肠癌化疗后未复发病例,miR-194-3p 在结肠癌化疗后复发样本中高表达(P<0.001),见图3。
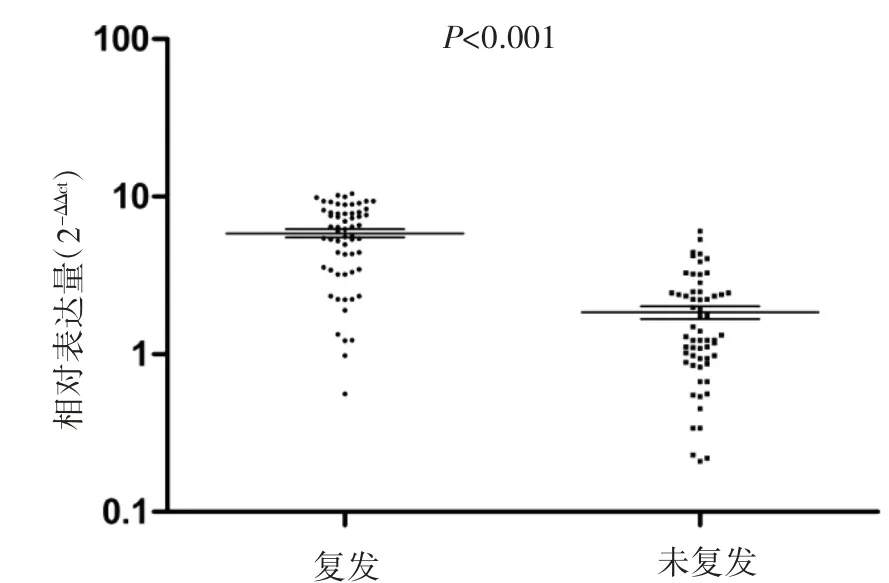
图3 miR-194-3p 在Ⅱ/Ⅲ期结肠癌复发/未复发样本的表达
3 讨论
我国为结肠癌高发的国家,男性发病率高于女性,随着年龄的增长,发病风险呈上升趋势,严重威胁人类的生命和健康[7]。针对Ⅲ期结肠癌患者,化疗耐药会导致约30%的患者最终发生术后复发及转移[8]。所以筛选有效的、特异性的结肠癌化疗相关靶标基因可以为临床指导用药提供有价值的信息。例如,临床检测错配修复蛋白表达情况可用于指导结肠癌Ⅱ期(T3N0M0 和T4N0M0)患者的化疗[9];结肠癌中错配修复蛋白表达缺失会导致遗传水平的高度微卫星不稳定,相比较微卫星稳定的患者具备更好的预后,但是高度微卫星不稳定的患者对以5-氟尿嘧啶为主的化疗方式不敏感,FOLFOX 方案化疗不受益[10-11]。因此,积极地筛选及鉴定新型结肠癌化疗耐药相关靶标基因,对于进一步阐明结肠癌化疗耐药的分子机制以及临床转化应用于改善预后等具有重要意义。
LCM 是一项在显微镜下从组织切片中分离、纯化单一类型细胞群或单个细胞的技术,它成功地解决了组织中的细胞异质性问题,是分子病理学和肿瘤基因组学研究的一项革命性技术[12]。本文应用该技术,针对Ⅲ期结肠癌化疗后复发及无复发病例,行肿瘤细胞纯化。进一步运用Agilent基因表达谱芯片检测两种细胞中的miRNA 表达情况,生物信息学分析,根据Fold Change 值和功能预测筛选结肠癌化疗相关靶标。结果显示,包括miR-194-3p,miR-3607,miR-887,miR-424-5p,miR-1237 等16 个miRNA 为差异基因,可作为潜在结肠癌化疗耐药相关靶标进一步研究。选择miR-194-3p 进行临床样本验证,对比无复发病例,miR-194-3p 在60 例Ⅱ/Ⅲ期结肠癌化疗后复发的样本中显著高表达,与芯片结果一致,其具体分子机制尚需进一步研究。
综上所述,本文建立了基于LCM-Agilent miRNA 芯片技术的结肠癌化疗耐药基因表达谱,筛选了结肠癌化疗耐药相关靶标基因,并初步进行了miR-194-3p 的临床样本验证。后续需结合患者临床病理指标、治疗效果和预后信息进行分析,形成结肠癌化疗耐药分子分型体系。

