雄激素抑制PI3K/AKT/AR 通路促进前列腺癌C4-2B 细胞凋亡
王振位, 聂黎虹, 杨博雅, 刘子洋, 甄 旭, 赵瑞宁
(1.宁夏医科大学总医院泌尿外科,银川 750004; 2.宁夏医科大学基础医学院,银川 750004; 3.宁夏医科大学临床医学院,银川 750004)
前列腺癌(prostate cancer,PCa)是男性好发恶性肿瘤,在全球范围内,其发病率与病死率分别位居男性恶性肿瘤的第2 位和第5 位,严重危害中老年男性健康[1]。PCa 进展的主要方式由雄激素受体(androgen receptor,AR)信号通路介导,因此干扰该信号通路的功能一直是治疗晚期PCa 的重要措施之一,如雄激素剥夺治疗、AR 阻断治疗等[2]。上述治疗措施仅在初期具有显著疗效,一般3 年左右演变成去势抵抗性前列腺癌(castrate-resistant prostate cancer,CRPC),其患者预后更差、病死率更高[3]。而靶向抑制AR 信号通路的功能依然是CRPC 的重要治疗措施。雄激素在体内作为AR 的主要配体,一直被认为是促进PCa 进展的主要原因[4]。但有临床实验研究[5]发现,PCa 患者根治术后给予雄激素治疗,维持血清睾酮水平在300~375 ng·mL-1,患者肿瘤复发率降低、中位生存期延长。另有研究[6-7]表明,AR信号通路对PCa 的发展具有抑制和促增殖的双向作用。目前,关于雄激素是否可通过调节AR信号通路抑制CRPC 阶段PCa 细胞增殖的研究鲜有报道。本研究采用双氢睾酮(dihydrotestosterone,DHT)对C4-2B 细胞进行处理,探讨DHT对C4-2B 细胞增殖和凋亡的影响及其可能机制,给CRPC 的临床治疗提供实验依据。
1 材料与方法
1.1 材料
C4-2B 细胞由美国加州大学Davis 分校的AllenC.Gao 教授惠赠;CO2细胞培养箱购于ThermoFisher 公司;DHT 以及渥曼青霉素(wortmannin,WM)购于APExBio 公司;胰蛋白酶、青/链霉素混合液(P/S)、无酚红1640 培养基、一抗稀释液购于北京索莱宝科技有限公司;胎牛血清(FBS)以及磷酸缓冲盐溶液(PBS)购于Gibco 公司;AnnexinVFITC/PI 双染细胞凋亡检测试剂盒购于上海贝博生物科技有限公司;全蛋白提取试剂盒、BCA 蛋白含量检测试剂盒、New-SUPERECL 检测试剂盒购于江苏凯基生物科技公司;B 淋巴细胞瘤2(Bcl-2)、Bcl-2 相关蛋白X(BAX)、裂解型胱天蛋白酶3(cleaved-caspase3,c-caspase3)、磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-AKT)、AR 兔抗人多克隆抗体购于ProteinTech 公司;AR 剪接变异体-7(androgen receptor splicevariant-7,AR-V7)兔抗人多克隆抗体购于Cell Signaling Technology 公司;β-Actin小鼠抗人多克隆抗体、辣根酶标记山羊抗小鼠、山羊抗兔IgG 购于北京中杉金桥公司;CCK-8 试剂盒购于赛文创新(北京)科技有限公司。
1.2 实验方法
1.2.1 C4-2B 细胞培养 C4-2B 细胞在完全培养基(90%无酚红1640 培养基,10%FBS,1%P/S)、恒温37 ℃、5%CO2培养箱中培养。48 h 更换1 次培养基,细胞贴壁生长至80%左右传代。
1.2.2 CCK-8 法检测C4-2B 细胞增殖活性 取对数生长期的C4-2B 细胞,用含乙二胺四乙酸(EDTA)的胰蛋白酶进行消化,细胞脱落变圆后,加入完全培养基终止消化过程,1 000 r·min-1离心5 min;弃去上清液,同时加入完全培养基、重悬细胞,以5 000 个/100 μL 将细胞接种至96 孔板。设置空白组、对照组(0 ng·mL-1DHT)和DHT 浓度梯度组0.125、0.25、0.5、1、2、4、8、16、32 ng·mL-1,每组设3 个复孔;CO2培养箱内培养,细胞完全贴壁后,各组予以相应处理,记为第1 天,48 h 更换含有不同浓度DHT 的完全培养基1 次,于第10 天终止培养。以换液的形式各孔加入含10%CCK-8 试剂的完全培养基,37 ℃条件孵育1 h,设置酶标仪450 nm 波长,检测各孔吸光度A 值并进行数据统计学分析。细胞存活率=[(A实验组-A空白组)/(A对照组-A空白组)]×100%。
1.2.3 细胞形态学观察 取对数生长期C4-2B细胞,接种于6 孔板,使每孔细胞为1.5×104个,24 h 细胞贴壁后,予DHT 干预。设置对照组(0 ng·mL-1)、DHT 处理组(0.25、0.5 ng·mL-1);48 h 更换含相应浓度DHT 的培养基,于第7 天在倒置相差显微镜(×100)下观察细胞形态变化并拍照。
1.2.4 平板克隆形成实验检测DHT 对C4-2B 细胞增殖的影响 取对数生长期的C4-2B 细胞,用6 孔板接种细胞,密度为800 个/孔。孵育24 h待细胞贴壁后,加入0、0.25、0.5 ng·mL-1DHT 处理,于培养箱中孵育,7 d 更换1 次含相应浓度DHT 的培养基,干预第14 天终止实验。PBS 漂洗2 次,预冷甲醇固定20 min;弃甲醇,每孔加入1 mL 结晶紫溶液(0.1%)染色处理0.5 h,PBS 再次漂洗2 次,空气干燥。拍照并记录肉眼可见克隆形成数目,计算克隆形成率,每组实验重复3次,数据用Image J 进行处理。克隆形成率=(克隆形成数/接种细胞数)100%。
1.2.5 流式细胞术检测C4-2B 细胞的凋亡 收集对数期C4-2B 细胞,调整细胞浓度并均匀接种于30 mm 培养皿中,使各皿细胞数为5×104个。给予0、0.25、0.5 ng·mL-1DHT 刺激,每48 h 换液1 次,于第5 天终止。收集细胞于1.5 mL 的EP管中。4 ℃、300×g 离心5 min,弃上清液,冷PBS清洗2 遍,每管加400 μL 的1×AnnexinV-FITC 结合液,调整细胞数为1×106个/mL。先后加入8 μL的AnnexinV-FITC 染液避光孵育15 min、5 μL 的PI 染液避光孵育5 min,孵育温度4 ℃。凋亡率使用流式细胞仪检测,数据用FlowJo 进行处理。
1.2.6 Western blot 检测C4-2B 细胞AR、ARV7、Bcl-2、BAX、c-caspase3、p-PI3K、p-AKT 蛋白表达 C4-2B 细胞处于对数生长期时收集并接种于60 mm 培养皿中,待细胞贴壁生长到50%~60%时,分别加入0、0.25、0.5 ng·mL-1DHT进行处理,设0 ng·mL-1DHT 为对照组,检测相关蛋白表达情况。抑制剂选用磷酸化磷脂酰肌醇-3-激酶(phosphatidylin ositol-3-kinase,PI3K)特异性抑制剂WM 干预,检测该通路的效应[8]。设0 ng·mL-1对照组、0.5 ng·mL-1DHT 处理组、3 μmol·mL-1WM 处理组、0.5 ng·mL-1DHT 和3 μmol·mL-1WM 联合处理组,刺激72 h。收集细胞,用含有蛋白酶、磷酸酶抑制剂的裂解液,冰上裂解细胞提取总蛋白,蛋白总量以具氰基丙烯酸正丁酯(BCA)法确定,以总体积的50%比例加入5 倍浓度蛋白上样缓冲液充分混匀,金属浴锅处理100 ℃8 min 后,变性蛋白储存于-20 ℃用于后续实验。以10%的SDS-PAGE 凝胶120 V 电泳条件分离蛋白,320 mA 恒流1 h 将不同分子质量蛋白转至0.45 μm 或0.22 μm 的PVDF 膜上;封闭液(5%脱脂奶粉)常温下封闭膜2 h,PBST 洗膜1 次,8 min;内参选择β-Actin(1∶2 000),分别加BAX(1∶10 000)、Bcl-2(1∶3 000)、c-caspase3(1∶1 000)、AR(1∶2 000)、AR-V7(1∶1 000)、p-PI3K(1∶2 000)、p-AKT(1∶2 000)、β-Actin 一抗孵育2 h,PBST 洗膜3 次,每次10 min;二抗(1∶5 000)孵育1 h,PBST 洗膜3 次,每次12 min;ECL 发光液制备,使用荧光图像分析仪曝光拍照。曝光后用Image J 进行条带灰度值检测,对目的蛋白灰度值与内参蛋白β-Actin 灰度值比值进行统计学分析。
1.3 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,组间对比采用单因素方差分析(ANOVA);以百分比(%)描述计数资料。P≤0.05 为差异有统计学意义。
2 结果
2.1 DHT 抑制C4-2B 细胞增殖
细胞增殖活性结果显示,不同浓度DHT 处理C4-2B 细胞后,0.125、0.25、0.5、1、2、4、8、16、32 ng·mL-1组存活率分别为(0.686±0.05)%、(0.590±0.06)%、(0.43±0.03)%、(0.415±0.03)%、(0.331±0.04)%、(0.218±0.03)%、(0.202±0.01)%、(0.193±0.01)%、(0.194±0.01)%,与对照组(0 ng·mL-1DHT)相比,DHT 浓度呈梯度增加时,各组C4-2B细胞的存活率均降低(P 均<0.01)。在0.125、0.25、0.5 ng·mL-1各组[生理剂量范围(0.11~0.96 ng·mL-1)]间细胞存活率比较差异均具有统计学意义(P 均<0.01);在1、2、4 ng·mL-1各组[超生理剂量范围(>0.96 ng·mL-1)]间细胞存活率差异也均具有统计学意义(P 均<0.05),而4、8、16 及32 ng·mL-1DHT 处理组间细胞存活率差异均无统计学意义(P 均>0.05),见图1。
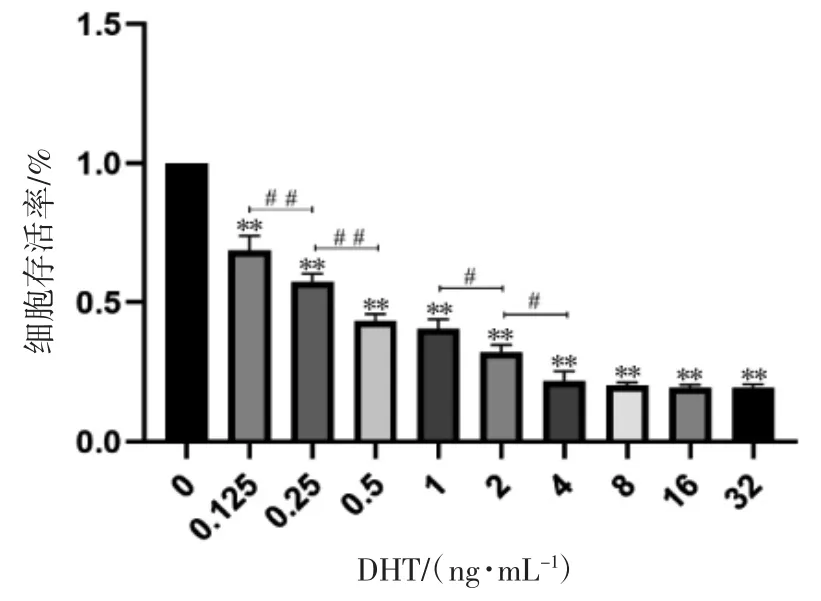
图1 不同浓度DHT 对C4-2B 细胞存活率的影响
2.2 DHT 对C4-2B 细胞数量、形态的影响
选用0、0.25、0.5 ng·mL-1剂量DHT 处理C4-2B 细胞7 d。对照组(0 ng·mL-1DHT)C4-2B细胞生长状态好,呈梭形,细胞间相互接触,不易脱落,基本无漂浮细胞;0.25、0.5 ng·mL-1DHT 处理细胞后,可见贴壁细胞体积缩小、变圆,周围可见大量细胞碎片,细胞形状呈不规则改变,细胞贴壁能力减弱,易脱落,可见大量漂浮死细胞,整体细胞密度较对照组明显减少,见图2。
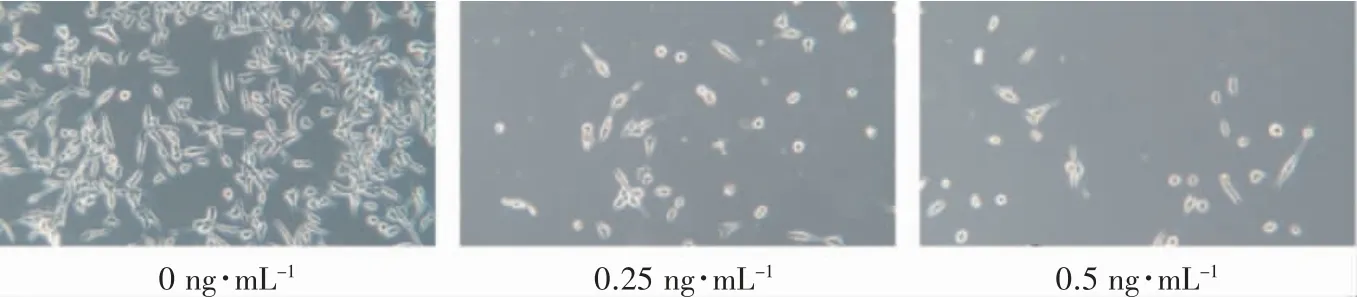
图2 不同浓度DHT 对C4-2B 细胞形态的影响(相差显微镜×100)
2.3 DHT 抑制C4-2B 细胞克隆形成能力
克隆形成实验结果显示,0.25、0.5 ng·mL-1DHT 处理组细胞克隆形成率分别为(16.67±1.7)%、(12.5±0.9)%,与对照组(0 ng·mL-1DHT)克隆形成率(22.7±1.9)%相比,克隆形成率均减少(P 均<0.01),所形成的克隆体积较小、染色变浅,见图3。
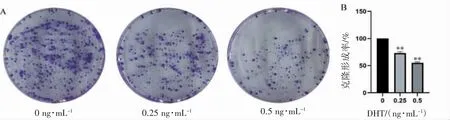
图3 DHT 对C4-2B 细胞克隆形成能力的影响
2.4 DHT 增加C4-2B 细胞的凋亡率
流式细胞术测定凋亡结果显示,0.25 ng·mL-1DHT 组凋亡率[(9.83±0.70)%]低于0.5 ng·mL-1DHT 组凋亡率[(13.1±0.4)%](P<0.01),且0.25、0.5 ng·mL-1DHT 凋亡率均高于对照组(0 ng·mL-1DHT)[(7.19±0.80)%](P 均<0.01),见图4。
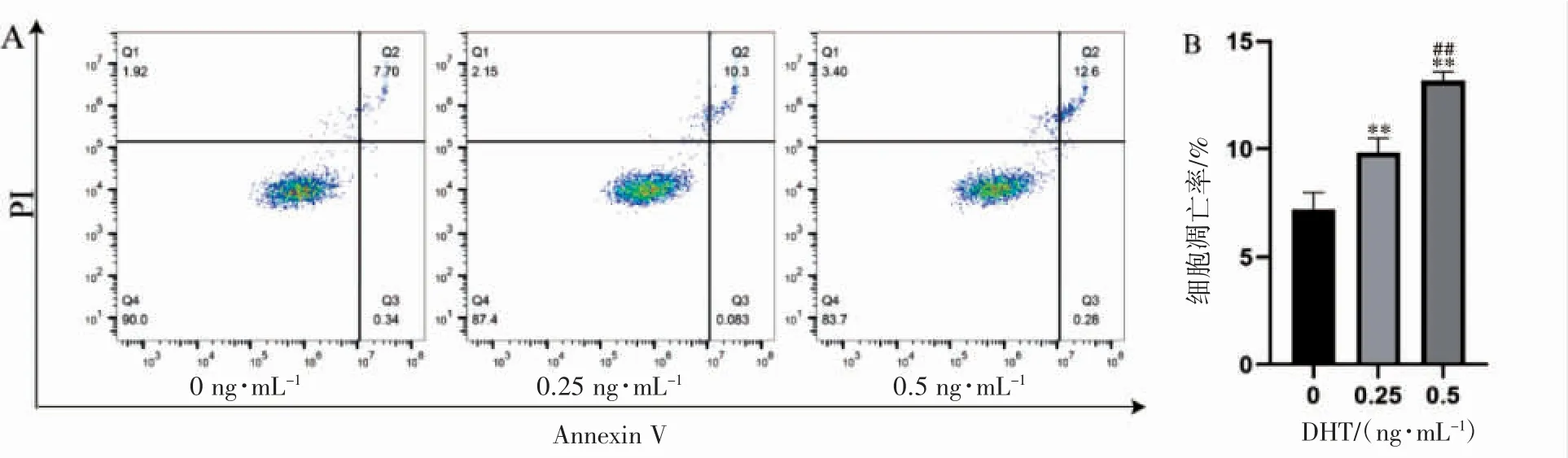
图4 DHT 对C4-2B 细胞凋亡的影响
2.5 DHT 对C4-2B 细胞凋亡相关蛋白BAX、Bcl-2、c-caspase3 蛋白表达的影响
Western blot 检测各组凋亡相关蛋白结果显示,与对照组(0 ng·mL-1DHT)相比,C4-2B 细胞中0.25、0.5 ng·mL-1DHT 处理组Bcl-2 蛋白表达均下调(P 均<0.05);与对照组(0 ng·mL-1DHT)相比,0.25、0.5 ng·mL-1DHT 处理组BAX、c-caspase3 蛋白表达量均上调(P 均<0.01),而0.25、0.5 ng·mL-1DHT 处理组BAX/Bcl-2 比值也增加(P均<0.05),见图5。
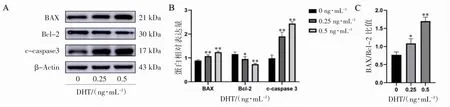
图5 Western blot 检测DHT 对C4-2B 细胞Bcl-2、BAX、c-caspase3 凋亡相关蛋白表达的影响
2.6 DHT 对C4-2B 细胞p-PI3K、p-AKT、AR、AR-V7 蛋白的表达的影响
Western blot 检测DHT 处理C4-2B 细胞后对照组及各DHT 处理组p-PI3K、p-AKT、AR、AR-V7 蛋白表达结果显示,与对照组(0 ng·mL-1DHT)相比,0.25、0.5 ng·mL-1DHT 处理组C4-2B细胞p-PI3K、p-AKT、AR、AR-V7 的蛋白表达量均下调(P 均<0.05),见图6。
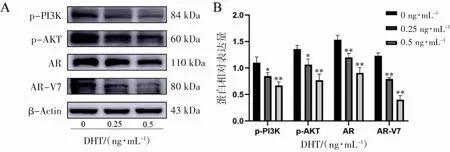
图6 Western blot 检测DHT 对C4-2B 细胞p-PI3K、p-AKT、AR、AR-V7 蛋白表达的影响
2.7 DHT 通过抑制PI3K 信号通路抑制C4-2B细胞AR、AR-V7 蛋白表达,促细胞凋亡
Western blot 检测PI3K/AKT 通路相关蛋白、凋亡相关蛋白BAX、Bcl-2、c-caspase3 以及AR、AR-V7 蛋白表达结果显示,单用DHT 或WM(3 μmol·L-1)处理C4-2B 细胞后,与对照组(0 ng·mL-1DHT)相比,BAX、c-caspase3 蛋白表达上调,同时Bcl-2、p-PI3K、p-AKT、AR、AR-V7 蛋白表达水平下调(P 均<0.05),并且0.25、0.5 ng·mL-1DHT 处理组BAX/Bcl-2 比值均增加(P 均<0.05)。联合应用DHT(0.5 ng·mL-1)、WM(3 μmol·L-1)共同处理C4-2B 细胞,与单用DHT(0.5 ng·mL-1)或WM(3 μmol·L-1)组相比,上述蛋白趋势性变化更加明显(P<0.01),见图7。
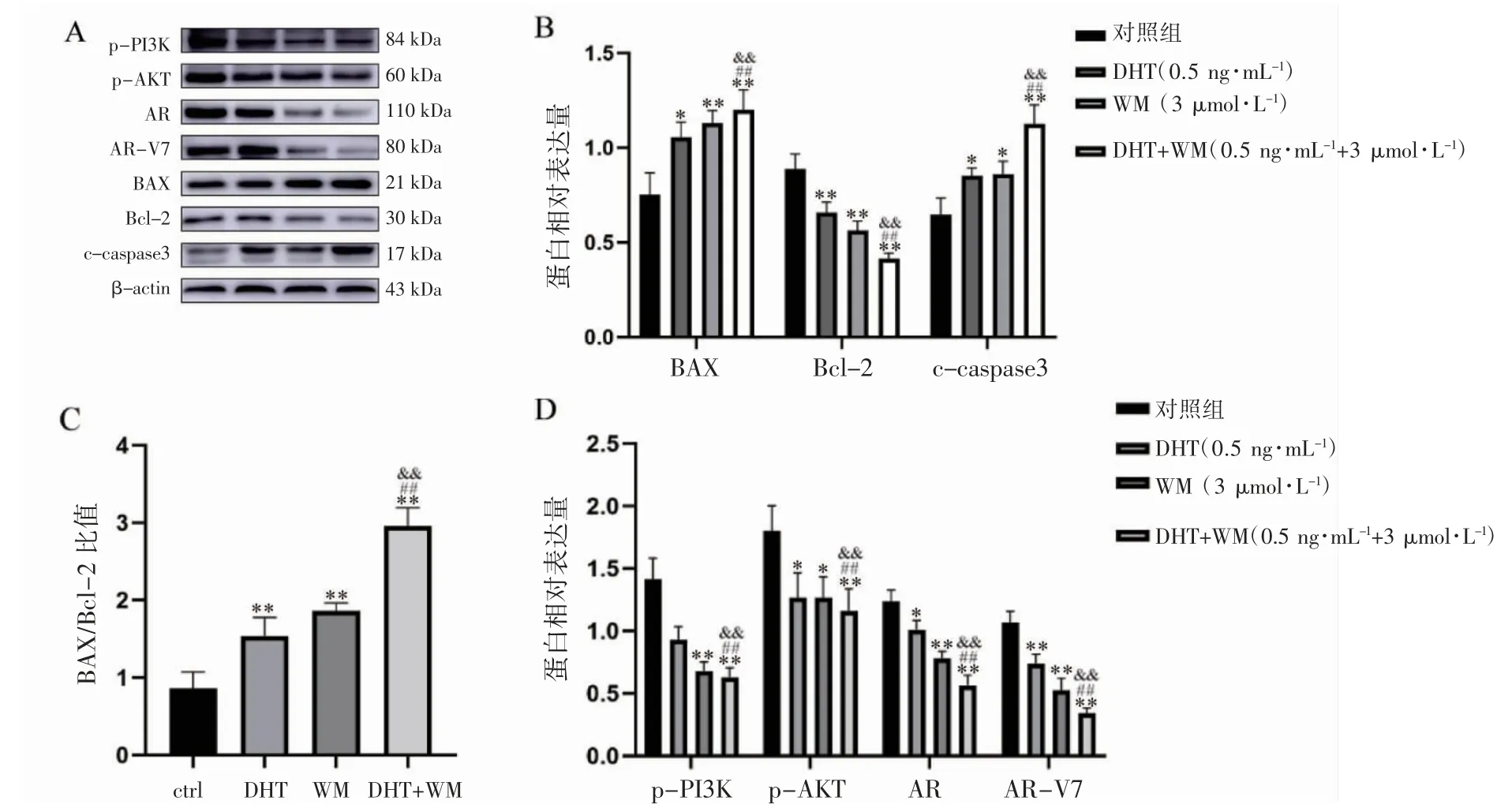
图7 DHT、wortmannin 单用或联合作用对C4-2B 细胞凋亡相关蛋白以及PI3K/AKT 通路蛋白表达的影响
3 讨论
雄激素剥夺理念最早由Huggins 提出,至今仍是PCa 的主要治疗方案[9]。但部分学者发现,给予不同剂量雄激素干预也会抑制PCa 细胞的增殖。Song 等[10]用不同浓度的睾酮和DHT 处理PCa细胞10 d 或20 d,AR 阳性的LNCaP 和MDAPCA2b细胞在DHT 生理水平范围内(0.11~0.96 ng·mL-1,MayoClinic)即表现出明显抑制效应;而AR 阴性的DU145 与PC3 细胞未见明显抑制效应。转染AR 于AR 阴性的PCa 细胞CWR22RV1 后,Isaacs等[11]观察到生理水平的雄激素可促其发生凋亡,提示在雄激素抑制PCa的增殖过程中,AR 信号的表达发挥关键作用。一项体内研究还发现,雄激素可抑制恩杂鲁胺耐药CRPC 移植瘤的增殖[12]。
C4-2B 细胞是由LNCaP 与骨基质细胞系细胞MS 相互作用得到的恶性程度较高的雄激素非依赖性细胞,其对激素不敏感并具有骨转移能力,可作为临床难治性PCa 的模型使用[13]。首先,使用对AR 具有高活性的DHT 作为靶向药物刺激C4-2B 细胞,浓度范围参考Song[10]的实验。CCK-8 结果提示,随着DHT 浓度增加,对C4-2B细胞增殖的抑制作用逐渐增强,在生理剂量内,呈浓度依赖性,在超生理剂量范围内,浓度依赖性不显著,即抑制作用存在一个平台期,继续增大DHT 浓度,抑制效应未见明显变化,这与Song 等[10]实验结果部分一致。因在生理剂量范围内,DHT对C4-2B 有抑制作用,因此本研究选择0.25 和0.5 ng·mL-1的DHT 进行后续实验。
显微镜下直接观察发现,DHT 处理细胞7 d后细胞贴壁能力变差、形态不规则、数量减少,提示可能与细胞凋亡增强有关。克隆形成实验结果显示C4-2B 克隆形成率可因DHT 的干预而降低。流式细胞术实验提示DHT 处理可使细胞凋亡率增加,提示生理浓度DHT 即可通过增加细胞凋亡水平抑制C4-2B 增殖。这与Joly-Pharaboz等[14]用合成雄激素类似物(R1881)100 和0.5 nm的DHT 处理LNCaP 细胞的结果相符。
细胞凋亡是由Bcl-2 家族介导的细胞程序性死亡过程,其中BAX、Bcl-2 以及活化的c-caspase3是参与此过程的重要蛋白,BAX/Bcl-2 是评估细胞凋亡的重要指标[15-16]。Western blot 结果显示,DHT 处理细胞后,c-caspase3 以及BAX 蛋白表达均上调,Bcl2 蛋白表达下调,BAX/Bcl2 比例增大;提示诱导细胞凋亡可能是DHT 抑制C4-2B细胞增殖的主要原因。
在PCa 的进展中,由于第10 号染色体缺失的磷酸酶及张力蛋白同源物的缺失,其下游信号通路PI3K/AKT 反复激活,是PCa 进展的重要诱因之一[17-18]。目前有研究[19]发现,PI3K/AKT 信号通路与AR 信号通路之间具有相关性。Liu 等[20]研究发现雄激素可通过PI3K/AKT 信号通路激活AR 诱导前列腺特异抗原(prostate specific antigen,PSA)的表达。本研究显示,给予DHT 处理C4-2B 细胞可引起p-PI3K、p-AKT、AR 蛋白表达量减少,可能是其诱导细胞凋亡的重要原因。给予PI3K特异性抑制剂WM 干预,p-PI3K、p-AKT、AR 表达量也减少,而细胞凋亡相关蛋白水平增加;DHT联合WM 干预后,p-PI3K、p-AKT、AR 表达下调更加显著,提示DHT 可能通过抑制PI3K/AKT/AR信号通路促进C4-2B 细胞的凋亡,从而抑制其增殖。本研究还显示,给予DHT、WM 联合干预后,AR-V7 与AR 呈现同样的变化趋势。AR 是配体依赖型的类固醇受体,但在去势条件下,其AR转录组可发生适应性改变,致缺乏配体结构域的AR剪接变异体转录增多,进而促PCa 细胞的增殖,这是CRPC 发生的重要原因之一[21-22]。提示DHT还可能通过抑制PI3K/AKT/AR-V7 信号通路促C4-2B 细胞凋亡。
综上所述,生理浓度DHT 可通过促进细胞凋亡,抑制C4-2B 细胞增殖,这可能与PI3K/AKT信号通路被抑制进而下调AR、AR-V7 有关;但AR、AR-V7 在此过程中的作用差异还有待进一步明确。本研究有望为CRPC 阶段的PCa 治疗提供简单而费用低廉的治疗措施线索。

