基于网络药理学研究黄芩治疗慢性乙型病毒性肝炎的作用机制
胡 泊, 孟祥云, 丁瑞洁, 李明芳, 段贤春
(1.安徽医科大学附属合肥市第二人民医院,合肥 230001; 2. 合肥市蜀山区小庙镇中心卫生院,合肥 230012;3.安徽中医药大学第一附属医院药学部,合肥 230031)
慢性乙型病毒性肝炎(CHB)是我国常见传染性疾病,一般以恶心、乏力、肝功能异常等临床表现为主。该病治疗周期长,若治疗不当最终可发展为肝硬化甚至肝癌。2014 年我国1~27 岁乙肝病毒易感染人群流行病学调查显示,国内该年龄段乙肝病毒易感人群构成比约35%,其中5~14岁年龄段有乙肝病毒疫苗史者的构成比较2006年提高了约8%[1],这得益于我国长期以来对该病实施预防为主、防治结合的应对策略[2]。目前我国CHB 患者约有7 000 万例[3]。西医治疗CHB 以抗病毒为主,通常使用干扰素或核苷类药物,但存在药物治疗效果差、不良反应大、容易产生耐药性等缺点[4-5]。中医认为该病病因病机主要是疫毒、湿热、正虚、肝郁,故应该采取疏肝理气、清化湿热的治疗方法[6]。
中药黄芩为唇形科多年生草本植物黄芩(Scutellaria baicalensis Georgi)的干燥根,具有清热燥湿、泻火解毒的功效,主要产自我国黑龙江,辽宁等地区[7]。《神农本草经》中称黄芩“味苦、性寒、主治诸热黄疸”,《雷公药性赋》中称其“治诸热、兼主五淋”。传统中医学认为黄芩对多种疾病均具有明显治疗效果,但因治疗疾病的药物活性成分和作用机制不明确,在一定程度上限制了该药的应用。
网络药理学是系统生物学的重要组成部分,是研究多靶点干预疾病网络以达到理想药物治疗效果的理论[8]。基本原理是通过药代动力学相关数据库和分析平台,采用现在计算机分析技术构建“药物成分-疾病-基因”关系网,明确药物所含有的多种成分是通过哪种手段和途径对疾病产生了治疗作用,最终为临床降低药物不良反应以及新药研发等提供参考意见。本文运用网络药理学的研究方法,探讨黄芩治疗CHB 的活性成分及其可能的作用机制,以期为深入研究和提高临床用药价值提供线索。
1 研究方法
1.1 筛选药物活性成分
对药物而言,人体内吸收、分布、代谢及排泄是四个最重要的药物代动力学过程。中药的入血成分是中药有效成分的体现[9]。本课题组选择能够评价药物口服吸收入血速度、程度的生物利用度(OB)和能够体现化合物、已知药物相似度的类药性(DL)这两个指标,通过中药系统药理学数据库与分析平台(TCMSP)对黄芩中活性成分进行筛选。具体要求为生物利用度(OB)>30%,类药性(DL)>0.18[10]。
1.2 筛选药物和疾病的共有靶基因
通过中药系统药理学数据库与分析平台(TCMSP)数据库[11]收集黄芩活性成分靶点,用Uniport 数据库(http://associazione-uniport.org/)对其靶基因进行标注。通过Genecards 数据库(https://www.genecards.org/)和Omim 数据库(https://www.omim.org/)收集人CHB 靶基因,将二者比较后提取相同靶基因。
1.3 构建“药物成分-疾病-靶点”关系图
将收集到药物活性成分及共有靶基因等信息输入可图形化分析软件Cytoscape 3.6.1[12]中建立“药物成分-疾病-靶点”关系图。
1.4 绘制蛋白互作网络图
在String 11.0[13]数据库(https://string-db.org/cgi/input.pl)中,以人类(Homo Sapiens)为背景,将收集到的药物-疾病共有靶基因信息输入其中,绘制蛋白互作网络(PPI)。PPI 中的节点(Node)代表基因或者蛋白,节点之间的相互作用以边(Edge)来体现,与某单个节点相互作用的节点总数称为度(Degree)。
1.5 GO 富集分析和KEGG 富集分析
为了研究药物活性成分在治疗疾病时参与的生物学过程和作用通路,本课题组把该药物-疾病共有靶基因ID 列表输入到程序(版本号3.6.2)中使用Bioconductor 平台(https://www.bioconductor.org/)提供的生物信息分析程序包,以P<0.05和Q<0.05 为条件进行GO 和KEGG 富集分析,并将分析结果进行图文展示。
2 结果
2.1 药物活性成分筛选结果
按照OB>30%及DL>0.18 的筛选标准,从TCMSP 数据库中共筛选出黄芩活性成分36 种,后期又发现有4 种化合物靶点与目标疾病相关基因无交集,故最终确定32 种活性化合物,见表1。
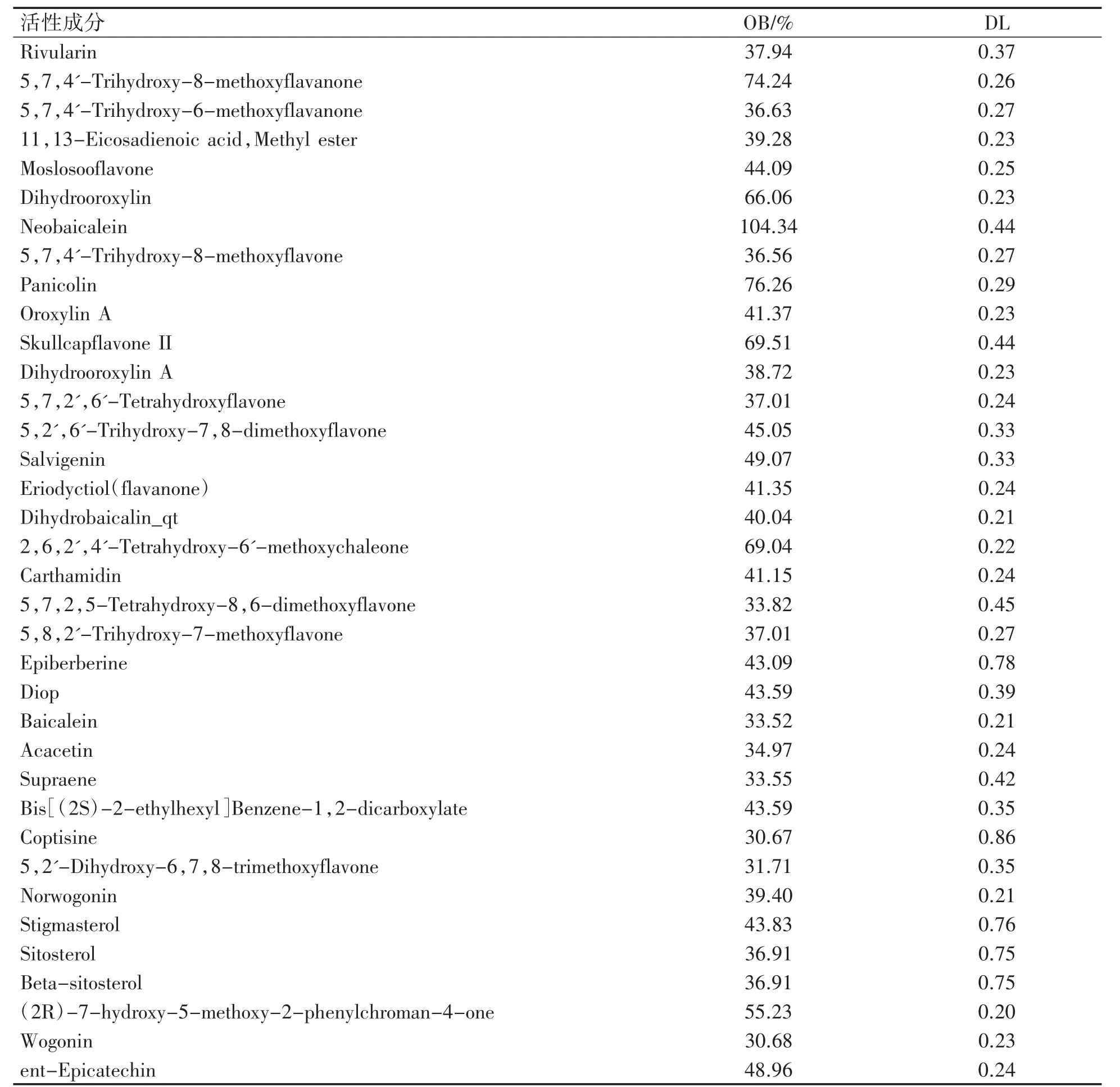
表1 黄芩活性成分
2.2 药物-疾病共有靶基因预测
从TCMSP 数据库中得到了黄芩有效成分的靶点96 个,用Uniport 数据库对这96 个靶点进行相应靶基因的标注。通过Genecards 和Omim数据库以“chronic viral hepatitis B”为关键词共得到人类CHB 相关基因6 388 个。将二者取交集最终得到黄芩和CHB 共有靶基因NOS2、PTGS1 等共计85 个。
2.3 “药物成分-疾病-靶点”可视化网络
通过Cytoscape 3.6.1 程序建立黄芩-CHB 的“药物成分-疾病-靶点”可视化网络图(图1),并使用程序自带的“NetworkAnalyzer”工具对其进行分析。分析结果中包含各网络节点的度值(Degree)。度值的大小反映了该节点在“药物成分-疾病-靶点”可视化网络图中的重要程度。度值越大,说明越可能是黄芩治疗CHB 中的重要靶基因或活性分子。度值排名前10 的基因和药物活性分子见表2。
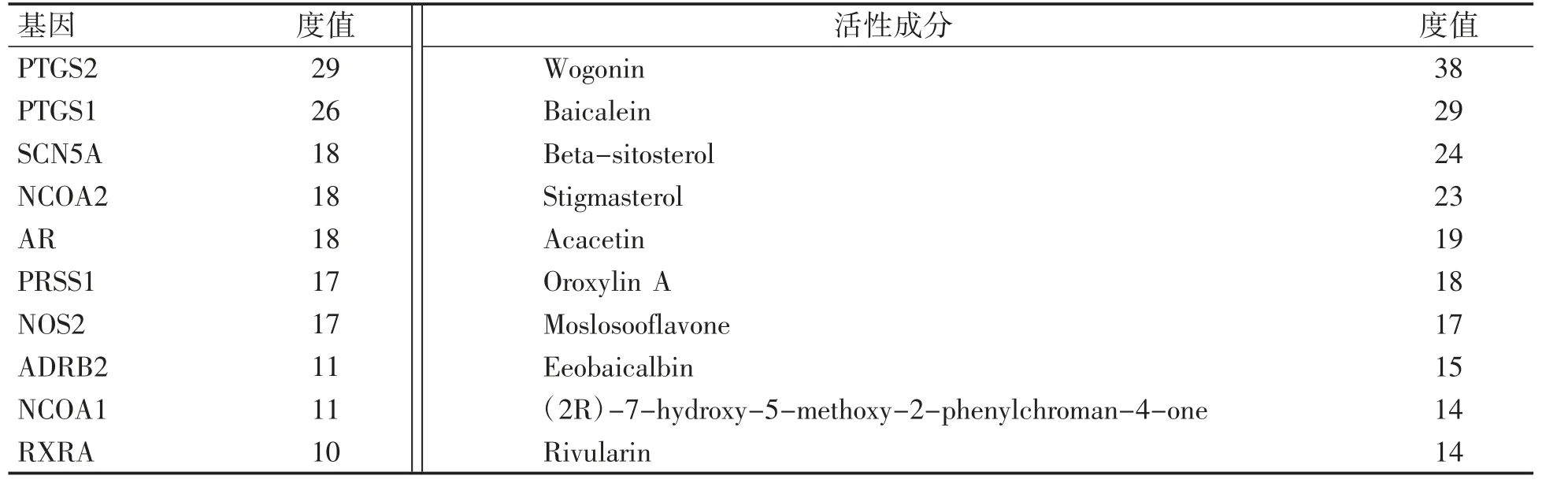
表2 排名前10 位的基因及活性成分的度值

图1 “药物成分-疾病-靶点”可视化网络图
2.4 蛋白互作网络图(PPI)的构建
以人类为背景,设最低蛋白互作值>0.9 为前提条件,将前述收集到的药物-疾病共同靶基因信息输入String 11.0 数据库中进行PPI 网络的绘制(图2)。该网络图中共有节点85 个,边302条,平均节点度为7.11。以每个节点的邻接节点数目为横坐标,选取邻接节点数排名前20 的节点绘制条形图(图3)。这20 个节点所代表的靶基因有可能是参与黄芩治疗CHB 的关键基因,大部分都与机体炎症反应相关。
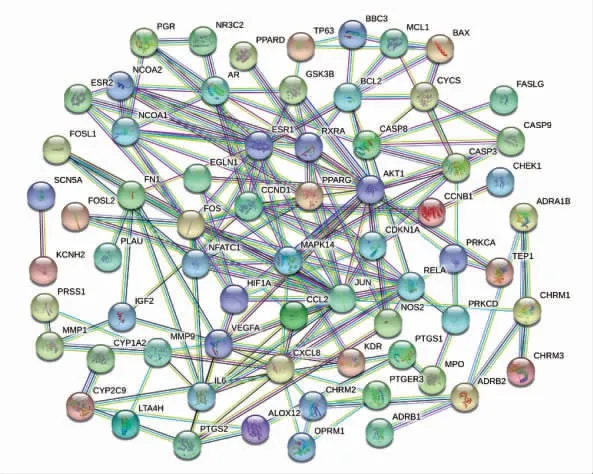
图2 黄芩-慢性乙型病毒性肝炎的PPI 网络图
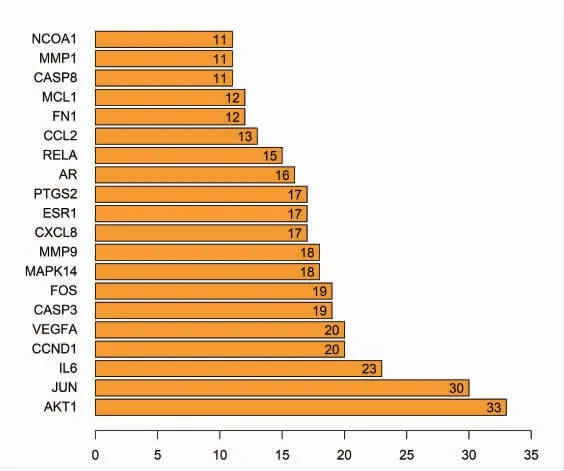
图3 关键基因的柱状图
2.5 GO 功能富集分析结果
使用R 语言程序对黄芩和CHB 的共有靶基因进行GO 富集分析,并将结果可视化(图4)。GO富集分析得到132 种基因功能。按Q-Value 对这些功能进行从小到大排列,排名前5 位的生物学功能依次为细胞核受体活性、转录因子活性、直接配体调节序列特异性DNA 结合、类固醇激素受体活性与RNA 聚合酶Ⅱ转录因子结合以及与血色素结合。GO 富集分析结果提示黄芩通过多种生物学功能协同作用对CHB 产生出治疗效果。
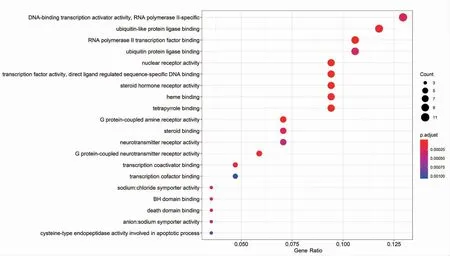
图4 黄芩-慢性乙型病毒性肝炎的GO 富集分析结果
2.6 KEGG 通路富集分析结果
在P<0.05,Q<0.05 的前提下,得到了124 条KEGG 通路并可视化(图5)。对这些通路按照Q从小到大排列,排名前5 位的通路分别是糖尿病并发症中的AGE-RAGE 信号通路、卡波西氏肉瘤相关疱疹病毒感染、乙型肝炎、人巨细胞病毒感染以及IL-17 信号通路。上述通路可能是黄芩对CHB 发挥治疗作用的关键通路。
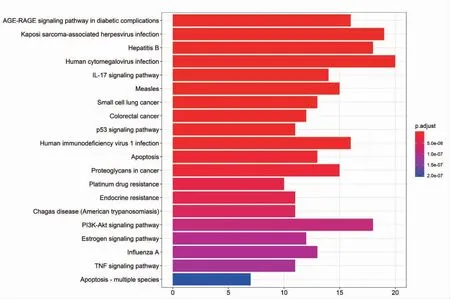
图5 黄芩-慢性乙型病毒性肝炎的KEGG 富集分析结果图
3 讨论
有研究[14]证实CHB 的肝细胞伤害并不完全在于乙肝病毒的直接作用,机体对乙肝病毒的免疫应答是其中一个重要因素。通过分析,本课题组发现黄芩所含有的汉黄芩素(Wogonin)、黄芩素(Baicalein)、β-谷甾醇(Beta-sitosterol)、豆甾醇(Stigmasterol)等药物活性分子是黄芩治疗慢性乙型病毒性肝炎的关键成分。丙二醛是细胞脂质过氧化的终产物,其细胞内含量可间接反映细胞损伤的程度。国内外研究[15-16]发现CHB 患者体内的丙二醛水平明显高于正常人。豆甾醇能够降低CHB 患者体内的丙二醛水平[17],有利于保护受损的肝细胞。β-谷甾醇在抑制脂质过氧化的同时可降低血清总胆固醇和低密度脂蛋白的水平[18],同样能起到保护受损肝细胞的作用。
黄芩素和汉黄芩素都是黄芩中重要的黄酮类成分。有研究[19]表明这两种物质均能抑制对恩替卡韦耐药的乙肝病毒的DNA、HBsAg 及cccD NA,二者联用则效果更佳[20]。黄芩素在动物体内可迅速转化为黄芩苷及其他代谢物[21]。黄芩苷因具有酚羟基结构,不仅能够抑制体内自由基脂质过氧化反应,还可以减少乙肝病毒的复制和传播[22]。目前国内已经出现采用黄芩苷为主要成分的中药制品用于急慢性肝炎的辅助治疗,如黄芩苷胶囊、茵栀黄颗粒等。2018 年版慢性乙型肝炎中医诊疗指南还将茵栀黄颗粒作为湿热蕴结型慢性乙型肝炎治疗推荐用药[23]。黄新造等[24]发现肝苏胶囊治疗HBV 时联用黄芩苷胶囊可以降低患者的HBV-DNA 水平,减轻肝脏纤维化的程度,效果优于单一用药。刘仁伟等[25]使用胸腺法新联合黄芩苷胶囊治疗HBV 亦得到与之相似的治疗效果。汉黄芩素的活性代谢产物汉黄芩素苷(Wogonoside)对CHB 病毒也具有较强的抑制作用[26]。
本研究中“药物成分-疾病-靶点”网络图以及PPI 网络图均显示PTGS2、AKT1 和SCN5A 等靶点参与了黄芩治疗CHB 的过程。丝氨酸/苏氨酸激酶B(AKT)是糖代谢的关键调控因子,由AKT1、AKT2 和AKT3 三个亚基组成,可间接调控核苷酸合成的重要原料5-磷酸核糖的生成。实验证实AKT 的活性与乙肝病毒DNA 在肝细胞中的载量呈正相关[27],提示使用AKT 抑制剂可减少病毒的复制和传播。花生四烯酸(AA)代谢途径可产生多种物质诱导炎症因子的生成和释放。前列腺素内过氧化物合酶2(PTGS2)是AA 代谢途径中AA 转化为前列腺素的限速酶,因此抑制PTGS2的活性有助于减轻炎症因子对肝细胞的破坏。此外PTGS1、RELA、IL-6 等因子也是机体炎症反应中的重要参与者。黄芩对AA 代谢途径多个环节具有明显抑制作用[28]。维持机体抑炎因子和致炎因子的平衡可能是黄芩减少肝细胞损伤的重要手段。
GO 和KEGG 富集分析结果显示了黄芩的多种途径治疗CHB 的特点,IL-17 通路是其中之一。有实验[29]证实IL-17 可通过辅助性T 细胞17(TH17)分泌。它作为促炎因子之一,参与了CHB的炎症过程。在慢性肝病发展的过程中,IL-17 的血清水平与肝脏的损伤程度呈正相关[30],降低血清IL-17 水平亦能够起到保护肝细胞的作用[31]。
综上所述,黄芩对CHB 的治疗作用体现了中药多成分、多靶点、多途径综合治疗疾病的特点,这些成分和靶点的发现为下一步通过体内外实验论证本文的研究成果提供了有力的理论和数据支持。

