宫腔镜电切联合孕激素治疗子宫腺肌病的效果研究
桂甜甜, 张小倩, 赵秉莳, 马鸿云
(宁夏回族自治区人民医院/西北民族大学第一附属医院,银川 750001)
子宫腺肌病是子宫内膜腺体及间质侵入子宫肌层并广泛生长,造成弥漫或局限性的病变,好发于育龄期女性。随着人工流产率和剖宫产率的升高,子宫腺肌病的患病率也显著上升[1-2]。子宫腺肌病病变范围广、侵袭性高和复发率高,其治疗效果不尽人意,根治性治疗需切除子宫,年轻患者往往不能接受。宫腔镜电切术对于无生育要求但要求保留子宫的患者提供了更多选择[3-5],尤其适用于病灶较为局限的子宫腺肌病患者[6]。但宫腔镜电切术后病情极易复发,需要术后予以孕激素治疗预防复发。
左炔诺孕酮宫内缓释系统(levonorgestrel-releasing intrauterine system,LNG-IUS)是一种宫内高效孕激素释放系统。地诺孕素(dienogest,DNG)是近年开始应用的一种新型高效孕激素。本研究回顾性分析宁夏回族自治区人民医院妇产科诊断为子宫腺肌病且经宫腔镜电切术治疗的90 例病例,对“宫腔镜电切术后联合LNG-IUS 治疗”与“宫腔镜电切术后联合DNG 治疗”在相关指标及不良反应发生情况加以分析,探讨在宫腔镜电切术后选择DNG 和LNG-IUS 是否可以达到同样的治疗效果。
1 资料与方法
1.1 一般资料
回顾性分析宁夏回族自治区人民医院妇产科2018 年1 月1 日至2019 年12 月31 日,诊断为子宫腺肌病且接受宫腔镜电切术治疗的90例病例,根据术后治疗方案不同进行分组:对照组(50 例)采用LNG-IUS[生产企业:Bayer Schering PharmaOy,规格:52mg/(个/盒),批准文号J20090144]治疗。患者取膀胱截石位,常规消毒、铺巾,充分暴露宫颈,使用探针确定宫腔的具体深度,宫腔置入LNG-IUS,预留1 cm 左右尾丝便于日后取出,1 次放置可维持5 年有效。实验组(40 例)采用DNG(拜耳公司,规格:2 mg×28 片/盒;批号H20180090)治疗:每次口服2 mg,每天1 次(最好同一时间),不间断,可于月经期任意一天开始服用[7]。比较两组患者经不同方案治疗6 个月后的子宫体积、月经量评分、痛经评分、血清糖类抗原125(CA125)和人附睾蛋白4(HE4)的水平变化,同时观察经两种不同方案治疗后随访6 个月出现的不良反应发生情况。
1.2 纳入及排除标准
纳入标准:1)符合子宫腺肌病诊断标准[2],且经术前、术中至少2 次B 超监测、定位,符合腺肌病病灶局限于宫腔内的子宫腺肌病[6],即腺肌病病灶浸润子宫内、不影响子宫外部结构,满足B超提示存在突向宫腔的腺肌病病灶、直径≤3 cm,腺肌病病灶边缘距浆膜层在1 cm 以上;2)进行宫腔镜电切术先行治疗,并进行后续孕激素治疗;3)非LNG-IUS 和DNG 过敏者;4)无生育要求,且要求保留子宫。排除标准:1)合并肝肾功能不全、心脑血管疾病等各种严重危及生命的急、慢性疾病和精神病患者;2)中途中断治疗与不能坚持随访者;3)合并宫腔镜手术及宫内节育器放置的禁忌证;4)患有血栓性疾病者。
1.3 宫腔镜手术方法[3-5]
所有患者入院治疗前均在门诊进行术前评估;对于合并贫血、糖尿病、心脏病、高血压、肝肾功能不全等慢性疾病患者请相关科室进行术前干预及纠正,同时请麻醉科医师进行麻醉评估;对于急性炎症期患者术前积极、规范抗炎治疗;所有入院治疗患者需排除手术及麻醉禁忌证,于患者月经结束后3~7 d 收住院待手术,手术当天清晨禁饮、食,术前10 min 静滴间苯三酚(南京恒生制药有限公司,规格40 mg,国药准字H20048788)80 mg。手术麻醉均选择静脉麻醉。手术设备选用STORZ 单极宫腔电切镜配套设备,电切镜外鞘直径为10 mm。膨宫液为甘露醇,膨宫压力100~120 mmHg,流速200 L·min-1,设置切割电极功率120 W,电凝电极功率60 W。监测设备为B 超,腹式超声引导监测下施手术。术中全面观察宫腔整体形态,结合超声判断腺肌瘤的位置、大小及大致浸润深度。置入单极针形电极纵行划开腺肌瘤表面,可见瘤结节无明显包膜;换环形电极,在B 超监测及引导下切除子宫腺肌病(或腺肌瘤)病灶,至前后壁厚度大致相等。采用“叠瓦状”方法切除剩余子宫内膜,球状电极电凝创面止血。查看宫腔无活动性出血后,术毕,切除标本全部送病检。待病理结果显示排除宫内恶性病变后,于宫腔镜术后1 个月门诊复查时宫内放置LNG-IUS 或口服DNG 进行后续治疗。
1.4 观察指标
1.4.1 子宫体积 子宫体积采用经阴道或经直肠B 超检查子宫体积:计算方法为(ABMπ/6)cm3,A、B、M 分别为子宫体的3 个径线,π=3.14[8]。宫腔镜电切术后1 个月子宫体积差值=宫腔镜电切术后1 个月子宫体积-宫腔镜术前子宫体积;孕激素治疗6 个月后子宫体积差值=治疗后6 个月子宫体积-宫腔镜电切术后1 个月子宫体积。
1.4.2 月经量评分 月经量评分采用月经失血图(pictorial blood loss assessment chart,PBAC)[9],>100 分认为经量过多,约多于80 mL;<25 分表示月经量过少,约少于20 mL。宫腔镜电切术后1个月月经量评分差值=宫腔镜电切术后1 个月月经量评分-宫腔镜术前月经量评分;孕激素治疗6个月后月经量评分差值=治疗后6 个月月经量评分-宫腔镜电切术后1 个月月经量评分。
1.4.3 痛经评分 痛经评分参考成人疼痛行为量表(adult pain behavioral scale,APBS)、疼痛程度数字评分法(numeric rating scale,NRS)[10],NRS疼痛程度范围为0~10,0 表示无疼痛,10 表示最剧烈的疼痛。数字越大,说明疼痛程度越重,由患者根据其疼痛程度选择相应的数字。宫腔镜电切术后1 个月痛经评分差值=宫腔镜电切术后1 个月痛经评分-宫腔镜术前痛经评分;孕激素治疗6个月后痛经评分差值=治疗后6 个月痛经评分-宫腔镜电切术后1 个月痛经评分。
1.4.4 血清CA125 和HE4 值 1)CA125、HE4检测方法:采集清晨空腹血8 mL,室温下静置30~60 min,以3 000 r·min-1离心15 min 后,提取上层血清,置于-70 ℃至-80 ℃冷冻箱内储存以备检测,血清CA125、HE4 的测定采用双抗体夹心酶联免疫吸附法(ELISA),试剂盒购于罗氏诊断公司,所有操作按照仪器及试剂盒说明书严格执行。CA125 正常参考范围(0~35)U·mL-1,HE4 正常参考范围(0~105.1)pmol·L-1。2)宫腔镜电切术后1 个月CA125(或HE4)差值=宫腔镜电切术后1 个月CA125(或HE4)数值-宫腔镜术前CA125(或HE4)数值;孕激素治疗6 个月后CA125(或HE4)差值=实验组或对照组治疗后6 个月CA125(或HE4)数值-宫腔镜电切术后1 个月CA125(或HE4)数值。
1.4.5 不良反应发生情况 采用问卷星调查问卷的形式,于患者持续治疗6 个月后随访时填写(其中不良反应包括闭经、阴道不规则点状出血、头晕头痛、周期性乳房胀痛、痤疮、脱环或节育环嵌顿移位等)。
1.5 统计学方法
采用SPSS 25.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t 检验,计数资料以例(%)表示,组间比较采用χ2检验或Fisher 确切概率法。P≤0.05 为差异有统计学意义。
2 结果
2.1 行宫腔镜电切术治疗1 个月后情况
实验组与对照组行宫腔镜电切术后1 个月子宫体积差值、月经量评分差值、痛经评分差值、CA125 差值、HE4 差值两组差异均无统计学意义(P 均>0.05),见表1。
表1 两组患者行宫腔镜电切术后1 个月相关指标比较(±s)

表1 两组患者行宫腔镜电切术后1 个月相关指标比较(±s)
?组别n 子宫体积差值/cm3 月经量评分差值/分 痛经评分差值/分 CA125 差值/(U·mL-1) HE4 差值/(pmol·L-1)实验组 409.25±7.5056.13±12.691.15±1.7111.30±5.401.93±5.18对照组 508.36±6.6457.56±13.041.20±1.9912.42±6.831.92±6.60 t 值0.597-0.525-0.126-0.8460.004 P 值0.5520.6010.9000.4000.997
2.2 行不同孕激素方案治疗6 个月后情况
实验组与对照组经不同孕激素方案治疗6个月后子宫体积差值、月经量评分差值、痛经评分差值、CA125 差值、HE4 差值两组差异均无统计学意义(P 均>0.05),见表2。
表2 两组患者不同孕激素方案治疗6 个月后相关指标比较(±s)
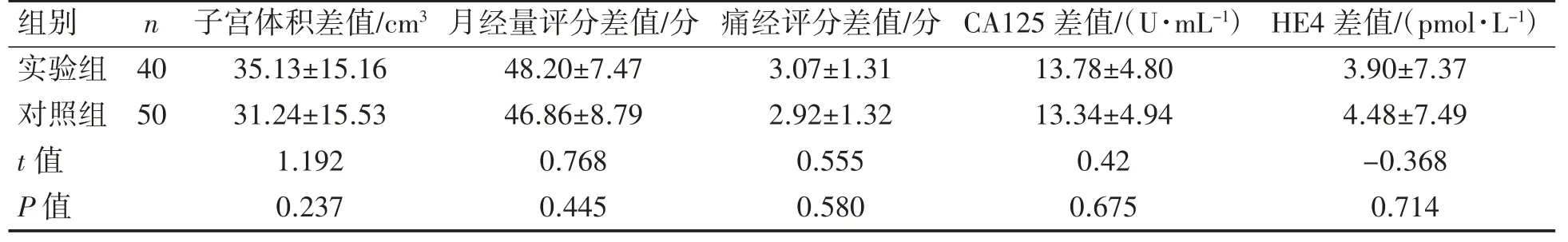
表2 两组患者不同孕激素方案治疗6 个月后相关指标比较(±s)
?组别n 子宫体积差值/cm3 月经量评分差值/分 痛经评分差值/分 CA125 差值/(U·mL-1) HE4 差值/(pmol·L-1)实验组 4035.13±15.1648.20±7.473.07±1.3113.78±4.803.90±7.37对照组 5031.24±15.5346.86±8.792.92±1.3213.34±4.944.48±7.49 t 值1.1920.7680.5550.42-0.368 P 值0.2370.4450.5800.6750.714
2.3 6 个月内不良反应情况
两组患者出现的不良反应主要表现为闭经、阴道不规则点状出血、头晕头痛、周期性乳房胀痛、痤疮、脱环或节育环嵌顿移位等。实验组与对照组在治疗6 个月出现闭经、周期性乳房胀痛、头痛头晕、痤疮方面均差异无统计学意义(P 均>0.05),但实验组阴道点状出血及脱环或节育环嵌顿的发生率低于对照组(P<0.05),见表3。

表3 两组患者治疗6 个月内出现的不良反应比较[例(%)]
3 讨论
目前,子宫腺肌病的发病机制尚不明确,普遍认为是子宫内膜的基底层受损缺乏黏膜下层,而内膜直接与肌层接触,使内膜更易侵袭肌层,形成周围肌层细胞肥大病变[11]。随着现代医疗理念的不断完善,子宫腺肌病的治疗也逐渐由子宫切除术为主的手术治疗演变为保留子宫、保留生育功能的多种方式及药物的综合治疗。宫腔镜下子宫腺肌病病灶切除相比腹腔镜及开腹子宫腺肌病病灶切除而言,具有创伤更小、出血更少、不破坏子宫的解剖结构、术后恢复更快、患者疼痛感更轻、住院时间更短等多个优势[4]。但因其适用范围有限,术前需做好充分的筛选、评估和准备,对于行宫腔镜电切术的必要性及手术的风险应慎重决择并计划足够的备选方案。本研究中纳入的所有病例均为病灶较为局限的子宫腺肌病病例,经B 超确定子宫腺肌病病灶为突向子宫黏膜层、直径≤3 cm、病灶边缘距离浆膜层>1 cm,术中通过超声监测、定位可帮助指引宫腔镜切割电极切割的方向和深度,防止子宫穿孔和临近器官损伤的发生,治疗后均获得满意的治疗效果。
LNG-IUS 是一种近年来应用广泛的宫内激素避孕环,通过每天于宫内恒定释放左炔诺孕酮20 μg,抑制异位内膜的生长、减少月经量的同时,降低了患者机体内的前列腺素Ⅰ和血栓素A2 水平,明显缓解了患者的痛经症状[12]。LNGIUS 放置及取出均非常方便且不影响患者行核磁等检查,可保持5 年有效。多年的临床经验和数位学者研究表明[13-17],LNG-IUS 对子宫腺肌病引起的月经量多和痛经症状都有满意的治疗效果,又能起到高效的避孕作用,已被普遍接受及肯定。子宫腺肌病患者往往子宫体积较大,对于宫腔较大的患者置环后环移位及脱环率相对较高[18],而且对于宫颈内口松弛患者脱环率升高。本研究显示,行宫腔镜子宫腺肌病病灶切除术后放置LNG-IUS 也可导致节育环嵌顿或脱环事件的发生,这些问题都增加了患者二次手术率、延长住院时间、增加术后并发症,降低治疗后患者满意度,而且在最初放置这段时期,不规则阴道出血情况非常普遍,放环后也有患者出现了不止一种不良反应,这些情况的发生都不同程度降低了患者的接受度,严重的甚至导致患者要求中断治疗。DNG 是一种结合了19-乙烯去甲睾酮和孕酮衍生物的药理学特性的新型孕激素[19],对子宫内膜有强烈抗雄激素活性和孕激素效应,可通过负反馈调节抑制垂体释放促性腺激素,发挥抑制子宫内膜生长、诱导子宫内膜组织萎缩的作用,而达到减少经量、缓解痛经的治疗效果。血清CA125 被证实在子宫腺肌病患者中升高,原因为异位的子宫内膜细胞可分泌CA125[20]。HE4 是一种发现于人附睾上皮由乳清酸性蛋白基因编码的分泌型糖蛋白,起初是发现其在卵巢癌患者中特异性高,在妇科良性疾病中,其数值常在正常范围内,常用于良恶性疾病的鉴别[21]。有研究显示,血清CA125、HE4 是临床反映子宫腺肌病严重程度的指标之一[22]。本研究结果显示,子宫腺肌病患者进行宫腔镜电切手术治疗前患者血清CA125 及HE4 水平较高,宫腔镜电切术后有所下降,进行LNG-IUS 或DNG 治疗6 个月后CA125及HE4 水平进一步下降。本文证实了对于子宫腺肌病病灶较为局限的患者进行宫腔镜子宫腺肌病病灶切除术后联合LNG-IUS 或DNG 同样可达到减小子宫体积、减少月经量、缓解痛经的治疗效果。我们随访发现,在采取LNG-IUS 或DNG 治疗的前3 个月,很多患者会出现淋漓不尽的阴道点状出血症状,且放置LNG-IUS 的患者更加常见,但在持续治疗6 个月后阴道点状出血症状明显减少,这与以往的研究结论一致[23-24]。与此同时,在宫腔镜电切术后选择口服DNG 继续治疗的患者无脱环或节育环嵌顿的发生,从而避免了再次手术创伤、手术风险及并发症,患者更易接受并坚持使用。
综上所述,在子宫腺肌病患者中采用宫腔镜子宫腺肌病病灶切除术联合LNG-IUS 或DNG治疗均可减小子宫体积、减少月经量多并有效缓解痛经症状,同时使血清CA125 及HE4 水平较治疗前下降,疗效肯定。采用DNG 治疗有无创的优势,避免了二次手术的创伤及风险,不良反应发生率也更低,值得临床推广应用。

