甘草甜素抑制PI3K/AKT/AR 通路诱导人前列腺癌C4-2B 细胞凋亡
杨博雅, 赵瑞宁, 王振位, 李佳鑫, 秦凯悦,郭凤英, 勉昱琛, 聂黎虹
(1.宁夏医科大学基础医学院,银川 750004; 2.宁夏医科大学总医院泌尿外科,银川 750004)
前列腺癌是一种最常见的男性恶性肿瘤,在世界范围内其发病率位列男性恶性肿瘤第二位[1]。近年来我国前列腺癌发病率呈上升趋势,已成为我国发病率增长最快的恶性肿瘤之一[2]。多数前列腺癌患者确诊时已发展至中晚期,经雄激素剥夺治疗(androgen deprivation therapy,ADT)18~36个月后,几乎均会发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),其患者预后更差[3]。因此,靶向CRPC 寻找有效防治前列腺癌的药物显得尤为重要。
甘草甜素(glycyrrhizin,GLY)为从甘草根茎中提取的三萜类化合物,是一种安全无毒的天然产物,在抗癌、抗炎及抗病毒等方面具有广泛的药理作用[4]。但GLY 是否可抑制CRPC 阶段的前列腺癌细胞及其机制目前鲜有报道。本研究采用不同浓度GLY 干预人前列腺癌C4-2B 细胞,探讨其对C4-2B 细胞增殖与凋亡的影响及可能机制,以期为丰富CRPC 临床治疗提供理论依据。
1 材料与方法
1.1 细胞株
实验所用的人前列腺癌细胞株C4-2B 由US California 大学Davis 分校Allen C.Gao 教授惠赠。
1.2 试剂
GLY 购自东京化成工业株式会社;胰蛋白酶、青霉素、链霉素购自北京索莱宝科技有限公司;胎牛血清(FBS)、磷酸缓冲盐溶液PBS、RPMI 1640 培养基购自Biological Industries 公司;CCK-8 试剂盒购自上海贝博生物科技有限公司;全蛋白提取试剂盒、BCA 蛋白定量试剂盒购自江苏凯基生物科技公司;兔抗B 淋巴细胞瘤2(Bcl-2)、兔抗Bcl-2 相关蛋白X(Bax)、兔抗裂解型胱天蛋白酶3(c-Caspase3)、兔抗磷脂酰肌醇-3-激酶(PI3K)、兔抗磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、兔抗蛋白激酶B(AKT)、兔抗磷酸化蛋白激酶B(p-AKT)、兔抗雄激素受体(androgen receptor,AR)购自Proteintech 公司;鼠抗β 肌动蛋白(β-Actin)多克隆抗体、HRP 标记的山羊抗小鼠IgG、HRP标记的山羊抗兔IgG 购自北京中杉金桥公司;渥漫霉素(WM)购于APExBio 公司;ECL 发光液购自北京赛文公司。
1.3 方法
1.3.1 细胞培养 将人前列腺癌细胞株C4-2B用含10%FBS、1%青霉素/链霉素的RPMI1640 培养基,放置于37 ℃、5%CO2培养箱内培养。
1.3.2 CCK-8 法检测 细胞存活率将处于对数生长期的C4-2B 细胞(5 000 个/孔)接种于96 孔板中,待细胞长至70%时,分别给予6.25、12.5、25、50、100、200、400、800 μmol·L-1GLY 药物处理,刺激48 h。48 h 后,取出96 孔板避光于每孔加入CCK-8 试剂10 μL,37 ℃温箱孵育1 h 后,用酶标仪在波长为450 nm 处测定吸光度值并记录。细胞的存活率=(加药组-空白组)/(对照组-空白组)×100%,生长抑制率=100%-细胞存活率。
1.3.3 集落形成实验 将处于对数生长期的C4-2B 细胞消化后接种于6 孔板中(1 000 个/孔),待细胞贴壁后,分别给予不同浓度的GLY(0、50、100、200、400 μmol·L-1)。14 d 后,弃去培养基,然后用甲醇对细胞进行固定20 min,然后用0.5%结晶紫染色15 min。当它们不少于50 个细胞聚集时,可对其进行菌落计数。
1.3.4 前列腺癌细胞计数 观察细胞的生长状态,将处于对数生长期C4-2B 细胞铺板并给予不同浓度的GLY(0、100、200、400 μmol·L-1)刺激,48 h后可以对培养的细胞进行计数。首先用胰酶对细胞进行消化,制备成单细胞悬液,离心后吸取上清再加入1 mL 新配置的完全培养基,用移液管反复吹打混匀,动作轻柔,最后使用细胞计数仪进行计数。
1.3.5 流式细胞术检测 将细胞种植于6 孔板,给予0、200、300、400 μmol·L-1GLY 刺激48 h。用不含乙二胺四乙酸(EDTA)胰蛋白酶消化,收集细胞于1.5 mL EP 管中。400×g 离心5 min,弃去培养基,用预冷的PBS 缓冲液清洗2 次,然后每管加入400 μL 的1×Annexin V-FITC 结合液调节细胞数为1×106个/mL。之后每管样品中加入5 μL Annexin V-FITC 染色液混匀,4 ℃下避光孵育15 min,最后加入5 μL PI 染色液混匀后,4 ℃下避光孵育5 min。用流式细胞仪检测细胞凋亡情况。
1.3.6 Western blot 实验 待C42B 细胞生长至约70%,分别加入0、100、200、400 μmol·L-1GLY药物处理48 h。48 h 后弃掉培养基,加入PBS 洗2 次,弃去PBS,加入胰蛋白酶消化2 min,镜下观察细胞漂浮且变圆后,加入完全培养基终止消化。在细胞悬液吹打混匀后,3 000 r·min-1离心5 min,弃上清;加1 mL PBS 吹打混匀后移入1.5 mL EP 管中,3 000 r·min-1离心5 min,弃上清得细胞。加入细胞裂解液裂解,置于冰上震荡,12 000×g 离心5 min,用全蛋白提取试剂盒提取细胞蛋白,BCA法进行蛋白定量。配置10% SDS-PAGE 蛋白电泳凝胶,120 V 电泳结束后以260 mA 恒流转膜1 h 转至PVDF 膜上,然后用5%脱脂奶粉在室温下封闭2 h;PBST 洗膜3 次,每次10 min;再加入1∶2 000 稀释的兔抗Bcl-2、1∶1 000 兔抗c-Caspase3、1∶2 000 兔抗PI3K、1∶2 000 兔抗AKT、1∶2 000 兔抗p-PI3K、1∶2 000 兔抗p-AKT、1∶5 000 稀释的小鼠抗β-Actin、1∶5 000 兔抗Bax、1∶5 000 兔抗AR 室温孵育2 h;孵育结束后,PBST 洗3 次,每次10 min;再加入1∶5 000 稀释的HRP 标记的山羊抗小鼠IgG、HRP 标记的山羊抗兔IgG,室温孵育1 h,PBST 洗3 次,每次10 min;配置ECL 发光液后使用化学发光成像仪进行曝光拍照。使用Image J软件做吸光度(A)值分析。
1.4 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(ANOVA)。P≤0.05 为差异有统计学意义。
2 结果
2.1 GLY 剂量依赖性抑制C4-2B 细胞增殖能力
与对照组(0 μmol·L-1GLY)相比,12.5、25、50、100、200、400、800 μmol·L-1GLY 组均可以抑制C4-2B 细胞的增殖(P<0.05 或P<0.01);且随着GLY 浓度增高,细胞增殖能力逐渐降低,组间对比细胞活性下降,呈剂量依赖性(P 均<0.05)。GLY 作用于C4-2B 细胞48 h,测得其IC50为321.1 μmol·L-1,见图1。
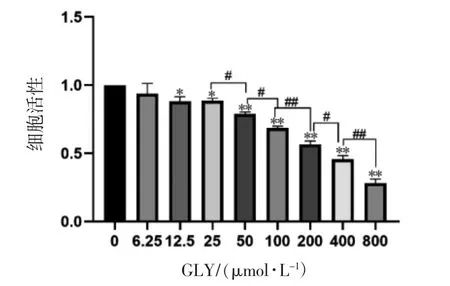
图1 不同浓度GLY 对前列腺癌C4-2B 细胞抑制率的影响
2.2 GLY 对C4-2B 细胞数目及形态影响
经显微镜观察,对照组C4-2B 细胞状态良好,贴壁生长。随着GLY 浓度升高,细胞形态发生改变,由多触角形变为单触角及梭形,细胞变窄小、皱缩,培养液中悬浮颗粒增多,细胞碎片增多。同时,加药组细胞数目与对照组比较(P 均<0.01),组间100、200 和400 μmol·L-1GLY 组的C4-2B细胞数目呈剂量依赖性减少(P 均<0.01),见图2。
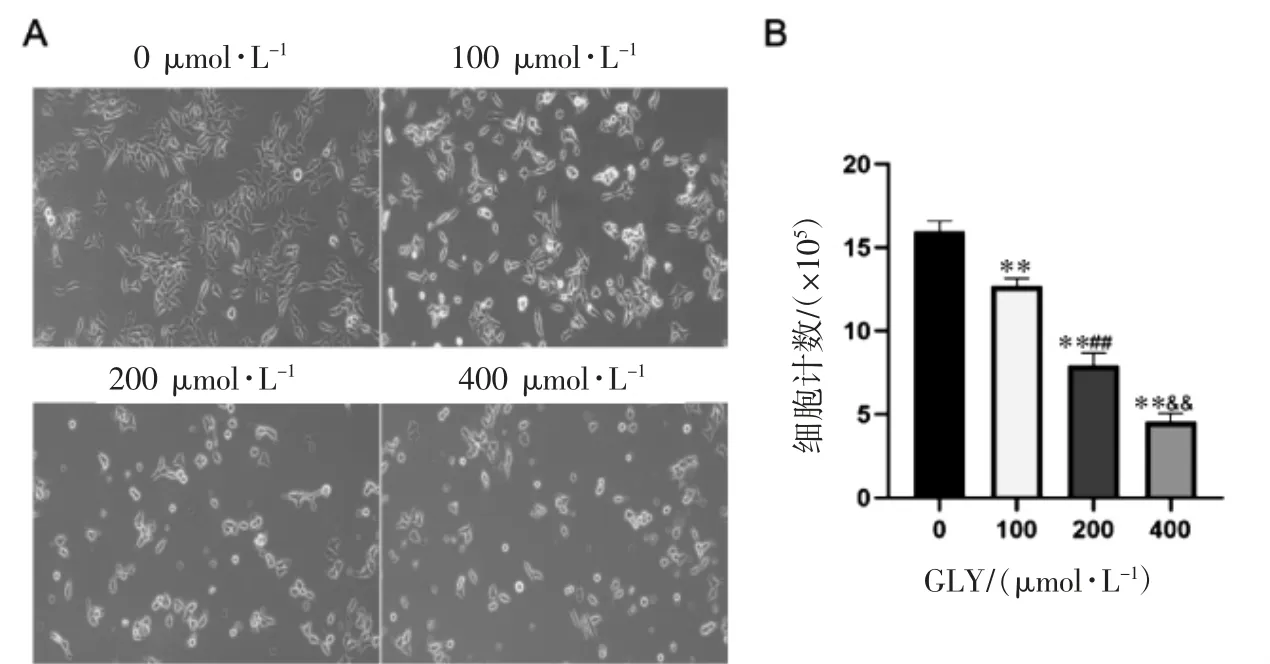
图2 GLY 对前列腺癌C4-2B 细胞形态及数目影响
2.3 GLY 剂量依赖性抑制C4-2B 细胞集落形成能力
与对照组(0 μmol·L-1GLY)相比,加药组(100、200、400 μmol·L-1GLY)集落形成的数目均减少(P均<0.01),100、200、400 μmol·L-1GLY 组间细胞克隆数目呈浓度依赖性减少(P 均<0.05),并且随着浓度增加,形成集落较小,颜色变浅,见图3。
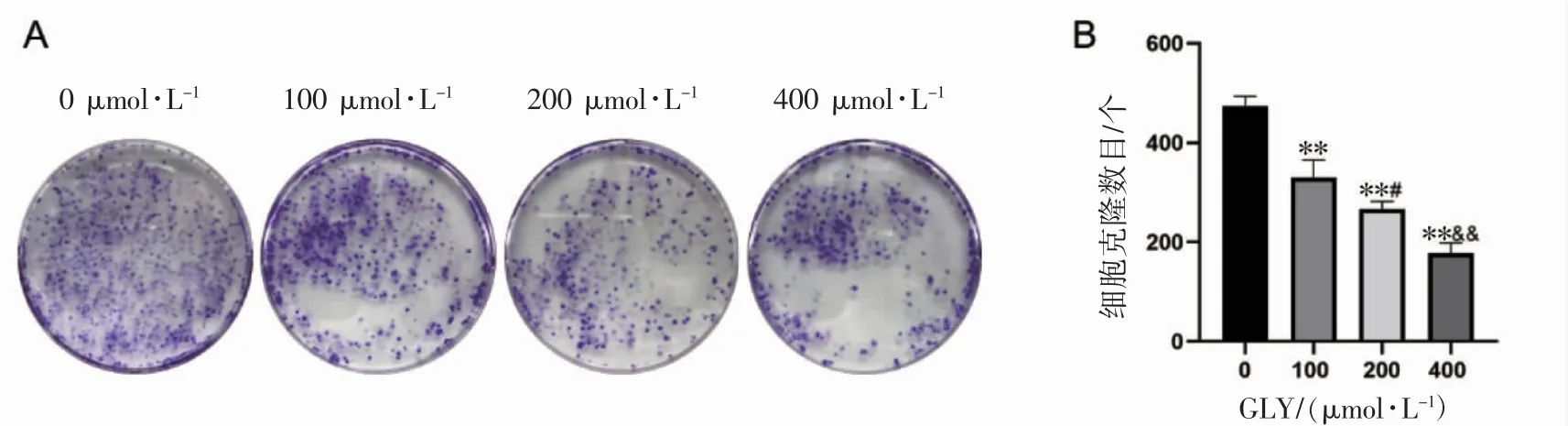
图3 GLY 对C4-2B 细胞集落形成能力的影响
2.4 GLY 对人前列腺癌细胞C4-2B 凋亡的影响
与对照组(0 μmol·L-1GLY)相比,GLY 处理组(100、200、400 μmol·L-1)凋亡率均增加(P 均<0.05),组间比较凋亡率呈浓度依赖性增加(P 均<0.05),见图4。
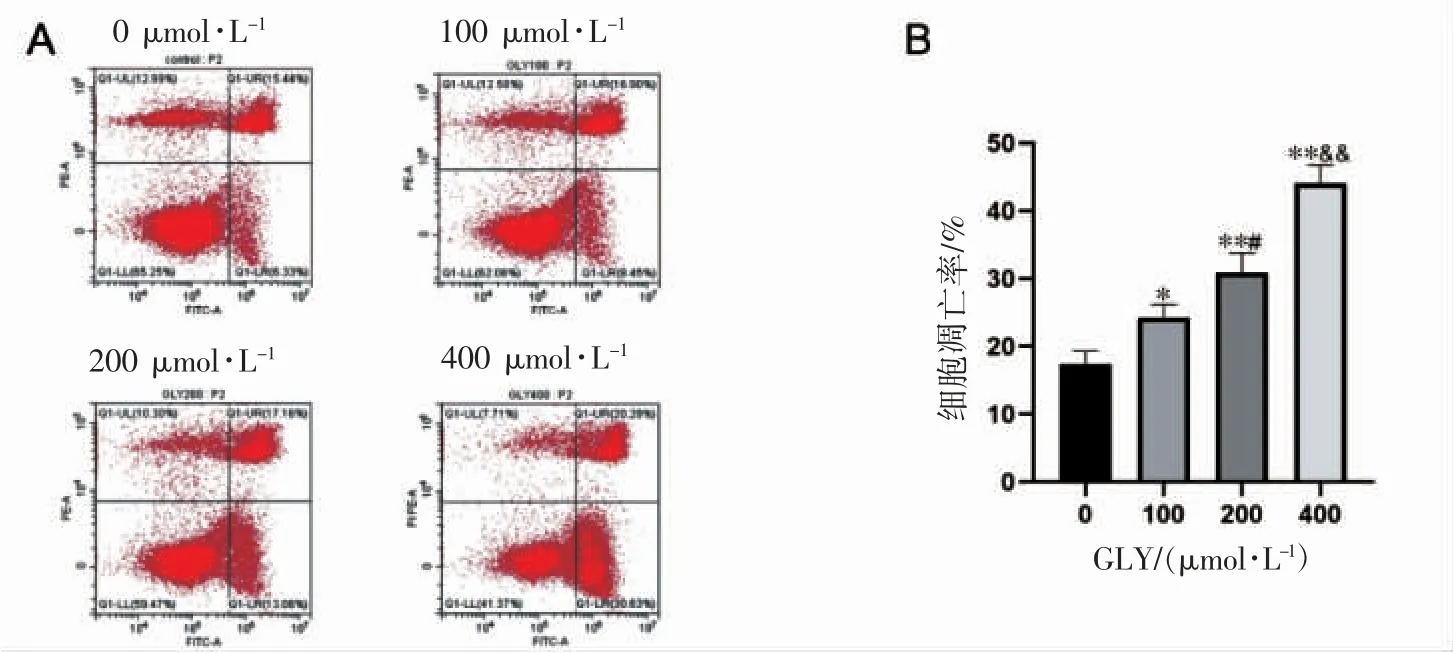
图4 GLY 对人前列腺癌C4-2B 细胞凋亡的影响
2.5 GLY 对C4-2B 细胞Bax、Bcl-2、c-Caspase3、PI3K、p-PI3K、AKT、p-AKT、AR 蛋白表达的影响
Western blot 实验结果显示,与对照组(0 μmol·L-1GLY)相比,GLY 处理组(200、400 μmol·L-1)Bcl-2 表达降低,Bax 表达升高,Bax/Bcl-2 表达升高(P 均<0.05),GLY 处理组(100、200、400 μmol·L-1)c-Caspase3 表达均升高(P 均<0.05),见图5。Western blot 实验检测通路相关蛋白结果显示,PI3K、AKT 蛋白表达无变化(P>0.05)。与对照组(0 μmol·L-1GLY)相比,GLY 处理组(200、400 μmol·L-1)p-PI3K、p-AKT、AR 蛋白表达随GLY浓度升高而降低(P 均<0.01)。在加入PI3K抑制剂后,与对照组(0 μmol·L-1GLY)相比,p-PI3K、p-AKT、AR、Bcl-2 表达降低,Bax、c-Caspase3表达升高,Bax/Bcl-2 比值升高(P 均<0.05),GLY 和WM 联用组下降更明显(P 均<0.01),见图6。
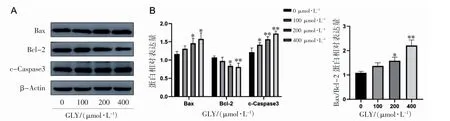
图5 GLY 对C4-2B 细胞Bax、Bcl-2、c-Caspase3 蛋白表达的影响
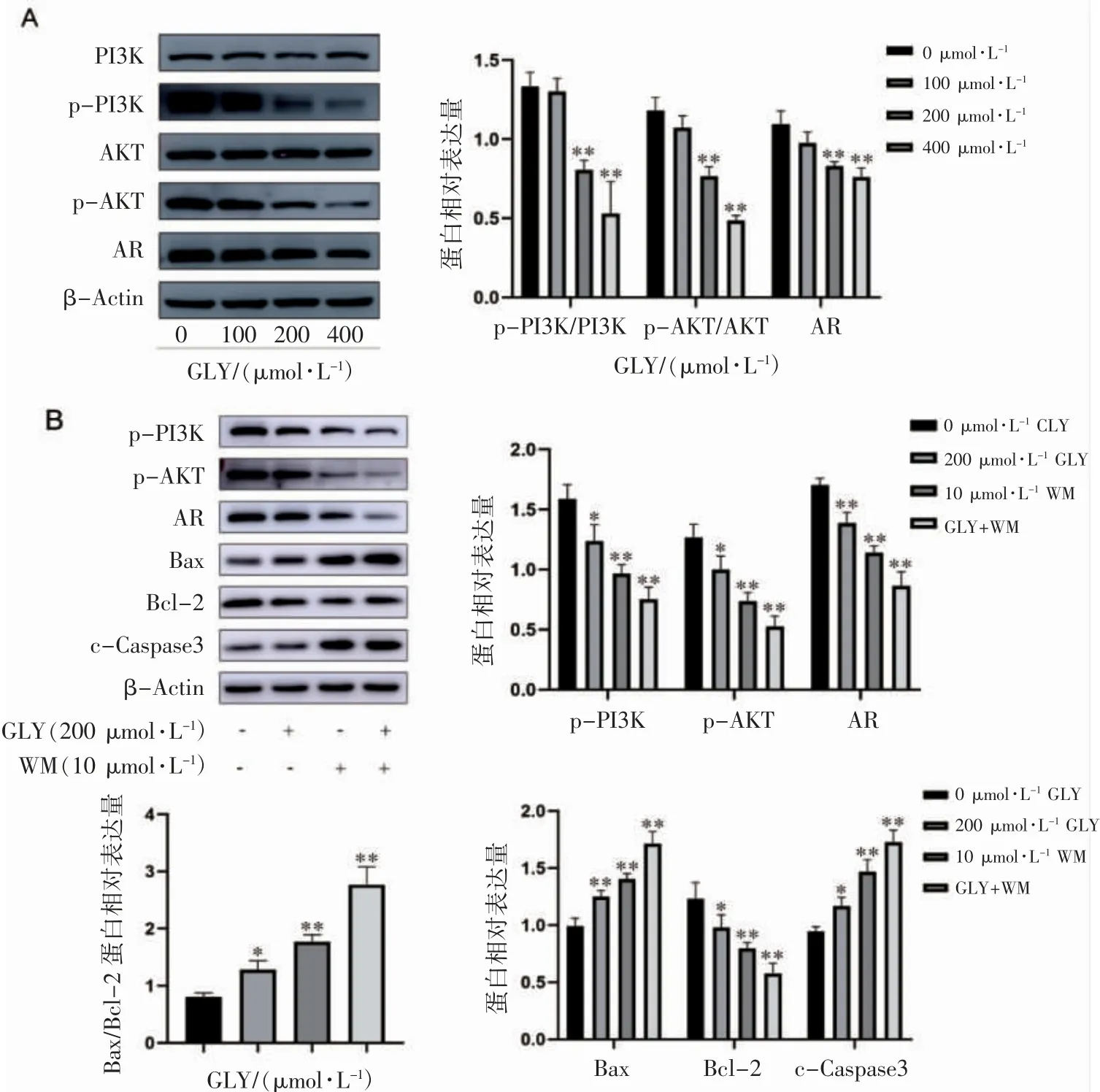
图6 GLY 对C4-2B 细胞PI3K 信号通路相关蛋白的影响
3 讨论
CRPC 是前列腺癌患者治疗发展的重要阶段之一,其耐药性产生的机制是前列腺癌治疗研究的热点问题。CRPC 的发生机制包括PI3K、WNT等激酶信号通路的异常激活、肿瘤免疫、肿瘤干细胞驱动、AR 及其变异体的过表达、上皮-间质转化紊乱、DNA 修复障碍等,近年来AR 信号通路的调控机制受到越来越多的关注[5-6]。因此,靶向抑制AR 筛选防治CRPC 的药物具有重要临床意义。GLY 是一种从甘草根中提取的天然无毒化合物,具有抗肿瘤、抗炎及抗病毒等多种活性作用,研究表明,GLY 可通过PI3K/AKT 信号通路、调控细胞周期、相关蛋白抑制前列腺癌细胞增殖[7]。目前鲜有关于GLY 通过影响AR 抑制CRPC 细胞增殖的研究。
本研究选用前列腺癌细胞C4-2B,为雄激素非依赖型细胞,其经历了由雄激素依赖细胞转变为雄激素非依赖细胞,模拟了前列腺癌转变为CRPC 的过程,且高表达AR。首先,CCK-8 实验结果显示GLY 剂量依赖性抑制C4-2B 细胞活性、抑制率IC50为321.1 μmol·L-1,本研究选择100、200、400 μmol·L-1作为后续实验给药浓度。随着GLY 浓度增高,C4-2B 细胞数目减少,细胞变小、皱缩,由多触角形变为梭形,核固缩破碎,细胞碎片增多。细胞克隆实验显示,随GLY 浓度增大,集落形成数目减少,单个集落体积变小,颜色变浅。提示细胞可能发生凋亡,进一步流式细胞仪检测结果提示GLY 促进前列腺癌C4-2B 细胞凋亡呈剂量依赖性增加。以上结果与Wang 等[8]结果相符。综上提示,GLY 可以抑制前列腺癌C4-2B 细胞增殖、可能促其凋亡。
细胞凋亡,是一种由基因控制的细胞自主性死亡方式[9]。由Bcl-2 家族介导,存在两种形式,促凋亡蛋白,如Bax、Bad 等,抑凋亡蛋白,如Bcl-2等,常以Bax 与Bcl-2 因子的相对比值作为凋亡指数来衡量细胞进入凋亡的状态,比值增加,从而激活下游Caspase3,促其活化为c-Caspase3,使细胞进入不可逆凋亡阶段的标志[10]。为了进一步明确GLY 促C4-2B 细胞凋亡的现象,我们检测了Bcl-2、Bax、c-Caspase3 蛋白表达变化。GLY(200、400 μmol·L-1)均可使C4-2B 细胞Bcl-2 蛋白表达降低,Bax、c-Caspase3 蛋白表达升高,Bax/Bcl-2 比值升高;进一步证实了GLY 可促C4-2B细胞凋亡,这与Orazizadeh 等[11]GLY 对凋亡蛋白作用结果相一致。
在大约40%的前列腺癌和70%的转移性前列腺癌中发现了PI3K/AKT 生存信号通路的突变,PTEN 是一种特异性的前列腺癌抑癌基因,它的缺失导致PI3K 的积聚,PI3K 激活AKT,抑制凋亡[12-13]。Kahn 等[14]研究发现,通过激活PI3K/AKT信号通路,诱导AR 磷酸化,可促进前列腺癌细胞生长,抑制凋亡。提示PI3K/AKT 与AR 信号通路的相互作用在前列腺癌进展中有重要作用[15]。Western blot 实验结果表明,与对照组(0 μmol·L-1GLY)相比,GLY(200、400 μmol·L-1)组p-PI3K、p-AKT、AR 表达降低,AKT、PI3K 表达差异无统计学意义。与方芳等[16]结果相符。为进一步探究GLY 抑制前列腺癌的增殖是否与PI3K/AKT/AR 信号通路相关,加入PI3K 抑制剂WM,结果表明,200 μmol·L-1GLY 组、10 μmol·L-1WM 组、200 μmol·L-1GLY 与10 μmol·L-1WM 联合处理组p-PI3K、p-AKT、AR 表达均下调,凋亡相关蛋白Bax、c-Caspase3 表达升高,Bax/Bcl-2 比值升高,Bcl-2 表达降低。提示GLY 对前列腺癌细胞C4-2B 促凋亡作用,其机制可能与PI3K/AKT/AR信号通路有关。
综上所述,GLY 抑制C4-2B 细胞增殖、促进其凋亡可能与抑制PI3K/AKT/AR 信号通路有关。本研究有望为GLY 应用于前列腺癌临床CRPC 期的治疗提供一定的理论支持。

