胸椎脊索瘤1 例
石学文, 岳丽娜, 李胜堂, 牛娟琴, 甄 平
(1.中国人民解放军联勤保障部队第九四〇医院骨科中心,兰州 730000; 2.中国人民解放军联勤保障部队第九四〇医院影像诊断科,兰州 730000; 3.宁夏医科大学临床医学院,银川 750000; 4.兰州大学第二临床医学院,兰州 730000)
脊索瘤起源于胚胎发育过程中残留的脊索组织,是一种较罕见的低度恶性骨肿瘤,占恶性骨肿瘤的1%~4%[1]。病因不明确,有文献[2]报道,原癌基因Brachyury、新的分子标志物iASPP、SMARCB1 及信号通路PI3K/AKT 等与脊索瘤的发生有关;邝磊等[3]认为RNA 腺苷脱氨酶1 的过度表达可能通过介导A-I RNA 编辑影响miR-10a 和miR-125a 的成熟和表达,参与脊索瘤发生中的细胞异常增殖调控。本病可发生于任何年龄,中老年患者多见[4]。好发部位为颅底和骶尾部,胸椎少见。
1 病历资料
1.1 一般资料
患者男,74 岁,主因“胸背部感觉异常6 个月,双下肢感觉运动障碍40 d”就诊。患者于6 个月前无明显诱因出现胸背部麻木及感觉异常,2 个月前出现双下肢由远端向近端蔓延的麻木、冰凉感,并进行性加重。在当地医院行针灸等保守治疗后,双下肢冰凉感略缓解。40 d 前患者出现双下肢无力并进行性加重,无法正常行走。20 年前曾因外伤致左胫腓骨骨折,未行手术治疗,无其他既往病史及家族遗传病史。
1.2 检查及诊断
1)专科查体:胸6 平面以下及双下肢感觉减退;双下肢肌张力正常,肌力Ⅱ级。双侧膝腱反射存在,跟腱反射未引出;Babinski 征阴性。2)胸椎X 线片:胸3 椎体略扁,胸2~4 椎体两侧软组织影增厚。3)CT 结果:胸2、3 椎体及附件见不规则骨质破坏影,密度不均匀增高,胸1~4 椎体层面椎体前缘见团块状软组织影,呈浅分叶状,其内密度不均匀,见斑片状低密度影(图1A、B)。4)MRI 结果:胸2、3 椎体及附件见不规则骨质破坏影,胸1~4 椎体层面椎前见团块状软组织影,呈浅分叶状,其内可见分隔影。病灶在T1WI 为混杂信号(图1C);在T2WI 以高信号为主(图1D、E)。病灶经椎间孔突入椎管内,椎管狭窄;脊髓明显受压变细,T2WI 呈高信号(图1F)。5)病理学检查:行椎旁病灶切开活检术,术中取出黄豆粒大小胶冻状灰白色软组织,瘤组织呈片状分布,细胞大、胞浆丰富(图2)。6)免疫组化结果:CKp(+),EMA(+),S100(+),Ki67≈2%。7)病理诊断:(胸椎体/旁)脊索瘤。8)最终诊断:胸椎脊索瘤、脊髓损伤(不全瘫,Frankel C 级)。患者及家属拒绝手术治疗及随访。
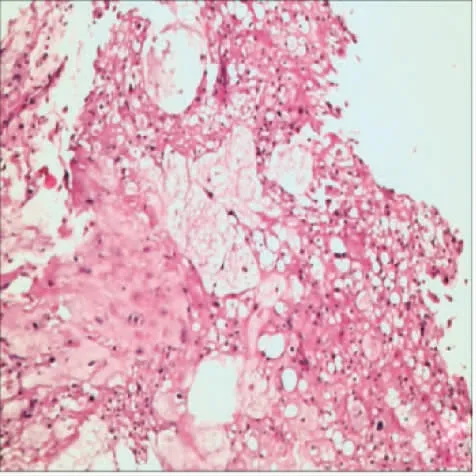
图2 胸椎脊索瘤病理图片(HE×100)
2 讨论
脊索瘤典型的影像学表现为骨质破坏、软组织肿块和肿瘤内钙化病灶,常累及多个椎体;CT 表现为溶骨性或膨胀性骨质破坏,可被软组织肿块代替,肿块包膜不完整,与正常骨分界不清,病灶内可见破坏残存的骨碎片及斑片状钙化灶;MRI表现为肿瘤边界清楚,边缘无硬化环,T1WI 呈低或等信号,T2WI 呈较高或高信号,增强后多呈轻度强化[5]。脊索瘤可分为四种病理组织学亚型——经典型、软骨样型、去分化型和肉瘤样型,其中以经典型最常见[6]。脊索瘤是化疗耐药肿瘤,对放疗也不敏感,治疗主要以手术为主,目前手术方法以肿瘤整体切除和宽边界切除为原则,但因其常临近重要的血管和神经组织,完整切除十分困难。手术近全切率为49.4%~73.2%;术后复发率高,5年复发率为47%~56%[7-10]。王科等[11]发现,Ki-67 指数与MRI 信号值是评判脊索瘤复发风险的较好指标,且两者均为脊索瘤复发的独立危险因素。流行病学调查统计脊索瘤患者的中位生存期为6.29 年、5 年、10 年及20 年的生存率分别为67.6%、39.9%和13.1%,影响其预后的因素包括肿瘤的生长部位、体积大小、侵犯范围、术前Frankel 评分以及手术切除的完整性等。孔金海等[12]借助3D 打印技术进行完整切除肿瘤减压并行内固定重建脊柱稳定性的治疗方法值得临床推广。随着对脊索瘤发病及细胞增殖机制的进一步认识,分子靶向治疗已逐渐成为治疗脊索瘤的研究热点。姚杰等[13]发现,细胞骨架调节剂(CYTOR)通过靶向调控miR-24-3p 表达抑制脊索瘤CM-319 和U-CH1 细胞的增殖、迁移和侵袭,增强细胞放射敏感性,表明lncRNA CYTOR是脊索瘤潜在的分子治疗靶点。Zhang 等[14]发现,miR-100-5p 在脊索瘤组织中表达较低,其表达可抑制脊索瘤的生长;miR-100-5p 可通过靶向胰岛素样生长因子1 受体来抑制脊索瘤的恶性行为,亦可通过抑制上皮间质转化(EMT)部分抑制脊索瘤细胞的迁移和侵袭。相信在不久的将来分子靶向治疗对脊索瘤的治疗会大有裨益。

