肝硬化合并门静脉血栓与门静脉癌栓多层螺旋CT 分析
张智博, 高知玲, 杨冠华, 任 涛, 李修元, 邓 林, 陈 勇
(1.宁夏医科大学,银川 750004; 2.宁夏医科大学总医院放射科,银川 750004; 3.宁夏医科大学总医院放射介入科,银川 750004)
门静脉血栓(portal vein thrombosis,PVT)与门静脉癌栓(portal vein tumor thrombus,PVTT)皆会引起不同程度的门静脉栓塞发生,栓子性质不同决定了其预后及治疗方式的差异。肝硬化患者肝内纤维组织增生、肝窦破坏、血管扭曲闭塞,入肝的门静脉血流速度降低,导致肝硬化PVT 形成风险显著增加[1]。PVTT 是肝细胞癌(hepatocellular carcinoma,HCC)发生、发展过程中常见的并发症,发生率为44.0%~62.2%,属于HCC 肝内、外转移的表现[2]。门静脉系统由于特殊解剖结构及其他原因产生的门静脉高压,使得门静脉系统内既可以出现PVT 也可以出现癌栓。临床上针对PVT与PVTT 的治疗方式截然不同,但PVT 与PVTT 征象重叠、临床症状相似,及早鉴别两者对治疗和预后十分重要[3-4]。多层螺旋CT 的高时间、高空间分辨率及多模式图像重组功能对肝脏门静脉系统的清晰显示使两者的鉴别成为可能,本文旨在探讨多层螺旋CT 征象结合患者基线资料对PVTT 与PVT 的诊断价值。
1 资料与方法
1.1 一般资料
收集2016年1 月至2020年7 月于宁夏医科大学总医院行上腹部多层螺旋CT 检查的肝硬化合并门静脉栓塞患者154 例,其中经临床、甲胎蛋白(AFP)及影像学特征综合诊断的PVTT患者79 例,包括巨块型40 例、结节型11 例、弥漫型28 例;经临床抗凝治疗随访观察证实的PVT 患者75 例。从医疗记录中收集患者基线资料,包括年龄、性别、CT 检查前一周内AFP、血清肌酐、总胆红素、丙氨酸转氨酶(ALT)、天冬氨酸转移酶(AST)、肝功能(Child-Pugh)分级。
1.2 纳入与排除标准
PVTT 患者纳入标准:1)经临床、AFP 及影像学特征综合诊断为肝癌合并PVTT 者;2)影像学资料及基线资料完整者;3)无CT 检查禁忌证者。PVTT 患者排除标准:1)合并其他器官恶性肿瘤者;2)有碘造影剂过敏史者。PVT 患者纳入标准:1)肝脏CT 表现支持肝硬化诊断者;2)CT 增强扫描门静脉内有对比剂充盈缺损影,且肝内无癌灶存在者;3)随访时间≥3 个月,门静脉内栓子有明显缩小或消失者。PVT 患者排除标准:1)CT 图像质量差影响分析或基线资料不全者;2)肾功能不全者。
1.3 检查方法
多层螺旋CT 检查:采用荷兰Philips 公司Brilliance iCT256 层螺旋CT 扫描仪进行检查。检查前15 min 饮用500~800 mL 温水,仰卧于检查床上,检查范围从肝膈顶部至双肾下级水平,扫描层厚5 mm,层间隔5 mm,转速0.27 s·r-1,Pitch 值0.915。采用美国Medrad 公司双筒高压注射器行对比剂注射,增强扫描造影剂为碘海醇(300 mgI·mL-1)经肘静脉注入,注射流速3.0~3.5 mL·s-1,造影剂总量80~90 mL,注射后用20 mL 生理盐水冲管,扫描时间为动脉期25~30 s、门静脉期70~80 s、延迟期180 s。检查前均签署造影剂不良反应知情同意书。
1.4 图像分析
两位腹部专业高年资医师通过影像归档和通信系统(PACS)对本研究病例图像采用动脉期及门静脉期多平面重组(MPR)、血管容积重建(VR)等方式,独立对图像评估,如不能确定则通过讨论达成共识。主要观察及测量的项目:1)门静脉栓子的位置(左支、右支、主干、肠系膜上静脉)。2)栓子密度及动脉期与平扫期差值,即ΔCT 值。测量CT 密度值时选择栓子相对均质部位,尽量位于栓子中心避开门静脉管壁,ROI 面积约为20 mm2,测量3 次取平均值,同一病灶各期测量时选取同一层面。3)观察附栓管壁是否光滑、门静脉管径有无局限性增宽、栓子的填充方式及有无肝外侧支循环。
1.5 统计学方法
采用SPSS 26.0 统计学软件对数据进行分析。分类变量以例数描述,组间比较采用χ2检验或Fisher 精确概率法。其中年龄、栓子密度等计量资料服从正态分布,以均数±标准差(±s)描述,组间比较采用两独立样本t 检验。AFP 水平等数据不服从正态分布,以M(QL,QU)表示,组间比较采用Mann-Whitney U 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 临床特征与栓子性质的关系
154 例患者中,PVTT 患者79 例(51.3%),PVT 患者75 例(48.7%),两组患者性别、年龄、乙肝表面抗原、血肌酐、总胆红素、Child-Pugh 分级差异均无统计学意义(P 均>0.05)。PVTT 患者血清AFP 水平高于PVT 患者(P<0.05)。PVTT 患者的ALT 及AST 水平均高于PVT 患者(P 均<0.05),见表1。
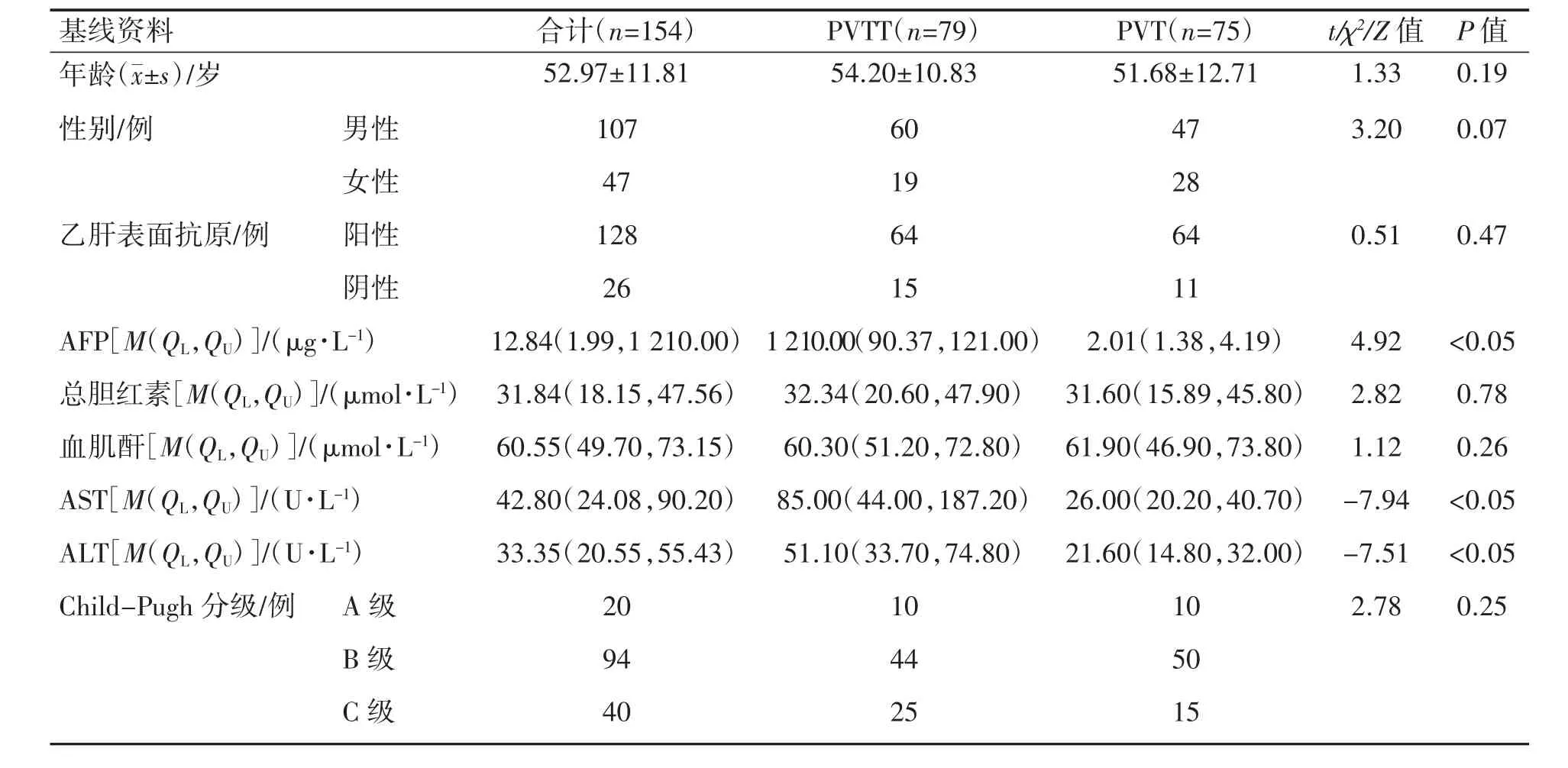
表1 PVTT、PVT 患者门静脉栓子的基线特征分布
2.2 门静脉栓子密度与栓子性质的关系
PVTT 患者栓子的密度在动脉期、门静脉期及动脉期-平扫期的差值均高于PVT 患者(P 均<0.05),PVT 患者门静脉主干内低密度影,增强扫描未见明显强化。PVTT 患者门静脉右支及主干内栓子完全填充,管壁不光整,增强扫描动脉期明显强化。平扫期与延迟期两组患者的栓子密度接近,差异无统计学意义(P 均>0.05),见图1、表2。
表2 PVTT 与PVT 患者在平扫和增强扫描不同期相的CT 密度比(±s,HU)

表2 PVTT 与PVT 患者在平扫和增强扫描不同期相的CT 密度比(±s,HU)
组别 n 动脉期-平扫期 平扫期 增强扫描动脉期 门静脉期 延迟期PVTT 79 33.08±14.41 33.72±6.86 66.81±16.17 71.00±21.81 40.55±6.81 PVT 75 12.86±3.90 34.61±5.20 47.46±6.39 41.24±5.95 39.60±6.65 t 值 11.75 -0.90 9.67 11.42 0.87 P 值 <0.05 0.37 <0.05 <0.05 0.39
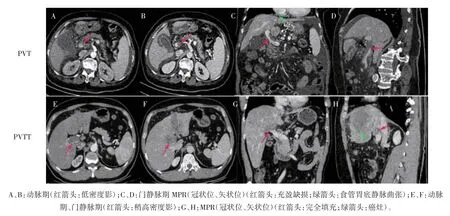
图1 PVT 与PVTT 患者CT 特征图
2.3 门静脉栓子其他CT 征象与栓子性质的关系
两组患者在栓子累及位置(主干、左支、右支、肠系膜上静脉)、附栓管壁光滑、肝外侧支循环、栓子填充方式、门静脉局限性增宽方面差异均有统计学意义(P 均<0.05),动脉期门静脉提前显影,左支及主干完全填充,PVTT 与管壁界限不清,见PVTT 滋养血管,两组患者在有无腹腔积液方面差异无统计学意义(P>0.05),见图2、表3。
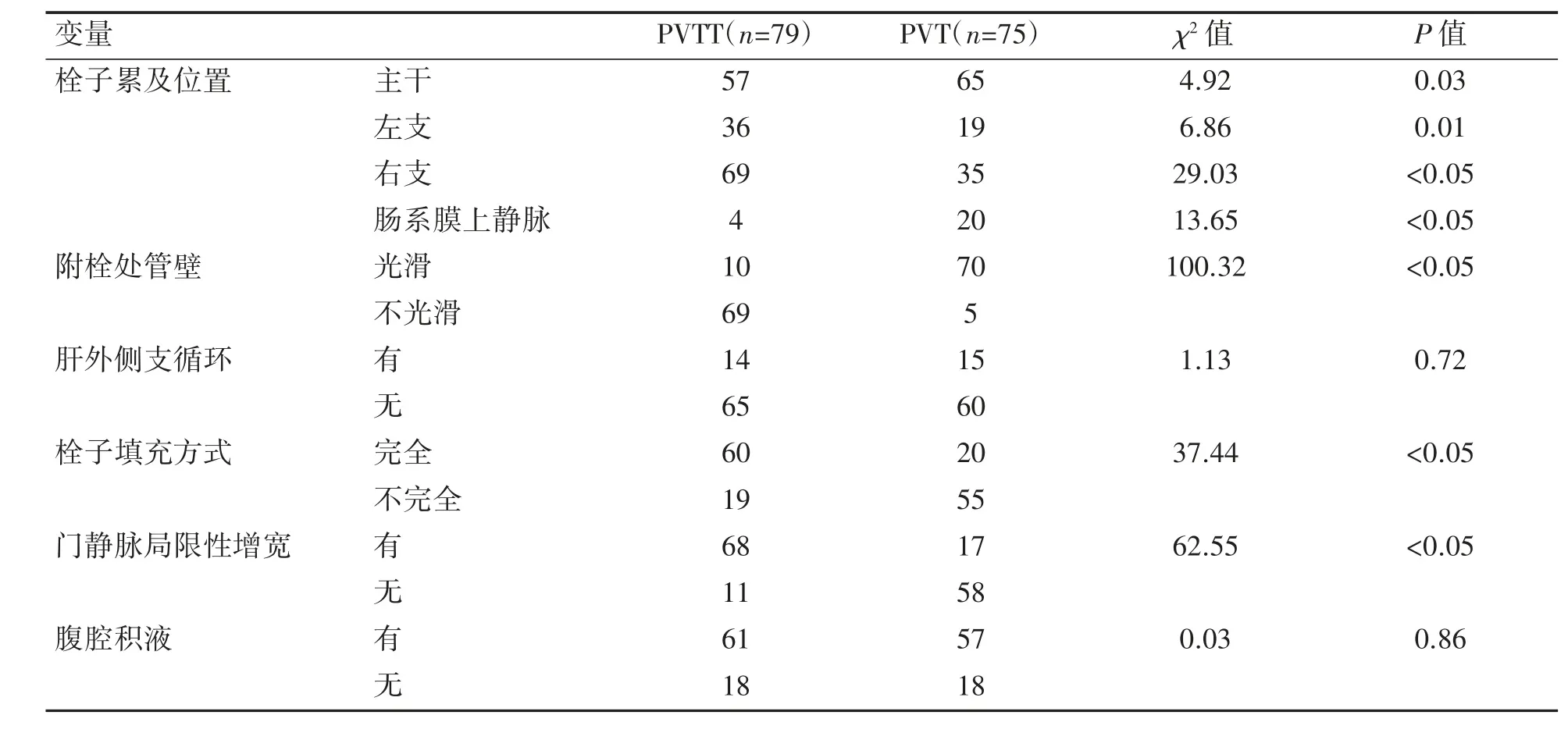
表3 PVT 与PVTT 患者门静脉栓子影像特征分析
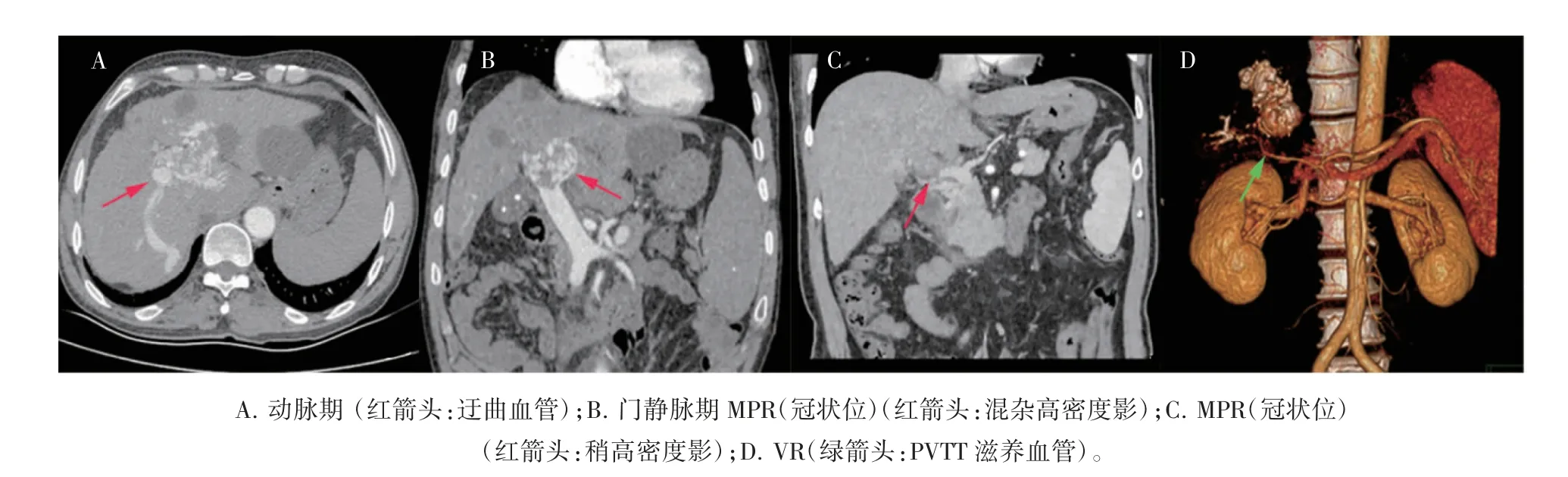
图2 PVTT 患者的CT 特征图
3 讨论
PVTT 与PVT 临床上均较为常见,相对而言,PVTT 较PVT 更为多见[5],PVTT 通常在肝硬化的基础上随癌灶一并检出,而PVT 患者通常由肝硬化导致的门静脉高压及脾切除、腹膜腔感染等引起。25%~30%的PVT 继发于肝硬化[6]。本研究病例选取的PVT 患者均合并肝硬化,两种栓子的形成皆与肝硬化相关。目前对门静脉栓子常见的无创诊断方法有CT、MRI 及多普勒超声检查。多普勒超声检查虽可以测定门静脉血流的方向及流速,但其易受检查者的经验及技术的影响而难以标准化;MRI 可以多参数、多方位成像,对门静脉的显示尚可,但其常难以甄别门静脉内栓子与肝硬化引起的血流变慢信号的差别,并且易受呼吸运动的影响而造成误诊[7];多层螺旋CT 具有较高的空间、密度分辨率和强大的三维图像后处理技术,对于显示门静脉受累及周围侧支循环有较大优势,因此可以对门静脉栓子做出更准确的判断[8]。
本研究基线资料显示,PVTT 患者AFP 值中位数高于PVT 患者,可能是因为AFP 值可以在约80%的肝癌患者中升高,且AFP 水平越高,肿瘤分化程度越差,越容易发生PVTT[9]。血清ALT、AST 水平及Child-pugh 分级情况也可反映患者的肝功能状况,这些指标的值越高肝细胞损伤越严重,本研究显示PVTT 患者肝功能总体上比PVT 患者差,可能与肝内癌灶所造成的肿瘤高负荷有关。
PVTT 与PVT 患者的CT 征象显示,PVTT 较易累及门静脉主干及右支,除去肝右叶体积大于肝左叶的因素,也可以从肝脏解剖及血流动力学上进行解释,门静脉右支较左支粗而短且与门静脉主干走行方向夹角较小,因此门静脉灌注血流更容易进入右支与背离肝生长方向的PVTT 发生“碰撞”,可能是本研究PVTT 更易定植于右支的原因,本研究中4 例侵犯肠系膜上静脉的PVTT 患者皆为由门静脉左支或主干逆血流方向蔓延所致,可能是由于肠系膜上静脉自右侧汇入门静脉且呈一定夹角,血液流速减慢,使得栓子更容易局部定植生长。血栓则是由肝硬化导致的血流缓慢、局部血管内皮损伤和血液的高凝状态,即菲尔绍(Virchow)三因素引起[10]。肝硬化引起门静脉高压状态使得门静脉主干及其所属分支向肝脏的供血阻力增高,门静脉内血液流速减慢,血流量减少,血栓更易先累及门静脉主干,顺着血流方向贴着门静脉管壁滑行至门静脉左右支,也可以随着血液的逆流蔓延至肠系膜上静脉。本研究中有20 例患者累及了肠系膜上静脉,所占比例约为27%,与寿毅等[11]研究基本一致。
本研究结果显示,门静脉期的癌栓累及部位血管壁不光滑,数量远多于血栓。可能与癌栓侵蚀附着处门静脉管壁,在增强的血管壁的映衬下,癌栓部分的管壁多表现为毛糙、不光整有关。本研究中PVT 与PVTT 患者在肝外侧支循环的形成上差异无统计学意义,侧支循环的形成是由肝硬化导致的门静脉高压,为缓解肝内压力而产生的,可能与两组患者均有不同程度的肝硬化有关。但PVTT 患者中出现6 例胆囊及胆总管周围“毛发状”侧支血管,而PVT 患者中无病例,这可能与PVTT 患者门静脉阻塞情况较为严重,导致肝脏低灌注,侧支循环为满足供应缺血的肝组织有关。本研究PVTT 患者中完全填充病例远多于PVT 患者,可能与相邻肝叶肿瘤直接侵犯相应门静脉分支并迅速生长有关。癌栓通常亦会因受累部位癌灶膨胀性生长,造成受累部位的门静脉被动扩张,表现为受累门静脉节段管径增粗,即门静脉局限性增宽[12],PVTT 患者有68 例呈现这一特点。本研究中,PVTT 患者有14 例出现了动脉早期受累的门静脉分支提前显影,这种现象称之为动脉-门静脉瘘(APS),而PVT 患者未见病例,此征象因癌栓的快速增殖破坏门静脉旁的小动脉分支,造成了小叶间动脉的血液直接引入门静脉腔,形成动-静脉短路[13],而血栓的形成不具有这种破坏性,因此,如栓子周围出现动脉-门静脉瘘,应高度怀疑PVTT。
本研究结果显示,平扫期的癌栓密度通常稍低(与同层主动脉相比),而血栓常呈稍高或等密度。可能是因为两组患者成分存在差异,癌栓内为大量排列紧密的活性肿瘤细胞而纤维患者组织含量相对较少,故密度较低,而PVT 成分多为纤维机化组织并伴少量钙盐沉积,所以密度相对较高[14]。但本研究中两组患者栓子密度未表现出统计学差异,这与过去的研究[15]基本一致,可能与目前此类研究样本量有限有关。动脉期癌栓的密度高于PVT,表现为明显强化,反映了癌栓供血丰富的特点。但本研究中,门静脉期的癌栓密度仍然较高,甚至高于动脉期,没有表现出典型的“快进快出”征象,可能是因为肝硬化门静脉高压导致门静脉血液回流受阻,门静脉期的癌栓需维持相对较高的动脉血供状态,使得回流时间延长,因而在该时相病灶仍保持较高的强化状态不退。本研究还比较了两种栓子动脉期与门静脉期CT 值的差值,依据Sherman 等[16]的 标 准,PVTT 的CT 值 增 长 值>20 HU,存在明显强化,而血栓则表现为弱强化或不强化,从CT 值的角度再次印证了两者成分的差异。
综上所述,门静脉栓子良恶性的诊断能够利用多层螺旋CT 及三维重建技术,从栓子密度、累及部位、栓子填充方式、附栓管腔及其周围侧支循环情况,全方位、多角度地分析、鉴别。同时还需紧密结合患者的临床资料,将临床资料与影像相结合,做出更准确的诊断,更好地指导患者治疗。

