弓形虫Ⅱ型ROP16 蛋白对大鼠肺泡巨噬细胞NR8383炎性反应的影响
党甜甜, 贾 伟, 陈 梅, 潘亚菲, 杨宁爱, 康宇婷,苏雅静, 汪澎涛, 赵志军
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学病原微生物重点实验室,银川 750004;3.宁夏医科大学总医院医学实验中心,银川 750004)
弓形虫是一种具有复杂的生命周期,可感染人类和多种温血动物的专性胞内寄生虫[1]。免疫功能低下的人群感染弓形虫会引起多种疾病,如HIV、癌症等,同时会通过胎盘经垂直传播导致孕妇流产[2]。在入侵宿主细胞过程中,弓形虫的顶端复合体发挥着重要的作用,而研究最为深入的是其棒状体,与其发病机制、宿主细胞入侵和与宿主细胞相互作用等密切相关。棒状体蛋白(rhoptry proteins,ROP)家族是T.gondii 特异性蛋白,包括ROP2、ROP4、ROP5、ROP8、ROP16 和ROP18 等,其中ROP16 是关键的毒力决定因子,可在寄生虫感染后迅速侵入宿主细胞核[3-5]。巨噬细胞表现出高度的可塑性,根据刺激信号采取不同的激活状态,从而保护组织稳态并调节炎性反应,对组织内的微环境因子作出反应。分化为两种不同的功能表型:M1 型表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),主要分泌白细胞介素-1β(interleukin-1β,IL-1β),白细胞介素-6(interleukin-6,IL-6),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎因子,M2 型表达精氨酸酶1(arginase 1,Arg-1),主要分泌IL-10、转化生长因子-β(transforming growth factor-β,TGFβ)等抑炎因子[6]。微环境中的LPS 与巨噬细胞表面TLR4 结合,作用于核转录因子κB(nuclear transcription factor κB,NF-κB)和干扰素调节因子3(interferon regulatory factor 3,IRF3),促进巨噬细胞M1 型的极化,分泌促炎因子。Ⅱ型弓形虫分泌的蛋白会使NF-κB 发生磷酸化而诱导巨噬细胞偏向M1 型极化[6-8]。信号转导与转录激活因子1(signal transducers and activators of transcription 1,STAT1)受γ 干扰素(γ interferon,IFN-γ)受体刺激后二聚体化,以二聚体的形式进入宿主细胞核中,与编码iNOS、IL-12 等基因中的序列结合,调控M1 型巨噬细胞的极化[8]。
基于以上研究,本研究拟使用大鼠肺泡巨噬细胞NR8383 作为模型来探讨Ⅱ型弓形虫ROP16对NR8383 巨噬细胞炎性反应的影响。通过构建Ⅱ型弓形虫ROP16 过表达载体,转染NR8383 细胞后,利用免疫荧光法确定ROP16 在NR8383 细胞中的定位情况,采用RT-PCR、Western blot 和ELISA 检测相关基因和蛋白表达情况,探讨Ⅱ型弓形虫ROP16 蛋白对NR8383 炎性反应的影响。
1 材料与方法
1.1 材料
NR8383 细胞保存于宁夏临床病原微生物重点实验室;嘌呤霉素购自Sigma 公司;实验所用慢病毒(空载体pHBLV-CMV 和ROP16 过表达载体pHBLV-CMV ROP16)均购自汉恒生物科技(上海)有限公司;逆转录试剂盒和荧光定量PCR试剂盒均购自日本TaKaRa 公司。鼠抗Arg-1 购自美国Proteintech 公司,鼠抗His-tag、兔抗iNOS、HRP 标记山羊抗兔IgG(HRP-IgG)、山羊抗鼠IgG(HRP-IgG)均购自美国Abcam 公司,兔抗NF-κB、磷酸化核转录因子κB(phosphorylated nuclear transcription factor κB,P-NF-κB)、STAT1、磷酸化转录活化蛋白1(phosphorylated transcription activating protein 1,P-STAT1)均购自CST 公司。酶联免疫吸附测定试剂盒购自江莱生物科技有限公司。RT-PCR 所用引物均由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 细胞培养 将NR8383 细胞从-150 ℃冰箱取出后,于37 ℃水浴箱中快速融化,并使用含20% FBS 的F-12K 培养液,于37 ℃、5%CO2恒温培养箱中培养,待细胞生长至80%左右时进行传代,传代3 次后的细胞用于后续实验。
1.2.2 ROP16 过表达稳转细胞株构建 将对数生长期的NR8383 细胞按1×104个/孔接种于96孔板,每孔加入100 μL 细胞悬液。分组设置为空白对照组(正常NR8383 细胞)、空载组(pHBLVCMV)和ROP16 过表达组(pHBLV-CMV ROP16)。按照说明书,向96 孔板中加入慢病毒,细胞培养箱中培养72 h 后,于荧光显微镜下观察结果。之后细胞培养密度达到80%时,用嘌呤霉素(1 μg·mL-1)筛选,得到稳转细胞系,即可用于后续检测。
1.2.3 蛋白免疫印迹检测各组NR8383 细胞相关蛋白的表达 收集细胞密度80%~90%时的空白对照组、空载组、ROP16 过表达组细胞,通过BCA 蛋白提取试剂盒提取全蛋白并检测相应蛋白浓度。配制7.5%浓缩胶、5%分离胶,根据蛋白浓度进行上样,通过电泳、转膜、封闭、一抗4 ℃过夜、二抗室温孵育后,配制显色液(1∶1),以凝胶成像系统观察结果,分析条带灰度值,以βactin 作为内参。
1.2.4 免疫荧光检测ROP16 蛋白在NR8383 细胞中的定位 将细胞爬片放置在24 孔板内,滴加细胞悬液,放置培养箱培养24 h 后,经过细胞固定、打孔以及封闭,加入Mouse monoclonal[HIS.H8]to 6X His tag抗体(Abcam,美国),4 ℃过夜,48 h 后,加入CY3 抗兔荧光二抗,细胞核染色(DAPI),封片,于激光共聚焦显微镜下观察结果。
1.2.5 RT-PCR 法检测各组NR8383 细胞ROP16及相关炎性因子的表达 Trizol 法分别提取空白对照组、空载组及ROP16 过表达组的总RNA后,反转录为cDNA,RT-PCR 法检测相关基因相对表达含量。20 μL 反应体系: cDNA 模板2 μL,上下游引物各0.8 μL,TB Green Premix EX TaqTMⅡ10 μL,ddH2O 6.4 μL。反应条件: 预变性95 ℃30 s,95 ℃5 s,60 ℃20 s,45 个循环。采用2-△△Ct法分析目标基因mRNA 水平的相对变化。其中,每组设置3 个平行孔,取平均值,见表1。

表1 RT-PCR 引物序列
1.2.6 ELISA 法检测各组NR8383 细胞培养上清液的炎性因子含量 收集空白对照组、空载组及ROP16 过表达组细胞培养上清液,根据说明书操作步骤,检测每组细胞上清液中炎性因子的含量。
1.3 统计学方法
采用GraphPad Prism 8.0 统计学软件进行数据分析。所有实验重复3 次,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 过表达ROP16 慢病毒转染NR8383 细胞结果
在荧光显微镜下观察发现,空载组和ROP16过表达组均带有绿色荧光,表明空载组和ROP16过表达组稳定株构建成功,见图1。
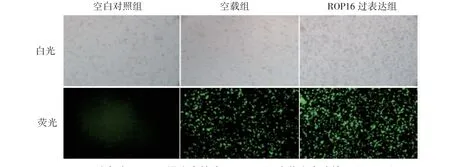
图1 过表达ROP16 慢病毒转染NR8383 细胞荧光表达情况(HE×20)
2.2 转染NR8383 细胞中ROP16 过表达的鉴定
RT-PCR 检测结果显示,ROP16 过表达组ROP16 mRNA 表达高于空白对照组(P<0.01);Western blot 结果显示,ROP16 过表达组中出现单一目的条带,分子质量为96 kDa,符合ROP16蛋白预期大小,即ROP16 蛋白成功表达于NR8383细胞中;空白对照组和空载组中均未出现单一目的条带,见图2。

图2 RT-PCR、Western blot 检测NR8383 细胞中ROP16 mRNA 及蛋白的表达
2.3 ROP16 蛋白在NR8383 细胞中的定位
免疫荧光结果显示,空白对照组和空载组均未出现红色荧光,ROP16 过表达组出现红色荧光。融合后发现ROP16 信号与细胞核重叠,聚集在细胞核中,即ROP16 过表达后定位于NR8383的细胞核中,见图3。

图3 免疫荧光确定ROP16 蛋白在NR8383细胞的定位(HE×600)
2.4 相关因子mRNA 及蛋白水平的检测
RT-PCR 结果显示,空白对照组与空载组之间各指标差异均无统计学意义(P 均>0.05),与空白对照组相比,ROP16 过表达组M1 型关键因子iNOS 和CD86 mRNA 的表达均增高(P 均<0.01),而M2 型关键因子Arg-1 和CD206 mRNA 的表达均降低(P 均<0.05),见图4;Western blot 结果显示,与空白对照组相比,ROP16 过表达组iNOS、M1 型 通 路 蛋 白NF-κB、P-NF-κB、STAT1、PSTAT1 蛋白的表达均增高(P 均<0.05),M2 型关键分子Arg-1 的表达降低(P<0.05),见图5。

图4 RT-PCR 检测各组NR8383 细胞iNOS、CD86、Arg-1 与CD206 的mRNA 表达

图5 Western blot 检测各组NR8383 细胞极化相关蛋白的表达
2.5 RT-PCR 检测各组NR8383 细胞相关炎性因子的表达
RT-PCR 结果显示,ROP16 过表达组中促炎因子TNF-α、IL-1β、IL-6 及IL-12 mRNA 表达水平均高于空白对照组(P 均<0.01),而抗炎因子TGF-β 和IL-10 mRNA 表达水平均低于空白对照组(P 均<0.01),空白对照组与空载组之间各指标差异均无统计学意义(P 均>0.05),见图6。

图6 RT-PCR 检测各组NR8383 细胞炎性相关因子mRNA 的表达
2.6 ELISA 检测各组NR8383 细胞上清中相关炎性因子的变化
ELISA 结果显示,ROP16 过表达组促炎因子TNF-α、IL-1β、IL-6 及IL-12 的含量均高于空白对照组(P 均<0.05),而抗炎因子TGF-β 和IL-10的含量均低于空白对照组(P 均<0.05),见图7。

图7 ELISA 检测各组NR8383 细胞上清炎性因子的含量
3 讨论
弓形虫感染后,转化为快速复制的速殖子,在宿主中传播,引起人兽共患的弓形虫疾病[9-10]。弓形虫的分泌蛋白可调控宿主的免疫反应,具有酪氨酸激酶活性的ROP16 会借助核定位结构(NLS)转运至宿主细胞核内,最终影响宿主细胞的表达[11]。ROP16 可通过调控因子IFN-γ 诱导NO 的生成,调控宿主对弓形虫的抑制作用,还可以通过基于脂多糖(lipopolysaccharide,LPS)诱导细胞因子的合成,参与调控宿主细胞,目前广泛应用于弓形虫疫苗的研究[12]。目前关于ROP16 基因过表达大鼠肺泡巨噬细胞的研究报道极少,因此,本文研究ROP16 调节大鼠肺泡巨噬细胞极化及其作用机制有积极作用。巨噬细胞根据对环境反应的不同,分为经典激活的巨噬细胞M1 和替代激活的巨噬细胞M2 两种不同的表型。M1 型巨噬细胞主要分泌IL-1β、IL-12、IL-6、IL-23、TNF-α 等促炎因子,起促进炎症的作用;M2 型巨噬细胞主要分泌IL-10、TGF-β、IL-4 等抑炎因子,起抑制炎症发生的作用。在正常状态下,M1 型细胞分泌的促炎因子与M2 型分泌的抑炎因子处于动态平衡,以保持体内状态平衡[13-15]。Jensen 等[16]报道,弓形虫株有3 个不同的谱系,Ⅰ型和Ⅲ型感染的巨噬细胞使其向M2 型极化偏移,而Ⅱ型感染的巨噬细胞则会向M1型极化偏移。有研究[2,10]结果显示,Ⅰ型和Ⅲ型弓形虫通过替代激活途径诱导巨噬细胞向M2 型方向极化,而Ⅱ型虫株诱导M1 型巨噬的极化,且Ⅰ型和Ⅲ型虫株的替代性激活通过JAK-STAT 信号通路等引发抗炎,而Ⅱ型菌株对巨噬细胞的经典激活则通过激活NF-κB 途径并引发促炎。
为研究弓形虫蛋白ROP16 与巨噬细胞之间的关系,本实验构建ROP16 过表达慢病毒载体转染至NR8383 巨噬细胞中,结果显示,ROP16过表达后向M1 型巨噬细胞偏移,其中iNOS,IL-1β 和TNF-α mRNA 水平与空白对照组和空载组相比增高,而Arg-1、IL-10 及TGF-β mRNA水平的相对表达量则降低。结合Western blot 和ELISA 实验结果,ROP16 过表达后iNOS、NF-κB、P-NF-κB、STAT1、P-STAT1 蛋白表达量增高,Arg-1 蛋白表达量降低,并且细胞上清中IL-1β、IL-6、TNF-α 及IL-12 含量增高,抗炎因子TGF-β及IL-10 含量降低。上述研究结果说明,NR8383巨噬细胞在ROP16 蛋白作用下可能通过NF-κB信号通路向M1 型极化偏移。通过体外建立巨噬细胞可塑模型,探讨弓形虫分泌蛋白ROP16 对大鼠肺泡巨噬细胞极化的影响,旨在为M1、M2 型炎性反应及一些自身免疫性疾病治疗提供新的思路和方法,也为弓形虫ROP16 对宿主细胞的致病机制研究提供一定基础,其后应建立动物模型,进一步研究动物体内弓形虫及其效应分子对巨噬细胞极化的影响,并对弓形虫ROP16 驱动巨噬细胞向M1 型巨噬细胞偏移的作用机制做更深入研究,为相关疾病的治疗提供实验数据的支持,为后续疾病治疗提出建议。
综上所述,本研究成功构建了Ⅱ型ROP16介导的NR8383 稳定细胞系,分析了ROP16 对大鼠肺泡巨噬细胞NR8383 炎性反应的影响,也为弓形虫ROP16 对宿主细胞的致病机制研究提供了一定基础。

