HDAC 抑制剂SB939 抑制三阴性乳腺癌细胞相关基因芯片分析
王宝祯, 凌 珺, 陈 静, 李 涛
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏回族自治区生育力保持教育部重点实验室,银川 750004;3.宁夏医科大学基础医学院,银川 750004; 4.宁夏医科大学总医院肿瘤医院肿瘤外二科,银川 750004)
乳腺癌是一种复杂的异质性疾病,转移和复发是三阴性乳腺癌预后较差的主要原因之一。其中侵袭和转移在恶性肿瘤发展过程中发挥着重要的作用[1-3],在转移过程中肿瘤细胞离开原发肿瘤病灶,侵入循环系统,进入远处器官并形成转移灶[4]。人类的大多数实体瘤都起源于上皮细胞,经历一个复杂的过程,启动上皮-间充质转化(EMT),使上皮细胞失去黏附特性和极性,并获得迁移和侵袭的能力[5-7]。研究[8-10]显示,IL-6/STAT3、TGF-β/smad、PI3K/AKT 等信号通路都参与了乳腺癌转移过程,且组蛋白乙酰化和去乙酰化的失调与癌症进展有关[11-12]。在体外细胞培养模型和体内肿瘤移植模型中发现,组蛋白去乙酰化酶抑制剂(HDACis)可诱导肿瘤细胞凋亡、分化和细胞周期阻滞[13-15]。目前,在转移性乳腺癌的临床试验中,LBH589、丙戊酸和MS-275 表现出良好的低毒抗肿瘤活性,但其副反应较为明显,因此,有必要寻找新的HDACis 用于乳腺癌的临床治疗[16]。Prinostat(SB939)是一种新型的口服HDACis,与其他抑制剂如Vorinostat(SAHA)相比,具有更好的药代动力学、理化和药学特性[17]。基于此,本研究通过利用生物信息学手段,分析SB939 抑制三阴性乳腺癌细胞相应基因表达的改变,寻找其作用的关键基因及相关重要通路。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备 二氧化碳培养箱(力康生物医疗科技控股有限公司),低温离心机(4 ℃)(Eppendorf 公司),全波长酶标仪(Thermo Fisher公司),NanodropR2000(Thermo Fisher 公司),ABI 9700 RCR 仪(ABI 公司),GeneChipR Hybridization Oven 645(Thermo Fisher 公司),GeneChipR Fluidics Station 450(Thermo Fisher 公司),GeneChipR Scanner 3000 7G(Thermo Fisher 公司)。
1.1.2 细胞和试剂 三阴性乳腺癌细胞MDAMB-231(ATCC),RPMI-1640 培养基(MultiCell Technologies 公司),胎牛血清(MultiCell Technologies公司),SB939(Selleck 化学公司),TRIzol(Ambol公司),总RNA 提取试剂盒(Macherey-nagel 公司),3’IVT PLUS 试剂盒(Affymetrix 公司),GeneChipR杂交、洗涤和染色试剂盒(Affymetrix 公司)。
1.2 细胞培养及总RNA 提取和纯化
三阴性乳腺癌细胞MDA-MB-231 用含有20%胎牛血清的1640 培养液在37 ℃、5%CO2培养箱中培养。待细胞贴壁后,分别用不同浓度的SB939(0、40、60 μmol·L-1)处理24 h,将收集的细胞分为对照组C(未经SB939 处理的3 个对照组C1、C2、C3)及6 个实验组T(经40 μmol·L-1的SB939 处理的3 个低剂量组T1、T2、T3,以及 经60 μmol·L-1的SB939 处理的3 个高剂量组T4、T5、T6)。当细胞贴壁程度达到85%~90%后,用PBS 洗3 遍,加入TRIzol,反复吹打,充分裂解细胞。随后加入氯仿,室温静置15 min,4 ℃、12 000 r·min-1离心10 min,吸取上清,加入异丙醇,静置10 min,再次4 ℃、12 000 r·min-1离心10 min,75%乙醇洗涤沉淀,离心,室温静置5 min。加入DEPC 处理水溶解RNA,-70 ℃保存。提取总RNA 的浓度和质量,采用分光光度计和琼脂糖凝胶电泳测定,总RNA 纯化的详细步骤严格按照3’IVT PLUS 试剂盒要求操作。
1.3 芯片杂交
芯片采用Affymetrix 公司提供的表达谱芯片进行分析,实际操作流程参照Affymetrix 表达谱芯片标准流程。cRNA 片段化处理后,加入GeneChipR杂交、洗涤染色试剂盒内提供的杂交液,将混匀的杂交液滴加在芯片上处理过夜。芯片杂交后的洗涤、染色等过程严格按照GeneChipR 提供的操作手册操作。
1.4 统计学方法
采用Affymetrix 官方软件Expression Console进行芯片QC 质检,并利用Bioconductor 项目中的affy、oligo、gcrma 与limma 包进行数据比对分析。使用DAVID 数据库,通过GO(gene ontology)功能富集及KEGG(kyoto encyclopedia of genes and genomes)通路富集对差异基因进行分析。GO 功能富集主要对差异的基因进行功能类别或者细胞定位分析。将上调和下调的基因分别经过GO功能富集后,红色表示上调的基因所富集的GO条目,绿色表示下调的基因所富集的GO 条目,柱形越长表示富集越显著。KEGG 通路富集分析:蓝色柱状图以Enrichment Score 为参数展示富集最显著的前10 条通路条目的情况,柱形越长表示富集越显著。P≤0.05 为差异有统计学意义。
差异基因火山图以倍数差异(log fold change)为x 轴,P 值为y 轴,并以灰色粗线标示倍数差异与显著性的阈值,将过检的下调基因标示为绿色,上调基因标示为红色。右上角添加moderated-t的观测值分布与理论分布的QQ 图,用以标注假阳性控制情况。
GSEA 分析的数据库来源于MSigDB v5.1,color bar 代表检出表达基因的数目,红色对应上调倍数,蓝色对应下调倍数,黑色线条表示对应位置的基因,绿色曲线代表所检测基因对应的Enrichment Score 分布(分数为负值,说明该靶基因在下调基因中富集;分数为正值,说明该靶基因在上调基因中富集)。
2 结果
2.1 差异基因表达分析
高剂量组(T4~T6)与对照组(C1~C3)相比,基因表达上调1.5 倍的基因共19 个,下调1.5 倍的mRNA 基因92 个,芯片杂交分析后的差异基因火山图如图1A 所示,越偏离中心两条线的点,代表此基因在高剂量组和对照组的差异越明显。从差异基因聚类热图(图1B)可以看出,下调的基因包括SOX4、HAS2 等,上调的基因包括IFIT1、IFIT2 等。
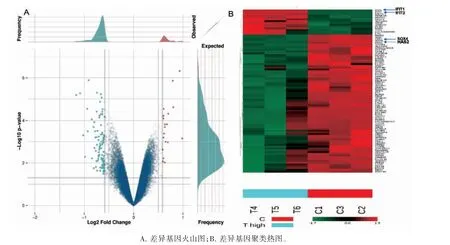
图1 差异基因的表达
2.2 GSEA 分析
GSEA 分析数据库对基因集做了如H(hallmark gene sets)、C1(positional gene sets)、C2_CP(Canonical pathways)、C3_MIR(microRNA targets)等13 组分类,本研究着重分析了C3_MIR 组(共221 个),主要用于鉴定表达差异是否可能由miRNA 引起。结果显示在经过SB939 处理后的三阴性乳腺癌细胞MDA-MB-231 中(图2),miR-501、miR-23A、miR-23B 在下调的miRNA 中显著富集(ES 值分别为-0.34 和-0.26)。
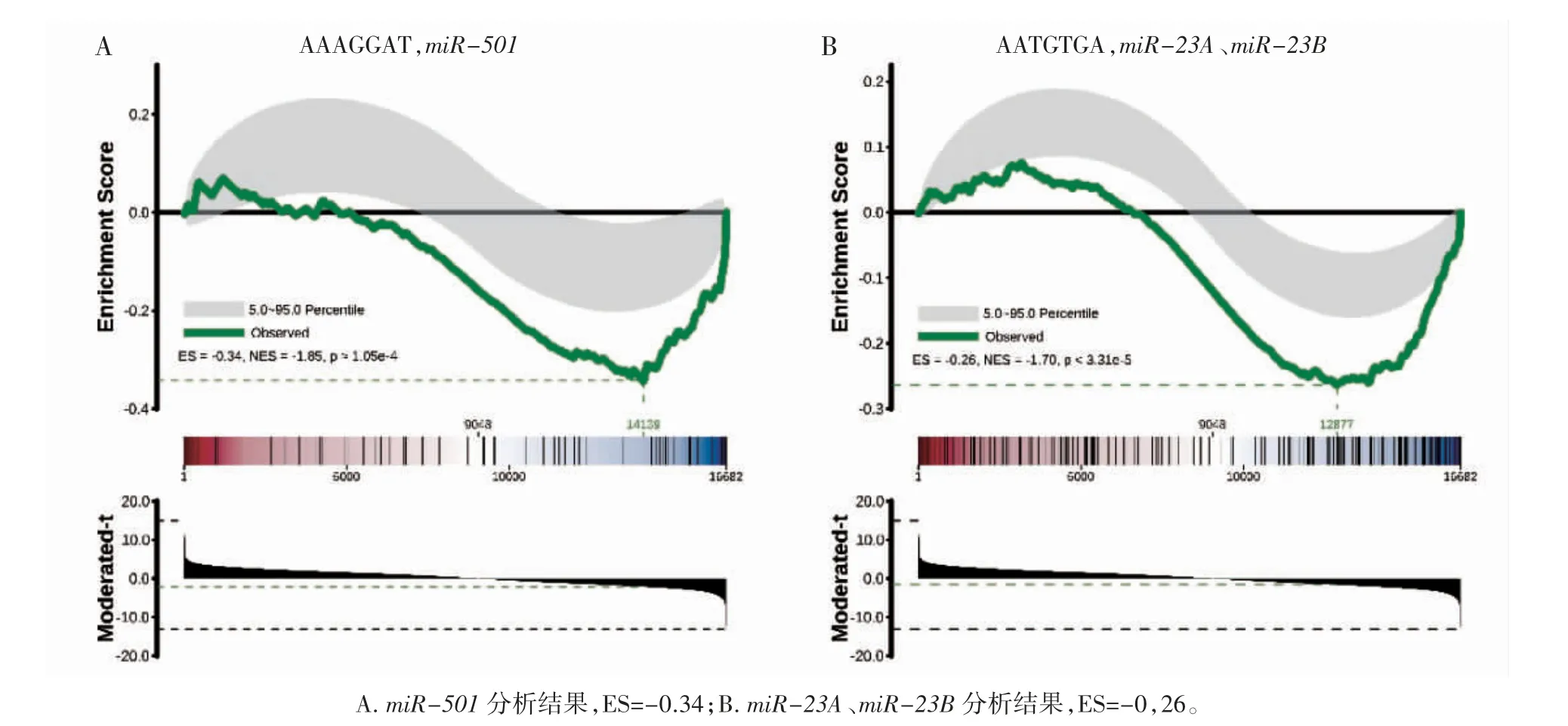
图2 GSEA 分析结果
2.3 GO 富集分析
在生物过程(biological process,BP)上调的DEGs 主要富集在Ⅰ型干扰素信号通路及对卵泡刺激反应、促性腺激素反应等;下调的DEGs 显著富集在唾液腺形态发生发展、二歧性上皮末端单元的再分裂、器官形态发生及骨形成(图3)。在分子功能(molecular function,MF)上,上调的DEGs 富集丝氨酸型肽链内切酶活性、氧化还原酶活性、丝氨酸型肽酶活性等,下调的DEGs 富集在受体结合、蛋白结合、RNA 聚合酶2 核心启动子近端区序列特异性DNA 结合转录因子活性参与转录的正向调控等(图4)。细胞组成(cellular component,CC)分析显示,上调的DEGs 显著富集于细胞溶质、胞质部分和有丝分裂器等;下调的DEGs 显著富集于细胞外空隙、血小板α 颗粒管腔和肌动蛋白丝等(图5)。
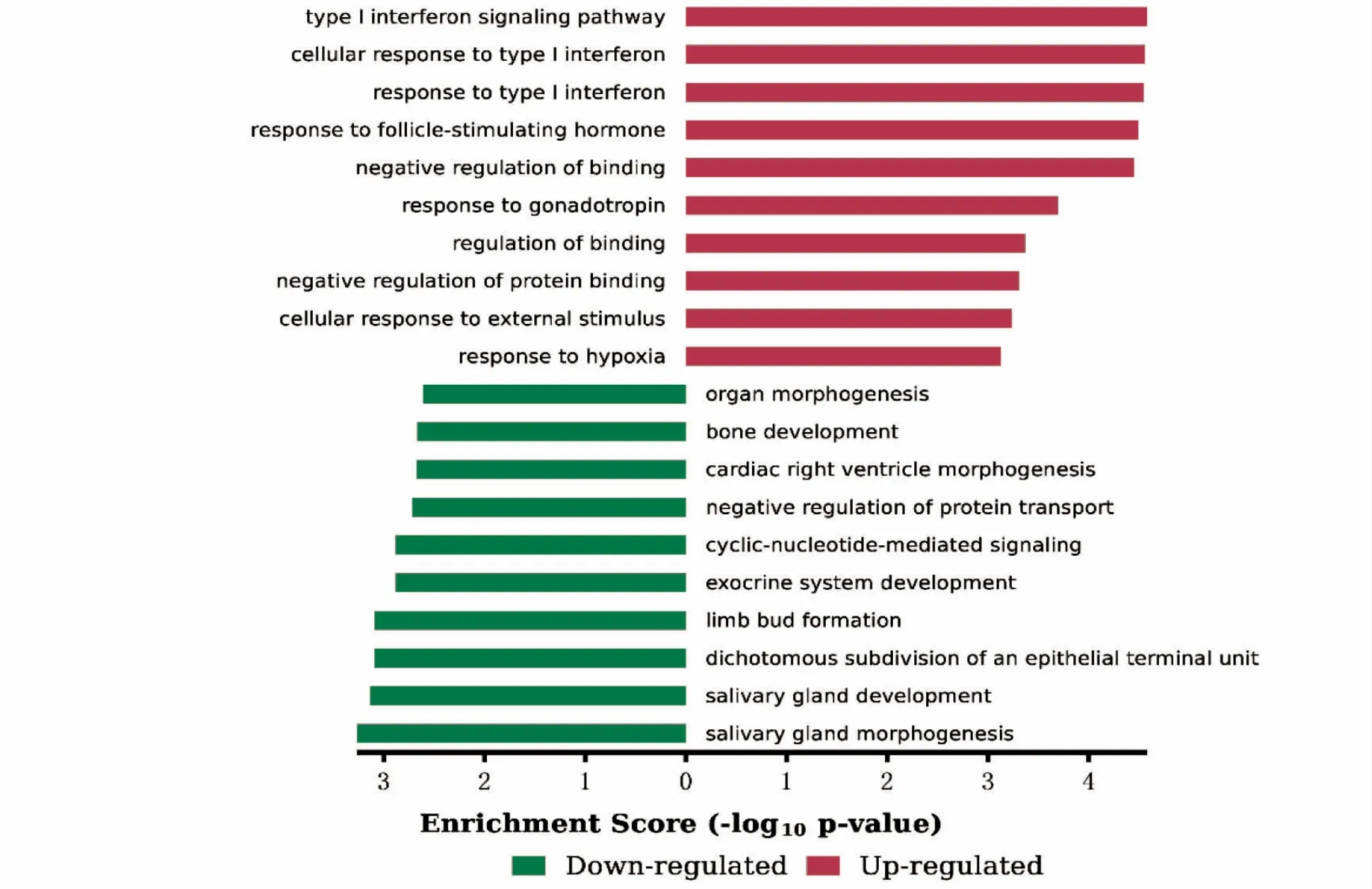
图3 BP 的GO 富集分析
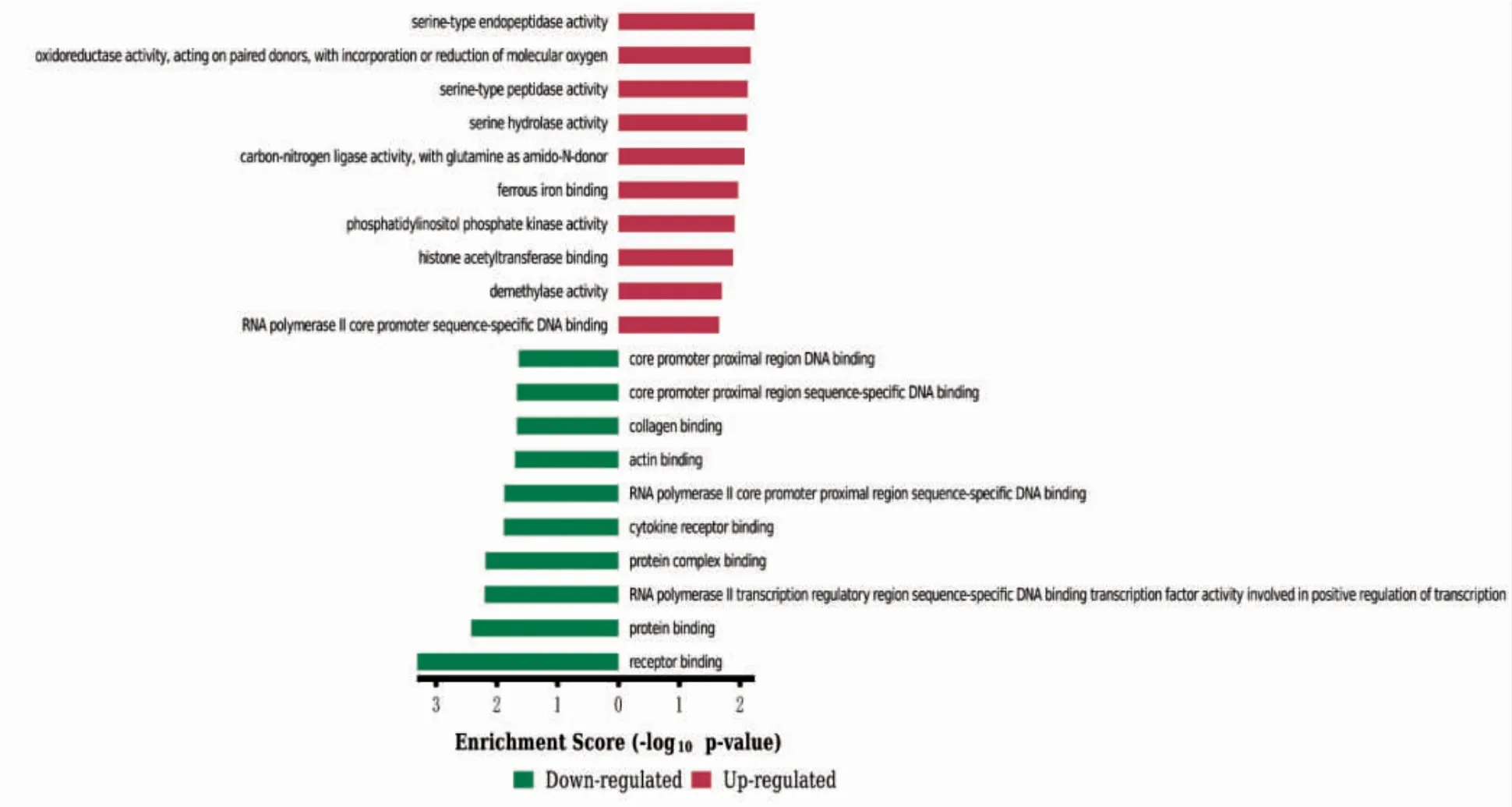
图4 MF 的GO 富集分析
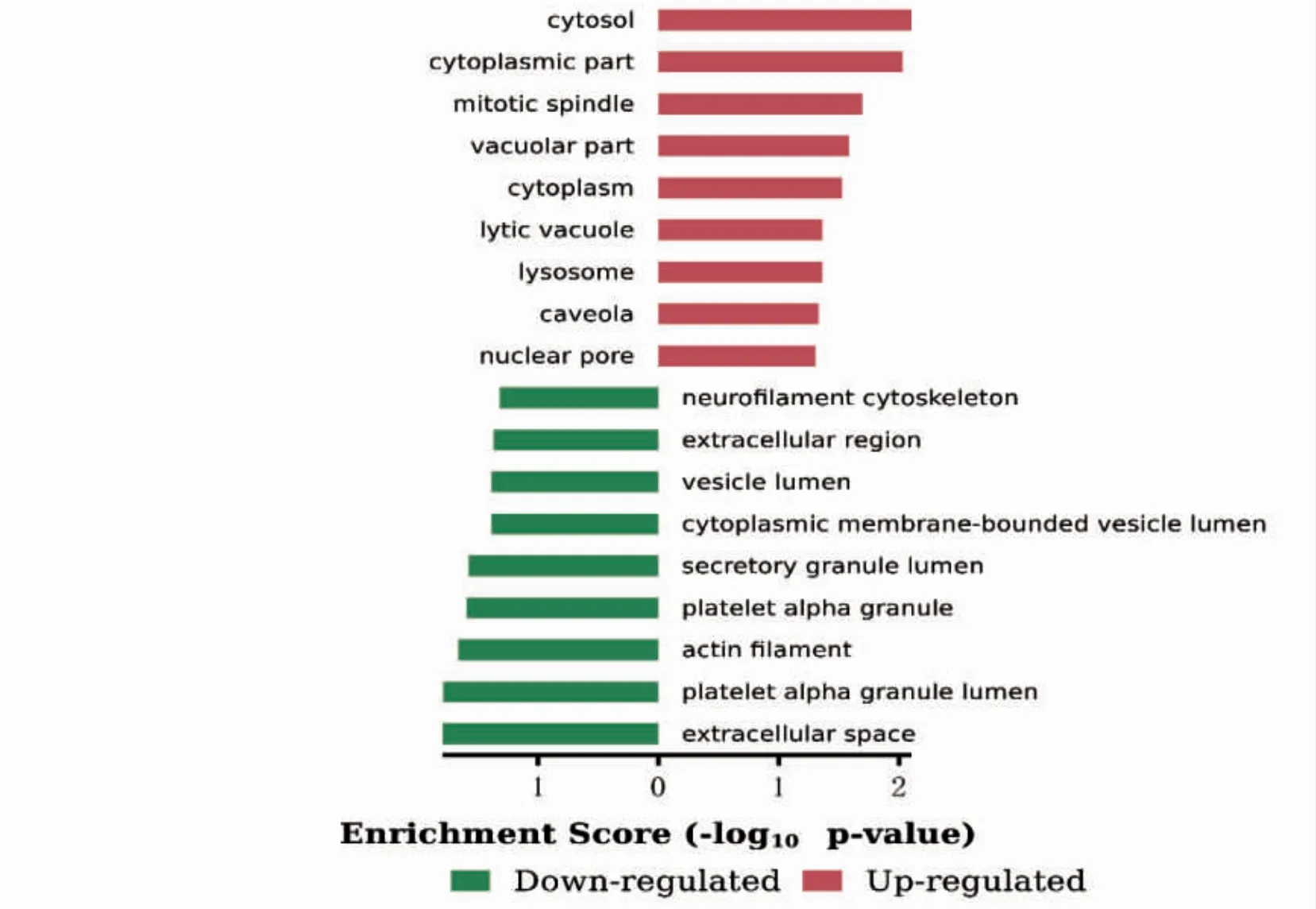
图5 CC 的GO 富集分析
2.4 KEGG 通路分析
下调DEGs 通路主要富集于上皮细胞的细菌侵袭途径、磷酸肌醇代谢、磷脂酰肌醇信号系统和ECM-受体相互作用途径,(图6)。
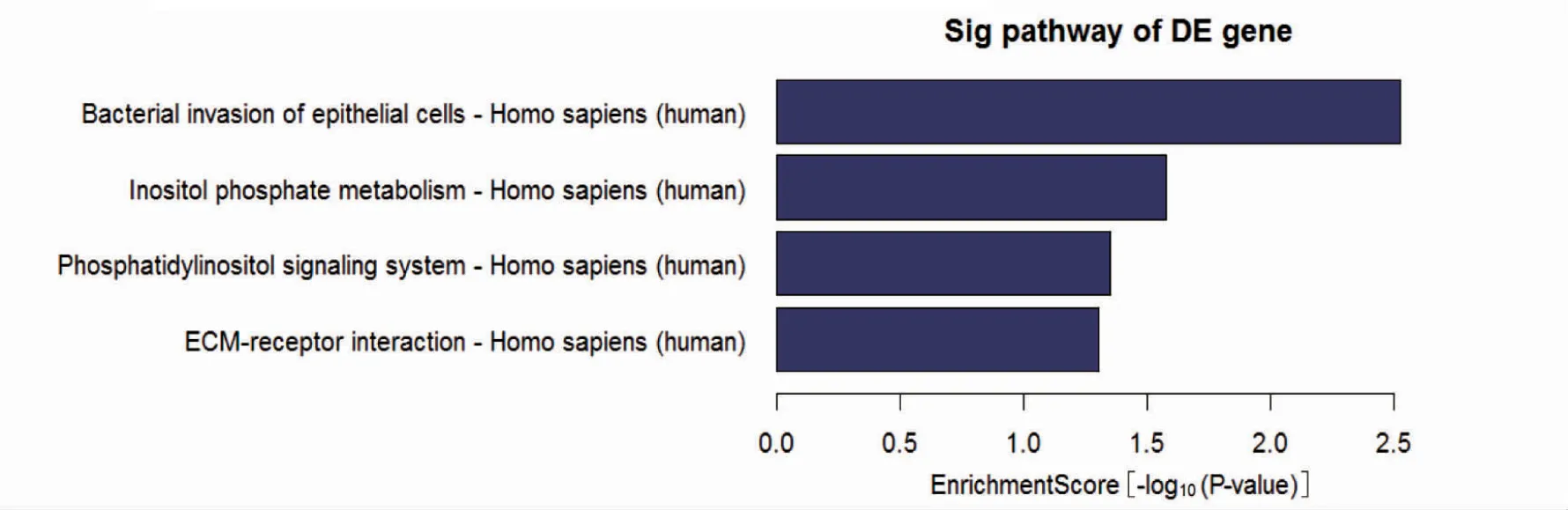
图6 KEGG 通路分析
3 讨论
乳腺癌是当今女性发病率和病死率最高的一种恶性肿瘤,我国乳腺癌的发病率和病死率处于逐年上升的趋势[18-19]。其中,三阴性乳腺癌发生早期转移是导致患者死亡的主要原因,由于其过早发生转移,因此,三阴性乳腺癌治疗方式主要以化学药物治疗为主。但随着靶向治疗在临床的应用,基因靶点的确定成为目前的研究热点。临床常用的组蛋白去乙酰化酶抑制剂药物包括丙戊酸和MS-275 等[20-22]。Prinostat(SB939)可明显抑制乳腺癌细胞的转移[23-26]。为了进一步研究SB939抑制三阴性乳腺癌细胞转移的机制,本研究通过设置SB939 实验组和对照组,对其进行基因芯片分析。
本研究通过基因芯片分析发现,在所有差异表达的基因中,有19 个基因表达上调,92 个基因表达下调。对差异基因进行GO 富集分析显示,上调的DEGs 主要富集在Ⅰ型干扰素信号通路、对卵泡刺激和促性腺激素反应等生物学过程;在分子功能上,上调的DEGs主要与丝氨酸型肽链内切酶活性、氧化还原酶活性和丝氨酸型肽酶活性相关;细胞成分分析结果显示,上调的DEGs显著富集于细胞溶质、胞质部分和有丝分裂器等部位。下调的DEGs 在生物学过程主要富集在唾液腺形态发生发展、二歧性上皮末端单元的再分裂、器官形态发生和骨形成;在分子功能上,下调的DEGs 富集在受体结合、蛋白结合、RNA 聚合酶2 核心启动子近端区序列特异性DNA 结合转录因子活性参与转录的正向调控等;细胞成分分析结果显示,下调的DEGS 显著富集于细胞外空隙,血小板α 颗粒管腔,肌动蛋白丝等。KEGG通路富集分析中结果显示,下调DEGs 通路主要富集于上皮细胞的细菌侵袭途径,磷酸肌醇代谢,磷脂酰肌醇信号系统,ECM-受体相互作用途径。
miRNA 在基因转录调控中起着非常重要的作用[27],而这些基因又可能与特定的生物过程有关。多数miRNA 控制的基因邻域参与如动力蛋白结构相关过程、免疫反应、血管生成、细胞因子活性和细胞运动及EMT 途径,在ER 阴性的乳腺癌肿瘤组织以及相应的细胞系中其异常升高导致了乳腺癌细胞的增殖[28-31]。miR-501 的表达与多种肿瘤的发生、发展密切相关,如它可以激活Wnt/β-catenin 信号进而促进结直肠癌的进展[32-37]。miR-23A 和miR-23B 是miR-23 两种亚型。miR-23A 的过度表达可促进癌细胞的迁移和侵袭[38-40],一方面miR-23A 可通过阻断TGF-β1 介导的EMT,从而抑制乳腺癌细胞的迁移、侵袭和转移。另一方面可以直接靶向上皮标志物基因CDH1,降低E-cadherin 的表达,从而激活Wnt/β-catenin信号[40]。GSEA 分析结果显示,与对照组相比,实验组经高剂量(T4~T6)处理后,miR-501、miR-23A、miR-23B 等在表达下调的miRNA 中显著富集,即可表明SB939 可以通过转录调控途径调节乳腺癌细胞的增殖与转移,其发挥作用的途径可能是多样的。
综上所述,HDACis SB939 具有抑制三阴性乳腺癌细胞增殖和转移的作用,可通过多种途径为三阴性乳腺癌的深入研究提供探索方法,也为三阴性乳腺癌的临床治疗提供了参考依据。

