超声造影对小鼠乳腺癌淋巴结转移模型的诊断价值
陶宏宇, 孙 楠, 朱 珊, 申洪远, 米成嵘, 王福霞, 王 文
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院超声科,银川 750004)
乳腺癌是全球范围内女性最常见的恶性肿瘤之一[1]。作为最易发生淋巴转移的肿瘤,乳腺癌患者腋窝淋巴结分期对于后续的治疗及预后有着重要意义[2]。前哨淋巴结(sentinel lymph node,SLN)是原发肿瘤引流区的第一个或第一组淋巴结,目前临床多采用前哨淋巴结活检(sentinel lymph node biopsy,SLNB)来判定其病理状况,但其本身为有创检查并且操作难度较高[3]。近年来,超声造影(contrast-enhanced ultrasound,CEUS)作为一种无创且简便的检查手段,被越来越多地应用于乳腺癌淋巴转移的临床研究和动物实验中,通过注射超声微泡造影剂可获得淋巴结内微血管分布及灌注信息,从而对SLN 状态进行判断[4]。本研究构建了Balb/c 小鼠乳腺癌细胞足垫成瘤的腘窝淋巴结转移模型,观察比较腘窝淋巴结在常规超声以及经静脉注射造影剂后CEUS 的表现,探讨CEUS 在小鼠淋巴结转移模型中的诊断价值。
1 材料与方法
1.1 实验动物及细胞株
健康Balb/c 小鼠50 只,均为雌性,鼠龄4周,体质量18~20 g/只,购于宁夏医科大学实验动物中心,在SPF 级环境中饲养。小鼠乳腺癌细胞株4T1,购于中国科学院上海细胞库。
1.2 小鼠乳腺癌细胞4T1 的复苏与培养
从液氮中将冻存的小鼠4T1 乳腺癌细胞取出,迅速放入37 °C 水浴锅中复苏,复苏后置于含10%胎牛血清的RPMI-1640 培养基,在37 °C、5%CO2环境下进行体外培养增殖,培养皿中细胞长至80%密度则进行传代,细胞传代三代以上后取对数生长期细胞配制成肿瘤细胞悬液。
1.3 构建Balb/c 小鼠腘窝淋巴结肿瘤转移模型
小鼠适应性饲养1 周后进行实验,取对数生长期的4T1 细胞,加入PBS 溶液稀释,配制成浓度约为1×107个/mL 的肿瘤细胞悬液。实验前对每只小鼠进行耳标编号,消毒小鼠右后腿足垫皮肤,使用1 mL 注射器将肿瘤细胞悬液(约60 μL/只)注射入足垫皮下,隆起皮丘后缓慢退针。之后定期观察并记录小鼠体质量、足垫肿瘤生长情况以及同侧腘窝淋巴结肿大情况,肿瘤体积计算公式为:体积(mm3)=(长×宽2)/2,根据计算结果绘制肿瘤时间生长曲线。在注射肿瘤细胞悬液后第2、3、4、5、6 周分别随机抽取10 只小鼠进行常规超声及CEUS 检查。
1.4 常规超声检查
使用西门子ACUSON Sequoia 彩色多普勒超声诊断仪,10 L4 线阵探头,检测频率10 MHz,实验中仪器各项参数保持不变。采用异氟烷吸入麻醉小鼠,取仰卧位固定于操作台上,超声耦合剂加热到适宜温度后使用,操作全程注意小鼠麻醉状态的监护及保暖。
使用常规超声扫描小鼠右后腿足部及同侧腘窝,充分显示足垫肿瘤及腘窝肿大淋巴结。观察肿瘤内部回声、有无液性暗区,在最佳成像切面测量淋巴结纵径及横径,观察记录淋巴结回声、纵横比、边缘及淋巴门状况等,彩色多普勒血流显像(color doppler flow imaging,CDFI)观察肿瘤及淋巴结血流情况。检查完毕储存静态图像,切换进入造影模式。
1.5 CEUS 及造影图像分析
超声造影剂选用意大利Bracco 公司的第二代微泡造影剂声诺维(SonoVue),将5 mL 0.9%NaCl 溶液与冻干粉混合后摇匀备用。在超声诊断仪上选择造影条件为SonoVue 专用模式,以团注方式对每只小鼠经眶后静脉丛注射0.1 mL 造影剂,注射后即刻开启仪器内置计时器,储存计时开始后5 min 内的造影影像。
对淋巴结造影增强模式进行分析,根据造影剂灌注淋巴结的模式可分为离心性增强以及向心性增强,根据到达增强峰值时淋巴结内造影剂的分布情况,可将腘窝淋巴结造影剂分布模式分为四类,即Ⅰ型:整体均匀增强,Ⅱ型:整体不均匀增强,Ⅲ型:仅周边环状增强,Ⅳ型:整体不增强或仅局部低增强。所有超声操作及诊断工作均为两名从事超声造影5年以上的临床医生共同完成。
1.6 病理检查
造影结束后,在深度麻醉下行颈部脱臼处死小鼠,解剖小鼠足垫肿瘤及同侧肿大腘窝淋巴结浸入4%多聚甲醛组织固定液中,之后包埋入石蜡,进行HE 染色,光镜下由专业病理科医师观察诊断。
1.7 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计数资料采用百分率(%)表示,计算常规超声与联合经静脉CEUS 的诊断准确度、特异度和灵敏度,组间比较采用χ2检验或Fisher 确切概率法。P≤0.05 为差异有统计学意义。
2 结果
2.1 小鼠足垫肿瘤生长情况
足垫接种肿瘤细胞悬液后4~5 d,50 只小鼠右后腿足垫处均可观察到有肿瘤结节长出,成瘤率100%(50/50)。足垫肿瘤体积随时间增加而逐渐增大,在接种后不同时间测量肿瘤大小,其时间生长曲线见图1。从接种第3 周开始,部分小鼠肿瘤表面开始出现溃烂、发黑,至接种后第6 周的超声检查前,所有剩余小鼠的肿瘤均出现程度不等的表面溃烂。
2.2 小鼠腘窝淋巴结转移情况
足垫接种肿瘤细胞悬液后1 周左右,50 只小鼠均可触及肿瘤同侧腘窝处米粒大小的肿大淋巴结。于接种后第2、3、4、5、6 周分别随机抽取10 只小鼠,在CEUS 检查后处死并解剖腘窝淋巴结进行HE 染色病理诊断,小鼠腘窝淋巴结转移情况见图1。

图1 足垫肿瘤的时间生长曲线及不同时间点腘窝淋巴结转移发生率
2.3 常规超声表现
常规超声显示,小鼠足垫原始肿瘤呈低回声,自接种第3 周开始,观察到部分瘤体内存在大小不等的液性暗区(提示存在液化坏死),CDFI 可见肿瘤内点状分布的血流信号。在常规超声下,反应性增生淋巴结典型表现为实质均匀低回声,纵横比>2,CDFI 可见淋巴门型血流或无血流信号。转移性淋巴结典型表现为实质回声不均匀,形状呈类圆形,纵横比<2,边缘不规则,淋巴门消失,CDFI 显示血流信号沿淋巴结周边散在分布,或表现为周边及淋巴门型血流同时存在,见表1。

表1 腘窝淋巴结常规超声表现(例)
2.4 经静脉CEUS 及病理表现
经眶后静脉丛注射造影剂后,足垫肿瘤即刻出现造影剂充盈,注射后3~5 s,腘窝肿大淋巴结处可观察到造影剂充盈,20 s 左右达到充盈峰值,之后造影剂开始缓慢消退。在常规超声检查的基础上,根据淋巴结造影剂灌注增强模式以及到达充盈峰值时淋巴结内造影剂的分布模式对淋巴结良恶性进行判断;转移性淋巴结在显像过程中造影剂灌注增强模式多为向心性增强,反应性增生淋巴结多为离心性增强(P<0.05),转移性与反应性增生淋巴结造影剂分布模式差异具有统计学意义(P<0.05),见表2。转移性淋巴结造影剂多呈不均匀分布且整体强度较低,造影剂分布模式多为Ⅱ型、Ⅲ型或Ⅳ型,见图2B;病理HE 染色切片显示,转移性淋巴结表现为淋巴结正常形态消失,内部淋巴细胞数量减少,可见肿瘤细胞浸润并取代正常淋巴组织,见图2C。反应性增生淋巴结多为整体均匀高增强,造影剂分布模式多为Ⅰ型,见图3B。反应性增生淋巴结的形态较正常,淋巴结内可见生发中心,无肿瘤细胞浸润,见图3C。
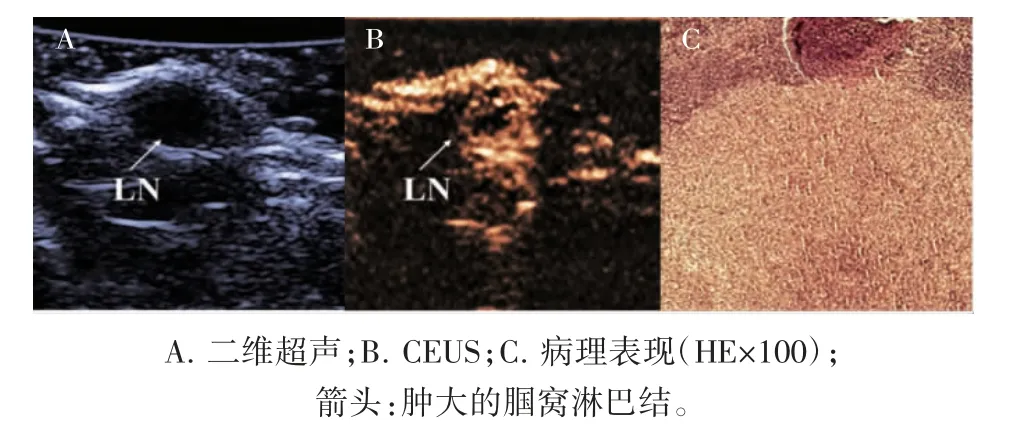
图2 典型转移性淋巴结声像图及病理表现
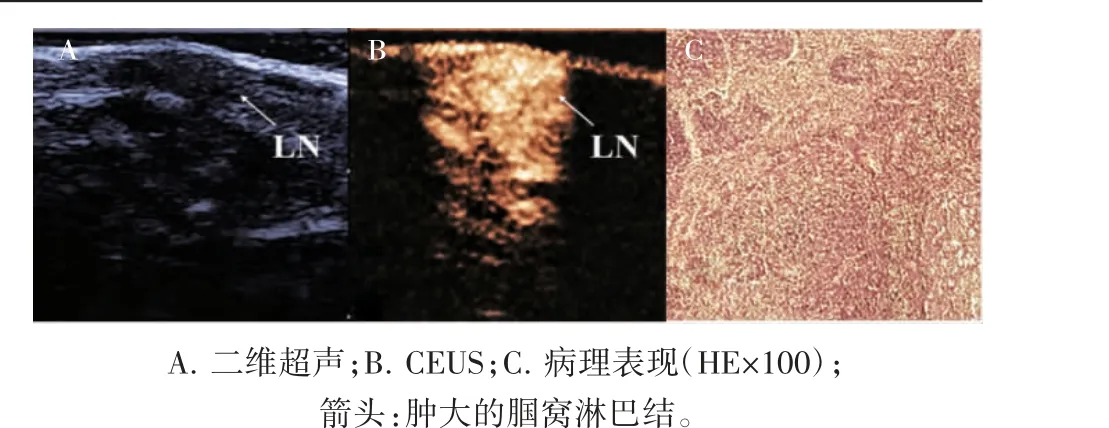
图3 典型反应性增生淋巴结声像图及病理表现

表2 腘窝淋巴结经静脉CEUS 表现[例(%)]
2.5 常规超声与联合经静脉CEUS 对小鼠淋巴结转移模型的诊断比较
在连续5 周分别解剖取出的50 只小鼠的50枚肿大腘窝淋巴结中,病理诊断32 枚为转移性淋巴结,18 枚为反应性增生淋巴结。以病理检查结果为金标准,常规超声对小鼠腘窝淋巴结良恶性的诊断准确度为56.0%,灵敏度为56.3%,特异度为55.6%;联合经眶后静脉丛CEUS 对小鼠腘窝淋巴结良恶性的诊断准确度为76.0%,灵敏度为75.0%,特异度为77.8%,见表3。两种超声检查方式对小鼠淋巴结转移模型良恶性鉴别的准确度差异有统计学意义(χ2=4.456,P<0.05),而灵敏度与特异度差异均无统计学意义(P=0.096,P=0.275,采用Fisher 确切概率法)。
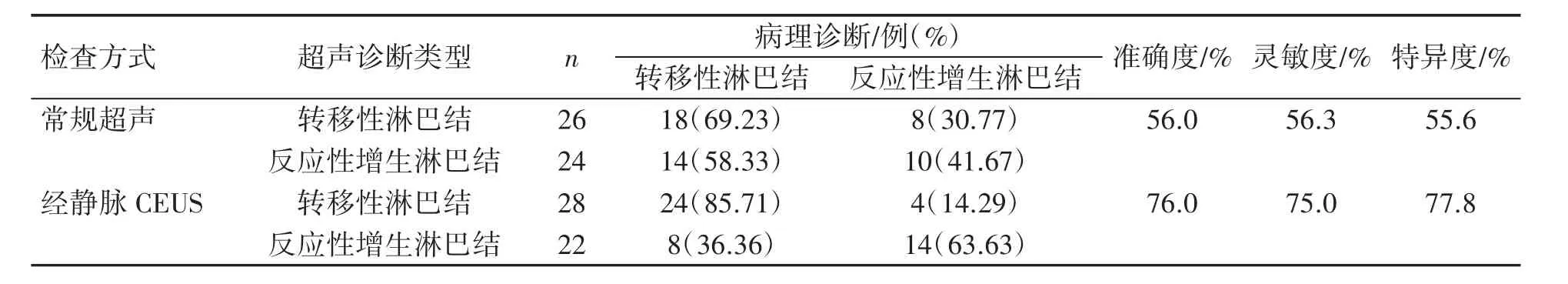
表3 常规超声及联合经静脉CEUS 检查与病理诊断结果比较
3 讨论
SLN 作为阻止肿瘤细胞经淋巴道扩散的屏障,其状态对于乳腺癌患者癌症分期以及后续治疗决策具有重要意义。在临床上,SLNB 是判定淋巴结性质的金标准,通过蓝色染料法和核素探测法标记淋巴结后进行SLNB 可得出对SLN 状态较精准的结果[5]。在乳腺癌发生发展的过程中,肿瘤细胞经淋巴道的转移以及肿瘤本身所引起的炎性反应均有可能引起SLN 的肿大,肿瘤引流区的非转移性肿大淋巴结被称为肿瘤反应性淋巴增生[6],如何早期发现肿大淋巴结并对其进行无创鉴别诊断依然是目前外科及影像专业所面临的难题。
本次实验中构建了4T1 乳腺癌细胞小鼠足垫成瘤的腘窝淋巴结转移模型,腘窝淋巴结是小鼠足掌区的第一站引流淋巴结,形成的单向淋巴道转移模型具有转移发生率高,可重复性好等优点,适用于单纯的淋巴结转移研究[7]。接种后1周,腘窝淋巴结肿大至米粒大小,触之质地较硬,可随皮肤滑动,随着时间发展至接种后3 周左右,一部分反应性增生淋巴结较之前稍减小,但与对侧相比依然处于肿大状态,而转移性淋巴结内癌灶不断生长,随着时间增长淋巴结继续增大,甚至纵径可超过1 cm。
二维超声以及彩色多普勒超声是临床检查淋巴病变的常规方法,但单独应用对淋巴结良恶性的诊断依然存在一定困难[8]。本次实验中转移及反应性增生淋巴结的常规超声及CDFI 表现存在一定的重叠,这与以往的研究[9]相一致。CEUS作为一种无创、无辐射且经济实用的技术,近年来被越来越多地应用于淋巴系统的临床及动物实验研究中。本实验采用经小鼠眶后静脉丛注射超声造影剂的方法,实时动态观察淋巴结内微血流灌注情况。使用的第二代超声造影剂SonoVue,即六氟化硫微泡,微泡平均直径为2.5 μm,小于红细胞直径,因而可以自由穿过淋巴结内微血管,同时增大声阻抗差使淋巴结显影[10]。在超声检查过程中,通过常规超声先找到肿大腘窝淋巴结的最佳成像切面,之后保持探头不动切换进入造影模式。由于小鼠尾静脉与腘窝淋巴结距离过近,在超声探头存在的情况下尾静脉注射造影剂无法很好地保证注射成功率,因而本研究选用了小鼠眶后静脉丛内注射作为鼠尾静脉注射的替代方法,其操作简便并且经过练习后注射成功率较高[11]。
对本次收集的50 枚肿大腘窝淋巴结的经静脉CEUS 图像进行分析,转移性淋巴结增强模式多为向心性增强,造影剂分布呈不均匀增强或无增强,而反应性增生淋巴结增强模式多为离心性增强,以及淋巴结内分布均匀的高增强,这与先前的动物实验研究[12]相一致。造成这种增强及分布差异的原因,是正常淋巴结由淋巴门动脉供血,形成最终可到达皮质区内的放射状分布的血管网,造影剂从淋巴门处进入并向周围分散流入淋巴结内各级小血管。反应性增生淋巴结内空间结构及血管网均规则存在,同时炎性反应使淋巴结内血管扩张,血流速度加快,因而在造影图像上就表现为离心性的均匀高增强[13]。而转移的肿瘤细胞首先通过周边淋巴管进入淋巴结中,伴随着大量肿瘤新生血管形成,进一步侵入实质内的肿瘤组织不断生长压迫淋巴结内正常结构,造成正常血管受压闭塞,血流灌注降低,静脉回流受阻,使组织失去正常血供,最终在淋巴结内形成低灌注的肿瘤组织区及无灌注的坏死区,因此造影图像表现为向心性的不均匀增强或不增强[14]。
本研究结果显示,在常规超声基础上联合经静脉CEUS 诊断小鼠腘窝淋巴结良恶性质的准确度要高于单独的常规超声检查。但实际操作中依然存在以下几个方面因素影响着超声对小鼠肿大淋巴结的准确诊断:1)小鼠的腘窝淋巴结空间结构以及声像图表现与人SLN 存在差异;2)小鼠淋巴结过小(肿大淋巴结纵径多在4~8 mm),影响医师的判断;3)没有摸索出最合适小鼠淋巴结的超声造影条件。
综上所述,经静脉CEUS 对Balb/c 小鼠乳腺癌足垫成瘤腘窝淋巴结转移模型的诊断具有一定的应用价值,本研究可为后续对小鼠淋巴结转移及通过超声方法评估淋巴结状态的实验带来一定的参考价值。

