锌指蛋白18在胰腺导管腺癌组织中的表达及临床意义
刘星辰 蒋慧 郑建明
海军军医大学第一附属医院病理科,上海 200433
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)是一种侵袭能力极强、恶性程度极高的消化系统肿瘤[1]。由于胰腺癌早期诊断困难、固有的化疗耐药以及缺乏有效的靶向药物,患者的5年生存率不足9%[2-3]。明确PDAC的发生发展机制,寻找有效的生物标志物对于PDAC的早期诊断以及评估疗效非常重要。锌指蛋白(zinc finger protein,ZNF)基因是人类基因组中最大的转录因子家族,能够调控包括分化发育、能量代谢和凋亡自噬等多种生物过程[4]。ZNF家族包括原癌和抑癌基因,不同的家族成员具有肿瘤选择性,几乎参与了肿瘤从癌变产生到转移形成的所有主要途径[5]。ZNF18基因定位于人染色体17p12-p13,包含9个外显子和8个内含子[6]。有研究报道中国北方高危地区的食管癌患者存在该基因的缺失[7]。目前关于ZNF18在PDAC中的作用尚未见报道。本研究通过检测ZNF18在PDAC组织中的表达情况,探讨其与PDAC临床病理特征及患者预后的相关性。
资料与方法
一、一般资料
收集2017年3月至2019年12月间海军军医大学第一附属医院收治的131例术后经病理学诊断为PDAC的癌组织标本,其中男性87例,女性44例,年龄32~84(61±11)岁。入组病例术前均未接受过放化疗及其他相关治疗。收集患者的临床资料,包括肿瘤部位、大小、分化程度、TNM分期、是否淋巴结转移、有无神经侵犯及脉管癌栓等。
二、PDAC组织ZNF18蛋白表达检测
采用免疫组织化学法检测石蜡封存的PDAC组织ZNF18的表达。按照免疫组织化学试剂盒说明书进行操作。兔抗人ZNF18抗体购自英国abcam公司,工作浓度1∶100,即用型山羊抗兔IgG二抗购自北京中杉金桥有限公司。由两名高年资病理科医师盲法独立阅片。根据肿瘤细胞着色强度及阳性细胞率进行评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞率0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。2个评分乘积为总评分,其中0~1分为阴性,2~4分为弱阳性,5~7分为中度阳性,≥8分为强阳性。阴性和弱阳性归为ZNF18低表达组,中度阳性和强阳性归为ZNF18高表达组。
三、随访
患者出院后通过复诊和电话等方式进行随访,时间截止于2020年1月31日,随访时间为52~928 d,中位随访时间为636 d。
四、统计学处理
应用SPSS 25.0统计软件进行临床数据分析。采用χ2检验分析ZNF18表达水平与PDAC临床病理特征的相关性。采用Kaplan-Meier法及Log-Rank检验比较ZNF18高、低表达组患者总生存期的差异。采用单因素和多因素Cox风险回归模型分析影响PDAC患者预后的独立危险因素。P<0.05为差异有统计学意义。
结 果
一、ZNF18在PDAC组织中的表达及其对PDAC患者预后的影响
ZNF18蛋白在PDAC肿瘤细胞的胞膜、胞质和胞核中均有表达,但主要表达于胞质(图1)。ZNF18低表达49例(37.40%),其中阴性8例,弱阳性41例;ZNF18高表达82例(62.60%),其中中度阳性55例,强阳性27例。ZNF18高表达组患者的总生存期显著长于低表达组[(21.53±0.69)个月比(12.17±1.57)个月],差异有统计学意义(χ2=14.16,P<0.001,图2)。
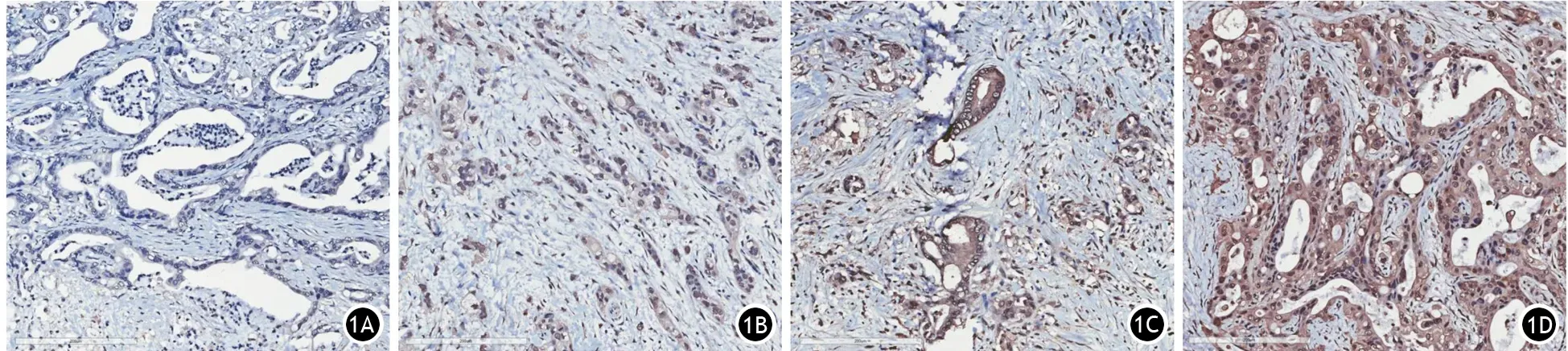
图1 锌指蛋白18在胰腺导管腺癌组织中的阴性(1A)、弱阳性(1B)、中度阳性(1C)、强阳性(1D)表达(免疫组织化学 ×200)
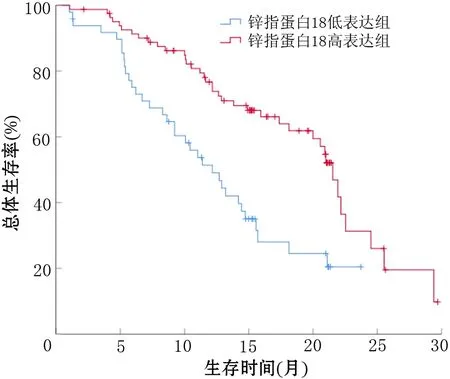
图2 锌指蛋白18高表达组和低表达组胰腺导管腺癌患者的生存曲线
二、ZNF18蛋白表达水平与PDAC临床病理特征的关系
ZNF18低表达与肿瘤淋巴结转移有关,而与PDAC患者的性别、年龄、肿瘤位置、肿瘤大小、分化程度、TNM分期、神经侵犯、脉管癌栓无关(表1)。
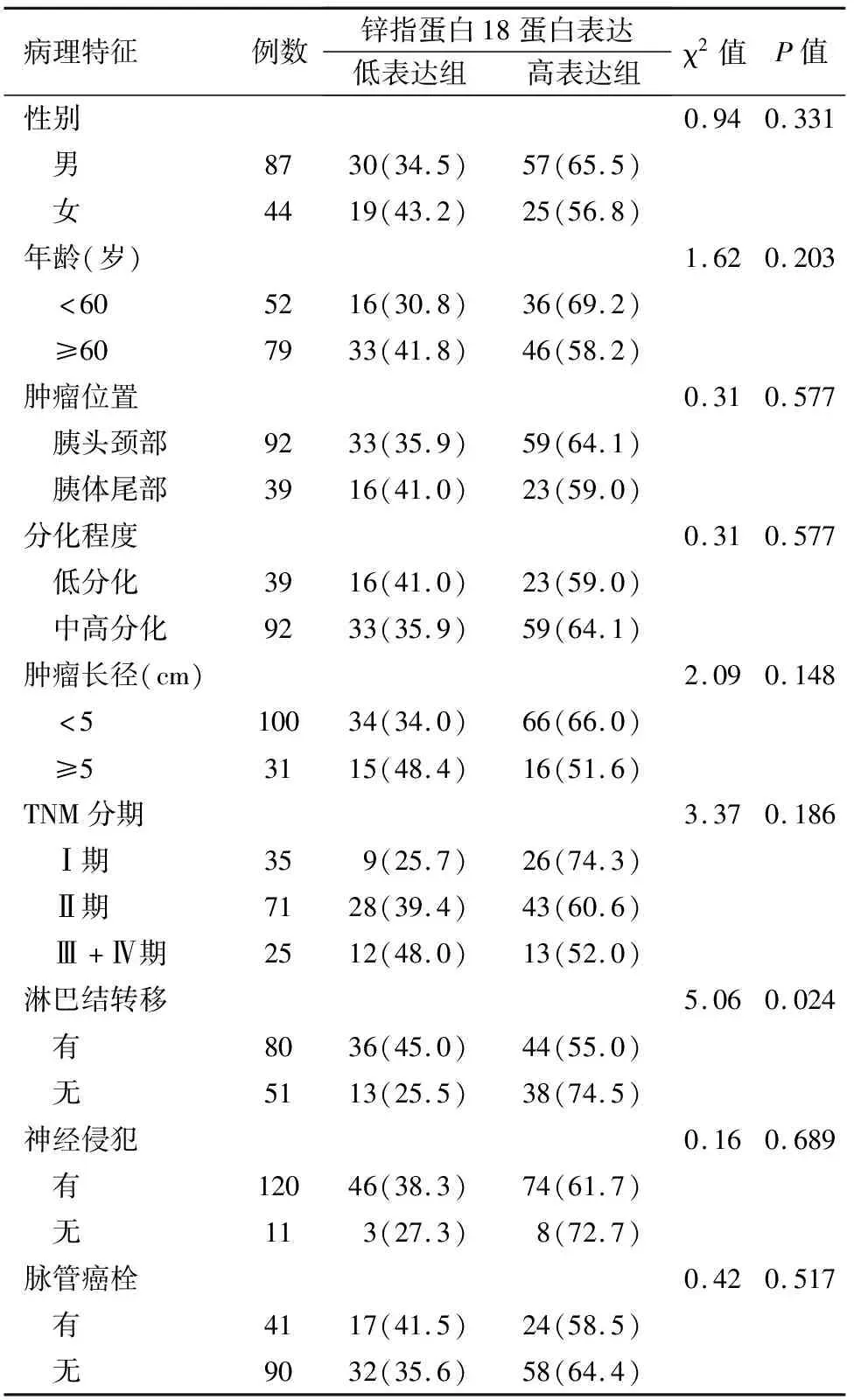
表1 131例胰腺导管腺癌组织锌指蛋白18蛋白表达与临床病理特征的关系[例(%)]
三、ZNF18蛋白表达与PDAC患者预后的关系
单因素Cox比例风险模型分析结果显示,肿瘤分化程度、TNM分期、淋巴结转移及ZNF18表达水平均与患者总生存期显著相关(表2);多因素Cox比例风险模型分析结果显示,肿瘤分化程度、淋巴结转移和ZNF18表达水平是影响PDAC患者预后的独立危险因素(表3)。
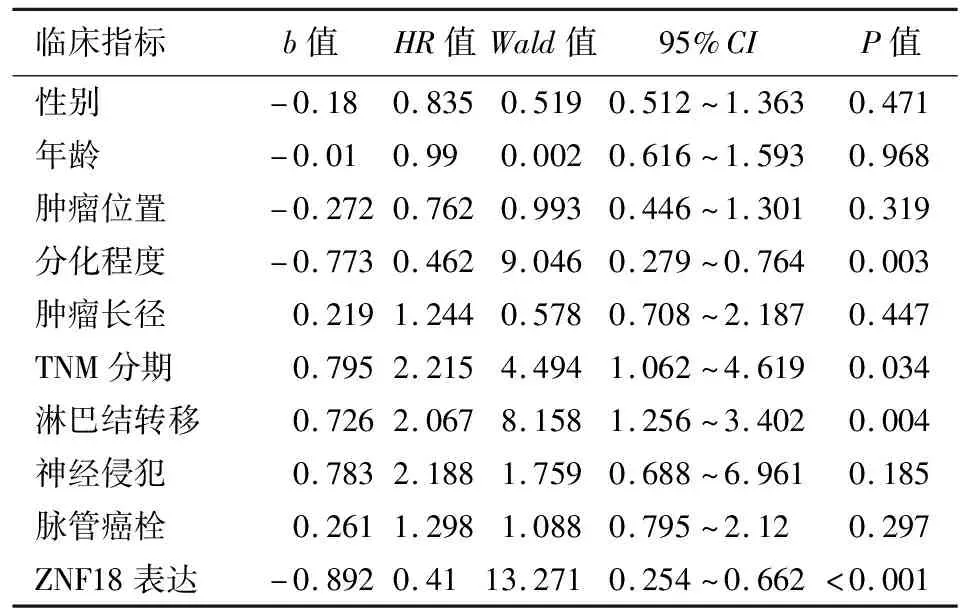
表2 131例胰腺导管腺癌患者预后的单因素分析
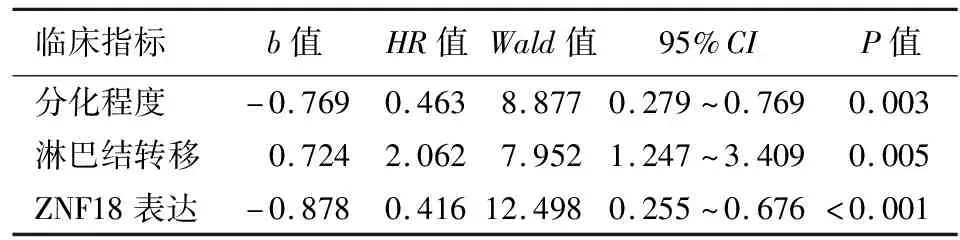
表3 131例胰腺导管腺癌患者预后的多因素分析
讨 论
PDAC是最常见的胰腺癌类型,占其90%以上,预后极差[8]。由于胰腺的解剖位置较深,早期临床症状不明显,以及缺乏特异性肿瘤标志物,超过80%的PDAC患者被确诊时,肿瘤往往已发展到中晚期[9]。即使能够及时进行根治性手术治疗,患者5年生存率也低于25%,且常易复发[10-11]。因此,寻找易于检测的生物标志物,有助于帮助PDAC的早期诊断和预后判断,对提高患者的生存率至关重要。
ZNF蛋白是真核基因组中最大的序列特异性DNA结合蛋白家族,由2%的人类基因编码[12-13]。截至目前,已经报道了8种不同类型的锌指结构域,其多样性决定了ZNF家族成员具有极大的生物功能差异[14]。研究表明,ZNF蛋白除了作为转录因子参与正常的细胞生理活动之外,还可以通过翻译后修饰等手段调控肿瘤的发生发展[4]。研究报道[15]ZNF388能够通过激活细胞周期蛋白D1和 α-内收蛋白,抑制p53基因表达,从而促进肺癌细胞的增殖、迁移和侵袭。同时,ZNF家族也能作为抑癌基因控制细胞过度生长。如ZNF545通过诱导细胞凋亡,抑制核糖体生物合成以及抑制NF-κB和AP-1信号通路转导,发挥肿瘤抑制作用[16]。还有一些ZNF家族成员具有肿瘤选择性,在不同的癌症类型中发挥促癌或抑癌作用,如ZNF395[17-18]和ZNF348[19-20]等。但关于ZNF18在胰腺肿瘤中的作用目前尚未有研究报道。
本研究结果显示,ZNF18蛋白定位于PDAC细胞的胞膜、胞质和胞核,其中以胞质分布为主。同时还发现ZNF18高表达组患者的总体生存期显著长于ZNF18低表达组,提示ZNF18高表达能显著改善患者预后。此外,本研究还发现ZNF18低表达与肿瘤淋巴结转移有关,提示ZNF18可能是抵抗PDAC转移的潜在靶点。单因素分析结果显示,肿瘤分化程度、TNM分期、淋巴结转移和ZNF18表达水平均与预后相关。多因素分析结果显示,肿瘤分化程度、淋巴结转移和ZNF18表达水平为影响PDAC患者的独立预后因素,即ZNF18低表达提示患者预后较差。临床可以通过监测ZNF18蛋白的表达水平,以评估PDAC患者病情进展情况及预后。
综上所述,本研究通过分析ZNF18表达与患者总生存期间的关系,首次提出ZNF18作为PDAC患者预后判断指标的可行性。ZNF18低表达可能介导了PDAC淋巴结转移等恶性生物学行为,是影响患者预后生存的独立危险因素。但ZNF18在胰腺肿瘤中的具体功能和相关机制尚不明确,需要进一步深入研究,为其作为PDAC的潜在分子靶点和预后标志物提供更多依据。
利益冲突所有作者声明无利益冲突
作者贡献声明刘星辰:实验操作、论文撰写、统计学分析;蒋慧:数据整理、研究指导;郑建明:论文修改、经费支持

