大黄牡丹汤对急性胰腺炎大鼠肝损伤的保护作用
孙银凤 杨丹 白敏 宋冰 康万荣汪永锋*张延英*
(1.甘肃中医药大学,兰州 730000;2.甘肃中医药大学甘肃省实验动物行业技术中心,兰州 730000)
急性胰腺炎(acute pancreatitis,AP)作为病情复杂、并发症多、病死率高的急腹症,易合并心、脑、肺、肾、肝等脏器的损害,发生多系统器官功能衰竭[1]。肝是AP 最易受损器官之一,15%~60%的AP 患者会合并肝损伤[2]。大黄牡丹汤由大黄、芒硝、丹皮、桃仁、冬瓜仁5 味中药组成,共奏泻热破瘀、通腑散结之效。本课题组前期研究表明该方能够有效改善AP 模型大鼠肝肾功能损伤,降低炎性因子水平,促进胰腺组织修复[3-6]。目前AP 肝损伤发病机制尚未明确,研究发现AP 肝损伤的发病进展与炎性因子级联效应息息相关,PI3K/Akt/NF-κB途径与炎症介质密切相关。因此,本研究进一步基于PI3K/Akt/NF-κB 信号通路关键分子深入探讨大黄牡丹汤对AP 肝损伤的保护机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
96 只2 月龄SPF 级雄性Wistar 大鼠,体重(200± 20)g,购自甘肃中医药大学SPF 级实验动物中心【SCXK(甘)2020-0001】。饲养于甘肃中医药大学SPF 级实验动物中心【SYXK(甘)2020-0009】。饲养条件:饮水自由,昼夜各半循环照明,湿度恒定45%~55%,温度维持21~25℃,常规饲养2 d后进行实验。正式实验前常规饲养1 周,所有操作均遵守甘肃中医药大学实验动物伦理原则(审批号:2021-242)。
1.1.2 主要试剂与仪器
大黄牡丹汤实验处方[7]:大黄、桃仁、芒硝,牡丹皮,冬瓜子,常规煎煮至浓度达到1 g/mL,4℃冷藏备用。奥曲肽,国药一心制药有限公司,171003;牛磺胆酸钠,北京索莱宝科技有限公司,1111J051;大鼠TNF-α、IL-1β、IL-6 ELISA 试剂盒,上海酶联生物科技有限公司,05/2021;PI3K 抗体,abcam 公司,GR3192684-9;p-Akt 抗体、Bax 抗体、Bcl-2 抗体、GAPDH 抗 体,ImmunoWay 公 司,B0601、B5501、B4101、B1501;p-NF-κB p65 抗 体,GeneTex 公 司,821904930。微量注射泵(深圳圣诺医疗设备有限公司,SN-50T6,中国)。
1.2 方法
1.2.1 动物模型复制
采用3%戊巴比妥钠进行麻醉,按文献[8-9]方法复制AP 大鼠模型,麻醉后将大鼠固定,进行剔毛和消毒,然后于剑突下切开,充分显露胰胆管与十二指肠,夹闭胰胆管远端,从十二指肠肠壁穿刺进入胰胆管,用动脉夹固定针头。将5%牛磺胆酸钠溶液使用微量泵恒速向胰胆管管内注入,注射完成后,继续夹闭5 min,然后取下头皮针,等待5 min 后逐层缝合即可。
1.2.2 动物分组及实验干预
大黄牡丹汤折算剂量参考《中药药理实验方法学》[10],根据人大鼠体表面积换算,大黄牡丹汤高、中、低组分别给予(14、7、3.5 g/kg)。空白组、模型组给予等体积蒸馏水灌胃。奥曲肽组予10 μg/kg奥曲肽背部皮下注射。各治疗组分别于造模前1 h、造模后12、24 h 分别给药治疗。
1.2.3 样本采集及指标检测
采用3%戊巴比妥钠进行麻醉,心脏采血后,离心机统一分离血清并冻存,取胰腺和肝组织,部分组织用4%多聚甲醛固定,部分组织-80℃冰箱冻存。
1.2.4 各组大鼠一般状态。
观察大鼠的精神和活动状态、扭体反应、弓背反应及便质改变等情况。
1.2.5 各组大鼠胰腺、肝组织病理学改变
取用甲醛固定的胰腺组织和肝组织,进行HE染色,脱蜡→覆水→苏木精染色→乙酸分化→伊红染色→脱水→封片等步骤,然后选取合适的放大倍数观察胰腺、肝组织病理形态变化,肝组织HE 染色完毕后,参照Camargo 等[11]病理组织评分法对肝组织镜下病理进行评分(见表1)。
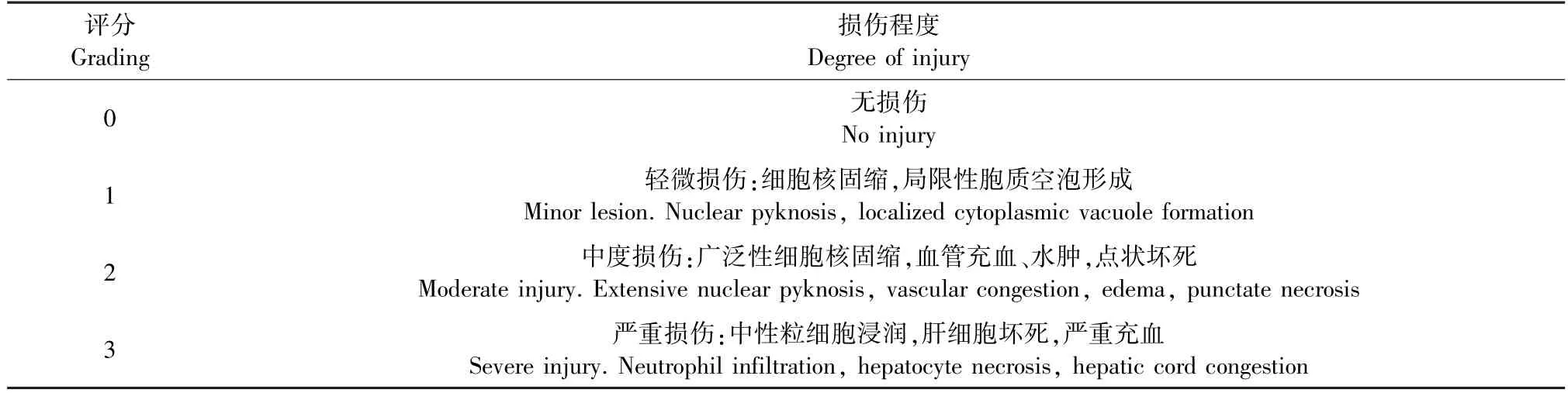
表1 肝组织镜下病理评分标准Table 1 Pathological scoring criteria of liver tissue under microscope
1.2.6 血清生化指标检测
取冻存血清,用全自动生化仪检测AMS、ALT、AST、ChE、CRP 含量。
1.2.7 ELISA 法检测各组大鼠肝组织TNF-α、IL-1β、IL-6 含量
将肝组织制备成匀浆液,用ELISA 试剂盒进行检测各组大鼠肝组织TNF-α、IL-1β、IL-6 含量,一切操作严格按照说明书进行,依据标准曲线计算肝组织匀浆样本中各个指标的含量。
1.2.8 Western Blot 法检测各组大鼠肝组织PI3K、p-Akt、p-NF-κB p65、Bcl-2、Bax 蛋白表达水平
各组大鼠干预24 h 后,将肝组织匀浆后,提取总蛋白并测定浓度,然后电泳、转膜、封闭,分别经过一抗过夜、二抗孵育和曝光等步骤,用Image J 软件进行扫描并分析条带。以GAPDH 为内参。
1.3 统计学分析
结果用平均值± 标准差()表示。采用SPSS 24.0 软件处理所有数据,组间均数差异的比较用方差分析,方差齐用LSD 法比较,方差不齐用Tamhane′s T2 法比较。以P<0.05 表示差异具有显著性。
2 结果
2.1 大黄牡丹汤对各组大鼠一般体征的影响
空白组大鼠一切体征正常,无异常反应出现;而模型组大鼠在造模后出现精神倦怠,眯眼,毛色杂乱,弓背、纽体反应明显;各治疗组在药物干预后观察到上述体征均有不同程度改善,其中大黄牡丹汤高剂量组大鼠的改善作用最为明显。
2.2 大黄牡丹汤对各组大鼠胰腺组织HE 染色观察
如图1 所示,空白组大鼠的胰腺组织病理切片未见异常改变,模型组大鼠可见胰腺腺泡间隙扩张,间质水肿和充血,部分腺泡细胞坏死,内含大量炎细胞浸润;各治疗组大鼠可见部分腺泡细胞水肿、出血及炎性细胞浸润均有不同程度减轻,尤以大黄牡丹汤高剂量组胰腺组织损伤程度最轻。
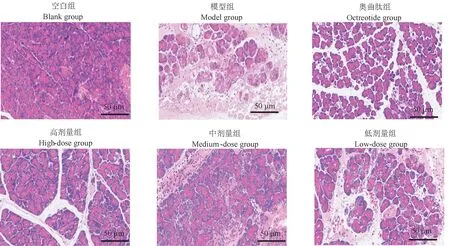
图1 各组大鼠胰腺组织病理变化Figure 1 Pathological changes of pancreatic tissue of rats in each group
2.3 大黄牡丹汤对各组大鼠肝组织HE 染色观察
如图2 所示,空白组大鼠肝小叶结构完整,肝细胞大小均匀,无变性、坏死等病理改变,无炎症细胞浸润;模型组大鼠局部可见肝细胞点状坏死,明显充血、水肿,胞质内可见微小的圆形脂肪空泡,并伴有少量炎性细胞浸润;各治疗组大鼠血管充血、水肿明显减轻,偶见点状坏死,少量炎细胞浸润,肝组织炎症明显改善,未发现片状坏死等情况,以大黄牡丹汤高剂量组肝组织损伤程度最轻。
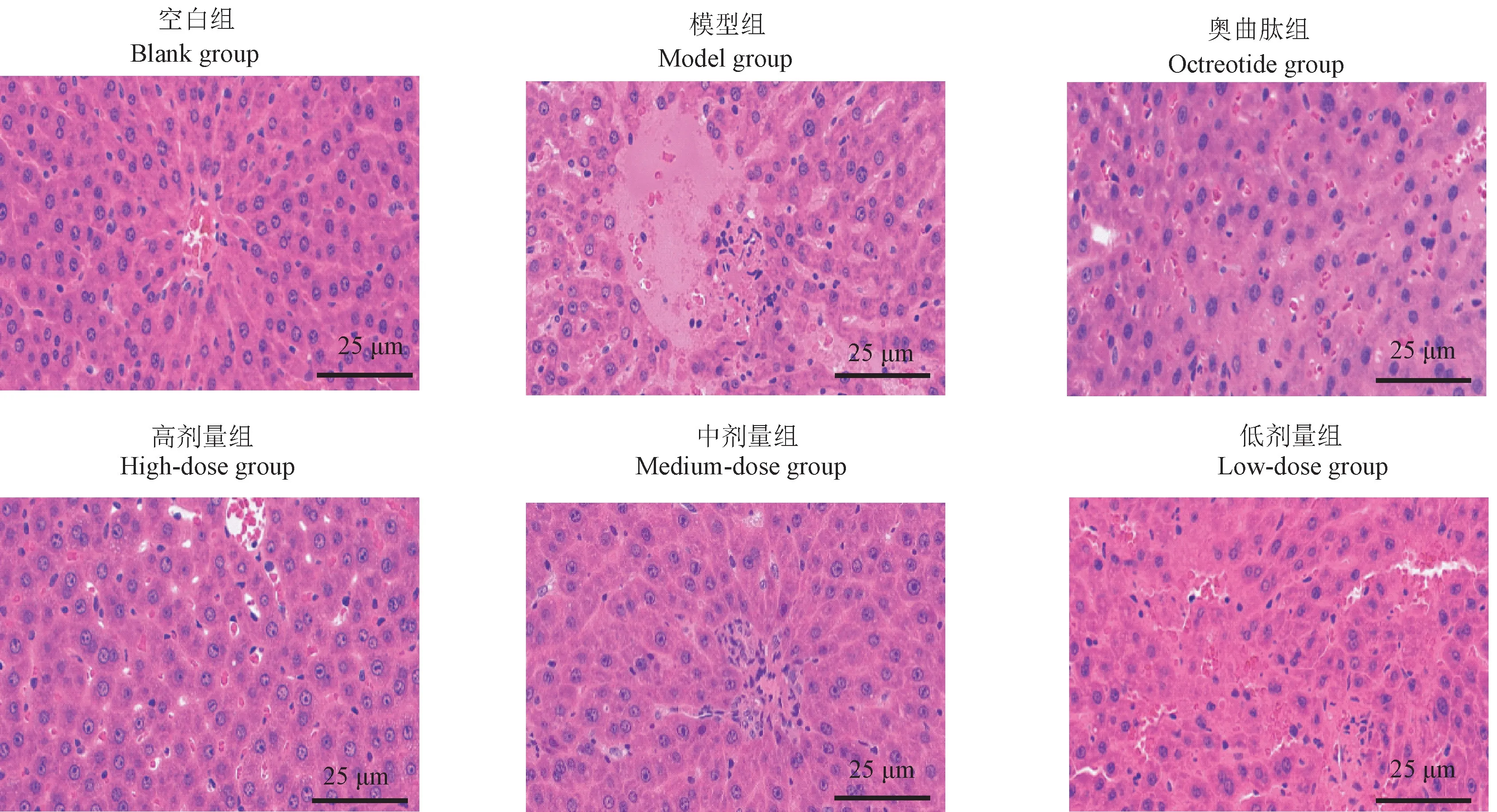
图2 各组大鼠肝组织病理变化Figure 2 Pathological changes of liver tissue of rats in each group
2.4 大黄牡丹汤对各组大鼠肝组织病理学评分的影响
空白组大鼠基本处于0 分区域,模型组大鼠6只处于3 分区域,2 只处于2 分区域,奥曲肽组大鼠1、2、3 分区域均散见,大黄牡丹汤高剂量组大鼠集中散于1、2 分区域,中剂量组超过半数散于2 分区域,低剂量组多处于2、3 分区域,大黄牡丹汤组大鼠明显呈剂量依赖性,提示大黄牡丹汤能够有效改善大鼠肝损伤(见表2)。
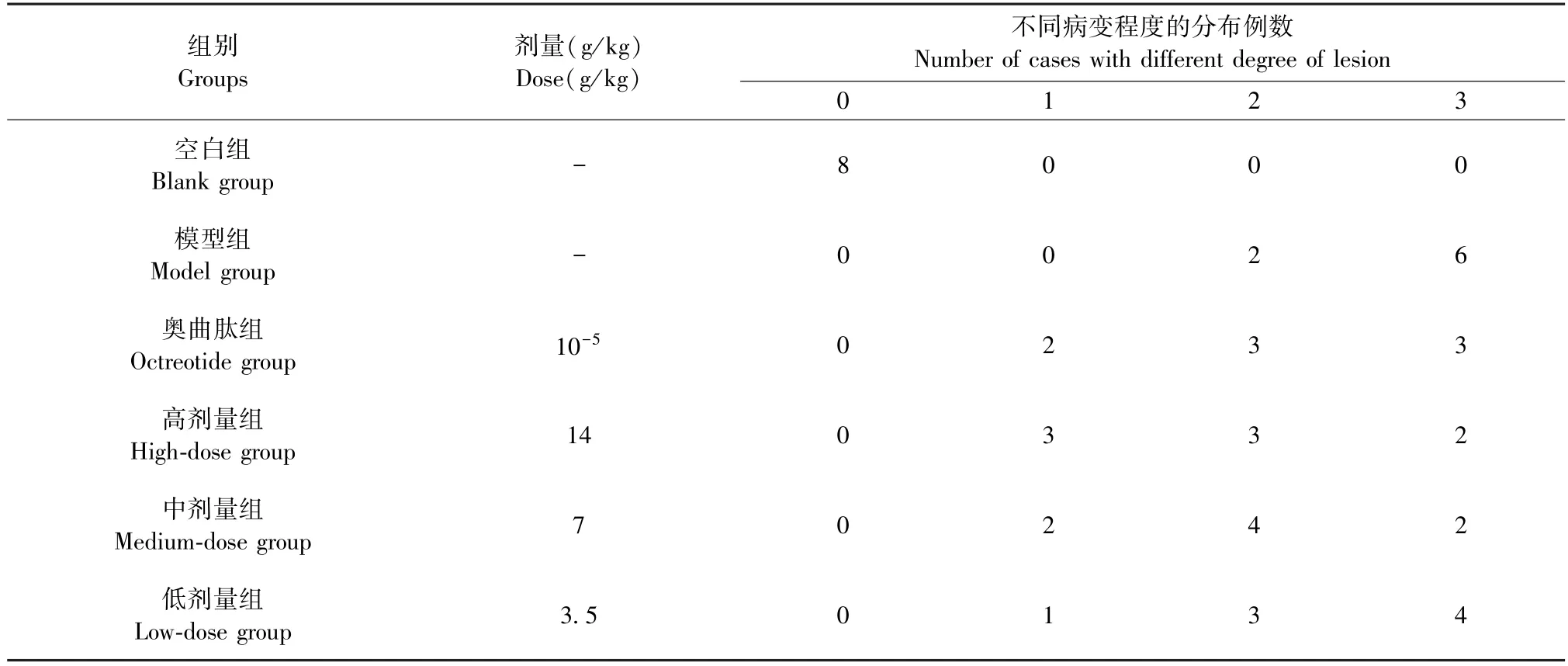
表2 大黄牡丹汤对AP 大鼠模型肝损伤病理分级的影响(n=8)Table 2 Effects of Dahuang Mudan Decoction on the pathological grading of liver injury in AP rat model(n=8)
2.5 大黄牡丹汤对各组大鼠生化指标的影响
与空白组比较,模型组大鼠AMS、ALT、AST、CRP 含量显著性升高,而ChE 含量显著性降低(P<0.05);在各治疗组大鼠中AMS、ALT、AST、CRP 含量均有下降趋势,而ChE 含量有上升趋势,其中尤以大黄牡丹汤高剂量组显著(P<0.05)(见表3)。
表3 大黄牡丹汤对AP 大鼠肝组织AMS、ALT、AST、ChE、CRP 含量的影响(,n=6)Table 3 Effects of DaHuang MuDan Decoction on the contents of AMS,ALT,AST,ChE and CRP liver tissues of AP rats(,n=6)
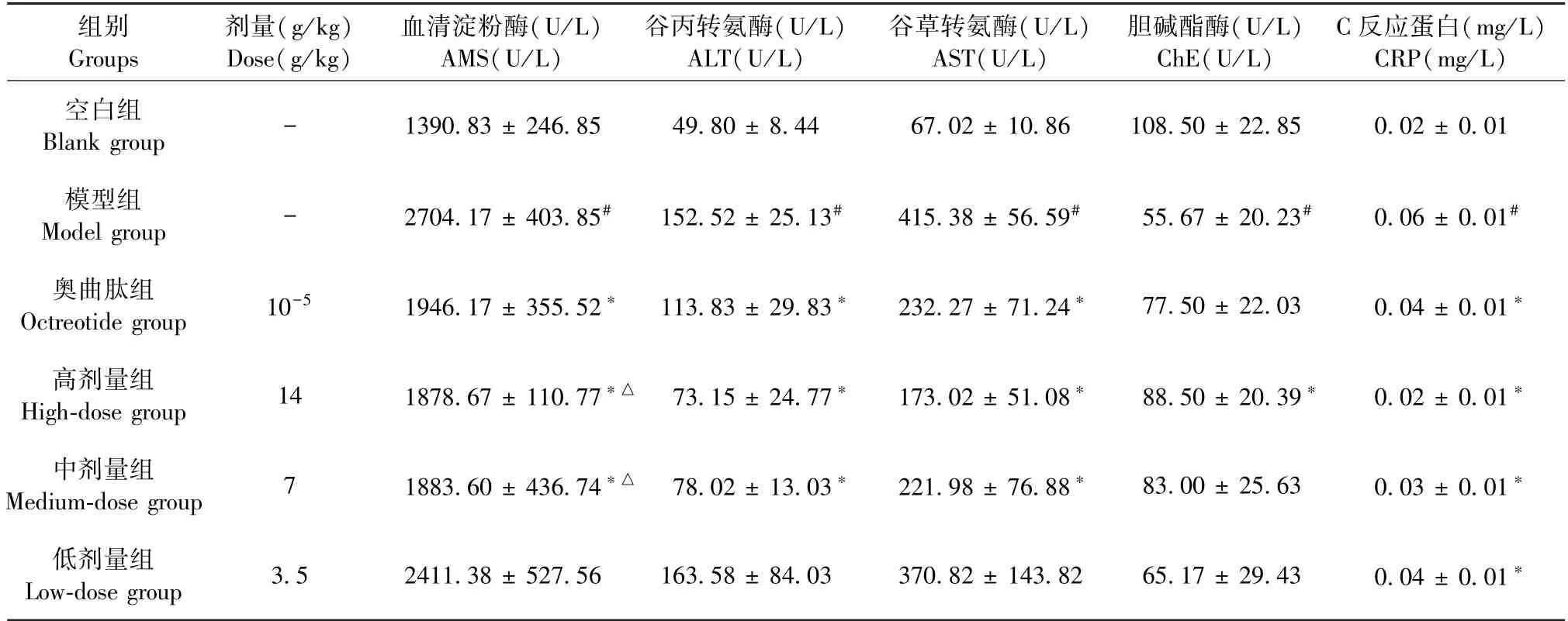
表3 大黄牡丹汤对AP 大鼠肝组织AMS、ALT、AST、ChE、CRP 含量的影响(,n=6)Table 3 Effects of DaHuang MuDan Decoction on the contents of AMS,ALT,AST,ChE and CRP liver tissues of AP rats(,n=6)
注:与空白组比较,#P <0.05;与模型组比较,*P <0.05;与低剂量组比较,△P <0.05。(下表同)Note.Compared with blank group,#P <0.05.Compared with model group,*P <0.05.Compared with low-dose group,△P <0.05.(The same in the following tables)
2.6 大黄牡丹汤对各组大鼠肝组织TNF-α、IL-1β、IL-6 含量水平的影响
与空白组比较,模型组大鼠TNF-α、IL-1β、IL-6含量显著升高(P<0.05);与模型组比较,各治疗组大鼠上述指标均呈下降趋势,其中尤以大黄牡丹汤高剂量组显著(P<0.05)(见表4)。
表4 大黄牡丹汤对AP 大鼠肝组织TNF-α、IL-1β、IL-6 含量的影响(,n=6)Table 4 Effects of DaHuang Mudan Decoction on the contents of TNF-α,IL-1β and IL-6 in liver tissues of AP rats(,n=6)
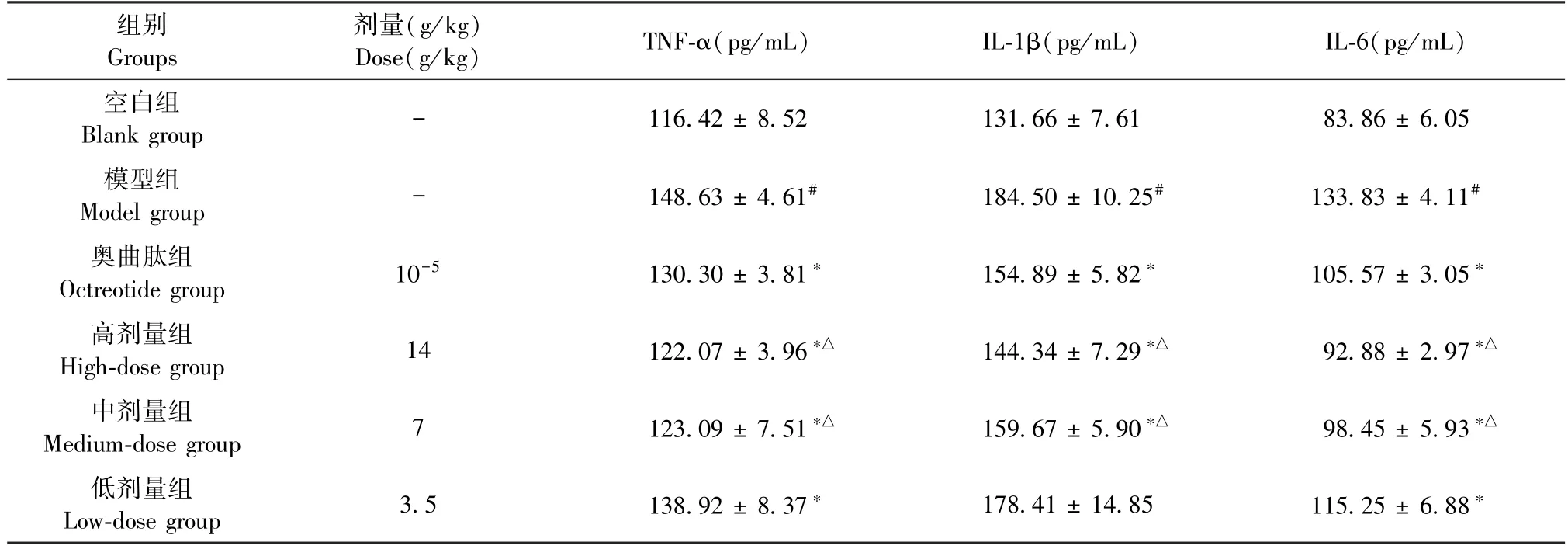
表4 大黄牡丹汤对AP 大鼠肝组织TNF-α、IL-1β、IL-6 含量的影响(,n=6)Table 4 Effects of DaHuang Mudan Decoction on the contents of TNF-α,IL-1β and IL-6 in liver tissues of AP rats(,n=6)
2.7 大黄牡丹汤对各组大鼠肝组织PI3K、p-Akt、p-NF-κB p65、Bcl-2、Bax 蛋白表达的影响
与空白组相比,模型组大鼠肝组织PI3K、p-Akt、p-NF-κB p65、Bax 蛋白表达显著升高,而Bcl-2 蛋白表达呈下降趋势(P<0.05);与模型组比,各治疗组大鼠PI3K、p-Akt、p-NF-κB p65、Bax 蛋白表达均不同程度下降,而Bcl-2 蛋白表达不同程度上升,其中尤以大黄牡丹汤高剂量组显著(P<0.05)(见表5、图3)。
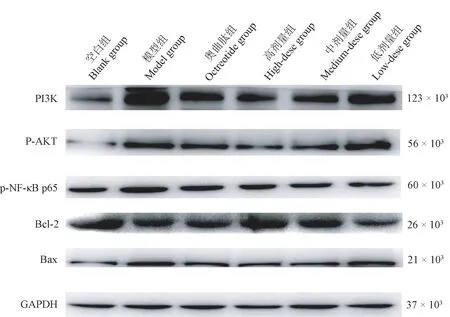
图3 大黄牡丹汤对各组大鼠肝组织PI3K、p-Akt、p-NF-κB p65、Bcl-2、Bax 蛋白表达电泳Figure 3 Protein expression electrophoresis of PI3K,p-Akt,p-NF-κB p65,Bcl-2 and Bax in liver tissues of rats in each group treated by Rhubarb Mudan Decoction
表5 大黄牡丹汤对各组大鼠肝组织PI3K、p-Akt、p-NF-κB p65、Bcl-2、Bax 蛋白表达水平的影响(,n=3)Table 5 Effects of DaHuang Mudan Decoction on the protein expression levels of PI3K,p-Akt,p-NF-κB p65,Bcl-2 and Bax in liver tissues of rats in each group(,n=3)
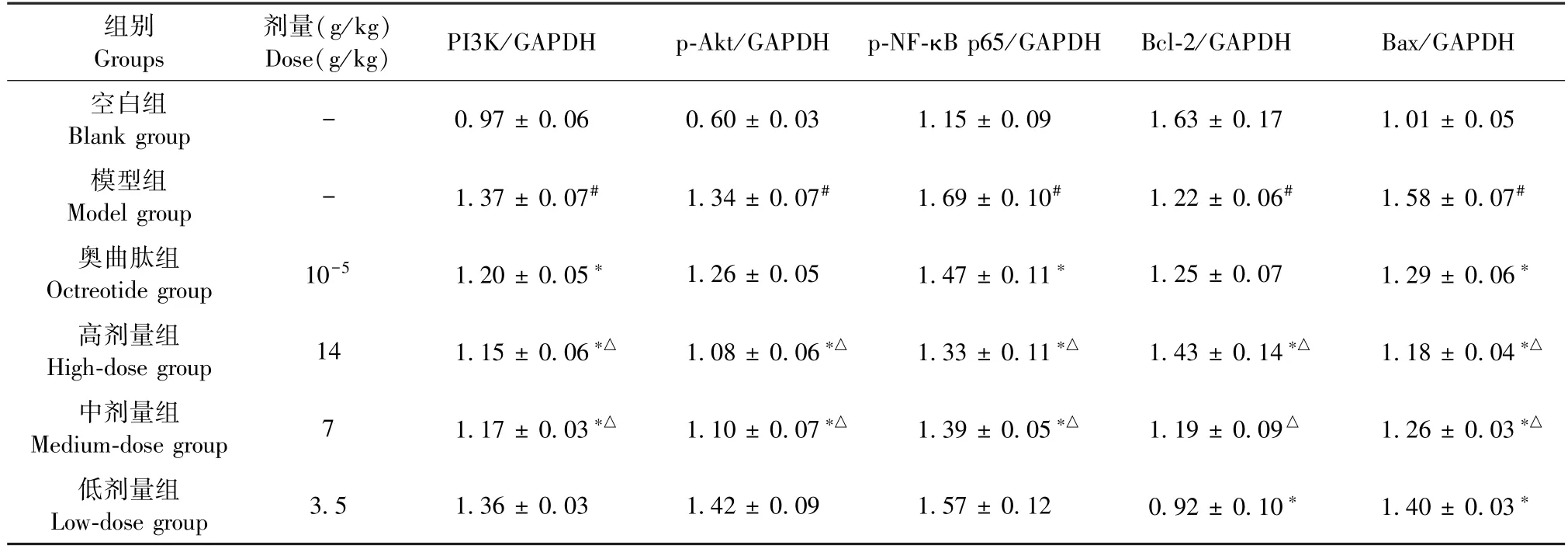
表5 大黄牡丹汤对各组大鼠肝组织PI3K、p-Akt、p-NF-κB p65、Bcl-2、Bax 蛋白表达水平的影响(,n=3)Table 5 Effects of DaHuang Mudan Decoction on the protein expression levels of PI3K,p-Akt,p-NF-κB p65,Bcl-2 and Bax in liver tissues of rats in each group(,n=3)
3 讨论
AP 发生时,PI3K/Akt 通路活化,可以诱导促炎细胞因子(如TNF-α、IL-6、IL-1β)的趋化和表达,导致“炎症级联风暴反应”,进一步损伤其他器官,肝与胰腺毗邻,AP 发生时产生的炎症因子可通过局部扩散或门静脉血流进入肝直接损伤肝细胞,使得肝损伤成为AP 发生时重要的并发症[12-13]。
大黄牡丹作为张仲景的经方之一,出自《金匱要略》,主治湿热蕴结,气血凝滞所致肠痈。方中大黄与丹皮二者合用,共泻肠腑湿热瘀结,为方中君药。芒硝和桃仁俱为臣药,其中芒硝助大黄荡涤实热,促其速下;桃仁破血逐瘀,协君药以通淤滞。冬瓜仁清理利湿,排脓消痈,涤荡湿热,是为佐药。本方泻热与逐瘀并用,使瘀结湿热速下,痛随利减,痈肿得消,诸症自愈。
在AP 炎症期间,炎性细胞因子使PI3K/Akt/NF-κB 通路活化,活化的NF-κB 转录因子进入细胞核,恢复其转录激活活性。NF-κB 的活化可以诱导促炎因子的表达,进而趋化大量炎性细胞浸润、聚集到炎症部位,最终导致炎症反应[12]。
AP 在发展过程中,炎症级联效应的爆发,使大量炎症因子进入肝,引起肝细胞的异常凋亡。Lapierre 等[14]发现,AP 发生时肝细胞的异常凋亡与肝的损伤程度密切相关,且组织损伤情况与病理改变相符合。刘宏等[15]研究发现,AP 肝损伤大鼠肝细胞异常凋亡数量与凋亡指数呈正相关。Bcl-2 蛋白家族包括抗凋亡蛋白(Bcl-2) 和促凋亡蛋白(Bax),Bax/Bcl-2 比率的升高是细胞凋亡的原因之一,因此,可通过降低Bax/Bcl-2 的比率来减轻肝损伤[16]。
本实验通过对凋亡相关蛋白(Bcl-2 和Bax)的检测,发现蛋白表达含量治疗前后有差异变化,但在病理切片上并未明确改变,以待后续进一步实验证明。
本实验结果显示,模型组AP 大鼠一般生存状态相对较差,肝组织中PI3K、p-Akt、p-NF-κB p65 蛋白表达显著升高,炎性因子TNF-α、IL-6、IL-1β 的分泌水平显著升高。与模型组比较,各治疗组AP 大鼠的一般生存状态不同程度缓解,肝组织病理损伤不同程度修复,ELISA 结果表明TNF-α、IL-1β、IL-6含量呈下降趋势,肝组织中PI3K、p-Akt、p-NF-κB p65、Bax 蛋白表达水平均呈下降趋势,其中大黄牡丹汤高剂量干预效果最为显著。这可能与高剂量大黄牡丹汤有效抑制了PI3K/Akt/NF-κB 信号通路的活化,进而抑制TNF-α、IL-1β、IL-6 等炎性因子的异常分泌,减轻了由此产生的炎性风暴级联放大反应,提高了肝的防御功能,进而减轻了肝损伤。

