LCMV-CL13 慢性感染小鼠模型的建立及其BCR 突变分析
李哲,蔡方舟,李丹,陈倩,苑一真,王卫
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,新发再发传染病动物模型研究北京市重点实验室,卫健委人类疾病比较医学重点实验室,北京 100021)
人类免疫缺陷病毒(human immunodeficiency virus,HIV)、甲型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)等慢性病毒感染威胁全球人类健康,是全球公共安全的重要威胁[1-2],亟待研发能有效抑制慢性病毒感染的策略。具有高频突变特点的广谱中和抗体(broadly neutralizing antibodies,bNAbs)被证明可抑制特定病毒的多种突变毒株[3],成为控制慢性病毒感染的希望所在。体细胞高突变(somatic hypermutation,SHM)是指抗体可变区(variable region,V)基因发生高频率点突变[4],增加抗体基因的遗传多样性和亲和力[5],是bNAbs 诱导的关键环节。因此,SHM 为抗体亲和力成熟和抗体多样性的产生提供了分子基础,也是优化抗体依赖性免疫反应的关键[6]。
尽管进行了多年的深入研究,但影响抗体基因发生SHM 以及SHM 靶向机制尚不清楚,原因之一是缺乏可用于SHM 研究的动物模型。建立可用于SHM 研究的动物模型具有重要意义,淋巴细胞性脉络丛脑膜炎病毒克隆13 (lymphocytic choriomeningitis virus clone 13,LCMV-CL13)感染,作为全身性慢性病毒感染模型被广泛使用,并被用于研究驱动人类慢性病毒感染的机制[7-8]。为了深入探究SHM 发生机制,本文使用LCMV-CL13 病毒尾静脉感染C57BL/6N 小鼠,分析感染小鼠中出现持续的生发中心(germinal center,GC)反应,及B 细胞受体(B cell receptor,BCR)V 基因的突变情况,分析其作为B 细胞受体高频突变研究模型的可能性,以期为SHM 实验研究提供借鉴,同时为抗体生成、进化机制研究奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
80 只SPF 级雌性C57BL/6N 小鼠,周龄为6~8 周,体重约18~22 g,购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】。实验动物的饲养及实验操作在中国医学科学院医学实验动物研究所动物生物安全二级实验室(ABSL-2)【SYXK(京)2019-0039】进行。饲养及实验环境:室内温度22~25℃,湿度40%~70%,12 h 光照/黑暗循环;动物在笼内自由摄食饮水。本实验过程遵循3R 原则,已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)的批准(WW21001)。
1.1.2 病毒株
淋巴细胞性脉络丛脑膜炎病毒克隆13 株(lymphocytic choriomeningitis virus clone13,LCMVCL13)由第三军医大学叶丽林教授赠送,由本课题组扩增。扩增后的病毒液经RNA 提取及PCR 扩增后送由中美泰和公司测序鉴定为目的序列,噬斑法检测病毒滴度为1.72 × 107PFU/mL。
1.1.3 主要试剂与仪器
RPMI 1640 培养基(Gibco:C22400500BT)、PBS(Gibco:C10010500BT)、GK1.5 抗体(Bio X cell:BE0003-1-100)、抗凝剂(索莱宝:G0280)、RNA 提取试剂盒(RNeasy Mini Kit:74104)、RNA 逆转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit:K1632)、实时荧光定量PCR 试剂盒(TB Green®Premix Ex TaqTMII:RR820A)、总RNA 提取试剂盒(Mag MAXTMmir VanaTMTotal RNA Isolation Kit:A27828)、BCR 建库试剂盒(KC-DigitalTMStranded BCR-seq Library Prep Kit for Illumina,DT0811-02,Seq Health)、红细胞裂解液(BD FACSTMLysing Solution:349202),流式抗体及染色方案见表1。
表1 抗体使用一览表Table 1 List of used antibodies
高速冷冻型离心机(SCILOGEX,美国)、多用途冷却离心机(HITACHI,日本)、普通PCR 仪T100TMThermal Cycler(Bio-Rad,美国),实时荧光定量PCR仪Quant StudioTM3 Real-Time PCR System(Applied BiosystemsTM,美国)、流式仪型号为BD FACS Aria II(BD,美国)。
1.2 方法
1.2.1 动物分组及感染
80 只C57BL/6N 小鼠分成两组。其中70 只为实验组,用于感染模型构建;10 只设立为对照组。实验组C57BL/6N 小鼠感染前1 d 腹腔注射500 μg CD4 抗体,感染当天经尾静脉注射LCMV-CL13 病毒2 × 106PFU,感染后第2 天再次经腹腔注射500 μg CD4 抗体[9];对照组小鼠经腹腔及尾静脉注射同等体积的PBS。
1.2.2 LCMV-CL13 感染小鼠体重监测
C57BL/6N 小鼠感染后,每日观察小鼠临床表现,包括一般状况、体态、毛发、饮食、活动、排便等。感染后前15 d 每天称重1 次,感染15 d 后每4 d 称重1 次。
1.2.3 组织采集
病毒感染后第10、20、30、40、50、60、70 天收集动物血液及组织样本。具体地,从小鼠眼眶静脉丛取血100 μL 置于装有10 μL EDTA.2K 抗凝剂(10X)的EP 管中,用于流式检测;排尽血液后,脱颈椎处死小鼠收集肠、肾、肝、脑组织,用于病毒载量检测;收集脾充分研磨制备单细胞悬液,用于流式检测。
1.2.4 组织病毒载量检测
使用RNA 试剂盒提取小鼠肠、肾、肝、脑组织RNA,反转录试剂盒将RNA 反转为cDNA,采用SYBR Green 染料法检测组织中LCMV-CL13 病毒载量[9]。
1.2.5 外周血淋巴细胞比例检测
取小鼠外周血100 μL 置于流式管中,同时加入流式荧光抗体CD45-FITC、CD3-PerCP/Cyanine5.5、CD4-PE、CD8a-APC 和CD19-PE/Cyanine7 各5~10 μL,室温避光孵育30 min,裂解红细胞,PBS 洗涤2次,2%多聚甲醛固定,流式上机检测荧光信号。
1.2.6 脾淋巴细胞比例检测
取小鼠脾置于RPMI 1640 不完全培养基充分研磨,经70 μm 滤网过滤、裂解红细胞,制备获得单细胞悬液。加入流式荧光抗体CD45R/B220-FITC、CD19-PerCP/Cyanine5.5、GL7-PE、CD95(FAS)-APC各5~10 μL;冰上避光孵育20 min,2%多聚甲醛固定,流式上机检测荧光信号。采用Flow Jo V10 对多色流式细胞仪上机结果进行分析。
1.2.7 免疫组库建库、测序
制备小鼠脾单细胞悬液,分离淋巴细胞,由武汉康测科技有限公司进行建库、测序。具体地,提取细胞总RNA、逆转录获取单链cDNA、UID(Unique Identifier)标记、使用免疫球蛋白亚型(IgM、IgA、IgG、IgD、IgE、IgK 和IgL) 的 特异 性引 物(gene specific primer,GSP)进行PCR 扩增和文库构建,运用高通量测序技术检测靶向扩增后B 细胞CDR3区域[10]。
1.2.8 生物信息学分析
首先,使用MiXCR(v3.0.3)软件[11],将纠错和去重后的数据与国际免疫遗传学数据库IMGT(http://www.imgt.org)的V、D、J 基因片段进行比对[12]。获取比对结果并开展后续深度分析。其次,数据多样性指标至关重要,多样性与免疫应答密切相关[13]。采用Shannon entropy 指数[14]计算样本IGH 组成多样性,Shannon entropy 值越大,说明样本多样性越高。
1.3 统计学分析
实验数据使用GraphPad Prism 8 软件进行作图和统计分析,以平均值±标准差() 表示,采用单因素方差分析,两组间均数比较采用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 LCMV-CL13 病毒在小鼠体内维持慢性感染状态
为了解LCMV-CL13 病毒对C57BL/6N 小鼠的致病情况,每天观察小鼠疾病表现,监测体重变化,小鼠感染后第7 天出现明显疾病表现,如竖毛、弓背、体重下降等症状,感染后21 d 体征逐渐恢复;在感染后32 d 体重下降最为明显,并再次出现明显竖毛、弓背、体重下降等症状,感染后40 d 体征逐渐恢复,可能受自身免疫反应影响[15],感染后实验组动物较对照组体重明显下降(P<0.0001),说明病毒感染可对小鼠致病(图1A)。为检测LCMV-CL13病毒在C57BL/6N 小鼠体内的复制扩增情况,每10 d采集小鼠肠、肾、肝、脑组织提取病毒RNA,使用实时荧光定量PCR 测定病毒载量。根据组织病毒载量结果,感染可分为急性感染期(0~10 d)及平台期(10~70 d)(图1B)。急性感染期,小鼠组织病毒载量迅速上升,在肠(7 × 106copies/μL)、肝(4.5 × 107copies/μL)组织维持高水平复制;而后组织病毒载量逐渐降低并保持在106copies/μL 水平(图1C、1E),进入平台期,主要在肾(3.5 × 107copies/μL)、脑(4.5 × 106copies/μL)组织维持高水平复制;之后在肾组织病毒载量逐渐降低并保持在107copies/μL 水平复制,在脑组织中病毒载量逐渐升高并保持在6 × 106copies/μL 水平复制(图1D、1F)。综上结果表明,LCMV-CL13 病毒可在C57BL/6N 小鼠维持较高水平的病毒载量及慢性感染。

图1 LCMV-CL13 小鼠感染模型体重、组织病毒载量的动态变化Note.A.Changes in body weight of C57BL/6N mice after infection with LCMV-CL13.B.The tissue viral load trend of C57BL/6N mice infected with LCMV-CL13.C、D、E、F.Viral load in the intestine,kidney,liver,and brain tissues of C57BL/6N mice infected with LCMV-CL13.Compared with the negative control group,*P <0.05,**P <0.01,***P <0.001,****P <0.0001.Figure 1 Dynamic changes of body weight and tissue viral load of LCMV-CL13 mouse infection model
2.2 病毒感染引起CD8+T 细胞耗竭、CD19+B 细胞增加
为了解LCMV-CL13 慢性感染是否会导致小鼠外周血适应性免疫细胞(CD4+T、CD8+T 及CD19+B细胞)的动态变化,在不同时间点收集外周血进行流式检测。结果发现,与未感染状态相比,GK1.5抗体先清除CD4+T 细胞,感染后20 d 开始CD4+T细胞比例随感染时间延长而恢复,感染后第70 天可达到13.15% ± 0.72%(图2)。CD8+T 细胞比例先降低后增加;在感染后10 d 占比(9.49% ±1.31%),随着感染的持续,感染后40 d 降低最明显(2.17% ± 0.40%);随之CD8+T 细胞比例开始升高,感染后70 d CD8+T 细胞比例可达到(6.65% ±0.52%)(图2),但未恢复到正常水平。CD19+B 细胞比例在感染前40 d 无明显变化,感染后40 d 比例逐渐升高,感染后70 d 达到(40.32% ± 0.46%)(图2),显著高于未感染状态。综上所述,GK1.5 抗体注射成功耗竭了小鼠体内CD4+T 细胞,帮助病毒感染;CD8+T 细胞在感染过程出现持续耗竭,后随着CD4+T 细胞比例增加而部分恢复;CD19+B 细胞比例受慢性病毒感染影响逐渐增加,提示病毒诱发了显著的体液免疫反应。
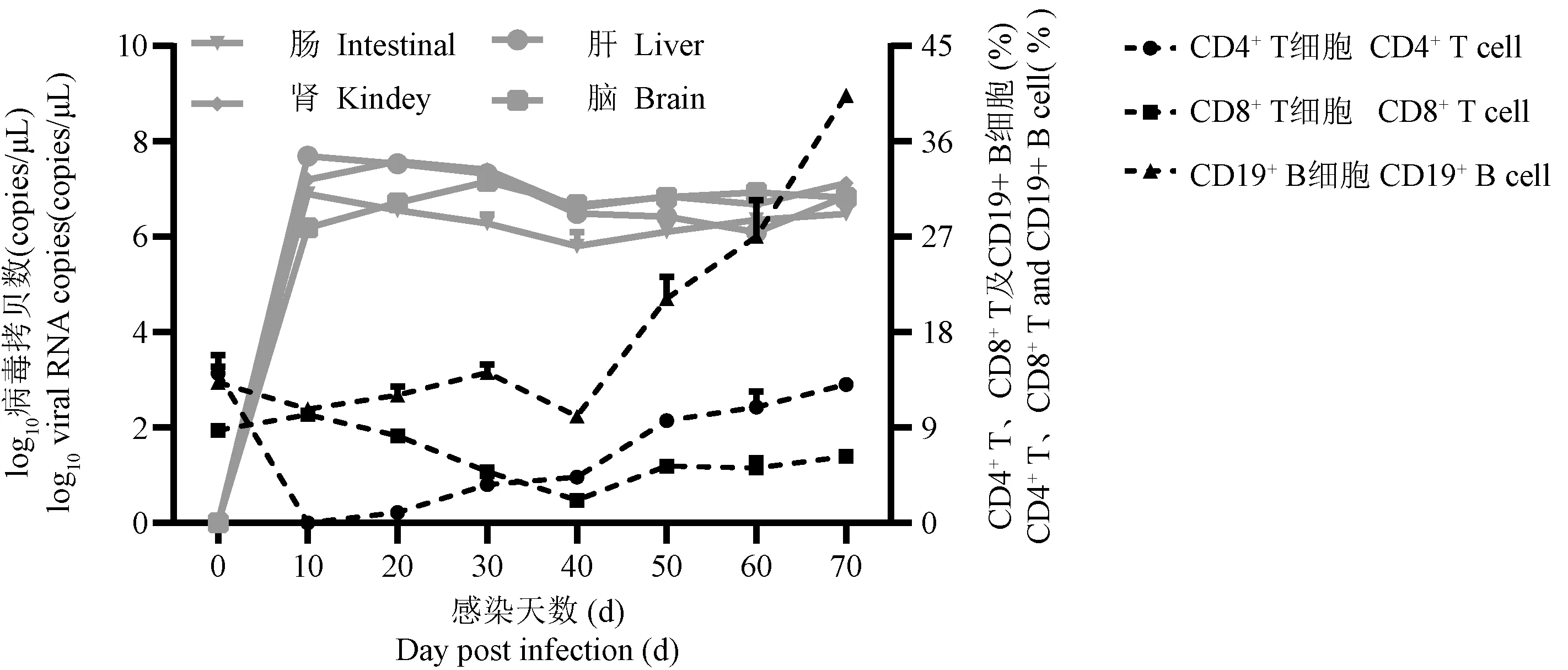
图2 感染后不同时间点,病毒拷贝数与外周血CD4+T、CD8+T、CD19+ B 细胞比例变化Figure 2 Trend of virus RNA copies and the proportion of CD4+ T,CD8+ T,and CD19+ B cells in the peripheral blood at different time points after infection
2.3 病毒感染诱导GC B 细胞比例增加
生发中心是免疫反应发生时,B 细胞在其中增殖、生长和突变的特殊区域。为了研究B 细胞的成熟及BCR 的突变,本文研究了LCMV-CL13 感染后脾生发中心B 细胞的变化趋势,我们对LCMV-CL13慢性感染小鼠脾中特异性GC B 细胞(B220+CD19+GL7+FAS+)进行流式检测。结果发现,急性期感染中,GC B 细胞比例急剧下降,感染后第40~70 天,GC B 细胞比例由(2.28% ± 2.68%) 增加至(10.03% ± 0.60%)(图3)。提示我们LCMV-CL13病毒感染初期可能对脾产生急性损伤,感染平台期尤其感染后30~70 d,GC B 细胞增加速率较快,提示这一时期病毒特异性GC B 细胞增殖较快,发生针对病毒的体液免疫反应。
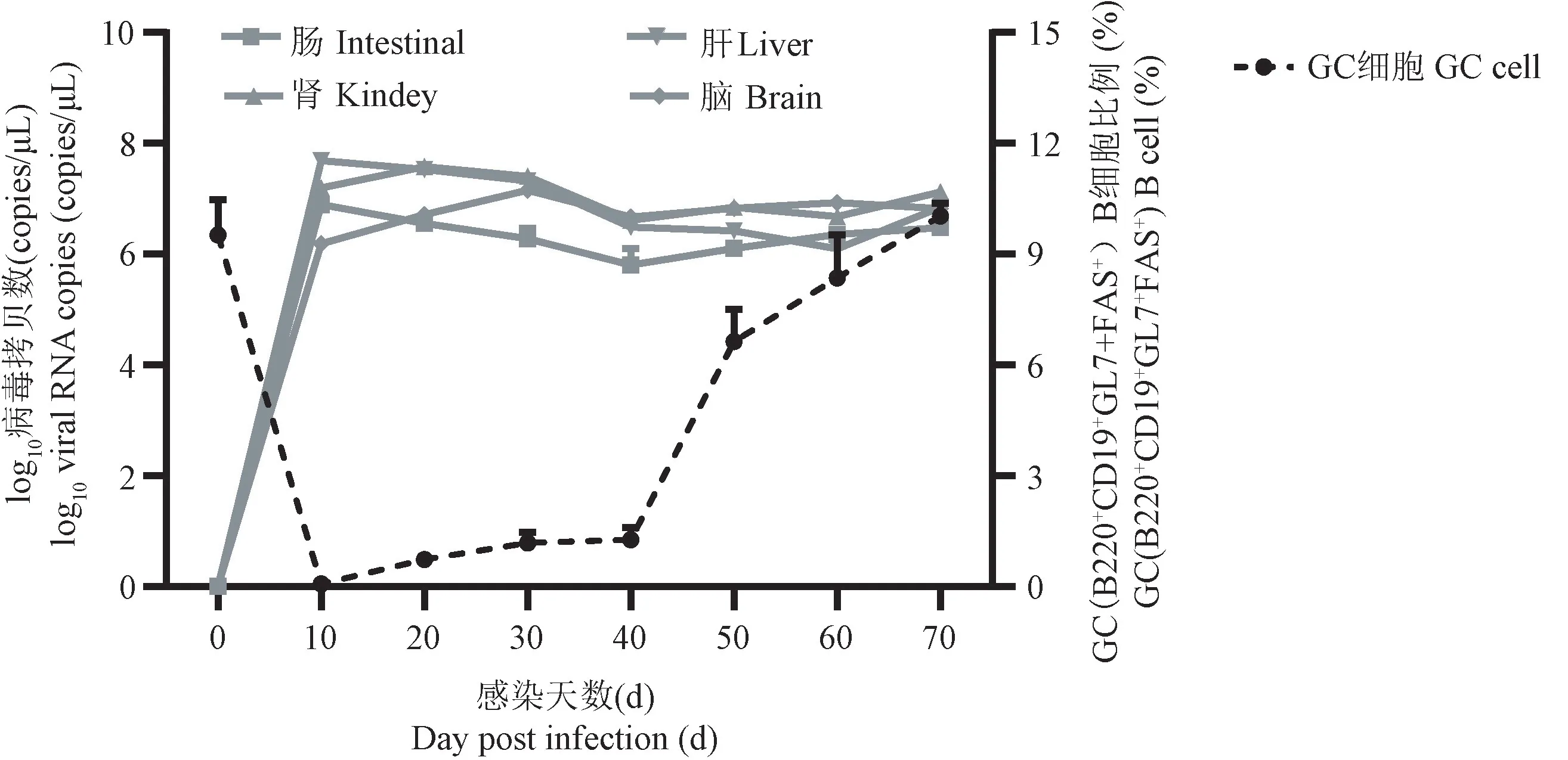
图3 感染后不同时间点,病毒拷贝数与脾中GC B(B220+CD19+GL7+FAS+)细胞比例变化Figure 3 Trend of virus RNA copies and the proportion of GC B cell (B220+CD19+GL7+FAS+) in the spleen at different time points after infection
2.4 样品多样性及V 基因使用频率、突变率分析
BCR 是一种长在B 淋巴细胞表面的免疫球蛋白分子(immunoglobulin,Ig),由重链及轻链构成,与抗体同属于免疫球蛋白家族。BCR 库多样性主要受免疫球蛋白基因中V、D、J 基因片段重组及V-D-J连接时发生核苷酸突变、插入或删除的影响。我们采用香农指数(Shannon index)为组间多样性的评价指标。分析感染后30 d 与感染后60 d IGH、IGL 多样性以及V 基因使用频率、突变率(图4),重链多样性具有显著性差异(P<0.01)(图4A),轻链多样性无显著性差异(图4B),重链V 区基因片段中,感染后60 d 组IGHV6-3、IGHV1-58、IGHV3-6 基因使用频率高于感染后30 d组(P<0.05),其他基因则在感染后30 d 组表达更多或两组表达无统计学差异(图4C,4D)。轻链V 区基因片段中,感染后60 d组基因使用频率与感染后30 d 组无显著性差异(图4E,4F)。可能是感染后60 d 形成了针对抗原的特异性克隆。SHM 定义为V 基因片段的突变频率,CDR3 区是抗原识别的重要部位,其特异性是被认为是SHM 突变的结果。为了确定此小鼠模型是否发生SHM,本实验分析不同时间点CDR3 区域V 基因突变率。突变率采用每10 000 个碱基中发生突变的碱基数量表示。如图4G,4H 所示,感染后60 d相比于感染后30 d,重链V 基因突变率有显著性升高(P<0.05),且突变率CDR3(60 d)/CDR3(30 d)约为1.7 倍。结果证明:感染时间的增加,V 区基因点突变增高。综上,提示Ig 基因发生SHM,且突变产生针病毒的特异性克隆,造成多样性降低。
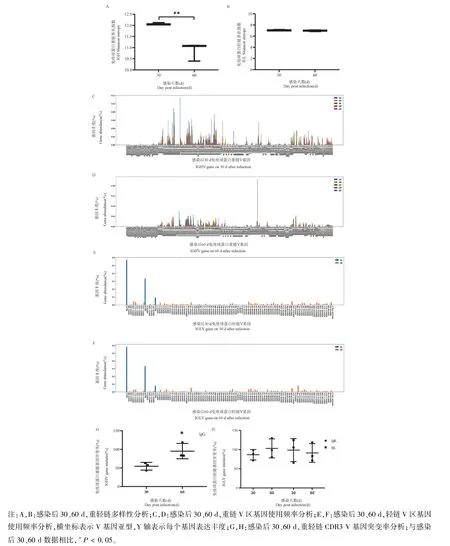
图4 分析感染后30、60 d 重轻链多样性、V 基因丰度及突变率Note.A,B.Diversity analysis of heavy and light chains at 30 and 60 days after infection.C,D.Frequency analysis of heavy chain V region gene usage 30 and 60 days after infection.E,F.Frequency analysis of light chain V region gene usage 30 and 60 days after infection.The Xaxis represents V gene subtypes,and the Y-axis represents the expression abundance of each gene.G,H.Mutation rate analysis of heavy and light chain CDR3 V gene at 30 and 60 days after infection.Compared with data of 30 and 60 days after infection,*P <0.05.Figure 4 Analysis of the diversity of heavy and light chains,the abundance and mutation rate of Vgene on 30,60 days after infection
3 讨论
LCMV-CL13 慢性感染小鼠是一种广泛用于研究病毒慢性感染机制的动物模型,为治疗人类慢性病毒性疾病和其他慢性疾病(如癌症)提供了宝贵的见解[16-19],包括抗原呈递的MHC 限制、T 细胞效应功能和记忆[20];LCMV-CL13 感染小鼠在感染8 d后体重下降20%,具有明显临床疾病评分。感染后1~5 周病毒保持高水平复制,感染后6 周血浆病毒滴度下降;感染后3 周内,CD8+T 细胞数量逐渐降低,CD4+T 细胞数量先升高后降低[15]。至今为止,该小鼠模型多用于T 细胞研究。有研究证明,成年小鼠在感染病毒时注射CD4 单克隆抗体,小鼠组织可终身保持高病毒水平[21]。因此,为建立慢性感染小鼠模型,本实验通过先消耗CD4+T 细胞再经尾静脉注射途径接种LCMV-CL13 病毒,感染后小鼠出现竖毛、弓背等体征,体重出现明显下降、在检测期内组织病毒载量维持在相对较高水平。我们同时聚焦小鼠细胞、体液免疫反应。通过流式检测小鼠外周血CD4+T 细胞、CD8+T 细胞以及CD19+B 细胞比例,发现CD8+T 细胞、CD19+B 细胞比例随着CD4+T 细胞比例的增加而增加,这与慢性病毒感染研究结果相符合[22]。以上结果证明,我们成功建立LCMV-CL13 慢性感染小鼠模型,且小鼠外周适应性免疫反应较为强烈。
Ig 基因SHM 在抗体介导的免疫反应中起关键作用。在抗病毒感染过程中,生发中心(germinal center,GC) B 细胞发生SHM 及类别转换(class switch recombination,CSR)诱导亲和力成熟,丰富抗体可变区多样化、提高抗体中和活性[23-24]。因此,GC B 细胞是产生有效体液免疫的关键所在[25]。基于此,我们流式检测GC B 细胞比例,发现感染前期GC B 细胞比例急剧下降,这可能与IFN-I 诱导的炎症有关[26]。在生发中心微环境中,GC B 细胞在暗区(dark zone,DZ)进行增殖和Ig 基因SHM,在亮区(light zone,LZ)进行基于亲和力的选择[27]。我们结果显示:感染后第40~60 天,GC B 细胞比例增加较快,说明此阶段GC B 细胞快速增殖。基于此,我们推测感染后40~60 d 可能发生B 细胞高频突变。为了验证我们的假设,分离感染后30、60 d 脾B 细胞进行BCR 建库以及测序分析。对重链、轻链多样性以及V 基因使用频率、突变进行比较分析。结果表明:感染后60 d 重链多样性降低,V 基因使用频率下降,但V 基因突变率增高1.7 倍。表明LCMV-CL13 慢性病毒感染模型发生B 细胞高频突变,Ig V 基因突变率随感染时间逐渐增加,产生病毒特异性克隆,导致BCR 库多样性降低。
SHM 可以增加免疫球蛋白对抗原识别和结合的亲和力,虽然过去对SHM 的分子机制进行了详细的研究,但仍有很多内容尚未阐明。例如,影响SHM 发生的关键基因及调控基因尚未明确。在本研究中,我们在成功建立LCMV-CL13 慢性感染小鼠模型的基础上,流式分析外周血、脾免疫细胞比例,并首次对B 细胞进行BCR 突变分析,初步探究V 区基因使用频率、突变率随感染时间的变化情况。这为在LCMV-CL13 慢性病毒感染小鼠模型中研究B 细胞高频突变、探究中和抗体的形成机制提供了基础信息以及数据支持。本研究下一步将扩大组内样本数量,从病毒与宿主共进化角度出发,筛选影响BCR 突变的关键基因以及CDR3 序列特异性识别的抗原特征,从而进一步探寻抗体生成及进化机制。

