乙酸联合束缚应激诱导腹泻型肠易激综合征小鼠模型的制备
程斌,黄琴,王军蒙,陈伟,张瑞斌,董龙聪,吴巧凤
(成都中医药大学针灸推拿学院,成都 610075)
肠易激综合征(irritable bowel syndrome,IBS)是一种以腹痛或腹部不适并伴有排便异常为主的肠功能紊乱性疾病,根据罗马Ⅳ诊断标准,该病共分为四型,其中腹泻型肠易激综合征最为常见,主要表现为腹痛、腹泻以及肠道动力紊乱[1]。其相关动物模型的研究与制备也较多,主要包括束缚应激刺激法、番泻叶灌胃、理化因素刺激法、母婴分离法、基因敲除法以及多种方式联合刺激等方法[2]。而乙酸刺激法因操作简单,成模周期短,被较多用于IBS-D 模型的研究。但是,既往研究大多采用大鼠构建模型,相关的小鼠造模方法仍不成熟,而众所周知,小鼠饲养方便、操作方便、繁殖速度快,因此,构建IBS-D 小鼠模型将进一步推进相关科研实验的进度,并方便后期开展基因敲除等实验。因此,本研究借鉴乙酸诱导IBS-D 大鼠模型,开展适宜浓度乙酸诱导腹泻型肠易激综合征小鼠模型的制备。前期经过不同浓度乙酸以及不同灌注次数探索发现,小鼠直肠多次灌注较低浓度乙酸是一种很有潜力的建模方法,但肠道局部症状不容易稳定。考虑到心理应激等因素是肠易激综合征的高风险因素[3],以及有乙酸联合束缚应激的相关报道[4]。因此,本实验通过比较3%乙酸经直肠灌注和3%乙酸经直肠灌注联合束缚应激两种造模方法探讨构建IBS-D 小鼠模型的较优方式,以期为后期相关的实验研究奠定模型基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用45 只无特定病原体(specific pathogen free,SPF)级雄性C57BL/6J 小鼠,9~12 周龄,体重(26 ± 2)g,由成都药康生物科技有限公司【SCXK(川)2020-034】提供,动物在成都中医药大学SPF级实验动物中心【SYXK(川)2019-049】饲养,昼夜各半循环照明,湿度恒定,温度控制在22~26℃,相对湿度55%~65%,光暗周期12 h/12 h。所有操作均符合成都中医药大学实验伦理学要求(备案号:2019-04)。
1.1.2 主要试剂与仪器
Fluorescein isothiocyanate-dextran 4(FD4,平均分子量:3000~5000,Sigma,BCCC8276)、5-HT 酶联免疫试剂盒(elabscience,E-EL-0033c)、TNF-α 酶联免疫试剂盒(elabscience,E-EL-M0049c)、Anti-5-HTR3A(Affinity,DF134415)。
小鼠麻醉机(RWD life science,中国)、恒温箱(中兴,中国)、千分位天平(赛多利斯,中国)、离心机(湘仪,中国)、HS6 病理切片扫描影像分析系统(舜宇,中国)等。
1.2 方法
1.2.1 动物分组及实验干预
选用45 只健康雄性小鼠适应性饲养7 d,按体重随机分为健康对照组(C 组)、模型组(3%乙酸组(A 组)、3%乙酸联合束缚应激组(A+R 组)),其中C 组小鼠正常饮食,不予任何处理,模型组小鼠给予3%乙酸溶液(≥99%乙酸与生理盐水体积比为3:97)灌肠。具体操作为:在异氟烷吸入麻醉状态下,在距肛门3~4 cm 的结肠中注入(200 ± 20)μL 的3%乙酸溶液,用手指夹住肛门附近皮肤组织,使肛门处于闭合状态,持续10 s,然后注入(200 ± 20)μL的生理盐水冲洗,将小鼠悬空,直到小鼠苏醒,3 d后再重复1 次。期间对A+R 组小鼠进行3 次束缚应激,每次1 h,A 组小鼠不予束缚应激;模型构建时间为8 d,具体干预如图1。

图1 模型的构建方法Figure 1 Model construction method
1.2.2 观察指标及取材
(1)一般情况:观察小鼠毛发和日常活动,每日称重,计算各组小鼠的体重变化百分数[(当前的体重×100)/造模前体重]。并记录整个造模周期内各组小鼠的存活情况。
(2)粪便含水量和全肠道转运时间:造模结束后第2 天,观察并测量各组小鼠的粪便含水量(fecal water content,FWC) 和全肠道转运时间(total intestinal transport time)[5]。评估前所有小鼠禁食不禁水12 h,按每只0.2 mL 的容量经口灌入3%苯酚红混悬液。记录4 h 内小鼠灌胃到首粒红便排出的时间。期间观测各组小鼠的粪便性状,并收集小鼠2 h 内的粪便,200℃恒温箱烘烤30 min,计算烘烤前后大便重量变化,计算粪便含水量。
(3)内脏高敏感性:造模结束后第3 天,对各组小鼠进行结直肠扩张(colorectal distention,CRD)刺激,并使用腹壁撤退反射(abdominal withdrawal reflex,AWR)评分[6]进行内脏痛阈值评价,以3 分(结肠扩张时腹部肌肉收缩,腹肌抬离桌面)作为内脏痛阈值评估小鼠的内脏敏感性[7],并记录注入水的体积,每只小鼠重复测量3 次,每次间隔5 min,取3 次的平均值作为小鼠的内脏痛阈值。AWR 评分标准(见表1)。
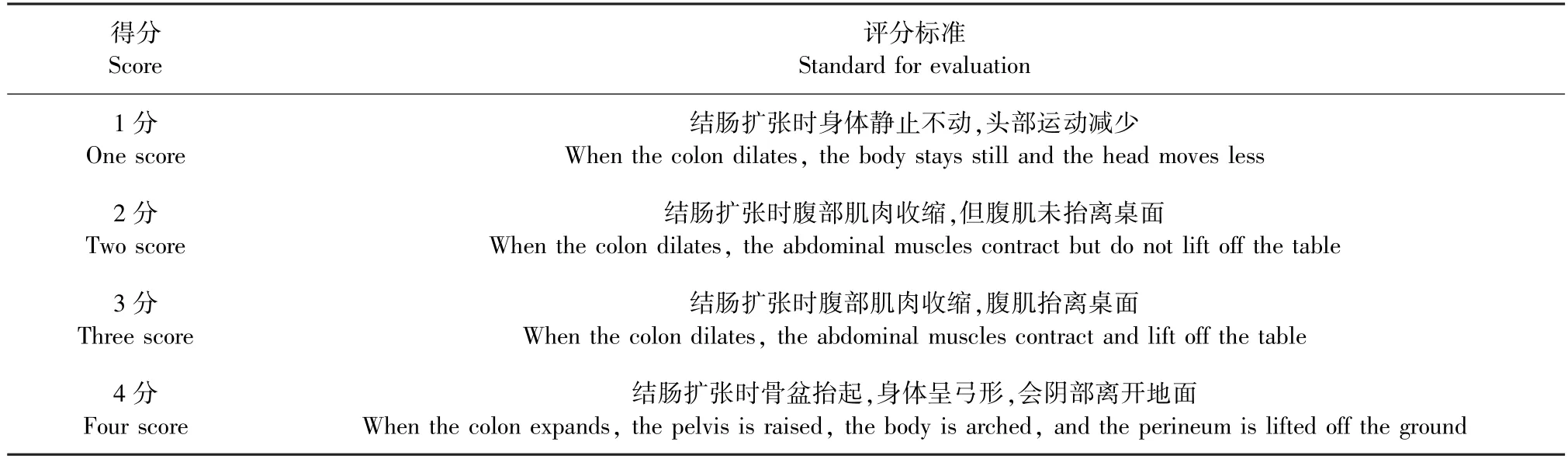
表1 AWR 评分标准Table 1 AWR scoring criteria
(4)样本采集:在造模第4 天采用异氟烷吸入麻醉方法取血,离心(4000 rpm,10 min,4℃)获得血清,-80℃保存备用,并剪取小鼠肛门上1 cm 到盲肠端的结肠组织,4%多聚甲醛固定,石蜡包埋,常规切片。造模结束后第5 天,将小鼠禁食4 h 后,称取各小鼠的体重,以灌胃的方式给予每只小鼠600 mg/kg 的FD4 溶液(1×PBS 配制,浓度为75 mg/mL,避光保存),2 h 后对小鼠行取血,将所取的血置于1.5 mL 棕色Tube 管中,并以50 U/mL 的比例加入1%的肝素钠,混匀后室温静置30 min 后,通过低温离心机(12 000 rpm、10 min、4℃)离心获取小鼠血浆[8-9],于-80℃冰箱避光保存。
1.2.3 结肠粘膜组织HE 染色评分和结肠粘膜屏障完整性评价
结肠组织切片,采用苏木精-伊红染色法染色,并在光镜下观察结肠组织的组织形态及结构。血浆样品解冻后,检测血浆样本中FD4 的含量。
1.2.4 血清5-HT 和TNF-α 含量
将置于-80℃保存的血清取出,严格按照ELISA说明书要求检测血清样本中5-HT 和TNF-α 的含量。
1.2.5 免疫组化检测结肠中5-HTR3A 含量
结肠组织石蜡切片经脱蜡复水、抗原修复、阻断内源性过氧化物酶、血清封闭以后,分别加入5-HTR3A抗体4℃孵育过夜,清洗后加入羊抗兔二抗室温孵育50 min、清洗后DAB 显色、复染细胞核、脱水封片,通过HS6 全扫仪器采集图像,并通过Image pro plus 6.0 软件分析。
1.3 统计学分析
结果用平均值± 标准差()表示,所有数据均用SPSS 24.0 和Image pro plus 6.0 以及Graph Pad Prism 8 软件进行统计分析并绘制统计图,两样本均数比较采用单样本t检验,多个样本均数间比较采用单因素方差分析,体重变化百分数组间比较采用重复测量方差分析,检验水准α=0.05,P<0.05 认为差异具有统计学意义。
2 结果
2.1 一般情况
通过体重的变化百分数来反映小鼠应激后的恢复情况,在小鼠第1 次乙酸灌肠后,体重明显下降,但第3 天后恢复到造模前体重水平;第2 次乙酸灌肠后,体重下降百分数与第1 次乙酸灌肠后相当,但其体重的回升速度变慢。在整个模型构建期间,与C 组相比,A 组与A+R 组小鼠体重均未见明显增长,其中A 组小鼠的体重回升更明显(见图2A)。期间模型组小鼠的活动均变少,毛发稍显无光泽。在实验过程中,C 组未发生死亡现象,A 组和A+R组均存在小鼠死亡的情况,死亡率分别为6.7%和13.3%(见图2B)。

图2 不同组别小鼠的体重变化及存活情况的比较Note.A.Group C(n=15),Group A(n=14),Group A+R(n=13).Compared with the group C,*P <0.05,***P <0.001.Compared with the group A,#P <0.05,###P <0.001.Figure 2 Comparison of body weight change and survival of mice in different groups
2.2 粪便含水量和全肠道转运时间
粪便含水量作为反映小鼠的腹泻情况以及肠道通透性的客观指标。结果如图3A 所示,与C 组小鼠的粪便含水百分数(43.53% ± 6.61%)相比,A组小鼠粪便含水百分数(48.86% ± 2.18%)存在明显差异(P<0.05),A+R 组小鼠的粪便含水百分数(57.45% ± 6.19%)存在显著性差异(P<0.001),并且A 组与A+R 组相比也存在显著性差异(P<0.001)。通过观察各组小鼠的全肠道转运时间和4 h 内红便排出百分数来反映各组小鼠的肠道动力情况,结果如图3B 和图3C 所示,与C 组的全肠道转运时间(172.97 ± 51.27)min 相比A+R 组的全肠道转运时间(130.41 ± 25.37)min 明显缩短(P<0.05)。而A 组全肠道转运时间(140.62 ± 45.48)min 虽然缩短,但与C 组相比未见明显差异(P>0.05),并且A+R 组4 h 内红便排出百分数明显增加。

图3 不同组别小鼠的粪便含水量、全肠道转运时间及4 h 内红色粪便排出百分数的比较Note.Compared with the Group C,nsP >0.05,*P <0.05,***P <0.001.Compared with the Group A,nsP >0.05,#P <0.05,###P <0.001.(The same in the following figures)Figure 3 Comparison of fecal water content,total intestinal transport time and percentage of red fecal excretion within 4 h in different groups of mice
2.3 内脏敏感性
通过统计注入水的体积来测量小鼠的内脏敏感性,A 组小鼠的注水量(0.10 ± 0.02)mL 与A+R组小鼠的注水量(0.08 ± 0.02)mL 均较C 组小鼠的注水量(0.13 ± 0.02)mL 明显降低(P<0.001),且两组间存在明显差异(P<0.05)(见图4)。
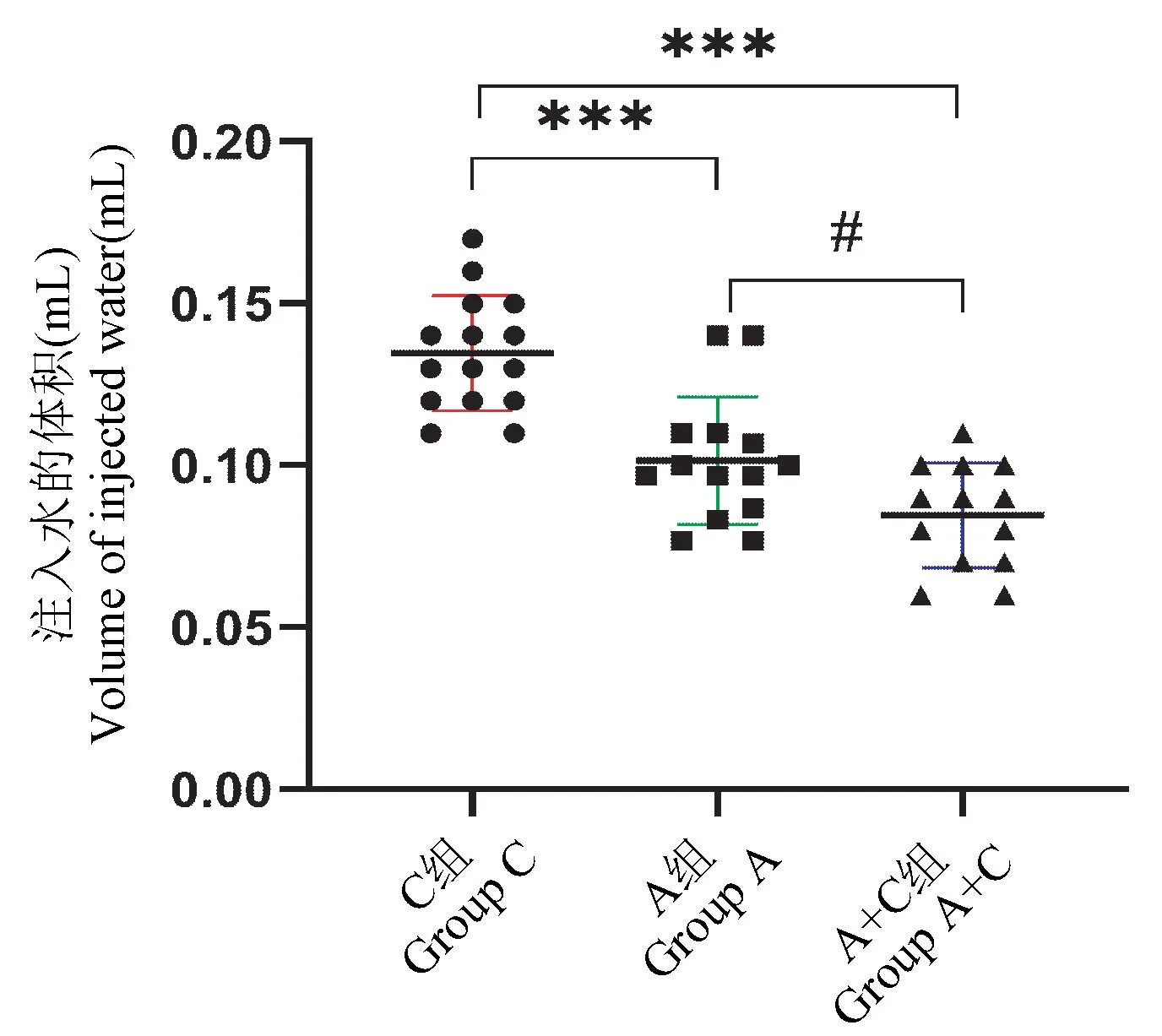
图4 注入水的体积(内脏痛阈值)Figure 4 Volume of injected water (visceral pain threshold)
2.4 结肠粘膜组织HE 染色和结肠粘膜屏障完整性
A+R 组和C 组小鼠结肠组织壁光滑无充血水肿,肠道组织与周围器官均无明显粘连,HE 染色显示,A+R 组小鼠结肠组织中的细胞排列稍显紊乱,炎性细胞无明显增加(见图5A)。在对结肠粘膜屏障的完整性(肠道通透性)的测量中发现,与C 组血浆中FD4 的含量(0.58 ± 0.23)μg/mL 相比,A+R 组小鼠血浆中FD4 的含量(1.85 ± 0.42)μg/mL升高(P<0.001)(见图5B)。
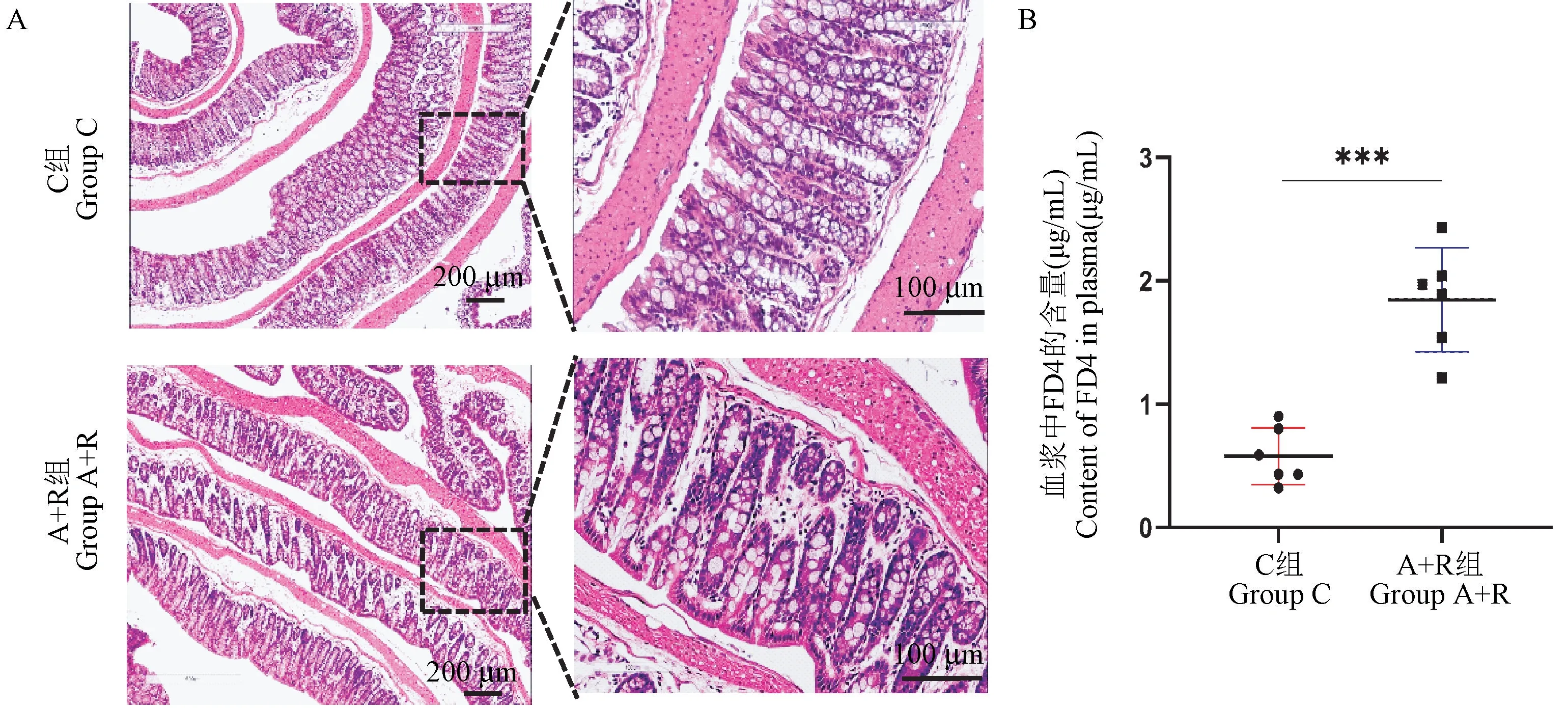
图5 结肠HE 染色结果及血浆中FD4 的含量Figure 5 HE staining of colon and the content of FD4 in plasma
2.5 血清中5-HT 和TNF-α 的含量
5-HT 被认为是参与IBS-D 发病的重要的胃肠激素之一,与肠道动力显著相关,而血清中TNF-α作为反映IBS-D 小鼠全身炎症状态的指标之一。在对C 组小鼠和A+R 组小鼠血清中5-HT 和TNF-α含量的检测中,发现A+R 组血清中5-HT 含量(229.70 ± 15.76)ng/mL 相对于C 组血清中的5-HT 含量(173.74 ± 8.11)ng/mL 显著增加(P<0.001)(见图6A);而A+R 组血清中TNF-α 的含量(59.31 ± 3.82)pg/mL 与C 组血清中TNF-α 的含量(52.78 ± 3.28)pg/mL 相比有显著性差异(P<0.05)(见图6B)。

图6 血清中5-HT 和TNF-α 的含量Figure 6 Level of 5-HT and TNF-α in serum
2.6 结肠组织中5-HTR3A 的表达情况
5-HTR3A 作为5-HT3 受体亚型,与肠道高敏感的形成密切相关。通过免疫组化测定结肠组织中5-HTR3A 的表达量(IOD 值),观察到A+R 组结肠组织中5-HTR3A 的表达量显著增加(P<0.001)(见图7)。
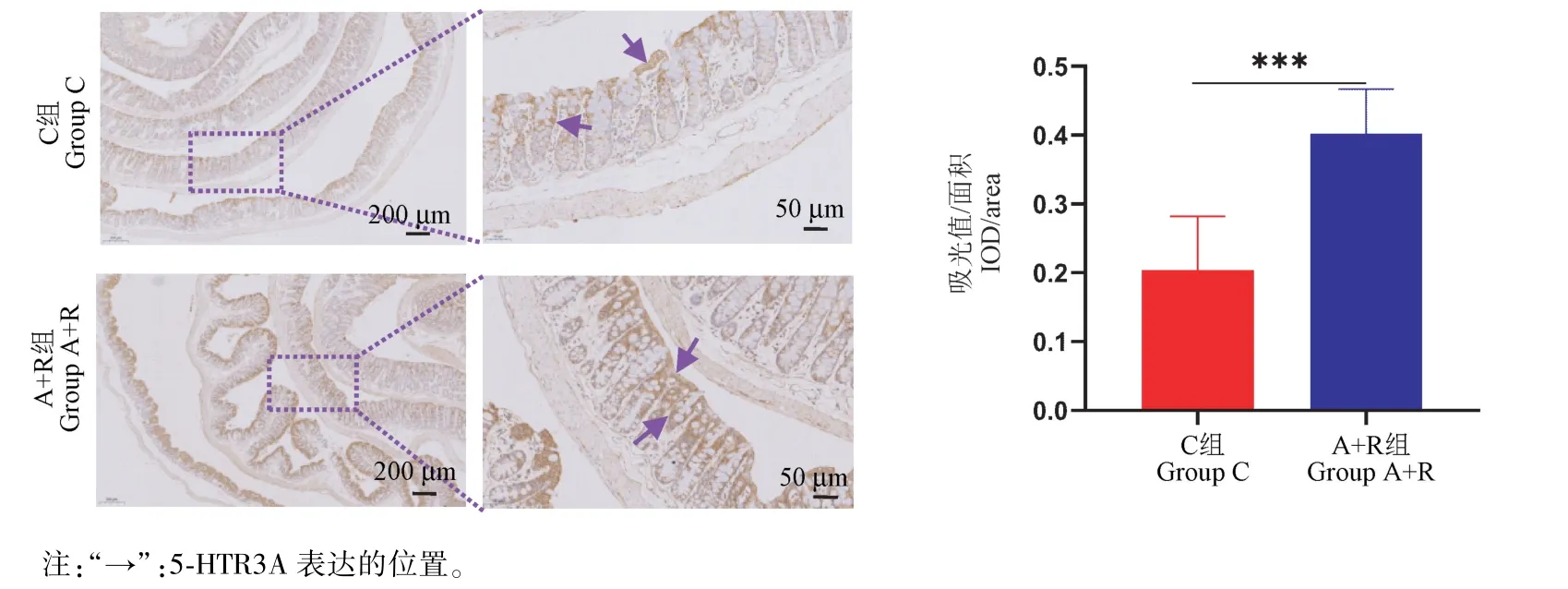
图7 5-HTR3A 在结肠组织中的表达量Note.“→”.The site of 5-HTR3A expression.Figure 7 Expression of 5-HTR3A in colon tissue
3 讨论
IBS-D 的病因及具体的病理生理机制尚不清楚,症状由多种机制共同作用导致,目前认为IBS-D主要是肠道通透性增加、内脏的敏感性增高、胃肠运动障碍、肠-脑轴调节异常、肠道感染、肠道菌群失调、饮食及心理社会等因素共同作用的结果,并伴有低度炎症[10]。关于IBS-D 造模方法的研究与制备也较多,主要包括束缚应激刺激法、番泻叶灌胃、理化因素刺激、母婴分离法以及多种方式联合刺激等方法诱导IBS-D 模型,虽然这些造模方法各有优点,但因造模周期长、造模成本高以及需要投入大量的精力,故在模型的制备上存在一定的局限性。而乙酸刺激作为一种常见的理化刺激方法,因操作简单,成模周期短,被较多用于IBS-D 模型的制备与疾病研究。
目前IBS-D 动物模型主要围绕肠道动力、内肠敏感性、肠道通透性等相关的病理生理改变来验证模型的建立是否成功[5,11-13]。研究发现,乙酸灌肠能诱导肠道高敏感,而且在结肠运动以及肠道通透性方面也有改变[14]。本研究观察到A+R 组的全肠道转运时间明显减少,内脏敏感性显著增加,模型小鼠均出现大便质稀,甚者为水样便。随着时间延长,小鼠的水样便以及稀便率降低,且在造模结束后第2 天,粪便含水量仍高于C 组,而A 组小鼠除了内脏敏感性增加和粪便含水量升高外,其全肠道转运时间在造模结束后均未发生明显变化。而与以往乙酸诱导IBS-D 模型的研究类似[15],本研究也存在小鼠死亡的现象,分析原因可能是小鼠肠道脆弱,乙酸刺激过强,并且此实验为体内刺激,导致部分小鼠不耐受而死亡。这一点在造模期间各组小鼠的体重变化中也有部分反映,在直肠灌注乙酸后小鼠的体重显著下降,但随后迅速恢复,表明小鼠的恢复能力较强,这也间接说明了为什么结肠HE染色未见明显炎性细胞浸润,但与A 组比较,A+R组小鼠体重恢复更缓慢,并不会明显增加小鼠的死亡率。以往研究发现胃肠炎患者康复后约有10%的患者会发展成IBS-D,并长期伴有腹痛、腹泻等症状[16],而在患胃肠炎症期间,心理因素会增加胃肠炎患者康复后患肠易激综合征的风险[3]。在肠道疾病相关的动物实验中也发现束缚应激可以加重疾病的相关症状及病理改变[17]。因此,A+R 组小鼠能成功诱导IBS-D 肠道相关症状,可能与胃肠急性炎症期间的应激反应有关。
与C 组相比,A+R 组小鼠血浆中FD4 的含量明显增加,表明小鼠结肠组织的肠道通透性增加,其结肠粘膜屏障功能受损。而肠上皮结构的完整性受损被认为是IBS-D 发生腹泻的重要因素之一[18-19]。此外,3%乙酸联合束缚应激诱导的IBS-D模型小鼠结肠组织中的炎性细胞与健康对照组相比无明显增加,也未发现明显的炎性细胞聚集/浸润现象,但血清中TNF-α 存在明显差异。这与临床IBS-D 患者的相关表现类似,有报道发现,与健康受试者相比,IBS-D 患者结肠组织无明显病理改变,但血清中多种炎症细胞因子发生了变化,其中TNF-α变化最为明显[20]。
5-HT 被认为是参与IBS-D 发病的重要的胃肠激素之一。有研究认为在IBS-D 患者以及动物模型中,血清中5-HT 的含量均有所增加[21-22]。大鼠腹腔注射5-HT 能显著加快肠道内容物的排出时间,甚至导致腹泻[23]。而5-HT 可与肠道中的5-HT 相关受体结合对肠道敏感、肠道吸收和分泌以及肠道动力产生直接或间接的影响,从而导致腹痛、腹泻以及肠道动力的改变。其中5-HT3 受体与IBS-D 的发病机制密切相关,在肠道感觉功能中发挥着重要作用[24]。5-HTR3A 作为5-HT3 受体的亚型之一,在关于5-HT3 受体功能性的研究中,发现其余的5-HT3 受体亚型与5-HTR3A 受体共同表达时才能形成功能性异聚体,发挥相应的作用[25]。因此,本实验观察到血清中5-HT 变化以及结肠组织中5-HTR3A 含量增加,结果发现其与临床IBS-D 相关报道一致。
综上,我们认为,3%乙酸联合束缚应激的方式能够较好的模拟IBS-D 肠道局部相关症状,并改变血清中5-HT 和TNF-α 的含量以及肠道5-HTR3A的表达,与临床IBS-D 表现相符,是一种具有较好推广价值的IBS-D 小鼠模型制备方法。

