复方中药提取物增强免疫力作用及初步机制研究
王涛 ,戴明珠 ,李延川 ,彭逸 ,李春启*
(1.无限极(中国)有限公司,广州 510610;2.杭州环特生物科技股份有限公司,杭州 310051)
免疫力可以保护机体不受侵害,近年来,由于生态失衡导致的免疫性疾病越来越多,西药不能起到预防作用,治疗效果不甚明显且存在毒副作用。而中药及其提取物在中医药基础理论指导下,擅治未病,最讲究协调和平衡且毒副作用小,所以中药及其提取物增强免疫力一直是新研究方向。已有研究表明,灵芝多糖和生物碱均能明显增强小鼠巨噬细胞吞噬能力和T 淋巴细胞转化能力,同时可提高小鼠外周血中IFN-γ 的表达水平[1-2]。五味子多糖[3-4]、白术多糖及内酯[5]均具有抗氧化和增强机体免疫力活性;菟丝子提取物是有效的抗菌剂,抗氧化剂和抗炎剂[6-7];党参[8]和茯苓[9]在多种急性和慢性炎症的不同实验模型中显示抗炎活性。然而大部分研究都是以传统的大小鼠为动物模型进行评价,具有造模时间长、成本高、通量小等缺点。
斑马鱼(Danio rerio,zebrafish)是一种国际认可的新型模式生物,其引人注目的优势是胚胎发育的透明性,基于高通量的检测体系,以及短时-高效-低费筛选。随着“3R (reduction,replacement,refinement)原则”的推行与实施,其在药物的靶点鉴别、疾病的模型开发和毒性评价中应用越来越广泛[10-13]。本研究采用体外细胞实验和体内斑马鱼免疫低下模型探究复方中药提取物对免疫力的影响,从RAW 264.7 小鼠单核巨噬细胞白血病细胞活性,斑马鱼巨噬细胞数量及其吞噬功能,T 细胞数量,免疫相关基因水平多方面考察复方中药提取物的生物安全性与增强免疫作用,对复方中药提取物增强免疫功能进行验证并提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
转基因巨噬细胞绿色荧光(Tg(mpeg1:EGFP))斑马鱼,转基因T 细胞红色荧光(Tg(rag2:DsRed))斑马鱼,均为受精后2 d(2 days post fertilization,dpf)已出膜幼鱼,体重每尾约0.25 mg,均来源于杭州环特生物科技股份有限公司。斑马鱼成鱼以自然成对的交配方式进行胚胎繁殖,胚胎置于标准稀释水中(标准稀释水:294.0 mg/L CaCl2·2H2O,123.3 mg/L MgSO4·7H2O,63.0 mg/L NaHCO3和5.5 mg/L KCl)在28℃条件下孵化,电导率450~550 μS/cm;pH 为 6.5~ 8.5;硬度为50~100 mg/L CaCO3。由杭州环特生物科技股份有限公司养鱼中心繁殖提供【SYXK(浙)2022-0004】,并通过国际AAALAC 认证(001458)[14-15]。所有操作经杭州环特生物科技股份有限公司审批(001458)。实验结束后,使用0.25 g/L 三卡因甲基磺酸盐对所有斑马鱼进行麻醉安乐死,符合美国兽医协会(American Veterinary Medical Association,AVMA)对斑马鱼麻醉安乐死的要求[16]。
1.1.2 细胞
RAW 264.7 小鼠单核巨噬细胞白血病细胞,订购于中国典型培养物保藏中心,培养条件:(89%DMEM+1%双抗+10% FBS)完全培养基,37℃,5% CO2培养箱培养。
酒石酸长春瑞滨(上海麦克林生化科技有限公司,批号:C10946321);盐酸小檗胺(上海源叶生物科技有限公司,批号:R29J6F1);百令胶囊(杭州中美华东制药有限公司,批号:180303);二甲基亚砜(DMSO,Sigma 公司,批号:BCBZ1685);MTT 细胞增殖及细胞毒性检测试剂盒(南京建成生物工程研究所,货号:G020-1-1);胎牛血清(FBS,Gibico 公司,批号:2152441P);双抗(Gibico 公司,批号:2145455);DMEM(Gibico 公司,批号:8120203);RNA 快速提取试剂盒(上海奕杉生物科技有限公司,货号:RN001);iTaq Universal SYBR Green Supermix(Bio-rad 公司,货号:1725124);Fast Quant RT Kit(With gDNase)试剂盒(天根生化科技(北京)有限公司,货号:KR106);荧光微球(Sigma 公司,批号:MKCB2036 V)。
多功能酶标仪(SPARK,TECAN,Switzerland);细胞培养箱(3111,Thermo,USA);紫外-可见分光光度计(Nanodrop 2000,Thermo,USA);普通PCR 扩增仪(T100,Bio-rad,Singapore);荧光定量PCR 仪(CFX Connect,Bio-rad,Singapore);低位裙边96 孔板(透明)(HSP9601,Bio-rad,USA);6 孔板(Nest Biotech,China);电动聚焦连续变倍荧光显微镜(AZ100,Nikon,Japan);显微注射仪(IM -300,Narishige,Japan);拉针仪(PC-10,Narishige,Japan)。
1.2 方法
1.2.1 复方中药提取物的制备
提取液1:赤灵芝→提取罐中提取→过筛(80目);提取液2:菟丝子、茯苓、五味子、党参、白术→提取罐中提取→过筛(80 目)。将提取液进行浓缩,浓缩过程中温度不可以超过95℃,真空度-0.03~-0.08 Mpa,浓缩至固形物含量在产品标准范围内进行出料。
1.2.2 RAW 264.7 细胞培养及复方中药提取物处理
取生长状态良好的RAW 264.7 小鼠单核巨噬细胞白血病细胞,2000 个/孔分别接种于96 孔细胞板使细胞贴壁完全。弃去旧培养基:(1)每孔依次加入复方中药提取物62.5、125、250、500 及1000 μg/mL 浓度的培养基,加入体积均为100 μL,24 h后弃去旧的培养基,避光条件下每孔加入100 μL 含0.5 mg/mL MTT 的培养基,继续孵育4 h,弃去上清,每孔加入150 μL DMSO,摇床振荡5 min,用酶标仪在490 nm 波长下测定各孔吸光度(OD)值,确定复方中药提取物最佳处理浓度。(2)除正常对照孔及溶剂对照孔(0.1% DMSO)外,其余每孔均加入酒石酸长春瑞滨12.5 μg/mL 浓度的培养基后,再依次加入复方中药提取物27.8、83.3、250 μg/mL 浓度以及阳性对照组盐酸小檗胺25 μg/mL 浓度的培养基。孵育24 h 后弃去旧的培养基,避光条件下每孔加入100 μL 含0.5 mg/mL MTT 的培养基,继续孵育4 h 弃去上清,每孔加入150 μL DMSO,摇床振荡5 min,用酶标仪在490 nm 波长下测定各孔OD值,评价复方中药提取物对RAW 264.7 细胞存活率的影响。
1.2.3 复方中药提取物安全性考察
为解决上述技术难点,分别建立永磁直驱柔性构架有限元瞬态响应分析模型及整车动力学模型,并提出架悬直驱结构与驱动轴间动态间隙的干涉评判指标,以此作为间隙大小设定的依据。
选取受精后2 d(2 days post fertilization,dpf)Tg(mpeg1:EGFP)转基因斑马鱼于6 孔板中,每孔(实验组)均处理30 尾斑马鱼,容量为3 mL。设置加药组:复方中药提取物62.5、125、250、500、1000、2000 μg/mL;同时设置正常对照组(养鱼用水处理的斑马鱼)。加盖置于28℃培养箱中孵育,每隔24 h统计并及时移除死亡斑马鱼,记录孵育至6 dpf 时斑马鱼各脏器毒性表型与死亡情况,确定复方中药提取物对正常斑马鱼的最大检测浓度(maximum tolerated concentration,MTC)。
1.2.4 复方中药提取物对斑马鱼巨噬细胞生成的影响
取2 dpf Tg(mpeg1:EGFP)转基因斑马鱼于6孔板中,设置加药组:复方中药提取物222、667、2000 μg/mL;同时设置对照组:阳性对照盐酸小檗胺5.33 μg/mL,正常对照组及模型对照组。除正常对照组外,其余各组均水溶给予酒石酸长春瑞滨400 μg/mL,建立斑马鱼巨噬细胞减少症模型。各组加盖置于28℃培养箱中孵育至3 dpf 时,在荧光显微镜下观察斑马鱼尾部静脉血管中巨噬细胞荧光强度(S1),并拍照。使用尼康NIS-Elements D 3.20 高级图像处理软件采集数据。
1.2.5 复方中药提取物对斑马鱼巨噬细胞吞噬功能的影响
选取2 dpf Tg(mpeg1:EGFP)转基因斑马鱼,均静脉注射红色荧光微球(直接用生理盐水稀释为2%溶液,每尾10 nL)作为异物以建立斑马鱼巨噬细胞吞噬功能模型。将模型斑马鱼分配于6 孔板中,30 尾/(孔·3 mL 体系),设置加药组:复方中药提取物222、667、2000 μg/mL;同时设置对照组:阳性药百令胶囊15.0 μg/mL 和模型对照组。加盖置于28℃培养箱中孵育至6 dpf 时,在荧光显微镜下观察斑马鱼体内(全身)荧光微球残留的数目(N),并拍照。使用Image J 高级图像处理软件采集数据。
1.2.6 复方中药提取物对斑马鱼T 细胞的影响及初步机制研究
选取2 dpf Tg(rag2:DsRed)转基因斑马鱼于6 孔板中,设置加药组:复方中药提取物222、667、2000 μg/mL;同时设置对照组:阳性对照百令胶囊60.0 μg/mL,正常对照组及模型对照组。除正常对照组外,其余实验组均水溶给予酒石酸长春瑞滨200 μg/mL,建立斑马鱼T 细胞减少症模型。各组加盖置于28℃培养箱中孵育至5 dpf 时,(1)对T 细胞生成的影响:在荧光显微镜下观察斑马鱼T 细胞荧光强度(S2),并拍照,使用尼康NIS-Elements D 3.20 高级图像处理软件采集数据;(2)机制研究:收集斑马鱼样本,采用经典的TRIzol 法提取各浓度组斑马鱼总RNA,以β-actin作为基因表达的内参,通过q-PCR 法检测目的基因肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、重组激活型基因-1(rag1)、重组激活型基因-2(rag2)、白细胞介素-12(interleukin-12,IL-12)和γ-干扰素(interferon-γ,IFN-γ)的转录水平,进行复方中药提取物增强免疫力初步机制研究。引物序列:βactin-FOR:5’-TCGA GCAGGAGATGGGAACC-3’,βactin-REV:5’-CTCGTGGA TACCGCAAGATTC-3’;TNF-α-FOR:5 ’-AGGAGAGTTGCCTTTACCGC-3 ’,TNF-α-REV:5 ’-AATGGATGGCAGCCTTGGAA-3 ’;rag1-FOR:5’-GGAAGGACTGAGAGAGAGGGCGC-3’,rag1-REV:5 ’-AGGACCAGATCCGTGCTTCTCG-3 ’;rag2-FOR:5’-TGGAAGCCCTGTCCTTACCT-3’,rag2-REV:5 ’-GACTCCCACATCATCCAGGC-3 ’;IL-12-FOR:5’-AACTCCTA CAAGCCCAGCAC-3’,IL-12-REV:5’-ACACTCGGTCGTCAAACGAA-3’;IFN-γ-FOR:5’-GCCTGGGGAGTATGTTTG CT-3’,IFN-γ-REV:5’-CAGGAAGATGGGGTGTGCAT-3’。基因相对表达量计算公式:RNA相对表达量=2-△△Ct;ΔΔC(t)=ΔC(t)实验组-;ΔC(t)=C(t)目的基因-C(t)β-actin
1.3 统计学分析
采用GraphPad Prim 5.0 软件进行统计学分析,数据处理结果用平均值± 标准差()表示;多组间采用方差分析和Dunnett’st检验,两独立样本用TTEST 检验,以P<0.05 作为显著性差异判定标准。
2 结果
2.1 复方中药提取物对RAW 264.7 细胞存活率的影响
当复方中药提取物浓度为62.5~250 μg/mL时,RAW 264.7 细胞存活率均>90.0%;当复方中药提取物浓度为500 μg/mL 时,RAW 264.7 细胞存活率下降为84.0%。故确定复方中药提取物对RAW
264.7 细胞最大安全浓度为250 μg/mL(见表1)。
表1 复方中药提取物对RAW 264.7 细胞安全浓度评价实验结果(n=4,)Table 1 Experimental results of evaluating the safe concentration of CHCe on RAW264.7 cells(n=4,)

表1 复方中药提取物对RAW 264.7 细胞安全浓度评价实验结果(n=4,)Table 1 Experimental results of evaluating the safe concentration of CHCe on RAW264.7 cells(n=4,)
由表2 可知,酒石酸长春瑞宾可导致RAW 264.7细胞存活率显著下降;同时复方中药提取物3 倍浓度梯度干预后,细胞存活率呈剂量依赖性升高,复方中药提取物250 μg/mL 可显著提高RAW 264.7 细胞存活率(P<0.01)。
表2 复方中药提取物对RAW264.7 细胞存活率的影响评价实验结果(n=4,)Table 2 Experimental results of CHCe on the survival rate of RAW264.7 cells(n=4,)
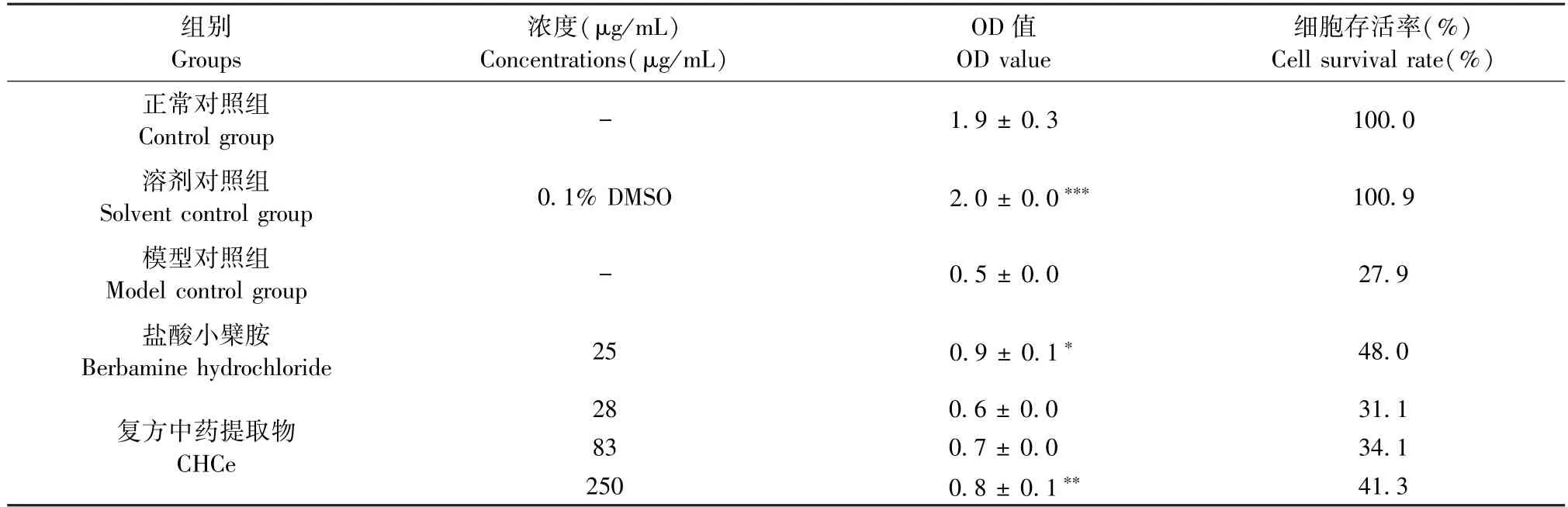
表2 复方中药提取物对RAW264.7 细胞存活率的影响评价实验结果(n=4,)Table 2 Experimental results of CHCe on the survival rate of RAW264.7 cells(n=4,)
注:与模型对照组比较,*P <0.05,**P <0.01,***P <0.001。(下表同)Note.Compared with the model control group,*P <0.05,**P <0.01,***P <0.001.(The same in the following tables)
2.2 复方中药提取物对斑马鱼的MTC
在实验终点,复方中药提取物62.5~2000 μg/mL 浓度组斑马鱼均未见明显异常,各脏器和行为状态与正常斑马鱼相似(见图1)。提示复方中药提取物对正常斑马鱼的MTC 为2000 μg/mL。

图1 复方中药提取物浓度摸索实验结果图片展示Figure 1 Picture display of the experimental results of the concentration of CHCe
2.3 复方中药提取物对斑马鱼巨噬细胞生成的影响
由统计结果可知(图2,表3),酒石酸长春瑞宾可导致斑马鱼免疫力低下,表现为与正常对照组比较,酒石酸长春瑞宾组斑马鱼中巨噬细胞荧光强度显著降低;复方中药提取物低、中、高3 倍浓度梯度干预后,巨噬细胞荧光强度均显著升高,巨噬细胞减少的改善功效分别为18%(P<0.05)、21%(P<0.01)和22%(P<0.01)。
表3 复方中药提取物对巨噬细胞减少改善功效评价实验结果(n=4,)Table 3 Experimental results of the effect of CHCe on macrophages(n=4,)

表3 复方中药提取物对巨噬细胞减少改善功效评价实验结果(n=4,)Table 3 Experimental results of the effect of CHCe on macrophages(n=4,)

图2 复方中药提取物处理后斑马鱼尾部静脉血管巨噬细胞荧光强度典型图Note.The green fluorescent particles are macrophages,and the yellow dotted frame is the analysis area (Veins from cloaca to tail end).Figure 2 Typical graph of fluorescence intensity of macrophages after CHCe treatment
2.4 复方中药提取物对斑马鱼巨噬细胞吞噬功能的影响
由统计结果可知(图3,表4),与模型对照组比较,复方中药提取物低、中、高3 个浓度组均可明显减少斑马鱼体内荧光微球残留数目(P<0.05),表明复方中药提取物具有促巨噬细胞吞噬功能作用。
表4 复方中药提取物对巨噬细胞吞噬功能促进功效评价实验结果(n=10,)Table 4 Experimental results of CHCe on the promotion of macrophage phagocytic function(n=10,)

表4 复方中药提取物对巨噬细胞吞噬功能促进功效评价实验结果(n=10,)Table 4 Experimental results of CHCe on the promotion of macrophage phagocytic function(n=10,)

图3 复方中药提取物处理后斑马鱼体内(全身)残留荧光微球典型图Note.Red fluorescent particles are fluorescent microspheres.Figure 3 Typical image of residual fluorescent microspheres in zebrafish whole body after CHCe treatment
2.5 复方中药提取物对斑马鱼T 细胞生成的影响
由统计结果可知(表5,图4),与正常对照组比较,模型对照组T 细胞荧光强度极显著降低,表明酒石酸长春瑞宾可诱导斑马鱼免疫抑制。与模型对照组比较,复方中药提取物中浓度T 细胞荧光强度显著升高(P<0.01);但高浓度对T 细胞荧光强度无升高作用且呈现降低的作用趋势。

图4 复方中药提取物处理后斑马鱼T 细胞荧光强度典型图Note.Red fluorescent particles are T cells.Figure 4 Typical graph of fluorescence intensity of T-lymphocytes after CHCe treatment
表5 复方中药提取物对T 细胞减少改善功效评价实验结果(n=10,)Table 5 Experimental results of the effect of CHCe on T-lymphocytes(n=10,)

表5 复方中药提取物对T 细胞减少改善功效评价实验结果(n=10,)Table 5 Experimental results of the effect of CHCe on T-lymphocytes(n=10,)
2.6 复方中药提取物对斑马鱼T 细胞的影响及初步机制研究
2.6.1 RNA 浓度及纯度
在实验终点,提取斑马鱼总RNA,用超微量分光光度计测定RNA 浓度及纯度(A260/A280 比值),结果表明A260/A280 比值均在1.88~2.03之间,表明提取得到斑马鱼总RNA 质量较好,可用于后续q-PCR 实验(见表6)。

表6 总RNA 的浓度及纯度Table 6 Concentration and purity of total RNA
2.6.2 对重组激活型基因rag1 和rag2 的影响
根据基因相对表达量公式计算,与正常对照组比较,模型对照组rag1、rag2 基因相对表达量均显著下调(P<0.01),复方中药提取物干预后,低、中、高浓度组rag1、rag2 基因相对表达量均显著恢复(见表7)。
表7 复方中药提取物对rag1 和rag2 基因表达的影响(n=3,)Table 7 Effect of CHCe on rag1 and rag2 gene expression(n=3,)

表7 复方中药提取物对rag1 和rag2 基因表达的影响(n=3,)Table 7 Effect of CHCe on rag1 and rag2 gene expression(n=3,)
2.6.3 对免疫因子IL-12 和IFN-γ的影响
根据表8 显示与正常对照组比,模型对照组IL-12 基因相对表达量极显著下调(P<0.001),复方中药提取物干预后,在实验终点,低浓度组IL-12 基因相对表达量极显著上升(P<0.001),中、高浓度组出现负反馈调节。
表8 复方中药提取物对IL-12 和IFN-γ 基因表达的影响(n=3,)Table 8 Effect of CHCe on IL-12 and IFN-γ gene expression(n=3,)

表8 复方中药提取物对IL-12 和IFN-γ 基因表达的影响(n=3,)Table 8 Effect of CHCe on IL-12 and IFN-γ gene expression(n=3,)
与正常对照组比较,模型对照组IFN-γ基因相对表达量显著下调(P<0.01),复方中药提取物3 倍浓度梯度干预后,IFN-γ基因相对表达量呈剂量依赖性恢复,复方中药提取物高浓度组IFN-γ基因相对表达量极显著上升(P<0.001)。
2.6.4 对致炎症因子TNF-α的影响
模型对照组TNF-α基因相对表达量(1.000)与正常对照组(0.006)比较极显著上调(P<0.001)。复方中药提取物低、中、高浓度组TNF-α基因相对表达量分别为0.023、0.002 和0.008(P<0.001),提示复方中药提取物可显著下调TNF-α基因相对表达量(见表9)。
表9 复方中药提取物对TNF-α 基因表达的影响(n=3,)Table 9 Effect of CHCe on TNF-α gene expression(n=3,)

表9 复方中药提取物对TNF-α 基因表达的影响(n=3,)Table 9 Effect of CHCe on TNF-α gene expression(n=3,)
3 讨论
复方中药提取物是灵芝[1-2]、五味子[3-4]、白术[5]、菟丝子[6-7]、茯苓[9]和党参[8]提取物为主要原料,在之前的研究中,这6 味中药提取物均具有增强免疫力相关报道;此外,菟丝子[6-7]、党参[8]和茯苓[9]在多种急性和慢性炎症模型中显示强抗炎活性。在本实验条件下,体外细胞实验中当复方中药提取物在62.5~250 μg/mL 时,RAW 264.7 细胞存活率均>90.0%,表明复方中药提取物具有良好的生物安全性,且在巨噬细胞的免疫作用方面,对于降低免疫力的造模剂来说,复方中药提取物也有很好的改善作用,与对照组相比,细胞活性上升,这可能是因为复方中药提取物主要原料的安全性和促进免疫力的作用。例如灵芝多糖可影响免疫细胞和免疫相关细胞,包括促进B 和T 淋巴细胞,树突状细胞,巨噬细胞和自然杀伤细胞活性[17-18]。复方中药提取物同时在本次实验中表现出较好的改善免疫力低下模型中巨噬细胞数量和吞噬能力,以及T 细胞的荧光强度,表明复方中药提取物在体内实验中能有效的增强机体免疫力,在之前的报道中,复方中药提取物中具备的灵芝提取物可下调LPS 诱导的促炎因子,并促进BV-2 和原发性小胶质细胞的抗炎细胞因子表达。另外,灵芝提取物通过改变巨噬细胞吞噬作用从而达到先天免疫应答的激活[19],对于基因表达水平方面,不同浓度的复方中药提取物对免疫力低下模型抗炎因子水平的恢复,以及致炎因子水平的降低可以很好的从分子机制解释复方中药提取物的增强免疫力的原理,另外相当多的研究对复方中药提取物中的中药成分免疫基因水平的表达给出了很好的解释[20-22],例如五味子可通过增加衰老小鼠的血清IL-2,IL-4,IFNγ,lgG,lgM和lgA的水平,降低TNF-α和IL-6 的含量,并增加白血球数量,吞噬活性,淋巴细胞增殖和体外脾指数去增强衰老小鼠的免疫力[23]。这些研究都为本实验提供了有效的实验依据的支撑,复方中药提取物的增强免疫力功效也均与之报道相符合。
4 结论
在体外实验中复方中药提取物有良好的生物安全性,且可明显提高酒石酸长春瑞滨诱导后小鼠单核巨噬细胞的存活率。体内研究表明,复方中药提取物可明显改善长春瑞滨诱发的斑马鱼巨噬细胞及T 细胞数量的减少,同时增强体内巨噬细胞的活性和吞噬能力;复方中药提取物可明显恢复模型对照组中rag1、rag2 基因相对表达量被下调的情况,复方中药提取物上调免疫因子IL-12 的表达量、IFN-γ基因的相对表达量,复方中药提取物可显著下调TNF-α基因相对表达量。体内、外实验表明复方中药提取物具有明显的增强免疫力作用。综上所述,复方中药提取物具有明显的抗炎及增强免疫力的作用。本研究可为复方中药提取物作为新的免疫保健食品和二次开发提供指导性依据。