LPS 诱导胆管炎症对胆管上皮细胞骨架形态学变化的影响及大黄灵仙方对其干预机制研究
李承积,俞 渊,甘苡榕,庞浇安,杨 文
(1.广西中医药大学,广西 南宁 530001;2.广西中医药大学第一附属医院肝胆外科,广西 南宁 530023)
肝内胆管结石被称为胆管良性疾病中的“不治之症”,是引起胆管化脓性炎症、胆管癌的重要因素,多发于中国、日本、韩国等亚太国家和地区[1]。肝内胆管结石的发病机制与诸多因素相关,较为复杂,但动物实验和临床研究已证实肝内胆管结石形成与胆道感染的相关性[2]。胆道感染主要是以革兰氏阴性菌感染为主,而革兰氏阴性菌内毒素脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁的重要组成部分,LPS 可通过Toll 样受体4(toll-like receptors TLR4)信号途径激活下游NF-κB(nuclear factor kappa-light-chain-enhancer of activated B cells)和MAPK(mitogen-activated protein kinase)信号通路参与炎症反应[3]。持续性炎性损伤可导致胆管上皮细胞(bile duct epithelia cells,BDECs)增殖,改变胆管树内胆汁流,引起致石性胆汁的形成和分泌[4]。
大黄灵仙方是唐乾利教授防治肝内胆管结石的经验方,长期临床及基础研究发现,该方可降低致石性胆汁的形成,并通过调控NF-κB/MAPK 信号通路关键下游因子,缓解胆道炎症反应[5,6]。细胞骨架纤维状肌动蛋白(F-actin)作为维护细胞稳态的重要结构,在炎症反应中参与上皮连接的破坏和通透性屏障的形成[7]。调节NF-κB/MAPK 信号通路是否会引起F-actin 的改变并使胆管上皮细胞的结构和功能发生异常变化,从而能影响结石的形成启人深思。因此,本研究基于F-actin 水平,采用LPS诱导的胆管炎症细胞模型,联合免疫印迹及激光共聚焦检测技术,观察在不同信号通路处理及大黄灵仙方干预下的胆管上皮细胞骨架蛋白F-actin 改变,以完善大黄灵仙方缓解胆管炎症治疗肝内胆管结石的机制研究。
1 材料与方法
1.1 实验材料
SD 大鼠胆管上皮细胞(上海细胞库);DMEM培养基、胎牛血清(FBS)(美国Gibco 公司,批号分别为(C11885500BT ;A3161002);罗丹明标记鬼笔环肽(Solarbio ,CA1610-300T);LPS(脂多糖,sigma);0.25% 胰 蛋 白 酶-0.02% 乙 二 胺 四 乙 酸(EDTA)溶液(批号:25200056 公司:Gibco);磷酸盐缓冲液PBS(批号:P1022-500),水为超纯水。
1.2 仪器
BSC-1300ⅡB2 型生物安全柜(上海博讯医疗生物仪器股份有限公司);5410 型低温高速离心机(德国Eppendorf 公司);371 型CO2培养箱、Multiskan FC 型酶标仪(美国Thermo Fisher Scientific 公司);激光共聚焦扫描显微镜(日本Olympus 公司,FV3100);IX71 型倒置荧光显微镜(日本Olympus公司)。
1.3 胆管上皮细胞培养
在37 ℃、体积分数5%CO2、饱和温度条件下用含10%胎牛血清和1%双抗(青霉素和链霉素)的DMEM 培养基常规培养。
1.4 细胞分组及干预
将培养好的胆管上皮细胞分别接种于9 个3 cm×3 cm 激光共聚焦培养皿中,待细胞长满80%后,分别用药干预,见表1。

表1 各组细胞的用药干预Tab 1 Drug intervention of each group of cells
1.5 观察各组胆管上皮细胞骨架重排情况
鬼笔环肽工作液配制取原液10 μL,加20 μL BSA 和2 mL PBS 稀释染色;用PBS 洗细胞2 次,用2.5% 的戊二醛固定液固定细胞15 min,PBS 洗3次,每次3 min;0.5%Trito-X-100 室温通透20 min,PBS 洗3 次,每次3 min。取300 μL 的TRIT 标记的鬼笔环肽工作液,室温避光孵育30 min 后PBS 洗2次;用200 μL 的DAPI 核染3 min,PBS 洗2 次,共聚焦激光扫描显微分析结果。采用ImageJ 6 软件对各组图片进行荧光强度分析。
1.6 Western blot 法检测细胞骨架蛋白F-actin 表达情况
细胞的总蛋白经全蛋白试剂提取盒提取,蛋白浓度经BCA 蛋白含量检测试剂盒检测,予SDSPAGE 电泳后,凝胶上的蛋白湿转至PVDF 膜上,予5%脱脂牛奶封闭后,予F-actin 一抗4 ℃孵育过夜,3 次1×TBST 漂洗后,分别加入抗兔/鼠IgG 二抗(HRP 标记),孵育1 h 于室温下,经1×洗涤后,予ECL 发光剂显影,最后经Image J 软件分析条带。
1.7 统计学处理
所有数据输入SPSS20.0 进行统计学分析,各组间比较采用单因素方差分析,计量资料数据用均数±标准差(±s)表示,P<0.05 为差异有统计学意义。
2 结果
2.1 胆管上皮细胞各组形态变化
在光学显微镜下观察到正常胆管上皮细胞贴壁单层生长,细胞外形不规则,细胞胞体较大,可见深褐色细胞核;LPS 干预后,与图A 相比细胞形态改变,胞体明显变圆变小,大量脱落,漂浮于液面;大黄灵仙方干预后,与图B 相比,细胞贴壁生长良好,外形不规则,胞体膨大,细胞核明显可见;通路阻制剂干预后,细胞脱壁死亡增多;大黄灵仙方干预后,各组细胞生长恢复,脱壁较少。结果见图1。
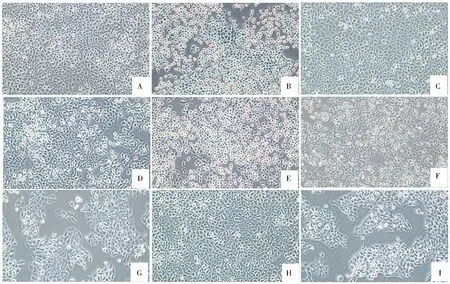
图1 不同干预后各组细胞形态图(4×20 倍数显微镜下观察)Fig 1 Cell morphology of each group after different intervention(observed under 4×20 microscope)
2.2 细胞骨架图片
共聚焦显微镜下可见,正常组细胞核(蓝色)完整,包膜清晰可见,细胞骨架(红色荧光)成丝状;LPS 干预后细胞核皱缩或破损,骨架丝状断裂或成团;大黄灵仙方干预后,细胞核皱缩减少,细胞骨架少量成团;通路阻制剂干预后,细胞核皱缩明显,细胞骨架均有不同程度的断裂,微丝排列紊乱;大黄灵仙方干预后,细胞核皱缩不明显,微丝排列部分整齐。结果见图2~4。
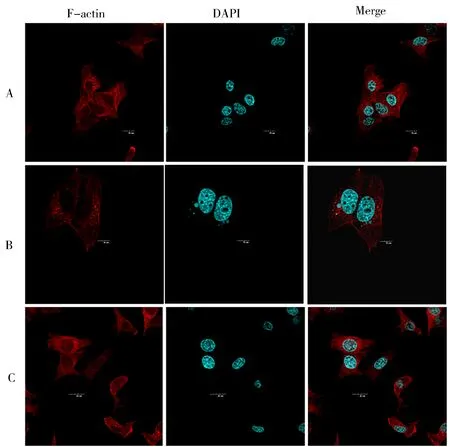
图2 细胞骨架图FIg 2 Cytoskeleton diagram

图3 通路阻制剂干预后细胞骨架图Fig 3 Cytoskeleton after intervention with pathway blocking agents
2.3 荧光强度

图4 大黄灵仙方+通路阻制剂干预后细胞骨架图Fig.4 Cytoskeleton diagram of RHUbarb Lingxianfang +pathway blocking preparation after intervention
(1)由表2 可见,与正常组(组A)相比,模型组(LPS 组)荧光强度明显减弱(t=5.816,P=0.004)。(2)与模型组(LPS 组)相比,LPS+中药组荧光强度增强(t=5.381,P=0.006);LPS+PDTC 组荧光强度增强(t=9.021,P=0.001);LPS+SB203580 组荧 光 强 度 增 强(t=13.798,P=0.000);LPS+PDTC+SB203580 组荧光强度增强(t=15.520,P=0.000);LPS+PDTC+中药组荧光强度增强(t=9.643,P=0.000);LPS+SB203580+中药组荧光强 度 增 强(t=9.160,P=0.001);LPS+PDTC+SB203580+中药组荧光强度增强(t=3.613,P=0.023);差异均有统计学意义。
表2 各组F-actin 荧光强度(±s,n=3)Tab 2 Fluorescence intensity of F-actin in each group(±s,n=3)
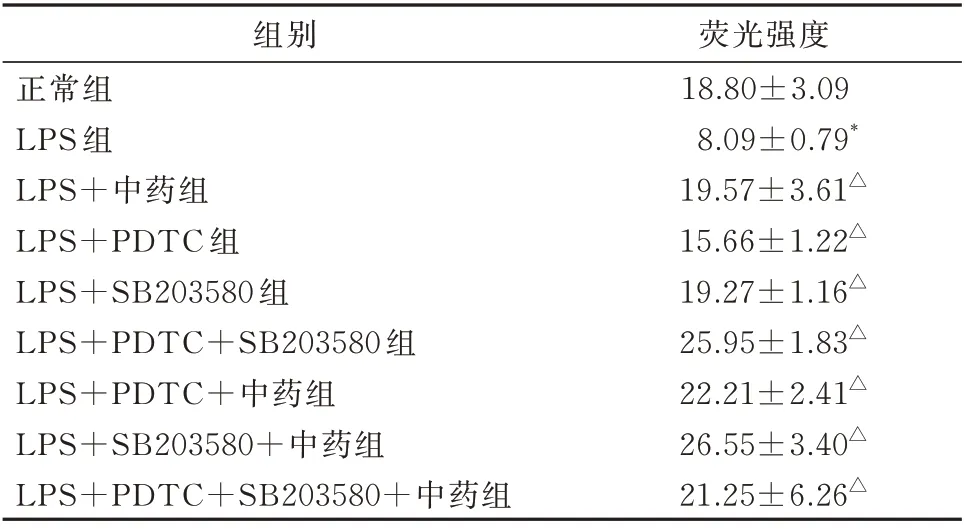
表2 各组F-actin 荧光强度(±s,n=3)Tab 2 Fluorescence intensity of F-actin in each group(±s,n=3)
注:与正常组相比,*P<0.05;与模型组相比,△P<0.05。
组别正常组LPS 组LPS+中药组LPS+PDTC 组LPS+SB203580 组LPS+PDTC+SB203580 组LPS+PDTC+中药组LPS+SB203580+中药组LPS+PDTC+SB203580+中药组荧光强度18.80±3.09 8.09±0.79*19.57±3.61△15.66±1.22△19.27±1.16△25.95±1.83△22.21±2.41△26.55±3.40△21.25±6.26△
(3)与LPS+中药组相比,LPS+SB203580+中药组荧光强度增强,但差异无统计学意义(t=2.438,P=0.071);LPS+PDTC+SB203580+中药组荧光强度增强,但差异无统计学意义(t=0.403,P=0.708);余下各组荧光强度均较模型组有不同程度增强。
2.4 Western Blot 检测F-actin 骨架蛋白表达情况
(1)与正常组相比,LPS 组F-actin 蛋白表达明显减少(t=6.473,P=0.003)。
(2)与LPS 组相比,LPS 组+中药组F-actin 蛋白 表 达 明 显 增 加(t=10.624,P<0.05);LPS+PDTC+中药组F-actin 蛋白表达明显增加(t=7.639,P=0.002);LPS+SB203580+中药组F-actin蛋白表达 明 显增加(t=7.243,P=0.002);LPS+PDTC+SB203580+中药组F-actin 蛋白表达明显增加(t=3.685,P=0.021);其余各组F-actin 蛋白表达与LPS 组比较差异无统计学意义(P>0.05)。
(3)与中药组相比,LPS+PDTC+中药组、LPS+SB203580+ 中 药 组 、 LPS+PDTC+SB203580+中药组F-actin 蛋白表达差异无统计学意义(P>0.05)。见表3 及图2。
表3 各组F-actin 骨架蛋白的表达(±s,n=3)Tab 3 Expression of F-actin skeleton protein in each group(±s,n=3)
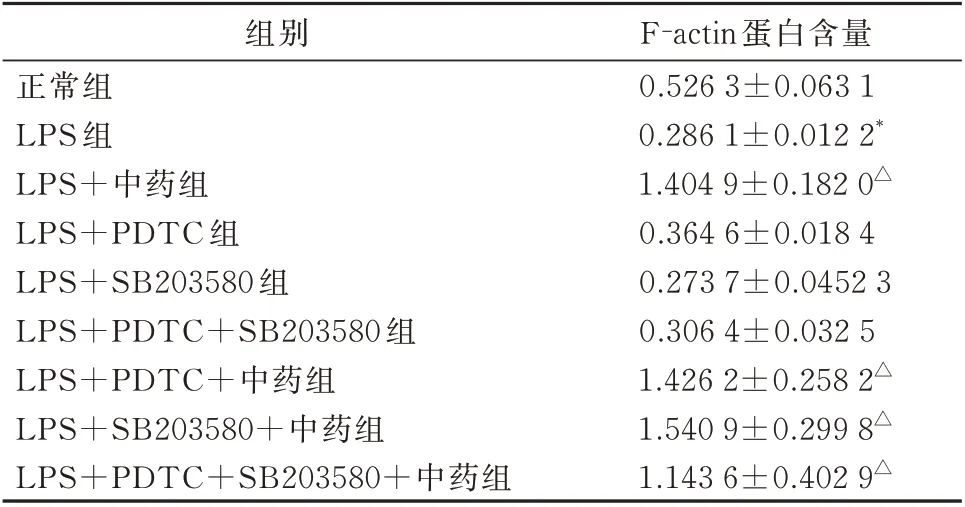
表3 各组F-actin 骨架蛋白的表达(±s,n=3)Tab 3 Expression of F-actin skeleton protein in each group(±s,n=3)
注:与正常组相比,*P<0.05;与模型组相比,△P<0.05。
组别正常组LPS 组LPS+中药组LPS+PDTC 组LPS+SB203580 组LPS+PDTC+SB203580 组LPS+PDTC+中药组LPS+SB203580+中药组LPS+PDTC+SB203580+中药组F-actin 蛋白含量0.526 3±0.063 1 0.286 1±0.012 2*1.404 9±0.182 0△0.364 6±0.018 4 0.273 7±0.0452 3 0.306 4±0.032 5 1.426 2±0.258 2△1.540 9±0.299 8△1.143 6±0.402 9△
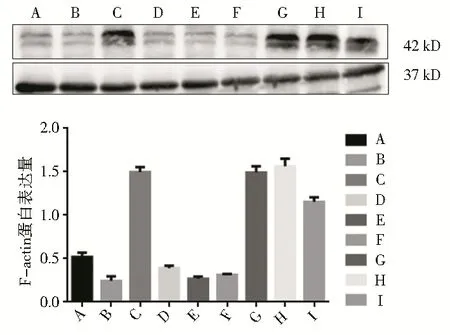
图5 各组细胞F-actin 蛋白表达情况Fig 5 Expression of F-actin protein in each group
3 讨论
由微管、微丝和中间纤维构成的细胞骨架是细胞的主要结构,其中细胞骨架的主要构成蛋白是Factin,也是细胞外信号启动和调控细胞内信号时的首要靶蛋白,其参与细胞维稳、运动、收缩、黏附、增殖和凋亡等多种行为,节细胞通透性的重要机制[8]。细胞骨架能够通过改变形状或移动来对环境做出反应。当细胞遭受到炎症等恶性刺激时,F-actin 会发生重组和再分布,细胞周边F 肌动蛋白环断裂,细胞中央出现大量呈束状密集排列的应力纤维,导致细胞中心张力增高,可加速细胞收缩,最终引起凋亡坏死的结局,进一步加重炎症反应[9,10]。
有关研究表明,NF-κB/MAPK 炎症信号通路的激活主要从以下两方面对细胞骨架进行影响。一方面,MAPK 信号通路不仅能够通过过度磷酸化MAPs 的方式来降低微管的稳定性,还能通过调节其它蛋白如DOC1R/MRP14 的磷酸化影响微管的稳定性[11]。另一方面,细胞在炎症等外界因素的刺激下,发生氧化应激反应,经MAPK 信号转导途径,进一步促进核转录因子NF-κB 活化,活化后的NFκB 进入细胞核中,加速TNF-a、IL-6 等炎症因子释放,导致F-actin 大量解聚[10]。除此以外,药物调控炎症信号通路对不同细胞骨架的变化在文献中均有报道,如淫羊藿苷通过抑制细胞骨架相关因子RhoA 和Cofilin 的mRNA 表 达 而 保 护LPS 诱 导 的成骨细胞F-actin 损伤[12]。岩白菜素通过抑制NFκB 及MAPKs 通 路 来 减 少 促 炎 因 子NO、TNF-α、IL-1β 及IL-6 的产生维持巨噬细胞骨架的稳态[13]。
本课题组基于“炎症假说”长期进行肝内胆管结石的机制研究,探究大黄灵仙方调节胆管炎症对肝内胆管结石形成的影响。前期研究表明,大黄灵仙方可以调控TLR4/NF-κB/MAPK 信号通路中Myd88、p-p38、TLR4、NF-κB 等蛋白及mRNA 的表达,从而逆转胆管细胞炎性反应[14,15]。该方以“疏肝利胆,攻下排石”为拟方原则,其组成中生大黄[16]和芒硝[17]具有泻下、抗炎等药理作用,两药共为君药起攻下导滞、利胆排石之功;金钱草[18]、郁金[19]可通过抗炎作用保护胆管上皮细胞;柴胡[20]中含有的柴胡皂苷a 和d 可抑制脂多糖(LPS)活性;枳壳、泽兰均具有保肝作用,可减少致石性胆汁的分泌[21]。可见大黄灵仙方具有保肝、调节胆道功能、抗炎等功效。
在本研究中,课题组通过观察炎症状态及不同通路阻制剂干预下细胞骨架蛋白的变化,以完善大黄灵仙方缓解胆管炎症治疗肝内胆管结石的分子机制。研究结果表明,LPS 干预后胆管上皮细胞出现F-actin 含量减少,肌丝排列紊乱、断裂的情况,而大黄灵仙方干预后有所好转,尤其是联合了通路阻制剂后,F-actin 含量提高,肌丝排列趋于整齐,可见大黄灵仙方可恢复炎症状态下胆管上皮细胞骨架的排列顺序,保护其微丝结构。表明了大黄灵仙方可能通过调节NF-κB/MAPK 炎症通路,缓解胆管细胞炎症,修复并维持细胞骨架的完整性。而F-actin 骨架蛋白的变化与上皮间质转化密切相关,胆管炎症的发生与上皮间质转化之间的分子机制研究将是课题组下一步的研究方向。
作者贡献度说明:
李承积:实验设计及实施,执笔;俞渊:实验实施;甘苡榕、庞浇安:实验评估;杨文:实验设计及审校。
文章内容不涉及相关利益冲突。

