基于网络药理学探讨疏肝健脾方治疗抑郁相关乳腺癌的分子生物学机制
吴静远,许博文,李 杰,崔玮璐,卢泰成,曹璐畅
(1.中国中医科学院广安门医院肿瘤科,北京 100053;2.北京中医药大学研究生学院,北京 100029)
2020 年全球最新癌症负担数据显示,占据女性癌症新发病例数1/4 和死亡病例数1/6 的乳腺癌已经超过肺癌成为全球最常见的恶性肿瘤[1]。罹患乳腺癌给女性的生理和心理都带来巨大压力,对疾病和自身健康的恐慌、手术以及后续治疗带来的相貌损伤和暂时无法回归社会导致自我价值上的落差都会使患者产生焦虑抑郁的情绪状态[2],而这种情绪状态也会进一步加重患者病情,影响患者的生存质量甚至提高肿瘤复发率[3]。针对乳腺癌患者的焦虑抑郁状态,现代医学多以抗抑郁药治疗为主,但相关药物不良反应多,有可能増加肿瘤复发转移风险,加之部分患者因抵触情绪较重而依从性不佳,故临床疗效往往不稳定[4]。
中医药重视整体调节、调和气血阴阳的特点对改善人体情志状态、舒畅全身气机有着一定的治疗优势[5],有利于乳腺癌患者术后整体康复及后续治疗[6]。疏肝健脾法是中医调畅情志、梳理气机的重要治法之一,中国中医科学院广安门医院肿瘤科在此基础上结合多位医家临床经验拟定疏肝健脾方,临床应用治疗乳腺癌效果颇佳,全方包括柴胡、杭白芍、郁金、预知子、生黄芪、夏枯草、三七粉、甘草等,具有调畅情志、理气活血的功效,方中柴胡和杭白芍散收配伍,疏柔合法,补肝体疏肝气,敛阴血助肝柔,郁金和预知子长于理气化瘀,生黄芪配伍三七粉补脾益气、行气行血,夏枯草清肝泻火,甘草调和诸药,全方既化裁于逍遥散有疏肝解郁、理气健脾之意又寓抗癌清源、扶正培本之功。抑郁焦虑状态可能通过炎性微环境促进乳腺癌的发生与发展,笔者团队的前期基础实验证明,疏肝健脾方能提高脑内5-HT 的表达,恢复海马等区域神经元功能从而改善抑郁障碍型乳腺癌小鼠的持续抑郁状态,通过介导细胞焦亡调控MicroRNA 并降低骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)的含量,恢复T 细胞抗肿瘤免疫,重塑免疫微环境进而控制肿瘤生长、延缓乳腺癌进展[6-8]。中药复方是一个由多个成分和靶标组成的复杂系统,它可以通过多靶点、多环节对人体生物多途径进行多种调节[9]。本文通过引入网络药理学方法,从分子角度发现和明确疏肝健脾方的活性成分,为理解中药复方与机体间的相互作用及靶点在人体内如何起效提供可能,也为后续深入挖掘相关基础及临床实验研究提供思路借鉴。
1 资料与方法
1.1 疏肝健脾方的活性化合物与靶点筛选
在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP,http://tcmspw.com/tcmsp.php)检索疏肝健脾方中各中药的化学成分。依据药代动力学(absorption,distribution,metabolism,elimination,ADME)原则,筛选出的化合物需满足口服利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18 的条件[10]。虽部分化合物不满足ADME 原则,但通过逐 一 查 看“Related diseases”,补 充 包 含“depression-related breast cancer”的候选化合物以完善结果。符合要求的活性化合物在DRUGBANK(https://www.drugbank.ca/)中匹配蛋白质靶点,并导入Uniprot(https://www.uniprot.org/)数据库校正为标准基因名称。在SwissTargetPrediction(http://www.swisstargetprediction.ch/)依据Probability=1 为条件对候选化合物进行靶点预测,两者汇总去重后得到疏肝健脾方中的药物靶标。
1.2 抑郁相关乳腺癌的疾病靶点收集
以“depression-related breast cancer”为关键词在人类基因注 释 数据库(GeneCards,https://www.genecards.org/)、在线人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM,https://omim.org/)中检索抑郁相关乳腺癌的疾病靶点,汇总所有数据并删除重复值得到所有疾病靶点。
1.3 构建“中药-化合物-靶点”网络与拓扑分析
利用R 语言对疏肝健脾方药物靶点与抑郁相关乳腺癌疾病靶点取交集。将获得的共同靶点输入R 语言软件包绘制韦恩图。利用Excel 表将交集靶点数据与疏肝健脾方的中药及活性成分一一对应再导入Cytoscape3.7.2 软件,构建“中药-化合物-靶点”网络以直观展示每一味中药活性成分所对应的每种化合物靶标。为全面了解化合物和靶点的特定属性以进一步分析各节点的重要性及节点间的相互关系,我们利用CytoNCA 插件进行拓扑分析得到该网络中所有节点的度中心性(degree centrality,DC)、中介中心性(betweenness centrality,BC)和接近中心性(closeness centrality,CC)。计算出以上节点属性的中位数并筛选出满足大于上述所有中位数的节点,即“Hit hubs”。
1.4 蛋白质互作网络构建及关键靶点筛选
将韦恩图中获取的交集靶点输入STRING(https://string-db.org/)中的“Multiple Proteins”板块,选择“Homo sapiens”后筛选出置信度高于0.95的靶点,导入Cytoscape3.7.2 后构建蛋白质-蛋白质相互作用(PPI)网络,并通过MCODE 插件中的分子复合物检测算法(MCODE)深度筛选出PPI 的潜在子网以聚焦疏肝健脾方中的活性起效成分,该密集连接的区域称为module[11]。
1.5 富集分析
借助Metascape(http://metascape.org/)对疏肝健脾方干预抑郁相关乳腺癌的候选靶点行基因本位(gene ontology,GO)和京都基因与基因组百科全 书(kyoto encyclopedia of genes and genomes,KEGG)分析。GO 包括细胞组成(cellular component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP),主要说明候选靶点在起效时的具体作用和功能;KEGG 则侧重于疏肝健脾方影响抑郁相关乳腺癌的信号通路。结合文献各筛选出60 条GO 和20 条KEGG 结果,对这些差异显著的富集分析绘制气泡图。利用Excel 表整理出KEGG 所映射的相关靶点,导入Cytoscape3.7.2构建“基因-通路”网络展示疏肝健脾方药物靶点与抑郁相关乳腺癌之间的作用关系,帮助我们明晰药物对疾病的影响以及在疾病网络中研究靶标。
2 结果
2.1 疏肝健脾方的活性化合物及药病靶点的获取
共获得疏肝健脾方活性化合物181 个,其中甘草90 个、生黄芪20 个、柴 胡17 个、郁金15 个、杭白芍14 个、夏枯草11 个、三七粉8 个、预知子6 个。经DrugBank 中匹配后得到药物靶点652 个。在Genecards、OMIM 数据库汇总并删除重复值得到抑郁相关乳腺癌靶点3 838 个。疏肝健脾方干预抑郁相关乳腺癌的共同靶点有250 个,经靶点映射后,实际获得121 个有效化合物。见表1 及图1。
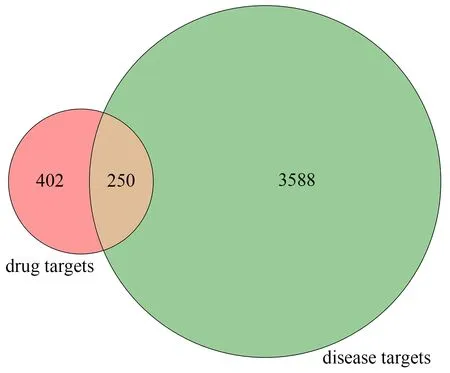
图1 韦恩图Fig1 Venny diagram
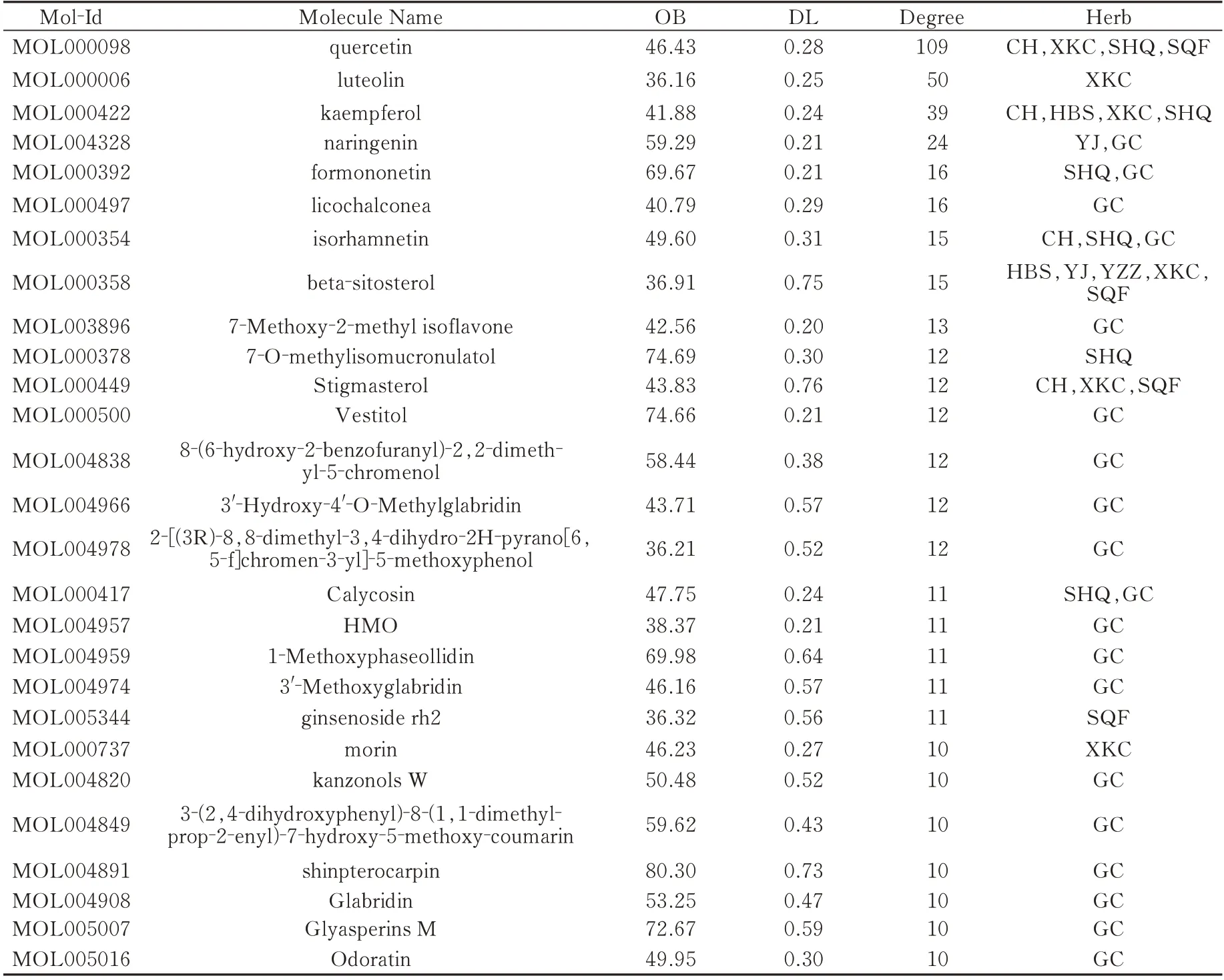
表1 疏肝健脾方活性成分(Degree≥10)Tab1 Active ingredients of Shugan Jianpi Decoction(Degree≥10)
2.2 “中药-成分-靶点”网络的构建和拓扑分析
借助Cytoscape3.7.2 构建“中药-成分-靶点”网络,选取Degree≥10 的靶点进行高频展示,该网络由179 个节点和492 条边组成,见图2。节点代表中药、化合物或靶点,边代表中药-化合物或化合物-靶点间的相互关系。并在CytoNCA 插件中依据拓扑分析参数筛选出“Hit hubs”节点(表2),“Hit hubs”的值越大,互作的靶点就越多,越可能为该网络的关键节点[12],其中有效成分主要包括槲皮素(quercetin)、木犀草素(luteolin)、山奈酚(kaempferol)和柚皮素(naringenin)。

表2 拓扑分析Tab 2 Topological analysis
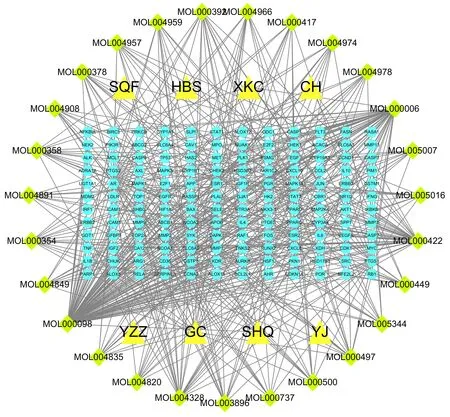
图2 “中药-成分-靶点”网络(Degree≥10)Fig 2 “TCM-ingredient-target”Network
2.3 PPI 网络的构建
在250 个候选基因的PPI 网络图中(图3),TP53、MAPK1、MAPK3、JUN、AKT1、RELA 等存在较多的交互关系,为进一步研究各靶点之间的相互作用,通过MCODE 插件得到module 网络区域,并根据P值保留module 中3 个最佳评分的生物学进程对其进行功能描述。见图4 及表3。
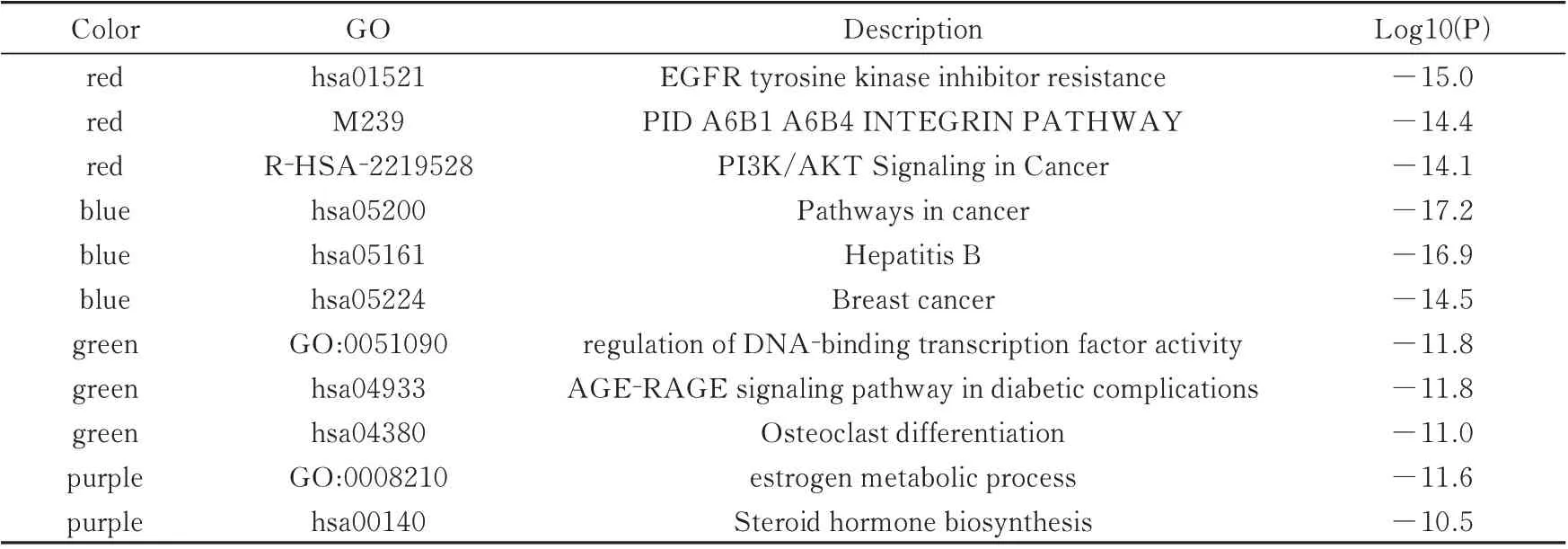
表3 PPI 内部潜在module 功能描述(前3 位)Tab 3 Description of potential module functions within PPI(top 3)
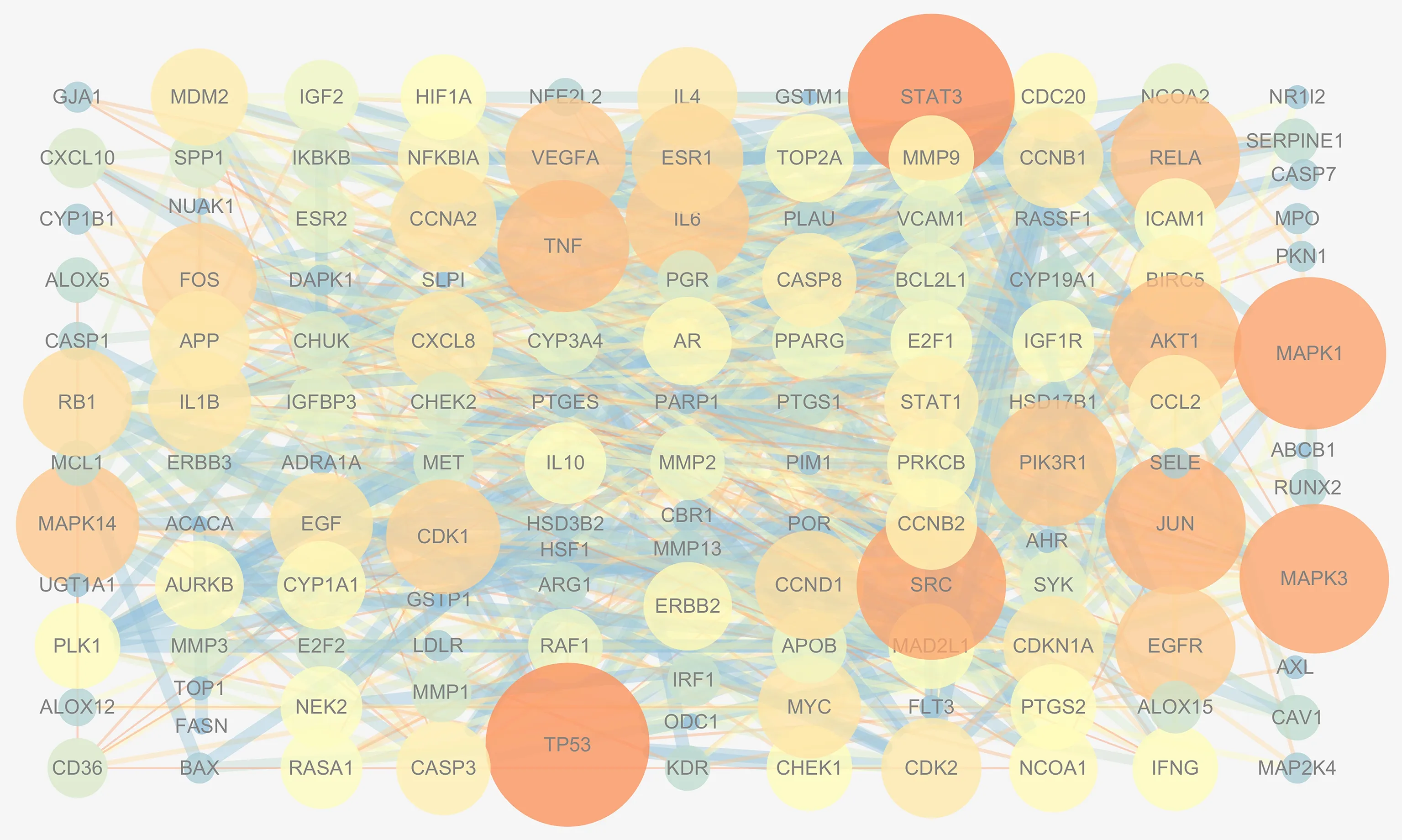
图3 PPI 网络图Fig 3 PPI network diagram
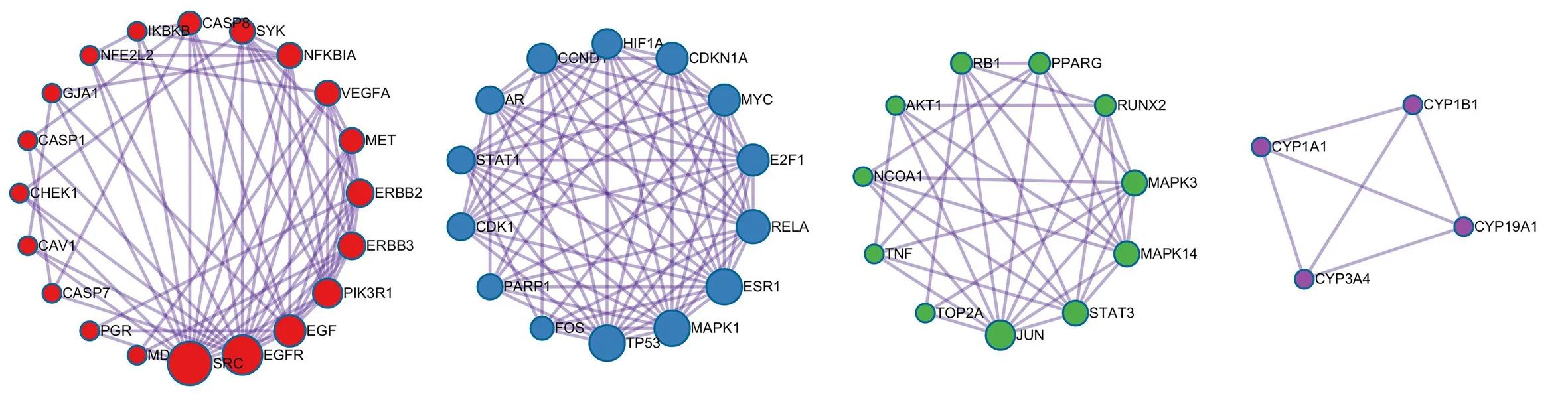
图4 核心PPI 网络内部潜在module 网络Fig 4 Latent module network inside the core PPI network
2.4 富集分析
GO 的富集分析结果显示,2 357 个GO 术语中包含171 个MF,2 101 个BP 和85 个CC,KEGG 的通路富集结果有184 条。据negLog10(P)值排序,选取前20 位用R 语言绘制气泡图,见图5。GO 涉及的主要过程有细胞对激素刺激的反应(cellular response to hormone stimulus)、细胞对脂质的反应(cellular response to lipid)、细胞对氧化应激的反应(cellular response to oxidative stress)、转录因子复合物(transcription factor complex)、蛋白激酶复合物(protein kinase complex)、激 酶 绑 定(kinase binding)、蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)等。从KEGG 的 图 中 可知,疏肝健脾方作用于抑郁相关乳腺癌的通路可能为Pathways in cancer、HIF-1 signaling pathway、PI3K-Akt signaling pathway、MicroRNAs in cancer、Central carbon metabolism in cancer、FoxO signaling pathway 等。
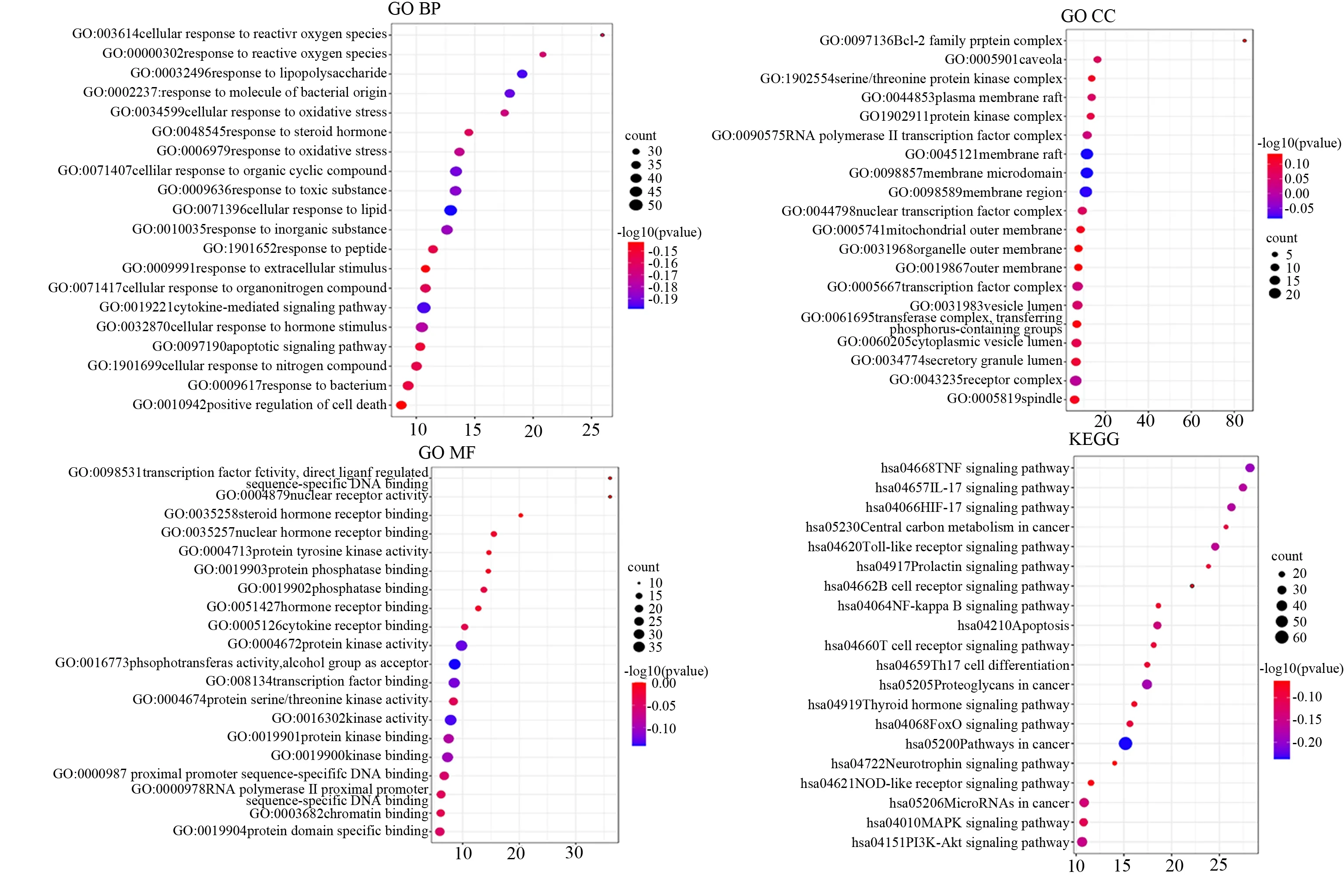
图5 富集分析气泡图Fig 5 Bubble chart of enrichment analysis
2.5 “基因-通路”网络分析
经靶点映射构建了一个包含20 条信号通路、133 个基因和571 条相互作用关系的“基因-通路”网络,见图6。该网络清楚地反映了疏肝健脾方中起效通路与成分之间的关系。 图中MAPK1、MAPK3、NFKB1、RELA、IKBKB、AKT1、PIK3R1度值较大,可能是疏肝健脾方干预抑郁相关乳腺癌的关键靶基因。
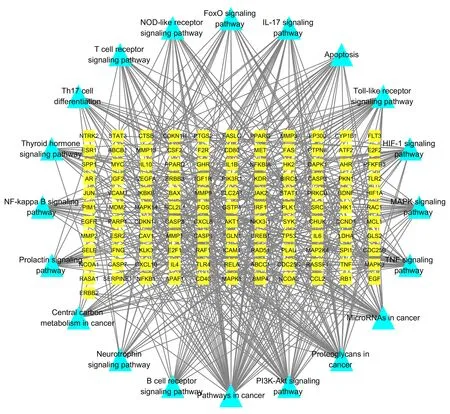
图6 “基因-通路”网络Fig 6 “Gene-pathway”network
3 讨论
情志障碍、抑郁焦虑状态对乳腺癌患者的病情发生、发展及预后影响甚大[13],乳腺癌抑郁患者常常表现出抑郁情绪、躯体性焦虑、精神性焦虑、睡眠障碍、乏力等症状[14],我们认为肝郁脾虚是贯穿其病情全过程的核心病机[15],以法立方,方随证出,疏肝健脾、调畅情志的疏肝健脾方是我院肿瘤科的经典方。依托既往研究,本文引入网络药理学方法从整体角度对其有效成分、作用靶点和富集通路等方面进行分子生物学机制分析。
3.1 潜在有效成分
从“中药-成分-靶点”网络图的拓扑分析得到居于前4 位的化合物为槲皮素、木犀草素、山奈酚和柚皮素,主要通过影响乳腺癌细胞周期、促进癌细胞凋亡发挥效应。研究发现槲皮素单用及联用化疗药物都显示出良好的的抗癌活性,能通过介导EGFR /AKT /mTOR 信号通路促进人乳腺癌细胞株T47D 的细胞凋亡[16],通过降低细胞表面干性相关标志物的蛋白表达有效抑制缺氧微环境中乳腺癌细胞的增殖[17]。木犀草素能发挥逆转TAZ 诱导的上皮间质转化、抑制乳腺癌细胞p-STAT3、p-EGFR、p-Akt 和p-Erk1/2 表达,从而抑制细胞迁移,阻断乳腺癌细胞周期发育,引发凋亡[18]。山奈酚具有多种调节作用,可通过下调CDK1、Bcl2,上调Bax 等使乳腺癌细胞周期阻滞在G2/M 期抑制癌细胞的生长、诱导乳腺癌细胞凋亡[19]。柚皮素是合成雌激素的天然替代物之一,能诱导表达ERα 或ERβ 的肿瘤细胞凋亡,将乳腺癌细胞周期阻滞在G0/G1期[20]、G2期[21],并 通 过 干 扰PI3K 和MAPK 通路抑制乳腺癌细胞增殖和运动[22]。
3.2 潜在作用靶点
结合PPI 网络中的关键网络节点和“基因-通路”网络中度值较大的节点,疏肝健脾方作用于抑郁相关乳腺癌的潜在作用靶点可能为MAPK1、MAPK3、RELA、AKT1,主要通过影响乳腺癌细胞的增殖、侵袭和转移发挥作用。MAPK1 和MAPK3是MAPK 信号通路中重要的蛋白激酶与调控因子,据报道人乳腺上皮细胞KRAS 和PIK3CA 突变的体细胞敲入伴随着MAPK1/3 磷酸化的增加[23],并且MAPK1/3 的磷酸化会导致蛋白的激活和从细胞质到细胞核的转位[24]。Ramirez-Ardila 的研究证明,PIK3CA 突变的乳腺肿瘤标本通过增加MAPK1/3磷酸化而表现出外显子依赖性的特征,MAPK1/3磷酸化可能在PIK3CA 突变的腔内乳腺癌患者中作为下游效应的靶点发挥重要作用[25]。趋化因子CXCL13 及其受体CXCR5 的共表达与原发性乳腺肿瘤向淋巴结的致死性转移有密切关系,而RELA 的表达与乳腺癌患者肿瘤内CXCL13 和CXCR5mRNA 的表达呈正相关,故在RERA 高条件下,低Nrf2 和缺乏CXCR5 启动子的DNA 甲基化控制了CXCL13-CXCR5 在乳腺肿瘤中的共表达,促使肿瘤向淋巴结转移推动疾病的进展[26]。AKT1 通过上调S6 和cyclinD1 促进乳腺癌细胞增殖,通过下调β-1 整合素和粘着斑激酶(FAK)抑制细胞的迁移和侵袭,即AKT1 的过表达会促进局部肿瘤的生长,AKT1 的下调会促进瘤周浸润和肺转移[27]。
3.3 相关富集通路
依据GO 和KEGG 富集结果,预测疏肝健脾方主要通过HIF-1、PI3K-Akt、MicroRNAs 和FoxO 信号通路及其交互作用共同发挥抗肿瘤作用。HIF-1是缺氧反应的主要调节因子,在EMT、侵袭、外渗和转移生态位的形成等乳腺癌细胞转移的多步骤起关键作用[28]。HIF-1 信号通路通过介导缺氧调控的MicroRNAs 编码基因表达在乳腺癌转移中发挥重要作用,如在MCF-7 乳腺癌细胞中,缺氧使41 个MicroRNAs 表 达 显 著 上 调,28 个MicroRNAs 表 达下调[29]。PI3K-Akt 信号通路是大多数实体瘤(包括乳腺癌)中常见的失控途径,其常见的改变如PIK3CA 和PIK3R1 基 因 的 突 变,Akt 的 体 细 胞 突变、抑癌基因PTEN 的失活突变或缺失以及其下游靶点p70S6K、p-4EBP1 和eIF4E 的过度表达或异常磷酸化,这些突变会激活PI3K-Akt 信号通路,并通过促进细胞转化、肿瘤的启动、进展和抗凋亡而成为致癌的驱动因素[30,31]。超过50%的人类MicroRNAs 定位于与肿瘤发展过程中发生的扩增、缺失或易位相关的脆弱染色体区域,致癌MicroRNAs 如miRNA-10 家族、miR-21、miR-17-92、miR-155 经常在乳腺癌中过表达以及刺激致癌转录因子来发挥其致癌潜力;肿瘤抑制因子MicroRNAs 如Let-7 家族、miR-200 家 族、miR-205、miR-145 等[32,33]在 癌 细胞中表达不足,通过抑制癌基因的表达控制细胞分化、增殖等。FoxO 信号通路的表达受到MicroRNAs 的抑制[34],乳腺癌细胞依赖FoxO 的存在来有效地生长和转移肿瘤,但同时FoxO3 水平的升高又可延缓转移[35]。
本研究采用网络药理学方法,在佐证我们既往研究中疏肝健脾方通过调控MicroRNAs 抑制癌细胞增殖的基础上,进一步发现其有效化合物如槲皮素、山奈酚、木犀草素、柚皮素等多作用于乳腺癌的细胞周期影响癌细胞的生长和凋亡,相关靶点如MAPK1、MAPK3、RELA、AKT1 等 通 过 作 用 于HIF-1、PI3K-Akt、MicroRNAs 和FoxO 等信号通路介导缺氧环境、肿瘤微环境等环节阻滞细胞周期、抑制癌细胞增殖、阻止其复发转移。故疏肝健脾方可能通过多靶点、多通路的方式对抑郁相关乳腺癌协同起效,以上探讨为深入挖掘中药复方的药物靶点及药物组合提供了新的思路和方法,但上述猜想假设仍需后续进一步的基础实验测试和临床观察验证。

