不同时长应激对大鼠抑郁样行为及内侧前额叶皮层CB1 及GluA1 表达的影响
张宇昕,孙红梅,盖 聪,程翠翠,杨璐平,郭振宇,高誉珊,胡 蝶
(北京中医药大学良乡校区,北京 102488)
抑郁症是一种广泛存在的慢性精神疾病,可以影响思维、情绪和身体健康,特征是情绪低落、缺乏活力、失眠并且伴有其他躯体症状,严重时导致认知功能损害[1,2]。目前全球抑郁症的患病率已超过3.5 亿,2008 年WHO 将严重抑郁症列为全球第三大疾病负担原因,并预计到2030 年抑郁症将成为首要导致人类患病和死亡的危险因素[3]。抑郁症的病因至今仍不完全清楚,大麻素受体1(cannabinoid receptor 1,CB1)属于内源性大麻素受体之一,在大脑中广泛分布,主要存在于神经元突触前膜,大量实验及临床研究表明内源性大麻素是突触可塑性和功能的重要调节因子,与抑郁症的发病密切相关[4]。离子型谷氨酸受体α-氨基-3-羟基-5-甲基-4-异丁唑基丙酸受体可介导中枢神经系统兴奋性突触传递,AMPA 受体亚基1(glutamate receptor 1,GluA1)主要存在于突触后膜,参与突触可塑性调节,其表达异常是多种精神疾病的常见机制[5]。
慢性不可预见性温和应激(chronic unpredictability mild stress,CUMS)被广泛用于抑郁症动物模型的建立,其主要是通过模拟人类受到慢性压力与刺激,从而产生抑郁样行为[6]。因此,在本实验中对大鼠采取CUMS 造模,筛选出较为稳定的CUMS造模时间,并通过检测大鼠大脑内侧前额叶皮层(medial prefrontal cortex,mPFC)脑区中突触体中大麻素受体CB1 和GluA1 蛋白表达水平,探讨应激导致的抑郁与mPFC 脑区中CB1 和GluA1 蛋白的相关性。
1 材料与方法
1.1 实验动物
Sprague-Dawley(SD)大 鼠30 只,雄 性,体 重220~240 g,购于北京维通利华实验动物技术公司,许可证号:SCXK(京)2016-0011。在北京中医药大学SPF 动物实验中心饲养,许可证号为SYXK(京)2016-0038。动物房恒温(23±2)℃,相对湿度为50%~60%,采用12 h 昼夜节律控制(8∶00~20∶00)。本研究经过北京中医药大学实验动物福利伦理委员会审查,并按实验动物使用的3R 原则,符合国家实验动物福利伦理相关规定,伦理审查编号:BUCM-4-2020080301-3004。
1.2 主要试剂和仪器
兔 多 克 隆 抗 体CB1(ImmunoWay,YT0687,1∶2 000);兔多克隆抗体GluA1(abcam,ab31232,1∶2 000)、GAPDH(abcam,ab9485,1∶2 000);Tanon-4500 化学发光成像仪(上海天能科技有限公司)。
1.3 动物分组及模型建立
实验前动物适应性饲养7 d 后按随机数字表法将大鼠分为3 组,对照组、3 周模型组、4 周模型组每组各10 只。
1.3.1 3 周模型组 给予3 周CUMS 建立抑郁症模型,每天选取一种长应激和一种短应激,同种应激不连续出现,防止动物产生适应性。
长应激的应激方法如下:(1)禁食:24 h 内不给大鼠提供饲料;(2)禁水:24 h 内将大鼠笼上水瓶拿掉或放置无水空瓶;(3)拥挤:将标准大鼠笼中放入15~20 只大鼠,不同组大鼠的尾部采用不同颜色的记号笔标记以区分,持续时间为24 h;(4)倾斜:将标准大鼠笼倾斜45 °放置,持续时间为24 h;(5)持续光照:给予大鼠饲养室24 h 持续灯光。
短应激的应激方法如下:(1)冰水游泳5 min:将大鼠放入装有4 ℃的冰水桶中,水深约45 cm,需保证大鼠鼠尾不能触底为准。(2)夹尾60 s:将大鼠放入固定装置中暴露尾巴,用夹子夹住距尾跟1 cm处,以令大鼠发出叫声为标准;(3)束缚2 h:将大鼠放入铁丝网中,需保证大鼠在其中无法移动;(4)频闪4 h:通过频闪灯对大鼠进行频闪,速度为每次1 s;(5)白噪音4 h:通过收音机播放白噪音,音量保持在100 dB。
1.3.2 4 周模型组 给予4 周CUMS 造模。
1.3.3 对照组 正常饲养,不做任何处理。
1.4 行为学指标测定
(1)一般行为学观察:在大鼠存活期内,对各组大鼠的一般行为学进行观察。并对其各项行为学进行检测。(2)糖水偏爱实验[7,8](sucrose preference test,SPT):3 周模型组自造模开始后第21~23 天进行SPT 实验,对每只大鼠进行单笼饲养;4 周模型组和对照组自造模开始后第28~30 天进行SPT 实验。SPT 实验第1 天为适应期,给予大鼠2 瓶糖水(浓度为1%),第2 天糖水和纯水各1 瓶,12 h 后调换两水瓶的位置。此阶段需检查水瓶是否漏水,避免正式测试时由于水瓶漏水导致的误差。第3 天正式测试,对24 h 内糖水摄入量和纯水摄入量进行称重,总摄入量=糖水摄入量+纯水摄入量。糖水偏爱率=糖水摄入量/总摄入量×100%。并比较总饮水量排除不同大鼠饮水的差异性带来的影响。总饮水量=总摄入量(mg)/体重(g)。(3)新颖环境抑制 摄 食 实 验[7,8](novelty inhibited feeding test,NSFT):3 周模型组自造模开始后第24~25 天进行NSFT 实验,4 周模型组和对照组自造模开始后第31~32 天进行NSFT 实验。大鼠禁食24 h 后在旷场中进行测试,旷场中央放置食物,将大鼠自旷场角落放入,并记录其摄食潜伏期。若10 min 后大鼠未摄食,则摄食潜伏期计为600 s。测试时需保持周围环境安静,测试结束令大鼠自由摄食,记录5 min内食物消耗量(mg)/大鼠体重(g),排除大鼠的食欲对 实 验 产 生 的 影 响。(4)强 迫 游 泳 实 验[7,8](forced swimming test,FST):3 周模型组自造模开始后第26~27 天进行FST 实验,4 周模型组和对照组自造模开始后第33~34 天进行FST 实验。强迫游泳实验容器为透明玻璃缸,水深30 cm,大鼠游泳时尾巴不能触及桶底,水温25 ℃。FST 实验第1 天为适应阶段,令大鼠在水中游泳15 min,第2 天正式测试并视频记录,时间为5 min,根据游泳视频分析大鼠的漂浮不动时间。测试时需保持周围环境的安静,每两个游泳容器之间需要放置不透明的挡板,使大鼠无法观察到其他大鼠的情况。(5)实验流程(图1)。

图1 大鼠经历CUMS 后进行行为学测试及取材流程图Fig 1 Flow chart of behavioral test and sampling after CUMS
1.5 Western blot 实验
检测突触体GluA1 及CB1 蛋白的表达。大鼠断头取脑后放入正己烷20 s,骤冷后取出,对mPFC脑区进行脑组织匀浆。匀浆后下静置使脑组织充分与缓冲液结合,离心10 min 取上清继续离心30 min,取沉淀溶解于HEPES-Lysis 缓冲液中,静置30 min 后在4 ℃下25 000g离心30 min,弃去上清获得突触体。突触体用RIPA 裂解液溶解,并用BCA法测定突触体蛋白的含量。采用SDS-PAGE 凝胶电泳,每道加20 μg 蛋白,电泳至条带到凝胶底部结束,恒流250 mA 将蛋白转移到PVDF 膜后封闭液封闭1 h,后加入相应一抗工作液GluA1(1∶2 000),CB1(1∶2 000)孵育4 ℃过夜,TBST 洗脱后孵育与一抗来源相同的二抗1 h。将增强型化学发光液的两种底物1∶1 混合,ECL 发光液均匀加到PVDF 膜上,放入化学发光仪中曝光。使用Image J 软件进行灰度值分析。最终表征蛋白水平的数据为实验组的数值比相应的对照组数值的比值[9]。
1.6 统计学处理
数据采用SAS 8.2 进行统计分析,采用单因素方差(ANOVA)进行统计分析,组间两两比较采用独立样本t检验,检验水准α=0.05,双侧检验。实验结果以Mean±SEM(±sem)表示。
2 结果
2.1 行为学结果
2.1.1 一般行为学的观察 造模开始前各组大鼠均毛色光滑,饮食饮水正常,体重无明显差异,活泼喜动,精神状态良好。3 周CUMS 后大鼠毛发粗糙,体重降低。4 周CUMS 造模后大鼠毛色暗淡,精神萎靡,不喜动,嗜睡,体重较对照组大鼠下降。
2.1.2 糖水偏爱实验结果 与对照组相比,3 周模型组大鼠糖水偏爱率与总饮水量均无显著差异。而4 周模型组大鼠的糖水偏爱率较对照组显著降低(P<0.05),但两组的总饮水量无显著差异(P>0.05)(表1)。提示4 周CUMS 造模可导致大鼠出现快感缺失症状。
2.1.3 新颖抑制摄食实验结果 3 周模型组大鼠的摄食潜伏期较对照组大鼠无明显差异,而4 周模型组大鼠的摄食潜伏期较对照组显著延长(P<0.01),3 组大鼠5 min 内总食物消耗量差异无统计学意义(P>0.05)(表1)。提示4 周CUMS 后导致大鼠出现焦虑样行为。
2.1.4 强迫游泳实验结果 结果显示,3 周模型组大鼠与对照组大鼠在5 min 内不动时间无明显差异,而4 周模型组大鼠在5 min 内的不动时间较对照组延长,差异有统计学意义(P<0.05)(表1)。提示4 周CUMS 造模后可导致大鼠出现绝望行为。
表1 各组大鼠行为学数据(±sem,n=10)Tab 1 Behavioral data in each group(±sem,n=10)
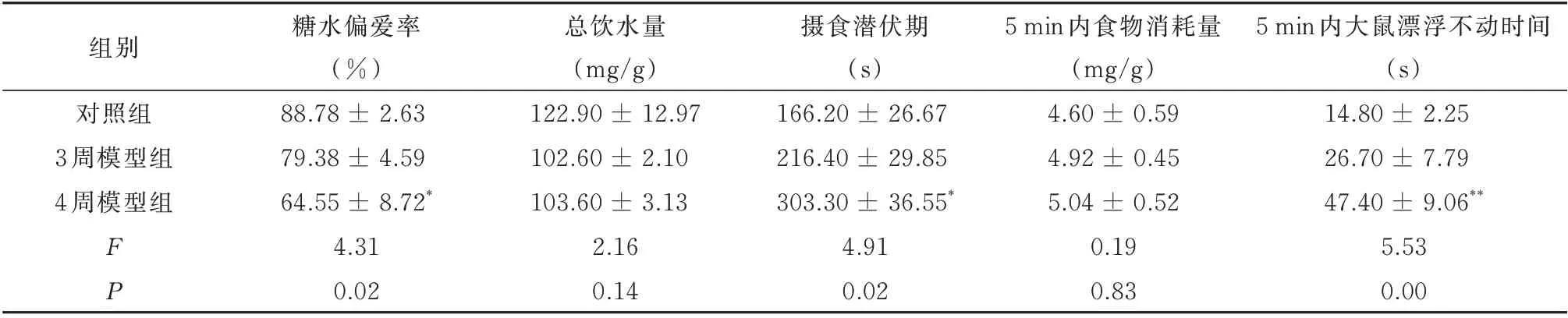
表1 各组大鼠行为学数据(±sem,n=10)Tab 1 Behavioral data in each group(±sem,n=10)
注:与对照组相比,*P<0.05,**P<0.01。
组别对照组3 周模型组4 周模型组5 min 内大鼠漂浮不动时间(s)14.80 ± 2.25 26.70 ± 7.79 47.40 ± 9.06**5.53 0.00 FP糖水偏爱率(%)88.78 ± 2.63 79.38 ± 4.59 64.55 ± 8.72*4.31 0.02总饮水量(mg/g)122.90 ± 12.97 102.60 ± 2.10 103.60 ± 3.13 2.16 0.14摄食潜伏期(s)166.20 ± 26.67 216.40 ± 29.85 303.30 ± 36.55*4.91 0.02 5 min 内食物消耗量(mg/g)4.60 ± 0.59 4.92 ± 0.45 5.04 ± 0.52 0.19 0.83
2.2 大鼠mPFC 脑区CB1 和GluA1 蛋白的表达
在mPFC 脑区中,与对照组大鼠相比,3 周模型组大鼠突触体中CB1 和GluA1 蛋白表达水平无明显差异,而4 周模型组CB1 和GluA1 表达水平均明显降低(P<0.05)(图2、表2)。
表2 各组大鼠CB1和GluA1蛋白的相对表达水平(±sem,n=10)Tab 2 Relative expression levels of CB1 and GluA1 protein in each group(±sem,n=10)
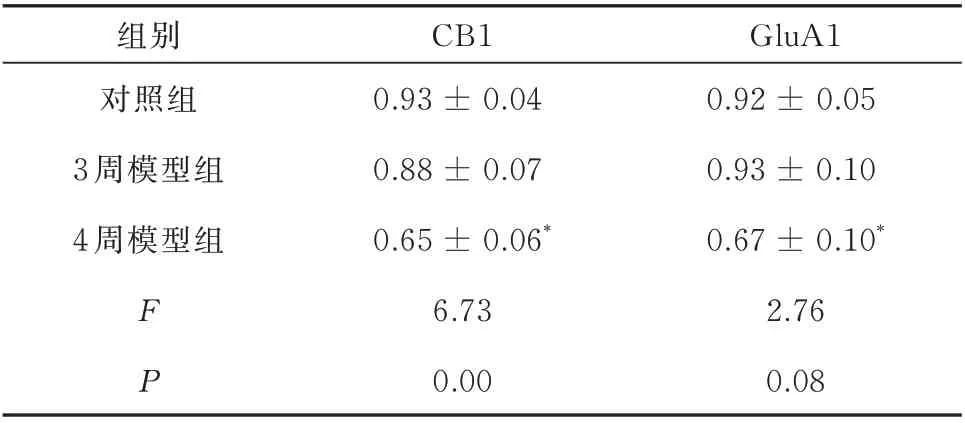
表2 各组大鼠CB1和GluA1蛋白的相对表达水平(±sem,n=10)Tab 2 Relative expression levels of CB1 and GluA1 protein in each group(±sem,n=10)
注:与对照组相比,*P<0.05.
GluA1 0.92 ± 0.05 0.93 ± 0.10 0.67 ± 0.10*2.76 0.08组别对照组3 周模型组4 周模型组FP CB1 0.93 ± 0.04 0.88 ± 0.07 0.65 ± 0.06*6.73 0.00
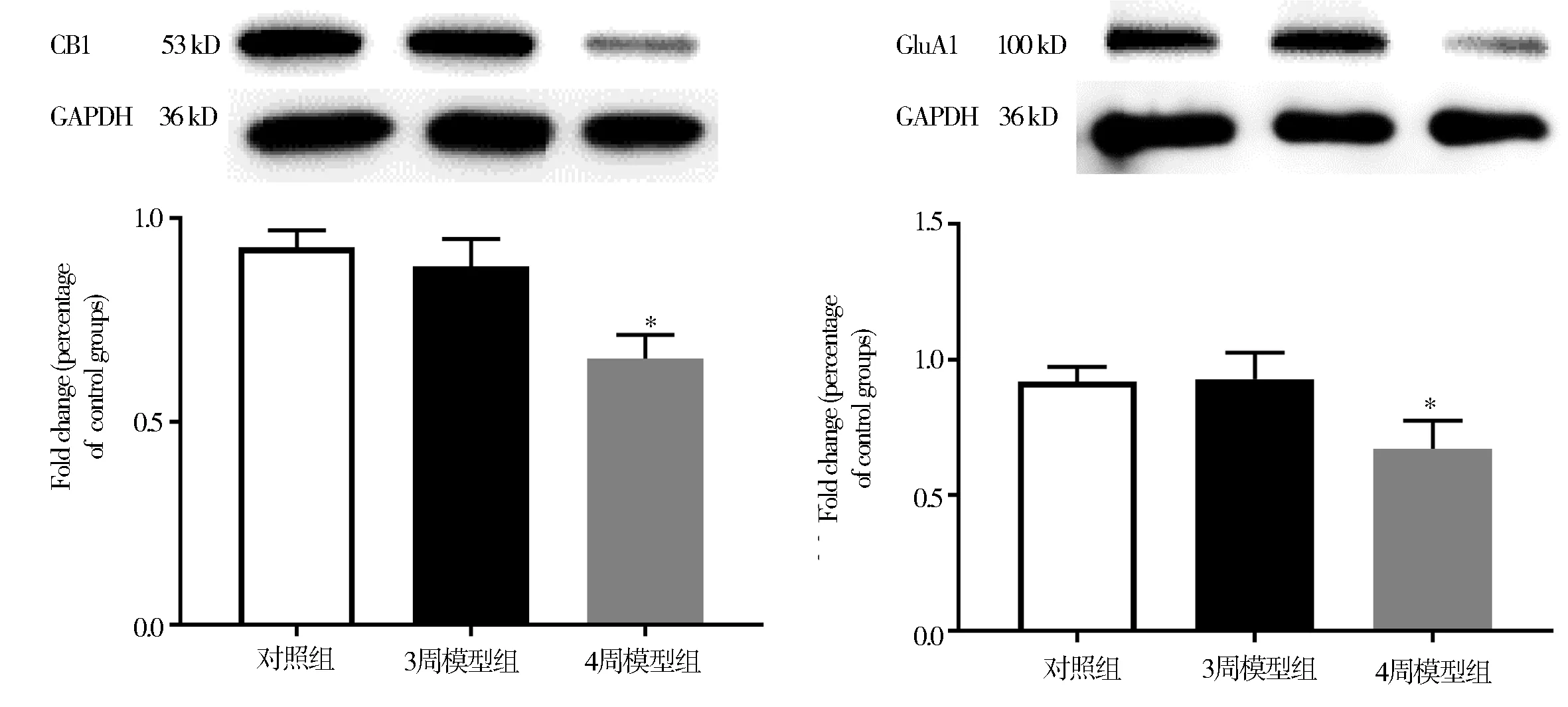
图2 各组大鼠PrL 脑区CB1 和GluA1 蛋白的表达情况Fig 2 Expression of CB1 and GluA1 proteins in PrL brain region of rats in each group
3 讨论
抑郁症的造模存在多种方式:应激模型、手术模型、药物模型及转基因模型[10-12],其中CUMS 造模由于可以模拟人类抑郁的主要症状,因而被广泛应用于抑郁症相关机制的研究中[13]。对近十年CUMS 抑郁模型统计后观察到造模时长通常为3~4 周[14-16],因此本研究分别采用3 周CUMS 造模和4周CUMS 造模来筛选出最稳定的造模时长。观察到大鼠经历4 周CUMS 后,与对照组相比,糖水偏爱率降低,新颖抑制摄食测试中摄食潜伏期增加,强迫游泳测试中不动时间增加,差异具有统计学意义(P<0.05),而3 周应激与对照组相比无明显差异,提示4 周CUMS 造模后大鼠产生明显的抑郁和焦虑样行为,大鼠抑郁模型造模成功。
mPFC 脑区参与了多种精神疾病的发病过程,其脑区体积减小、突触结构及功能的改变,脑区内神经元萎缩和均与抑郁症[17,18],课题组前期研究也发现mPFC 脑区内mPFC 脑区中GABA 能神经元功能异常与慢性应激导致的抑郁相关[7]。mPFC 是皮层中负责执行功能的主要区域,当其功能受损时,与情绪障碍相关的情绪加工、认知表现、神经传递、自主调节和神经内分泌反应障碍[19]。在实验研究中可观察到mPFC 脑区损伤大鼠的应激易感性较正常大鼠增加,其机制可能是由于涉及神经内分泌和自主反应的大脑区域的激活[20]。因此,本研究主要通过观察慢性应激对大鼠mPFC 脑区内CB1和GluA1 蛋白表达水平的影响。
内源性大麻素系统因参与多种不同的大脑生理过程(包括情绪、动机和认知功能的调节)而受到越来越多的关注,内源性大麻素的产生能够促进神经可塑性[21]。此外动物和临床研究表明,内源性大麻素信号传导功能障碍会产生类似抑郁的行为[22]。内源性大麻素的活性可通过中枢神经系统中的CB1 受体进行调节,在抑郁症患者的PFC 脑区中发现内源性大麻素浓度和CB1 受体的结合亲和力及其密度的变化[23]。本实验也证实了大鼠经4 周CUMS 后诱导的抑郁模型大鼠发病与mPFC 脑区CB1 表达水平降低有关。
神经元之间突触传递强度的变化对于中枢神经系统的信息处理至关重要,离子型谷氨酸受体AMPA 受体介导了哺乳动物大脑中的大部分快速兴奋性突触传递。AMPA 受体可快速地插入以及移出突触后膜,这种动态转运方式被认为是突触可塑性、学习和记忆的主要机制[24]。GluA1 作为AMPA 受体亚基,存在于兴奋性突触的突触后膜中,参与突触可塑性调节,其表达异常是抑郁症、精神分裂症和慢性药物成瘾等精神疾病的常见机制[25]。本实验也证实了大鼠经4 周CUMS 后诱导的抑郁模型大鼠发病与mPFC 脑区GluA1 水平降低,从而影响突触可塑性。
研究发现,CB1 可能与谷氨酸能信号传导有关,在酒精依赖并抑郁症动物模型中,抗抑郁药治疗的中止会导致PFC 脑区CB1 受体表达下降以及谷氨酸受体GluN1、GluA1、和mGlu5 表达异常[26]。在大鼠青春期腹腔注射CB1 受体拮抗剂AM251 会导致谷氨酸受体亚基的表达异常,从而影响谷氨酸神经元的成熟[27]。 注射四氢大麻酚会导致大鼠脚桥核中AMPA 亚基组分的变化,以及引发长时程抑制(long term depression,LTD)作用,导致突触可塑性的变化,而此过程可被AM251 逆转[28]。然而尚未发现有报道阐明在抑郁症中CB1 如何影响谷氨酸能信号传导及突触可塑性。
综上所述,采用4 周慢性应激建立的抑郁症动物模型更加稳定。此外,本研究从基础研究的角度探讨mPFC 脑区中CB1 和GluA1 表达异常影响与慢性应激导致的抑郁相关,为今后抑郁症的研究和治疗提供了新的思路。
作者贡献度说明:
张宇昕:进行实验操作、数据收集处理及撰写文章;孙红梅:写作审查和监督;盖聪、程翠翠:数据分析;杨璐平、郭振宇、高誉珊:参与了实验的执行;胡蝶:负责提出实验方案、文章修改。所有作者都设计了实验、撰写了手稿并修改了论文。

