犬瘟热病毒感染雪貂的临床症状及其治疗探究
潘虹军,陈 杰,龚成燕,胡 博,白 雪,王全凯,赵建军
(1.吉林农业大学,吉林 长春 130118;2.中国农业科学院 特产研究所 农业部经济动物疫病重点实验室,吉林 长春 130122;3.黑龙江八一农垦大学,黑龙江 大庆 158308)
犬瘟热(Canine distemper, CD)是由犬瘟热病毒(Canine distemper virus, CDV)引起的一种难治愈、死亡率高的高度接触性传染病,临床症状以直肠温度升高、消化道和呼吸道感染为主要特征。CDV传播途径多样,传播范围广泛,报道的物种除犬科外,还包括猫科、鼬科、熊猫科、熊科等食肉目动物及猕猴等非人类灵长动物,甚至在人类的体内也检测到CDV的存在。有研究者认为犬瘟热可能成为人畜共患疾病,对公共卫生安全造成威胁,所以对CDV的研究愈发重要。
雪貂因对多种病毒性传染病易感性强、容易饲养、性格温顺而逐渐被用于实验动物。随后研究人员将雪貂陆续应用于生理、病理、毒理、药理的研究,但因雪貂特异性试剂而使其应用受到限制。雪貂对CDV高度易感,致死率高达100%。因此CDV感染雪貂模型常被用于CD的相关研究,von Messling等利用CDV 5804P株建立了CDV感染雪貂的毒力和免疫抑制模型,并发现基质、融合和血凝素蛋白基因是决定CDV毒力的重要因素。在此基础上,von Messling等构建了一种表达增强型绿色荧光蛋白(eGFP)的重组CDV毒株5804P-eGFP/H,并证明CDV V蛋白维持以淋巴细胞为基础粘膜组织和淋巴器官的快速侵袭,而CDV C蛋白维持随后的感染阶段。随后,他们通过替换野生型5804P和A75毒株的H蛋白,证明CD病程是主要由H蛋白的神经毒力决定。并以CDV 5804PeH质粒全基因组为基础构建了重组CDVs,证明了麻疹病毒M和F基因之间的区域通过转录控制F基因表达来调节毒力。
目前,接种疫苗的动物能有效控制CDV的感染和流行,但依然有因接种不及时或疫苗毒力残留所致的动物发病而死亡。因此,疫苗并不能完全保护集约化饲养或作为宠物的雪貂,需要探索一种动物感染CDV后的救治方案。由于CD是一种免疫抑制性传染病,且常引起混合感染及继发感染, 因此多采用抗病毒和消炎的方式治疗。李明浩等使用CDV单抗配合拜有利注射液、维生素B、B和科特壮使患CD的犬病情得到控制。王风莲等采用CDV抗体血清联合复方氨基比林、头孢曲松钠和开胃消食灵联合给药的方式治疗CDV感染发病的雪貂。
本试验使用雪貂为试验动物,5804P-eGFP/H作为接种毒株进行攻毒试验,对该毒株所产生稳定、发病明显的临床症状及CDV感染雪貂的治疗方法进行探究,为犬瘟热的早期诊断和后期治疗提供依据。
1 材料和方法
1.1 动物和毒株
安格鲁雪貂(),12只,2月龄,体重0.40~0.50 kg,购自中国江苏省无锡珊瑚生物科技有限公司,试验前CDV抗原和抗体检测结果均为阴性,试验在中国农业科学院特产研究所实验动物房进行。为保证动物福利,雪貂试验开始前将舒泰-50注射至后腿肌肉(10 mg/kg)将动物麻醉,减少动物痛苦。试验用CDV强毒5804P-eGFP/H株由德国Paul Ehrlich Institute(PEI)研究所Veronica von Messling教授惠赠。
1.2 主要试剂和仪器
TRIzol购自Thermo公司;Prime Script II 1st Strand cDNA Kit 反转录试剂盒、HS Ex Taq Premix reaction mix荧光定量PCR 试剂盒购自宝生物工程技术有限公司;EDTA-K2抗凝管购自洪达医疗器械集团有限公司;拜有利针剂(Baytril,100 mL)购自拜耳医药保健有限公司;舒泰-50(Zoletil-50)购买自法国维克制药有限公司;CDV多克隆抗体血清中和效价为1:64,由本实验室制备和保存;安乃近(2 mL)、盐酸肾上腺素(1 mL)、维生素B(2 mL)和B(1 mL)针剂购自新乡市华畜商贸有限公司,兽药产品批准文号分别为:兽药字(2016)163232505、兽药字(2016)163231220、兽药字163232797、兽药字163231406。
1.3 攻毒试验
攻毒试验参考文献[11],试验前禁食12 h,少量喂水;5804P-eGFP/H配置至105.0 TCID50/250 μL备用。动物分为试验组A、治疗组B和对照组,试验组A和治疗组B通过鼻内接种5804P-eGFP/H病毒液,对照组接种等量PBS;动物被麻醉后用移液器将病毒液缓慢滴入鼻腔,攻毒剂量250 μL/只。详细过程见表1。

表1 犬瘟热病毒攻毒试验
1.4 临床症状观察和评分
攻毒后每天观察、测量和记录所有出现的临床症状,并参照文献[17]进行分级评分,其中黑色为2分,花色为1分,白色为0分。详细评分标准见表2。综合症状分数=所有试验动物9种症状(直肠温度、体重变化率、精神状态、腹泻、食欲、结膜炎、鼻腔分泌物、呕吐和红疹)得分之和/试验动物数;体重变化率为检测体重/攻毒当天体重。

表2 临床症状评分标准
1.5 淋巴细胞数检测
试验组A于攻毒0 d、7 d、14 d使用颈静脉采血的方法,取雪貂全血放入抗凝真空采血管(EDTA-K2),抗凝血分离出淋巴细胞后用于淋巴细胞计数。
1.6 排毒检测
排毒通过鼻腔、眼角分泌物拭子和直肠拭子进行测定,每日采集拭子后于-20 ℃ 保存备用;使用TRIzol提取病毒RNA,cDNA的合成和荧光定量PCR试验过程参照文献[3],引物和探针序列由长春生工公司合成。
1.7 剖检观察
试验过程中病死动物或14 d 后存活动物安乐死,解剖后对脑、肝、脾、肺、肾、肠进行观察。
1.8 治疗试验
根据试验组A中临床症状种类和发病程度确定治疗时间和药品使用。试验起点为试验组A中临床症状明显发病且血液中淋巴细胞明显受到抑制时,试验终点为连续5 d未见发病和排毒,试验期间参照1.4对临床症状进行记录和评分。试验开始后每天清理眼、鼻分泌物,并使用高锰酸钾对环境进行消毒;所有药品在第1次使用前,均通过皮内注射0.1 mL药品的10倍稀释液进行皮试,观察是否有药品不良反应,治疗过程中根据临床症状适当调整药品使用,详细治疗过程见表3。其中盐糖饮用水为生理盐水:葡萄糖注射液:饮用水1∶1∶1混合,流食为盐糖饮用水与饲料混合。
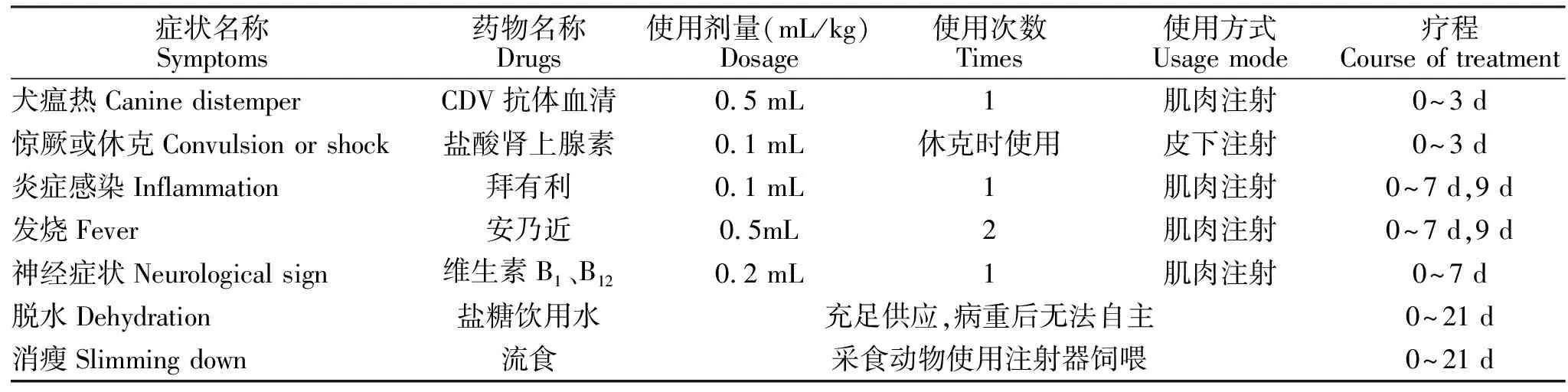
表3 犬瘟热治疗方案
1.9 统计学分析
2 结 果
2.1 试验组A临床症状汇总和评分
试验组A临床症状汇总结果见图1,雪貂体重从接毒后第6 d开始下降,变化率达5%,第8天超过10%,直到第14天未见体重明显的改变,与对照组差异显著(<0.05,图1A);直肠温度从接毒后第3天开始升高,第4 d超过39.2 ℃,第5天直到试验结束维持在39.5~40.0 ℃之间(图1B);在接毒后第6天,可见雪貂有轻微的结膜炎,随后眼鼻分泌物逐渐增加,9 d左右发现分泌物化脓(图1C);少量红疹在接毒后第8天开始出现,发病较轻且未扩散到全身(图1D);接毒后第3天开始发现部分动物有明显的食欲减退,7 d后动物出现食欲废绝,第9天左右发现抽搐、转圈等神经症状;接毒后第6 d发现动物腹泻,7 d发现部分动物呕吐,9 d出现便血现象。对照组动物正常,均未出现任何临床症状。试验组A临床评分结果和综合症状评分结果见图2,在感染过程中临床症状分数与试验时间成正比,综合症状分数在0~3 d、4~6 d、7~9 d、10~14 d分别为0.5、6、12.25、14。

图1 CDV感染发病雪貂的临床症状

图2 试验组A临床症状评分
2.2 剖检观察结果
组织器官的CDV试纸条的检测结果见图3,对照组为阴性,试验组A为阳性;试验组A动物的病理剖检结果见图4,肾脏肿大且有发炎现象,肝脏肿胀并有点状出血,肠体有明显带状和弥漫性出血,脑有充血现象,脾脏充血,肺脏红肿、充血。对照组脏器形态、颜色均正常。

图3 对照组(左)与试验组A(右)纸条检测结果
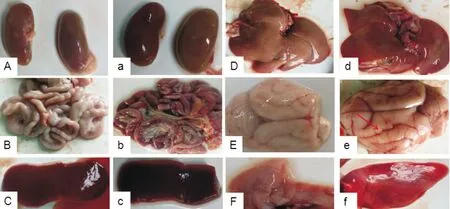
图4 雪貂感染CDV后组织剖检结果
2.3 血液中淋巴细胞分析结果
血液中淋巴细胞结果见图5,CDV感染后宿主体内免疫细胞受到抑制。试验组A淋巴细胞在攻毒后第7天明显减少,0~7 d从4 300 μL下降到2 200 μL,与对照组淋巴细胞数差异显著(<0.01)。
2.4 排毒检测结果
CDV病毒在宿主体内复制后经眼鼻和直肠排出。试验组A中眼鼻拭子和直肠拭子排毒结果见表4,整体变化基本相似,最早在接毒后第3天检测到CDV RNA,随后在眼鼻和直肠拭子中均能检测到病毒RNA直至试验结束。对照组眼鼻拭子和直肠拭子中未检测到CDV RNA。
2.5 血液中淋巴细胞分析结果
血液中淋巴细胞结果见图5,CDV感染后宿主体内免疫细胞受到抑制。试验组A淋巴细胞在攻毒后第7天明显减少,0~7 d从4 300 μL下降到2 200 μL,与对照组淋巴细胞数差异显著(<0.01)。
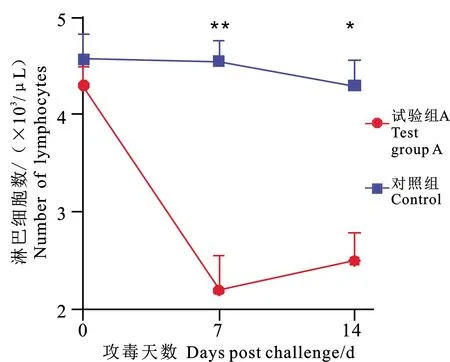
图5 淋巴细胞计数结果
2.6 排毒检测结果
CDV病毒在宿主体内复制后经眼鼻和直肠排出。试验组A中眼鼻拭子和直肠拭子排毒结果见表4,整体变化基本相似,最早在接毒后第3天检测到CDV RNA,随后在眼鼻和直肠拭子中均能检测到病毒RNA直至试验结束。对照组眼鼻拭子和直肠拭子中未检测到CDV RNA。
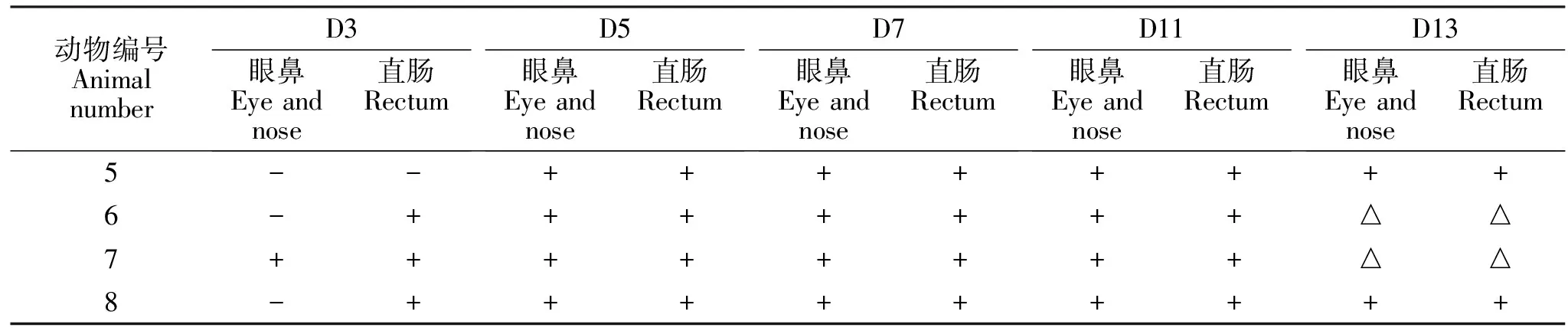
表4 拭子中病毒载量检测结果
2.7 犬瘟热的治疗
于攻毒后第9天对B组雪貂进行治疗,雪貂呈现不同程度的消化道症状(食欲减退或废绝、呕吐、腹泻、便血、脱水、消瘦),呼吸道症状(鼻腔分泌物、呼吸困难呈腹式呼吸),神经症状(抽搐、转圈),皮肤症状(少量红疹),眼睛症状(结膜红肿、分泌物增多化脓)和炎症反应(发热、继发性感染)等。首先保证治疗后每天对动物自身和生活环境进行彻底消毒,随后对犬瘟热临床症状进行观察和治疗。结果显示:治疗后1~3 d临床症状仍然较为严重,雪貂精神萎靡、食欲减退、呼吸困难、有较多的眼鼻分泌物、直肠温度高、排血便、瘦弱,参照表3针对性使用CDV抗体血清、拜有利、安乃近、盐酸肾上腺素、维生素B和B等针剂,密切观察雪貂休克现象,及时使用盐酸肾上腺素,避免因休克导致的死亡,同时对病重动物使用注射器进行盐糖水和流食的饲喂,在治疗的同时补充营养和水分;4~6 d雪貂精神状态稍有恢复,发热、呼吸困难等现象减轻,行动状态迟缓,所有雪貂均可自主采食,继续饲喂盐糖水和流食,停用CDV抗体血清和盐酸肾上腺素,其他治疗方案与0~3 d相同;7~10 d临床症状基本消失,尝试停止用药,开始饲喂正常饲料和饮用水,但9 d有一只雪貂发热,9 d当天再次进行治疗,治疗方案与4~6 d相同;11 d之后临床症状完全消失,于11~21 d对雪貂进行试纸条检测,结果见表5,检测结果均为阴性,期间未见临床症状复发,确认雪貂康复。

表5 治疗11 d后CDV试纸条检测结果
试验组B临床评分结果见图6,攻毒后7~9 d、治疗后0~3 d、4~6 d、7~10 d、11~21 d综合症状分数分别为11.25,13,9.25,1.25,0。从攻毒到治疗,除治疗后0~3相较攻毒后7~9 d得分稍有上升外,综合症状分数随着时间的增加而下降,直至降为0。

图6 治疗前后临床症状评分结果
3 讨 论
自20世纪50-60年代犬瘟热弱毒疫苗应用以来,犬等易感动物CD发病率大大降低,但仍有野生动物、宠物感染CDV而发病的报道。雪貂除用作某些疾病和药物的实验动物外,因雪貂生性活泼、外形可爱而成为一种新型高端宠物。在国内,将雪貂作为宠物的数量正逐渐上升,因此,对CDV感染雪貂发病程度的准确判断可为成功治疗提供有价值的参考。为了对试验雪貂的发病程度进行准确描述而便于诊断,本研究参考已有CDV感染雪貂的实验动物致病模型,以综合症状分数(动物症状得分之和/试验所用动物数)作为试验结果。在临床症状观察时发现CDV感染雪貂出现直肠温度上升、体重下降、结膜炎、精神状态、食欲减退、腹泻、鼻腔分泌物增多,这些明显可见的变化可作为临床评价指标。红疹等症状与von Messling等研究结果不同,试验中仅在2只动物腹部发现少量红疹,且持续时间短,具体原因仍需探究。在接毒后第0~3天临床综合分数较低,与接毒后第3天开始排毒的结果共同表明,此时虽然有病毒排出,但未对雪貂造成严重损伤。然而病毒经过进一步大量增殖,表现明显的临床症状。同时接毒后病毒持续抑制雪貂免疫系统,使其淋巴细胞数下降。与之相对应的感染雪貂病理解剖结果显示因CDV感染而导致的主要器官的炎症、肿胀等变化。本研究临床评分可以为诊断提供参考,通过外在临床综合表现可推断出病毒的感染情况。
为了找到控制CDV感染的有效措施,在临床症状评估的基础上,进一步对雪貂犬瘟热的治疗方法展开研究。在治疗过程中需对动物和环境进行清理和消毒,从而在一定程度上减少与病毒接触频率;饲喂的饲料为商品全价饲料,将其与盐糖混合水制成流食后可保证营养和水分的摄入。在治疗过程中,为避免药品对雪貂产生副作用,所有治疗性药物在使用前均需进行药物皮试。在治疗药物的选择上,对患犬瘟热的动物采取特异性治疗的方法可以提高其治愈率:犬瘟热的主要治疗包括CDV单克隆抗体及含有抗体的高免血清,两者均有不错的临床效果;在犬瘟热其他临床症状治疗中,对于雪貂的神经症状、惊厥和休克,使用盐酸肾上腺素针剂辅助治疗,同时使用维生素B和B营养神经;对于继发性感染引起的炎症,可选用氨苄青霉素、头孢菌素、喹诺酮类和磺胺嘧啶类等,拜有利通过阻断致病菌DNA合成从而达到抗菌消炎作用,其安全性较高,且对革兰阳性和革兰阴性菌均有较好的抑制效果;对于感染雪貂出现的直肠温度上升现象,柴胡、地塞米松、赖氨匹林、安宫牛黄丸和紫雪丹后具由不错的降温效果,但对于价格适中、快速退烧的要求,安乃近是最好的选择。
本研究成功治愈了典型CD临床症状均已出现,并且免疫系统受到明显抑制的雪貂,说明所采用的治疗方法可以有效消除体内的病毒对雪貂的致病作用,但本试验仅通过治疗后的临床症状评分对该治疗方案的效果进行评价,未对不同发病程度、不同年龄段的雪貂、不同给药梯度、不同药物之间的配伍禁忌做研究,同时未检测治疗期间雪貂的血常规、电解质、抗原、抗体和体内器官随时间的变化情况。接下来的试验将参考Krumm等,将攻毒后到治疗结束期间分成几个区段、选取不同年龄段的雪貂和不同给药浓度进行研究,并对雪貂的血常规、电解质、抗原、抗体、血液中药物浓度等进行检测,同时使用X光、B超、病理切片、免疫组化切片等病毒感染检查措施对体内器官进行检查,进一步探究此治疗方案中药物的最佳给药剂量和半数致死剂量,从而更准确的评价治疗方案对犬瘟热的影响。
4 小 结
本研究成功治愈了典型CD临床症状均已出现、并且免疫系统受到明显抑制的雪貂,说明所采用的治疗方法可以有效消除体内的病毒对雪貂的致病作用。但本试验仅通过治疗后的临床症状评分对该治疗方案的效果进行评价,未对不同发病程度、不同年龄段的雪貂、不同给药梯度、不同药物之间的配伍禁忌做研究,同时未检测治疗期间雪貂的血常规、电解质、抗原、抗体和体内器官随时间的变化情况。接下来还需对这些项目进行检测,同时结合X光、B超、病理切片、免疫组化切片等病毒感染检查措施对体内器官进行检查,进一步探究此治疗方案中药物的最佳给药剂量和半数致死剂量,从而更准确地评价治疗方案对犬瘟热的影响。

