尼可地尔通过NLRP3/Caspase-1通路对糖尿病心肌病大鼠心脏损伤的影响
王攀,彭菊琴,陈潇潇,刘哲,高云霄,刘建勋,任钧国
糖尿病心肌病(diabetic cardiomyopathy,DCM)为糖尿病心血管并发症,其发病机制复杂,其中炎性反应与其关系密切。高血糖可诱导多种炎性因子生成与释放,如核因子-κB和炎性小体[1-2]。据报道,高血糖会激活NLRP3炎性小体,从而促进pro-Caspase-1裂解为Caspase-1,裂解的Caspase-1一方面将白介素-1β前体(pro-interleukin-1β,pro-IL-1β)和白介素-18前体(pro-interleukin-18,pro-IL-18)转化为成熟的IL-1β和IL-18[3];另一方面切割消皮素D(GSDMD)的N端序列,促使大量成熟的IL-1β、IL-18释放到胞外,募集炎性细胞,扩大炎性反应,诱发细胞焦亡[4-5]。此外,炎性小体的激活和细胞因子的释放可促进胶原蛋白沉积和纤维化形成,进一步加剧DCM的严重程度[6]。因此寻找针对心肌细胞焦亡的有效药物,可以缓解DCM的进程。尼可地尔是一种已被确认具有临床意义的抗心绞痛药物,通过促进NO的释放和KATP通道开放引起血管舒张,增加冠状动脉血流量,减少血管痉挛,改善心功能[7-9]。最近的研究表明,尼可地尔可通过抑制心肌梗死大鼠细胞焦亡来减轻心肌损伤[10],但其是否能减轻DCM心肌细胞焦亡尚未见报道。现探讨尼可地尔对DCM大鼠心功能的保护作用及潜在的分子机制,为DCM的治疗提供更多的科学依据,报道如下。
1 材料与方法
1.1 材料 (1)动物:健康雄性Wistar大鼠,8周龄,体质量180~220 g,购自斯贝福(北京)生物技术有限公司,许可证号 SCXK(京)2019-0010。动物饲养于中国中医科学院西苑医院实验动物中心,温度 20~26℃,湿度 40%~70%,明暗12 h交替,自由摄食摄水。(2)药物及试剂:尼可地尔片(中外制药株式会社),链脲佐菌素(STZ,Sigma公司),柠檬酸、柠檬酸钠(国药集团化学试剂有限公司),大鼠IL-1β、IL-18检测试剂盒(FANKEW公司),Anti-NLRP3 抗体、Anti-Caspase-1 抗体、Anti-GSDMD 抗体(abcam公司),羊抗兔IgG H&L抗体(Bioss公司),RIPA蛋白裂解液、脱脂奶粉(雅酶公司),BCA蛋白定量试剂盒(南京建成生物工程研究所公司),PMSF、ECL Plus超敏发光液(Solarbio公司)。(3)仪器设备:高分辨率小动物超声仪(加拿大VisualSonics公司,型号Vevo 2100),高速冷冻离心机(Thermo公司,型号IEC CL31R),酶标仪(芬兰Labsystems Multiskan MS公司,型号352),超声破碎仪(美国Sonics公司,型号VCX130),化学发光仪(六一电器公司,型号WD-9423C),奥林帕斯显微镜(日本奥林帕斯公司,型号BX51)。
1.2 造模与分组 2020年10月—2021年1月在中国中医科学院西苑医院基础医学研究所进行实验,本研究经中国中医科学院西苑医院伦理委员会批准(2021XLC001-2)。24只健康Wistar大鼠随机选取8只常规饲料喂养(正常组);余16只给予高糖高脂饲料喂养(高糖高脂饲料:蔗糖10 % 、猪油10 %、胆固醇2.5 %、胆酸钠1 % 、普通饲料76.5 %),6周后,禁食不禁水10 h,腹腔注射STZ 30 mg/kg (用pH 4.2~4.5的枸橼酸缓冲溶液配制,现用现配),正常组注射同体积的枸橼酸缓冲溶液;注射 STZ 72 h后尾静脉采血测血糖,以空腹血糖≥16.7 mmo/L的大鼠为糖尿病模型复制成功,16只成模大鼠随机分为模型组8只、尼可地尔组(5 mg/kg)8只,继续高糖高脂饲料喂养,4周后开始给药,照尼可地尔组按照1 ml/100 g灌胃给药,正常组、模型组给予同体积的蒸馏水,每天灌胃1次,连续4周,第14周后实验结束,进行相关指标检测。
1.3 观察指标与方法
1.3.1 心功能测定:实验结束后,各组大鼠采用3.5%水合氯醛腹腔注射麻醉,胸部剃毛,仰卧位固定。当大鼠心率稳定时开始检测,以高频探头定位,在左心室长轴及胸骨旁短轴各切面应用M模式超声心动图观察心脏运动,选用左心室长轴切面计算左心室射血分数(left ventricular ejection fraction,LVEF)、左心室缩短率(fractional shortening,FS)、每搏输出量(stroke volume,SV),各项指标均选取连续3个心动周期测量值的平均值。
1.3.2 心肌组织形态学观察:每组随机选6只大鼠取心脏, 用预冷的等渗生理盐水洗净血迹,滤纸吸干,各取1块约3 mm3大小的左心室组织置于10% 中性福尔马林中固定,石蜡包埋,切片(4 μm),HE染色,脱水封片,显微镜下观察小鼠心肌组织的形态改变。
1.3.3 心肌纤维化程度测定:每组取6个石蜡包埋好的心肌组织切片(4 μm),经Masson染色,脱水封片。显微镜下观察小鼠心肌纤维化变化。采用图像分析软件Image-J 1.51统计胶原容积分数,胶原容积分数(%)=胶原阳性的蓝色面积/视野总面积×100%。
1.3.4 心肌组织NLRP3、Caspase-1蛋白表达测定:每组随机选3只大鼠各取左心室组织约50 mg置于冷冻管中,-80℃冰箱保存。检测时取出样本,冰上解冻后,加 RIPA裂解液(含PMSF)提取总蛋白,4℃,用超声破碎仪破碎组织,离心吸取上清,采用BCA法测定蛋白浓度并进行蛋白定量。然后制胶(10%分离胶,5 %浓缩胶)、上样(每样品孔上样30 μg总蛋白)、电泳、转膜、5 %脱脂奶粉封闭(室温轻摇60 min),5 %牛奶-TBST稀释一抗NLRP3、Caspase-1、GAPDH(1∶1 000,室温孵育15 min),4℃摇床过夜。第二天5 %牛奶-TBST稀释二抗(1∶1 000,室温轻摇60 min),TBST洗膜,ECL曝光并用化学发光仪拍摄照片。运用Image J 1.51软件分析条带,以目标蛋白灰度值/内参蛋白灰度值表示目标蛋白的相对表达量。
1.3.5 心肌组织GSDMD蛋白表达测定:每组取6个石蜡包埋好的心肌组织切片(4 μm),乙醇梯度脱蜡,抗原修复,10%BSA室温封闭1 h,滴加PBS稀释好的一抗GSDMD(1∶1 000),4℃孵育过夜,加入生物素标记的二抗,室温孵育1 h,DAB 显色,苏木素复染30 s,流水冲洗5 min,脱水封片,显微镜下观察并拍照,GSDMD蛋白阳性表达为棕色。采用Image J 1.51软件计算GSDMD蛋白表达的积分光密度值(IOD),用IOD表示GSDMD蛋白的表达水平。
1.3.6 血清IL-1β、IL-18水平测定:实验结束后,3.5%水合氯醛腹腔注射麻醉大鼠,腹主动脉取血,室温静置2 h后离心取上清,采用ELISA法检测血清IL-1β、IL-18水平,具体方法参照试剂盒说明书进行。

2 结 果
2.1 各组大鼠心功能比较 与正常组比较,模型组大鼠LVEF、FS、SV均降低(P<0.05);与模型组比较,尼可地尔组大鼠LVEF、SV均升高(P<0.05),FS差异无统计学意义(P>0.05),见表1。
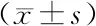
表1 各组大鼠心功能比较
2.2 各组大鼠心肌组织形态学比较 正常组大鼠心肌结构完整,肌纤维排列整齐,形态正常,间质未见充血、出血,未见明显炎细胞浸润;模型组大鼠心肌纤维排列紊乱,肌间隔增宽,灶性水肿变性,间质充血、出血,中等量炎细胞浸润;尼可地尔组大鼠心肌纤维排列较规整,纤维束间隔增宽不明显,心肌细胞水肿变性偶见,间质轻度充血、水肿,少量炎细胞浸润,见图1。
图1 各组大鼠心肌组织形态学比较(HE染色,×200)
2.3 各组大鼠心肌纤维化程度比较 正常组大鼠心肌纤维束排列整齐,无胶原纤维沉积;模型组大鼠心肌纤维束排列不规则,且存在大量胶原纤维沉积;尼可地尔组大鼠心肌纤维束排列明显改善,胶原纤维沉积显著降低,心肌纤维化明显减轻,见图2。与正常组(12.83±3.97)%比较,模型组胶原容积分数(30.00±7.62)%升高(t/P=4.896/0.001);与模型组比较,尼可地尔组胶原容积分数(21.67±5.57)%降低(t/P=2.163/0.036)。

图2 各组大鼠心肌纤维化程度比较(Masson染色,×200)
2.4 各组大鼠心肌组织NLRP3、Caspase-1及GSDMD蛋白表达水平比较 与正常组比较,模型组大鼠心肌组织NLRP3、Caspase-1、GSDMD蛋白表达水平均升高(P<0.05);与模型组比较,尼可地尔组大鼠心肌组织NLRP3、Caspase-1、GSDMD蛋白表达水平均降低(P<0.05),见表2。
表2 各组大鼠心肌组织NLRP3、Caspase-1 、GSDMD蛋白表达水平比较
2.5 各组大鼠血清IL-1β、IL-18水平比较 与正常组比较,模型组大鼠血清IL-1β、IL-18水平升高(P<0.01);与模型组比较,尼可地尔组大鼠血清IL-1β、IL-18水平降低(P<0.01),见表3。
表3 各组大鼠血清中IL-1β、IL-18水平比较
3 讨 论
DCM为糖尿病心血管并发症,其特征是在没有高血压、冠状动脉疾病和其他心脏病情况下的结构异常和功能障碍,主要体现在心肌纤维化、心肌肥厚、舒张功能或收缩功能障碍等[11-12]。目前,DCM是糖尿病所有并发症中死亡的主要原因[13],其发病机制复杂,尚未明确。本研究采用高糖高脂饲料联合腹腔注射STZ的方法建立DCM大鼠模型,通过焦亡相关信号通路NLRP3/Caspase-1来探讨尼可地尔对DCM大鼠心功能的影响及潜在机制。本结果显示,模型组大鼠表现出心肌细胞水肿、心肌纤维化明显及心功能低下特点,符合DCM的主要特征,并与文献中DCM大鼠模型(模型建立方法与本研究相同)的表现一致[14-15],提示该模型建立成功。Wang等[16]研究发现,尼可地尔对DCM有重要的保护作用,可通过抑制DCM心脏纤维化和凋亡直接缓解心脏重构,改善心功能,此外还能促进eNOS活性,释放NO,其机制与激活PI3K/Akt通路有关。
本研究中,给予尼可地尔后,DCM大鼠心肌细胞水肿减轻,炎性细胞浸润面积、心肌纤维化面积减少,且心功能(LVEF、SV)明显升高,提示尼可地尔有效改善了DCM大鼠的心肌重构及心功能。
DCM期间心肌细胞的终末途径是细胞死亡,因此抑制细胞死亡信号通路显然是DCM的潜在治疗靶点。在形态学上,细胞死亡可分为4种不同的形式,包括凋亡、自噬、坏死和吞并。此外,还存在一些其他类型的细胞死亡,如铁死亡、溶酶体依赖性细胞死亡等,这些可能都与DCM相关[17]。近年来研究发现,焦亡是程序性坏死的一种新形式,与细胞凋亡不同,其本质是细胞的炎性反应性死亡,是心肌细胞丢失的机制之一[18]。细胞焦亡的特征是孔隙形成、质膜破裂和细胞肿胀[19]。据报道,细胞焦亡参与了DCM的发展[20-21],在高糖刺激下,炎性小体NLRP3激活,进而促进pro-Caspase-1裂解,裂解的Caspase-1一方面促进炎性因子前体pro-IL-1β和pro-IL-18转化为成熟的IL-1β和IL-18,另一方面切割GSDMD的N端序列,促进细胞裂解,释放大量成熟的IL-1β、IL-18,诱发细胞焦亡[3-5]。本研究结果显示,模型组大鼠心肌组织中NLRP3、Caspase-1、GSDMD蛋白表达水平明显高于正常组,且血清IL-1β、IL-18也明显高于正常组,再次证实与炎性反应相关的细胞焦亡参与了糖尿病诱导心脏损伤的发病机制[20-21]。尼可地尔作为常用的抗心绞痛药物,可以对冠状动脉产生积极的扩张作用、增加血流量、抑制冠状动脉痉挛,减轻心绞痛,还能对部分濒死的心肌进行挽救,降低心血管事件的发生[8-9],但其是否能通过抑制DCM细胞焦亡来减轻心脏损伤尚未报道。本研究结果显示,给予尼可地尔干预后,DCM大鼠心肌组织中NLRP3、Caspase-1、GSDMD蛋白表达水平明显降低,且血清中IL-1β、IL-18水平也明显降低,提示尼可地尔可能通过抑制焦亡信号通路NLRP3/Caspase-1来减轻DCM心脏损伤。
综上所述,尼可地尔可能通过抑制焦亡相关信号通路NLRP3/Caspase-1来抑制炎性因子的释放,进而抑制心肌重构和心肌纤维化,改善心功能。本研究为丰富DCM细胞死亡的研究及未来DCM新的疗法奠定了基础。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王攀:设计研究方案,实施研究过程,论文撰写及修改;彭菊琴、陈潇潇、刘哲:实施研究过程,资料搜集整理;高云霄:进行统计学分析;刘建勋:论文修改;任钧国:设计研究方案,提出研究思路,论文审核

