miR-155在急性胰腺炎中相关作用研究进展
郝逸飞综述 李之拓审校
急性胰腺炎(acute pancreatitis, AP)是最常见的胃肠道疾病之一,需要急诊入院治疗,然而,急性胰腺炎引起器官衰竭的发病机制尚未完全阐明,因此目前也并无针对急性胰腺炎的特效治疗方法。目前猜测早期干预以减少全身或局部炎性反应可能是改善急性胰腺炎预后的有效治疗方法[1]。 miR-155是一种与炎性反应相关的多功能miRNA,由不同类型的炎性介质调节,在AP患者的外周血及淋巴液中表达上调,表明miR-155在AP的发病机制及进展中可能有其独特的作用。近年来越来越多研究分析miR-155在胰腺炎发病机制及进展中的调节作用,笔者现就miR-155 在AP中的作用研究进展作一综述。
1 miR-155概述
1.1 MicroRNA 微小核糖核酸(microRNA,miRNA)是小的非编码核糖核酸分子,通过调节目标信使核糖核酸(mRNA)转录物的稳定性或活性来控制基因表达[2-3],每个miRNA被转录后加工成包含2条链的双链体。在动物中,miRNA双链体的每一条链长度都在21~22个核苷酸范围内[4],在miRNA链选择的过程中,2条miRNA链中的一条被选择性地装载到Argonaute蛋白中,以形成miRNA诱导的沉默复合物(miRISC);另一条链从复合物中弹出,并被降解。miRISC的靶基因特异性是由装载精氨酸的miRNA链和靶mRNA之间的序列互补性决定的。miRNA双链体的每一条链都有能力被装载到miRISC中,并拥有一个独特的种子序列[5]。它们通过与靶mRNA的3'-非翻译区 (3'-UTR) 结合来调节基因表达,从而促进 mRNA 降解或抑制其翻译。因此,miRNA链的选择在决定miRNA对其目标的功能方面起着决定性作用,并提供了一种以开关样方式改变基因表达的机制。异常的链选择可导致miRISC基因调控的改变,并在包括癌症在内的多种人类疾病中观察到[6-8]。
1.2 miR-155 miR-155由miR-155-5p和miR-155-3p组成,是从位于21号染色体的B细胞整合簇(BIC)基因(现命名为miR155宿主基因或miR155HG)加工而来。miR-155-5p在活化的B细胞、T细胞及单核细胞/巨噬细胞中高度表达。
miR-155是最具特征性的miRNAs之一,最早作为巨噬细胞引起炎性反应的因子,此后越来越多研究发现miR-155具有与炎性反应相关的调节功能。研究报道,在激活的巨噬细胞外泌体中miR-155表达上调,而富含miR-155的外泌体能够明显促进成纤维细胞的炎性反应[7]。在另一项研究中,miR-155缺失的小鼠的肝脏Kupffer细胞可免受酒精诱导的脂肪变性及炎性反应影响,且巨噬细胞的分型相较于同条件下的正常小鼠发生了明显改变,证明了miR-155可以促进骨髓来源巨噬细胞的M1表型[8-9]。
2 miR-155在AP发病机制及进展中的作用
急性胰腺炎在高收入国家每年发生率为34/10万[10]。该疾病的特征是局部和全身炎性反应,并具有不同的临床病程。急性腹痛伴血清淀粉酶升高是其主要临床表现,根据其是否有持续性的器官功能衰竭可分为轻症急性胰腺炎(mild acute pancreatitis, MAP)、中重症急性胰腺炎(moderately severe acute pancreatitis, MSAP)和重症急性胰腺炎(severe acute pancreatitis, SAP)。大多数患者为轻度急性胰腺炎,具有自限性,通常在1周内消退。大约20%的患者发展为中度或重度急性胰腺炎,伴有胰腺或胰周组织坏死或器官衰竭,或两者兼有,病死率为20%~40%[11-13]。然而,AP引起器官衰竭的发病机制尚未完全阐明,因此目前也并无针对AP的特效治疗方法。
2.1 通过SOCS1调节Th17/Treg比例 急性胰腺炎时胰腺自身消化引起的细胞损伤诱导可以产生白介素-17的CD4+T辅助细胞(Th17)积累,刺激炎性反应[14]。调节性T细胞(Treg)是CD4+T细胞亚群之一,其主要分泌特异性表达叉状头转录因子,具有免疫抑制作用,通过分泌IL-10、IL-4等细胞因子维持体内免疫环境的稳定[15]。Th17细胞和Treg细胞的分化过程是相互拮抗的,在机体正常状态下,二者通过免疫网络保持抗炎—抑炎平衡,当机体损伤时,抗炎—抑炎的平衡被打破,对机体免疫起负调节作用,Th17细胞与Treg细胞比例失衡与各种自身免疫性和炎性疾病有关[16-19]。Th17/Treg细胞比例的增加导致细胞因子水平的显著升高,进而通过Janus激酶(JAK)信号转导子和转录激活子(STAT)途径转导信号[14]。据报道,细胞因子信号抑制因子(SOCS)蛋白家族以JAK/STAT途径为靶点调节炎性反应[20],这些信号分子之间的相互关系复杂,不同的SOCS蛋白针对不同的STAT调节剂,反过来影响不同的细胞因子,从而导致不同的结果[14]。已有文献确认miR-155通过调节SOCS1影响重症急性胰腺炎肺损伤,且SOCS1可以通过STAT5来调节Treg细胞数量[21-22]。研究表明miR-155在促进CD8+T细胞免疫中起重要作用,miR-155及其靶SOCS-1是影响CD8+T细胞的关键调节因子,发现miR-155通过调控SOCS1的表达,影响JAK/STAT途径。另一项研究报道了重症胰腺炎患者外周血中miR-155水平与Th17/Treg水平呈正相关[23]。最终,Wang等[14]通过实验证明了在AP中miR-155通过靶向SOCS1调节JAK/STAT通路来调控Th17/Treg细胞比例,进而导致组织炎性反应。最近一项研究显示,一种具有强效抗炎作用的树精香(Mastiha)的抗炎机制似乎也与此有关[24]。
2.2 通过Rictor调节自噬 细胞自噬是将细胞内受损、变性或衰老的蛋白质及细胞器经自噬体运输到溶酶体进行消化降解的过程。适度的自噬有利于维持细胞乃至生物体的稳定。然而研究发现在多种病理状态下存在自噬功能障碍,甚至在某些情况下,自噬异常能导致疾病的发生或进展。胰腺中特异性敲除自噬体形成关键因子自噬相关蛋白(autophagy-related protein,ATG)5、ATG7的小鼠会出现自发性胰腺炎,并伴随胰蛋白酶原活化、纤维化、炎性反应、腺泡导管化生及腺体萎缩[25-26]。
mTOR是自噬的主要细胞内阻遏物,由PI3K/AKT途径正向调节,PI3K/AKT/mTOR途径调节的自噬在胰腺炎胰腺组织纤维化中起着至关重要的作用[27-28]。一项研究中,研究者用生物信息分析软件推测出Rictor蛋白(与mTOR同为mTORC2蛋白质复合物的组成部分)是miR-155的推定靶标,而后便大胆的假设了miR-155可能通过靶向Rictor来调节AP中胰腺细胞的自噬。实验证明,在雨蛙肽建立的胰腺炎模型中miR-155过表达,并出现自噬受损;而miR-155沉默的细胞中自噬损伤减轻。又通过蛋白印迹分析证明miR-155的过表达抑制PI3K/AKT/mTOR信号通路并降低Rictor表达[29]。该研究证明了miR-155是通过靶向mTORC2中的Rictor来调节PI3K/AKT/mTOR信号通路从而影响AP中的自噬受损。
2.3 通过Rela/Traf3调节NF-κB通路 在以往几乎所有有关miR-155与AP相关的研究中,研究者发现在AP整个病程中,外周血中的miR-155均呈上调趋势[14, 29]。而Liu等[30]在2018年报道的一项研究中却从不同的角度得到了不太一样的结果。该项研究中,研究者建立了MAP和SAP的小鼠模型,从外周血中分离出血清进行阵列分析后发现,在MAP小鼠的外周血中,miR-155-5p表达下调约17倍;而SAP小鼠的外周血中miR-155-5p表达下调约20倍。miR-155-5p被证明在AP患者的外周血中表达下调,且与AP的严重程度呈负相关。该研究中,还推定Rela与肿瘤坏死因子受体相关因子3 (Traf3)是miR-155-5p的靶标。
NF-κB转录因子家族包含5个成员,包括p50、p52、p65 (Rela)、Relb和c-Rel,在广泛的生理过程如炎性反应、免疫反应、细胞增殖、细胞分化、细胞自噬和凋亡中发挥重要作用。Traf3可以通过经典和非经典2种不同的机制调节NF-κB信号通路,从而参与一系列生理反应。已有文献证明,miR-155-5p过度表达可以通过激活NF-κB信号通路,促进干扰素-γ(IFN-γ)刺激唾液腺上皮细胞的凋亡和炎性反应,抑制人蜕膜基质细胞的凋亡[31-32]。研究证实miR-155-5p靶向Rela与Traf3并通过NF-κB信号通路反向调节AP的进展。并且用该成果成功地治疗了小鼠实验性急性胰腺炎,证明miR-155-5p可能成为治疗急性胰腺炎患者的有效方法[30]。
2.4 通过RhoA调节肠黏膜屏障功能 肠黏膜屏障功能障碍,组织学上表现为肠黏膜层上皮细胞的坏死和脱落,会导致内毒素血症和多器官衰竭,与重症胰腺炎患者的不良预后密切相关,被认为是SAP进展的主要原因,但肠黏膜屏障功能障碍在SAP中的发生机制仍然有待研究。
肠黏膜屏障由位于顶端连接复合体(AJC)的一层交联高分化上皮细胞组成。AJC可以维持上皮细胞极性,缩小上皮细胞之间的间隙,降低上皮通透性,故而也可防止肠毒素、病原体和其他外源性物质通过上皮层进入黏膜下组织和循环,被认为是维持肠屏障和防止肠内毒素血症的主要结构,其损伤可导致肠屏障功能障碍。RhoA属于Rho家族的小GTP蛋白,是AJC表达的主要调节因子。RhoA促进AJC的形成和稳定,RhoA的低表达通过阻断TJs和AJs的蛋白质合成导致AJC的破坏。一项研究报道,RhoA基因在3’UTR区域包含3个miR-155特异性结合位点,被确定为miR-155的可能靶基因之一。这提示miR-155可能通过RhoA影响AP中的肠黏膜屏障功能,从而调节AP的病程进展。随后研究者建立了SAP小鼠模型并与对照组对比发现,miR-155在SAP组小鼠肠上皮细胞中显著过表达,SAP组小鼠出现明显的肠上皮损伤,而RhoA mRNA在SAP组和对照组小鼠的肠上皮细胞中表达无明显差异,但在2组小鼠肠上皮细胞中RhoA蛋白表达却存在明显差异,SAP组小鼠肠上皮中的RhoA蛋白表达显著下调[33]。由此可总结出miR-155在AP向SAP进展中的作用机制:过度的炎性反应导致炎性细胞因子(如肿瘤坏死因子-α)的过度释放,并诱导肠上皮中miR-155的过表达。过表达的miR-155通过调节RhoA基因转录后的蛋白翻译来抑制RhoA蛋白合成,并下调AJC的2个主要组成蛋白,导致肠黏膜屏障功能障碍,发展出内毒素血症和多器官衰竭,最终使AP的病程进展。
3 miR-155的临床应用研究
急性胰腺炎作为严重威胁人类健康及生命安全的一种疾病,既没有合适的药物或方法进行特异性治疗,也没有充足治疗窗口期让临床医生进行充分的临床干预,患者预后往往较差。SAP则更是如此,甚至经常危及患者的生命。因此,开发良好的病情及预后预测指标及揭示AP发病机制,探究有效的治疗靶点对AP的治疗前景至关重要。
3.1 新的预后标志物 近年来miRNA被证实在人体的各种生理功能及多种疾病发生中起到广泛而重要的调控作用,因而成为生物医学领域的研究热点。一项研究中报道在不同组AP模型小鼠的外周血中观察到64种不同的miRNA出现表达的显著差异。其中,随着病情严重程度的进展,有34种miRNA表达上调,30种miRNA表达下调,而miR-155为变化幅度最大的几种miRNA之一,有潜力成为临床上预测AP严重程度及预后好坏的标志物[30]。
3.2 新的治疗靶点 目前临床上并无针对AP的特效治疗方法,通常使用抗生素及生长抑素等进行对症、支持治疗。最近一项研究报道miR-155通过TLR4/NF-κB通路调节炎性因子,从而损伤了肠黏膜屏障,证明丙泊酚治疗可抑制miR-155、TLR4/NF-κB的表达,逆转炎性反应[34]。另有研究表明,对重症胰腺炎患者应用益生菌联合早期肠内营养治疗,可以减轻肠道菌群失调、肠道黏膜屏障损伤,减少肠道内毒素释放入血,降低外周血miR-155水平[35]。另一项研究显示,一种仅产自希腊希俄斯岛的具有显著抗炎作用的树精香(Mastiha)也是通过调节miR-155的表达来实现其抗炎作用[24],而医学上仍存在较大争议的白藜芦醇近来也被证明有抑制miR-155表达及抗炎作用。目前针对AP特效药物的研究仍较少,有待进一步发掘。
4 今后研究方向
4.1 miR-155-3p与miR-155-5p功能细化研究 在以往近乎所有有关miR-155与AP相关的研究中均提出外周血中miR-155呈上调趋势[14, 29],而另一项研究却报道了AP小鼠中miR-155-5p在外周血中表达明显下调[30]。miR-155的2条链分别来自pre-miRNA的3’和5’端,也因此将其命名为5p/3p链,且2条链各有其独特的功能[4-5]。在生物中,所有的miRNA的5p链与3p链都是同时存在和表达的,且生理情况下5p/3p的比率会维持在一个比较固定的数值[36- 37],病理条件下5p/3p失衡与总体数量变化都是病程发展的影响要素。
miR-155-5p已经被证明可以靶向Rela与Traf3并通过NF-κB信号通路来影响AP的发生与进展。而目前也有研究证实miR-155-3p在许多疾病中有其独有的调节作用,例如miR-155-3p靶向Kctd1以部分激活规范Wnt信号通路来调节牙骨质细胞分化而在牙周炎中起到调控作用,通过Sp4转录因子参与双相情感障碍中的锂反应,以及通过抑制KDM3A和HIF1α来改善椎间盘退化等[38-40]。
在现今的研究中,尚未完全明确miR-155-5p和miR-155-3p各自的变化趋势与起到的作用。相信针对该方面的研究可进一步了解AP发病及重症化的机制,将研究推向一个更加细致的层面。
4.2 细胞焦亡与坏死性凋亡——AP发病机制的新方向 细胞焦亡(pyroptosis)又称细胞炎性坏死,是炎性细胞(如巨噬细胞)中依赖炎性半胱天冬酶(如Caspase-1,4,5,11等)的一种程序性细胞死亡形式。其形态学特征、发生及调控机制等均不同于凋亡、坏死等形式。
过去研究者们认为坏死性凋亡在胰腺炎中起到重要作用,使用抑制坏死性凋亡的坏死稳定素(RIP)可以拯救胰腺炎中超过50%的腺泡细胞死亡[41]。但近期一项关于胰腺炎中细胞焦亡作用的研究中,研究者发现AP中死亡的腺泡细胞大部分出现焦亡,且可被特异性含NLR家族Pyrin域蛋白3(NLRP3)和半胱氨酸天冬氨酸特异性蛋白酶1(Caspase-1)抑制剂抑制,或是通过敲除焦亡相关基因来起到保护作用[42]。2项研究采取保护措施后,胰腺炎腺泡细胞死亡率下降到相同的水准。在前一项实验中,同时使用RIP1和广泛Caspase抑制剂ZVAD时,腺泡细胞死亡率与只使用RIP1时比较没有明显变化。而后一项实验中得到的结果却是与RIP3抑制剂相比,焦亡相关Gastermin D(GsdmD)蛋白基因缺失在降低胰腺炎中细胞死亡的作用更为显著。结果存在分歧的原因可能有:(1)前一项实验较早,对胰腺炎中死亡的腺泡细胞只简单的按坏死性凋亡和凋亡分类,未考虑到焦亡等其他细胞死亡方式;(2)实验中使用的坏死稳定素、特异性NLRP3和Caspase-1抑制剂可能存在脱靶效应,影响其他细胞死亡途径;(3)不能排除细胞焦亡和坏死之间存在潜在的关联,例如,在人类细胞系中,MLKL离子通道的形成可导致NLRP3炎性反应小体以细胞内在方式激活。因此,可以大胆猜测在胰腺炎发生时两者共同发生作用,在其中之一受到抑制时,另一者也被抑制。
坏死与焦亡在胰腺炎中的角色,具体的作用机制在未来胰腺炎的特异性治疗中占据至关重要的位置,但其中的争议仍待探索。目前已有实验证明,miR-155在牙周炎中通过调节SOCS1、Caspase-11、Caspase-1和NLRP3的表达,促进牙龈假单胞菌刺激的巨噬细胞的焦亡[43]。也有报道蛋氨酸硒通过miR-155/TRAF3/ MAPK轴拮抗LPS诱导的鸡肝细胞坏死凋亡,沙门氏菌诱导的miR-155可通过靶向RIP1/3增强巨噬细胞中坏死性调亡[44-45]。证明miR-155在2种细胞死亡方式中都扮演着重要的角色,在未来的AP研究中仍拥有巨大的潜力。
5 结 语
综上所述,目前的研究已经证实miR-155在AP的发病机制及病程进展中扮演了一个独特且重要的角色(见图1);而且在预后标志物、治疗靶点和细胞焦亡与坏死性凋亡等方面都还有很大的研究潜力。相信随着研究的深入,miR-155与AP的紧密联系会不断明晰,在未来很可能会成为AP的有效治疗靶点及预后标志。
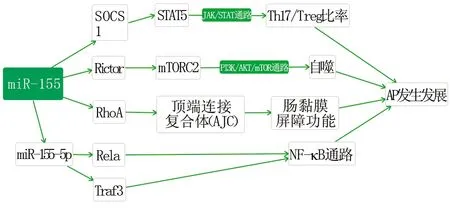
图1 miR-155在AP发病机制及病程进展中的演变过程

