鲢蛋白酶解物理化特性及其对益生菌增殖的影响
黄馨柔,张慧娟,王 凯,罗永康
鲢蛋白酶解物理化特性及其对益生菌增殖的影响
黄馨柔,张慧娟,王 凯,罗永康
(中国农业大学食品科学与营养工程学院,北京 100083)
【】探究不同酶解方式所得的鲢()鱼肉蛋白酶解物的理化特性及对鼠李糖乳杆菌()、动物双歧杆菌()的潜在益生元活性。分别用复合酶Ⅰ(中性蛋白酶、碱性蛋白酶活性比1∶1)和复合酶Ⅱ(中性蛋白酶、碱性蛋白酶、风味蛋白酶活性比1∶1∶0.5)水解鲢鱼肉,获取不同酶解时长的酶解物,测定其水解度、分子质量分布和感官评价,经胃肠模拟消化(GID) 处理后添加于培养基中培养两种益生菌,测定培养基的浊度。用复合酶Ⅱ水解4 h所得鲢鱼酶解物的水解度(DH)显著高于复合酶Ⅰ(<0.05),可达27.2%。感官评价分值中,复合酶Ⅱ酶解产物的苦味分值比复合酶Ⅰ高。经模拟消化后,蛋白肽的小分子肽(<2 ku)组分比例超过90%。与空白组相比,该酶解物经胃肠模拟消化后按5 g/L剂量添加至益生菌培养基时,能显著促进益生菌在对数期的生长繁殖(<0.05)。5 g/L模拟消化产物对鼠李糖乳杆菌和动物双歧杆菌的生长繁殖均有促进作用,鲢鱼肉蛋白酶解物有作为益生元的潜质。
鲢;酶解产物;水解度;分子质量分布;益生菌
鲢()是我国淡水养殖产量第二大的鱼种[1],其肉质鲜嫩,蛋白含量高,但因肌间刺多、土腥味重等,通常加工为附加值低的鱼糜及鱼糜制品。长期以来,我国水产加工品竞争力弱、精深加工比例低[2]。鱼类蛋白肽是精深加工的高价值新型加工品,已成为近年来的研究热点。鲢鱼肉经过单蛋白酶或多蛋白酶酶解,所得的蛋白肽有不同的生物活性:其蛋白多肽有抗氧化[3],低温保护[4],调节人体血糖[5]、血压[6]等多种功能,因而有营养补充剂开发前景。目前,常用益生元多为低聚糖类[7]、多糖类[8]、植物活性物质[9]。近年已有蛋白肽益生作用的报道,如有肠道菌群调节作用的蛋清肽[10]、可促进罗伊氏乳酸杆菌LR08 ()生长繁殖的大豆蛋白肽[11]、可特异性增加大鼠肠道内鼠李糖乳杆菌()含量的乳清蛋白肽[12-13]等,因此蛋白肽有被开发为新型益生元的潜力,但目前对于鲢蛋白肽的潜在益生元活性研究未见报道。本研究采用两种复合酶酶解鲢鱼肉,制备酶解产物,分析酶解产物水解度、感官指标及分子质量分布,通过模拟消化方式获得不同水解物的模拟消化产物,并作用于鼠李糖乳杆菌()、动物双歧杆菌(),分析模拟消化产物对益生菌的增殖作用影响,为鲢鱼肉蛋白肽的益生活性研究提供参考。
1 材料与方法
1.1 材料
鲢,购自北京健翔桥农贸市场,充氧活运至实验室;鼠李糖乳杆菌LGG()、动物双歧杆菌Bb12(),由北京银河路经贸有限公司提供;中性蛋白酶(31 890 U/mL,pH 6.40,50 ℃)、碱性蛋白酶(227 980 U/mL,pH 6.40,50 ℃)、风味蛋白酶(37 140 U/mL,pH 6.40,50 ℃),购于诺维信(中国)生物技术有限公司。邻苯二甲醛购于上海麦克林生化科技有限公司,乙腈购于Fisher Scientific。MRS肉汤培养基(De Man Rogosa and Sharpe Broth)购于北京索莱宝科技有限公司。
1.2 仪器设备
P4紫外分光光度计,上海美谱达仪器有限公司;DGU-20A3R(C) 高效液相色谱仪,日本岛津公司;TSK gel G2000 SWXL凝胶柱(7.8 mm × 300 mm),日本东曹株式会社;Supermax 3000FA酶标仪,上海闪谱生物科技有限公司。
1.3 方法
1.3.1 鲢鱼鱼肉酶解产物的制备 取鲢鱼片,去皮,用绞肉机绞碎,将肉、蒸馏水按质量比1∶2混合,经90 ℃水浴20 min后,得肉糜液。肉糜液在50 ℃、1 g蛋白总酶活性5 000 U的条件下进行酶解。复合酶中各种酶按酶活性比例混合:复合酶Ⅰ,碱性蛋白酶、中性蛋白酶活性比1∶1;复合酶Ⅱ,碱性蛋白酶、中性蛋白酶和风味蛋白酶活性比1∶1∶0.5。分别在酶解0、15、30、60、120、180、240 min时取样,以90 ℃水浴20 min,于4 ℃下静置12 h,去除上层脂肪,样品以10 000条件离心10 min,取上清液,冻干,低温干燥保存备用。
1.3.2 水解度(DH)测定 参照Spellman等[14]方法测定DH(%)。配制0.5 mg/mL的蛋白酶解物溶液,将150 μL样品与3 mL OPA溶液(含0.05 mol/L四硼酸钠、10 mg/mL十二烷基硫酸钠、体积分数0.2%-巯基乙醇、0.8 mg/mL邻苯二甲醛、体积分数2%无水乙醇)混匀,室温避光条件下反应3 min,于340 nm处测定光密度值,采用0 ~ 4.0 mmol/L的苯丙氨酸标准溶液绘制标准曲线,计算氨基氮含量。
水解度=(-0)/×tot,
其中,为水解后氨基氮浓度(mmol/L),0为水解前氨基氮浓度(mmol/L),为样品质量浓度,tot为样品肽键质量摩尔浓度(mmol/g)。
1.3.3 感官评价 参照王雨生等[15]方法进行。感官评价小组由年龄21 ~ 30岁的12名成员组成,评估根据水解度挑选出的7种鲢鱼肉酶解产物风味特征。12名评价员对样品进行预评估,从而确定描述词。因产品冻干粉复溶后的溶液颜色会影响感官评价结果,故溶液颜色一并评价。评分标准见表1。

表1 鲢鱼鱼肉酶解产物感官评价评分标准
1.3.4 分子质量分布测定 参照Qin等[16]方法进行。用高效液相色谱测定鲢鱼肉酶解产物及其模拟消化产物的分子质量。流动相为含体积分数0.1%三氟乙酸和体积分数45%乙腈的超纯水,样品质量浓度为2 mg/mL,进样前由孔径0.22 μm滤膜过滤,分析柱型号TSK gel G2000 SWXL(7.8 mm I.D.× 30 cm)。检测条件:流动相流速0.5 mL/min,进样量25 μL,柱温25 ℃,检测波长220 nm。通过测定低聚肽标准品,建立保留时间与分子质量的标准曲线。
1.3.5 模拟消化 参照Brodkorb等[17]等方法进行。取2.0 g样品,加入2 mL口腔相模拟消化液,于37 ℃水浴震荡2 min,随后加入4.0 mL胃相模拟消化液,并用5 mol/L盐酸调节pH至3.0,加入酶活性为16 000 U的胃蛋白酶以模拟胃消化,摇匀,于37 ℃水浴震荡2 h。胃消化结束后,加入8.0 mL肠相模拟消化液,用5 mol/L NaOH调节pH至7.0,加入酶活性为1 600 U的胰蛋白酶及160 mmol的胆盐,摇匀,于37 ℃水浴震荡反应2 h,沸水浴5 min终止反应,产物冰浴冷却,冻干保存。
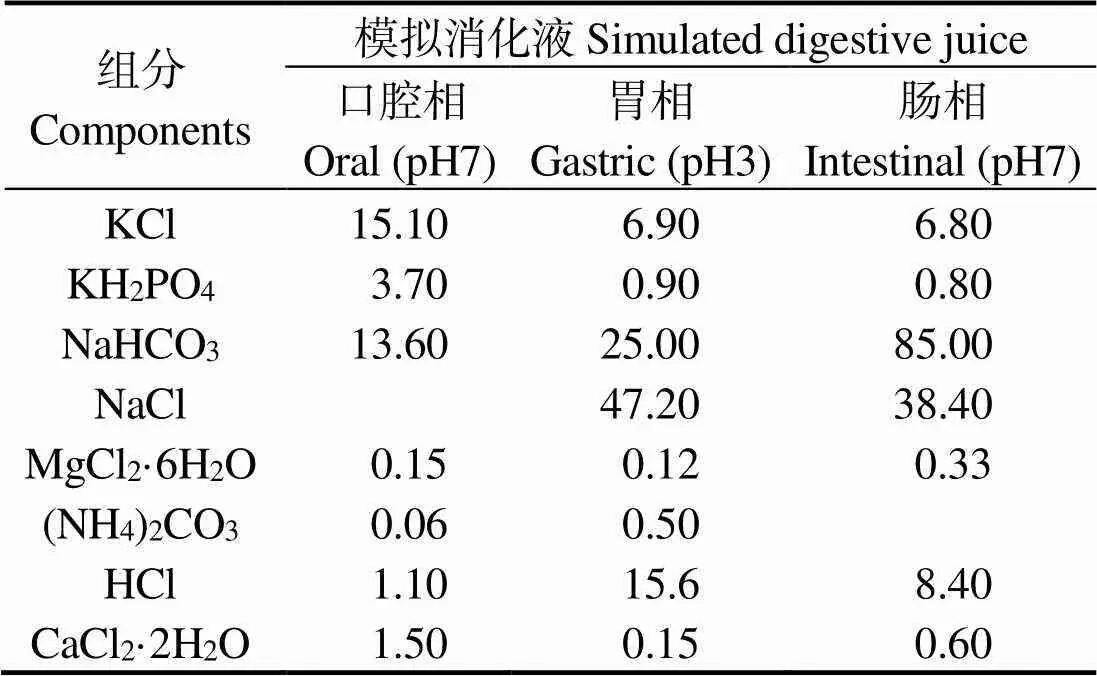
表2 胃肠模拟消化液主要组分终浓度
1.3.6 益生菌菌种的前期活化 活化培养基为MRS肉汤培养基(de Man Rogosa and Sharpe Broth),主要成分:蛋白胨10 g/L,牛肉浸粉5 g/L,吐温80 1 ml/L,磷酸氢二钾2g/L,酵母浸粉4 g/L,硫酸镁0.2 g/L,柠檬酸三铵2 g/L,葡萄糖20 g/L,硫酸锰0.05 g/L,乙酸钠5 g/L,pH 6.2 ± 0.2。
将于-80℃保存的菌种以体积比1%的接种量接种至MRS培养基,于37 ℃下培养24 h后进行二次传代,活化12 h,达到对数期,用于后续实验。
1.3.7 鲢鱼鱼肉酶解物的模拟消化产物对益生菌增殖作用的测定 空白组培养基:MRS肉汤培养基。
对照组培养基:蛋白胨、牛肉浸粉、酵母浸粉以质量比10∶5∶4混合,以1、5 g/L添加至MRS肉汤培养基。
酶解产物浓度实验培养基:复合酶I、II酶解4 h的鱼肉酶解产物的模拟消化产物(分别记为R2-4、R3-4)以1、5 g/L的剂量添加至MRS肉汤培养基。
酶解时间实验培养基:复合酶I、II酶解0.5、2、4 h的鱼肉酶解产物的模拟消化产物(分别记为R2-0.5、R2-2、R2-4,R3-0.5、R3-2、R3-4)以5 g/L添加至MRS肉汤培养基。
以上培养基均分装于20mL无菌厌氧管,以体积比1.0%的接种量分别接种鼠李糖乳杆菌和动物双歧杆菌菌液,在37 ℃下培养24 h,每6 h测600 nm处光密度值(),对照样品是未加菌的培养基。
1.4 数据处理与分析
用Excel 2016处理数据,所有实验均设置3组平行,结果以平均值± 标准差表示。用SPSS v20 进行单因素方差分析,显著性水平为0.05。采用GraphPad Prism 9及Excel 2016绘图。
2 结果与讨论
2.1 不同酶解方式下酶解产物的水解度
图1可见,随酶解时间的增加,水解度逐渐增大。这是因为鱼肉蛋白被酶解成更多的小分子肽段和氨基酸[18]。复合酶Ⅰ酶解作用在酶解2 h后趋于平缓,而复合酶Ⅱ的蛋白水解物水解度在2 ~ 4 h仍保持提升,表明风味蛋白酶与另外两种蛋白酶有一定协同作用,风味蛋白酶水解暴露更多氨基酸残基[19],促进整个酶解过程,提高酶解效率。在各时间节点,复合酶Ⅱ的蛋白水解物水解度均显著高于复合酶Ⅰ(<0.05),表明风味蛋白酶的加入对于鲢鱼肉蛋白的酶解有显著促进作用,可能是因为风味蛋白酶有不同的酶切位点,使复合酶Ⅱ更适应于与鲢鱼肉蛋白结构的酶切位点结合[20],对鲢鱼肉的水解作用更为有效[21]。熊思佳等[22]利用复合酶酶解鲢鱼肉4 h的水解度为29.30%,与本研究复合酶Ⅱ结果相近。
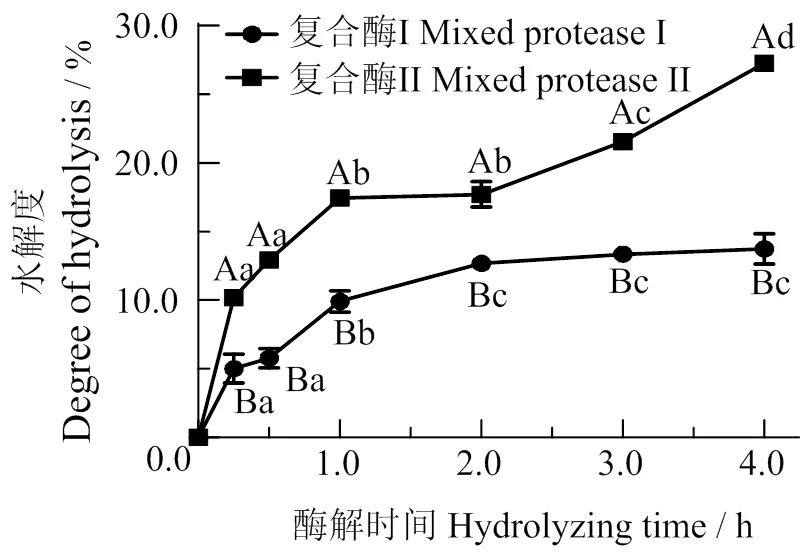
不同大写字母表示组间差异有统计学意义(P<0.05),不同小写字母表示组内差异有统计学意义(P<0.05)
2.2 酶解产物的感官评价
图2可见,复合酶Ⅱ酶解产物粉末颜色较复合酶Ⅰ更深,对应溶液也更浑浊更偏黄,这是由于鱼肉中含有一定量的糖原,在50℃长时间反应下,产生美拉德反应,导致产物颜色变深[23]。其中复合酶Ⅱ酶解4 h的酶解产物除苦味外,其他指标值均最低,表明长时间多酶酶解会引起酶解物及其溶液的颜色变黄、鱼腥味增加,降低感官接受程度。相同酶解时间时,复合酶Ⅱ的酶解产物苦味比复合酶Ⅰ更轻,这可能是由于不同酶解条件可能产生不同的多肽或氨基酸产物,产生的苦味肽和游离氨基酸含量也不同,进而感官感受不同[24]。另一方面,由于风味蛋白酶的加入可减少苦味肽的生成[25],加入风味蛋白酶酶解的鱼肉可释放风味小分子肽,产生独特的香味[26],从而降低感官上的苦味,增进水解物的风味。苗晓丹等[27]对暗纹东方鲀()肌肉呈味肽的感官评价结果表明,风味蛋白酶酶解鱼肉蛋白能降低酶解产物的苦味,与本研究结果一致。
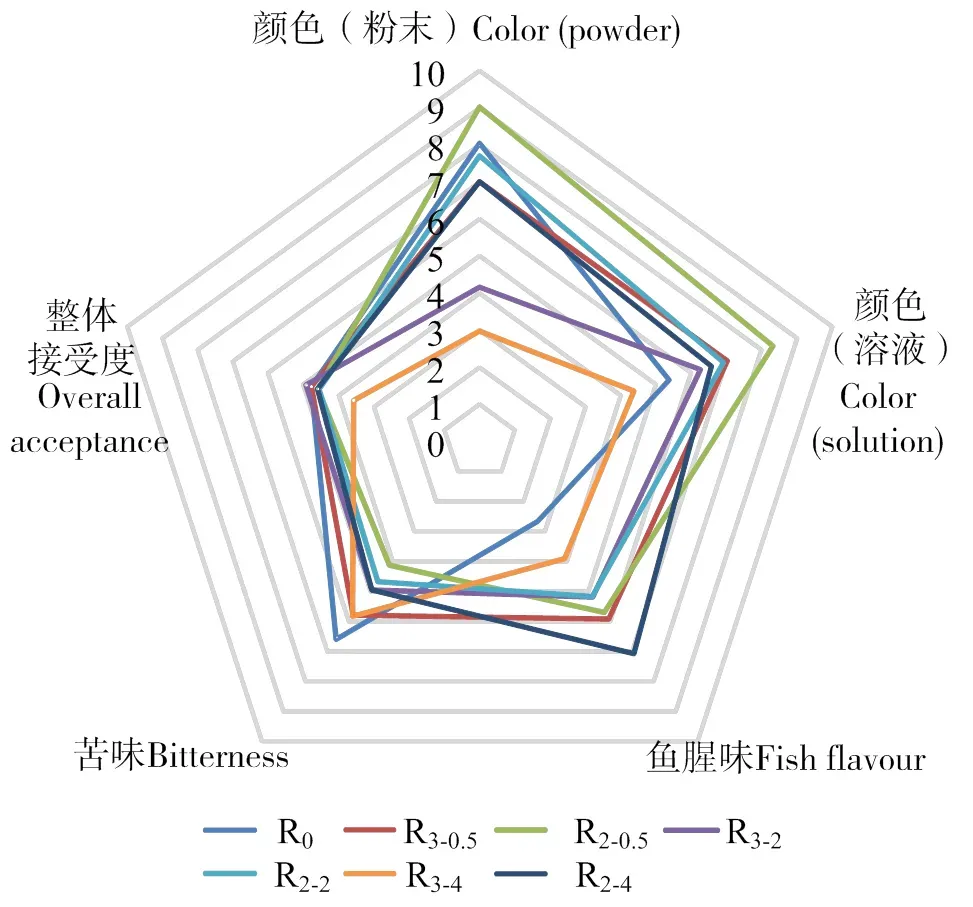
R0,未加酶鲢鱼肉蛋白;R2-0.5、R2-2、R2-4,复合酶Ⅰ酶解0.5、2、4 h的酶解产物;R3-0.5、R3-2、R3-4,复合酶Ⅱ酶解0.5、2、4 h的酶解产物
2.3 酶解产物及其模拟消化产物的分子质量
图3(A)表明,未酶解的鲢鱼肉蛋白大于10 ku的组分有50%以上,多为肌原纤维蛋白和肌浆蛋白[3]。在两种不同复合酶酶解后,大分子蛋白被酶解成小分子肽,大于10 ku组分比例在酶解0.25 h时大幅度减少,酶解4 h时仅为0.6%。水解物中小于2 ku组分随酶解时间的延长占比逐渐增加,并趋于平稳,最终两种复合酶解在酶解4 h时小于2 ku的比例均高于80%,说明在水解度超过13%时,鱼肉中大部分蛋白质在蛋白酶作用下水解成小分子肽,故小于2 ku的组分比例增加。复合酶Ⅱ酶解产物中小于0.5 ku肽段的比例比复合酶Ⅰ多10%以上,可见两种复合酶均可有效酶解鲢鱼肉蛋白,且参与酶解的酶种类越多,酶解效果越佳。此外,复合酶Ⅰ和复合酶Ⅱ的酶解产物中小分子比例变化趋势与水解度变化趋势一致[28-29]。
由于在模拟消化过程中添加了胃蛋白酶和胰蛋白酶,对蛋白肽进一步水解。图3(B) 表明,经过模拟胃相和肠相2 h的反应,大分子肽(>2 ku)组分进一步水解,模拟消化后酶解产物分子质量进一步减小,小于2 ku的组分比例均超过90%,且随着酶解时间的增加而增加。分子质量0.5 ~1.0 ku的组分在模拟消化前后变化不明显,尤其是酶解时间较高的组(3 h和4 h组),表明在长时间水解后再进行模拟消化,鲢鱼蛋白肽分子质量组分变化不明显,可能有一定的抗消化特性[30]。
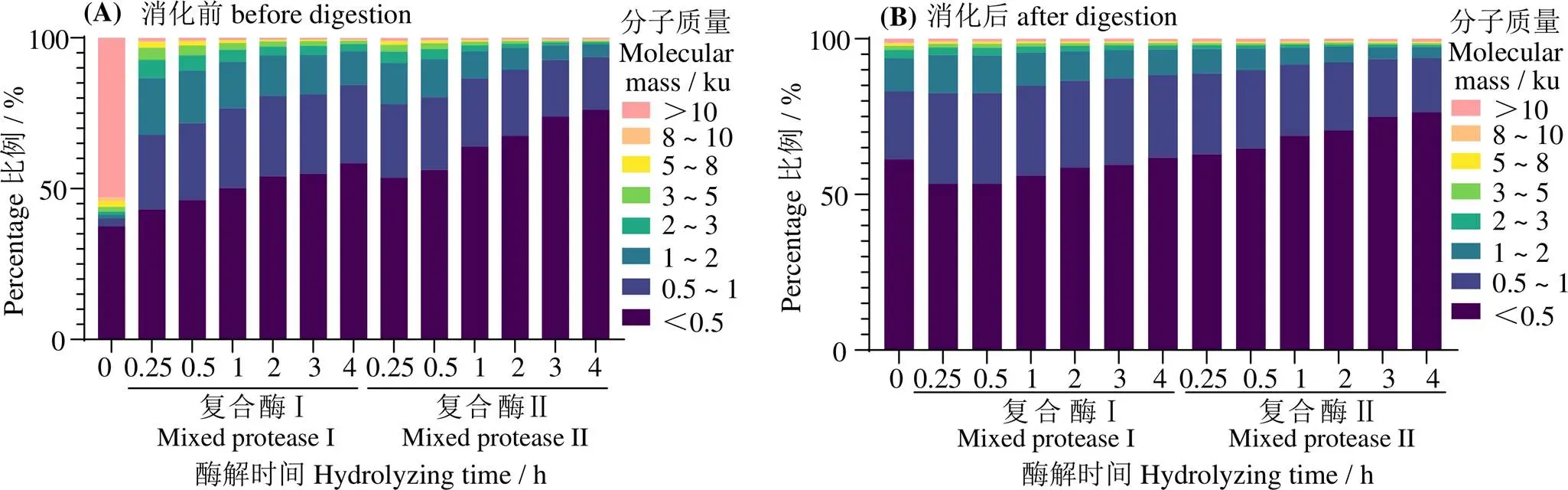
图3 鲢鱼鱼肉酶解产物模拟消化前和消化后的分子质量分布
2.4 酶解产物浓度对益生菌增殖的影响
表3表明,二对照组间6 ~ 24 h内浊度均无显著差异(>0.05)。培养基浊度可反映益生菌增殖情况,浊度越高则同体积下菌浓度越高,在相同培养时间下菌数量越多则细菌增殖效果越佳[31]。二对照组间浊度差异不显著表明额外添加氮源对鼠李糖乳杆菌的增殖无影响。这是由于对照组添加的氮源组分及其比例与MRS培养基相同,减小了不同蛋白组分的增菌效果不同带来的影响[32]。培养鼠李糖乳杆菌时,实验组中添加5 g/L酶解产物在培养12 h时浊度显著高于空白组和对照组(<0.05),但在24 h时无显著差异。复合酶Ⅰ的酶解产物在添加量5 g/L时比1 g/L仅在12 h时有显著差异(<0.05)。培养动物双歧杆菌时,复合酶Ⅱ的酶解产物添加5 g/L时与空白组在6、12、24 h有显著差异(<0.05),与对照组在6 h时有差异(<0.05)。由于在益生菌生长中后期,培养基环境pH下降,培养24 h后菌悬浊液内菌总数达到饱和,生长曲线进入稳定期,抑制了菌的生长繁殖,故浊度无显著差异,而当光密度值在0.1 ~ 1.0范围内时,符合检测仪器的敏感范围[33],故光密度值在对数期有显著差异。
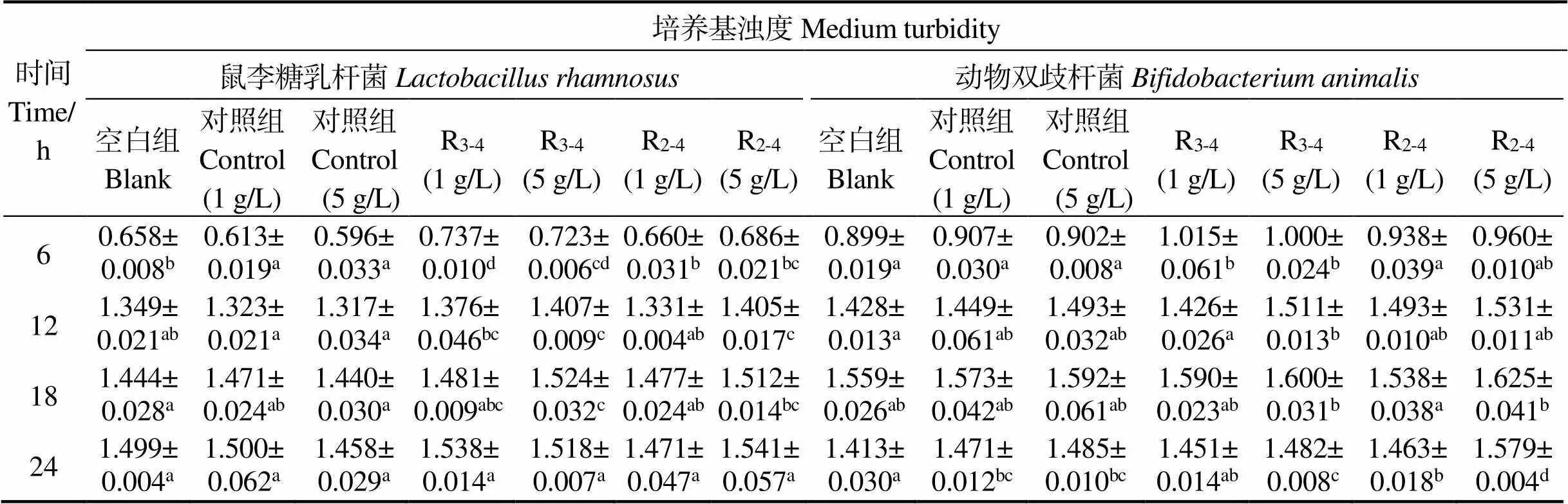
表3 不同浓度鲢鱼肉酶解物的模拟消化产物对鼠李糖乳杆菌、动物双歧杆菌增殖作用的影响
注:不同小写字母表示同一培养时间内组间具有显著差异(<0.05);R3-4,鲢鱼肉采用复合酶Ⅱ酶解4 h;R2-4,鲢鱼肉采用复合酶Ⅰ酶解4 h。
Notes: different lowercase letters indicate that there are significant differences between groups in the same culture time (< 0.05). R3-4: silver carp fillet was hydrolyzed 4 hours by using mixed protease Ⅱ; R2-4: silver carp fillet was hydrolyzed 4 hours by using mixed protease Ⅰ.
因此,在培养两种益生菌时,鲢鱼肉酶解产物模拟消化产物5 g/L的添加量增殖效果较佳,即添加5 g/L的酶解产物模拟消化产物对对数期益生菌的增殖有促进效果,较一般的蛋白酶解物添加10 ~ 20 g/L[34-36]更有优势,说明鲢鱼肉酶解产物中的肽段会被益生菌优先酶解吸收,作为优质氮源[37],促进益生菌生长繁殖[38]。
2.5 酶解产物酶解时间对益生菌增殖的影响
由图4(A)可见,培养鼠李糖乳杆菌时,酶解产物的模拟消化产物在细菌对数生长期(6 h)与空白组和对照组有显著差异(<0.05),不同酶解时间的酶解产物模拟消化产物对鼠李糖乳杆菌的增殖作用无显著差异(>0.05),但对数生长期,酶解2、4 h的复合酶Ⅱ酶解产物模拟消化产物的增殖促进作用较复合酶Ⅰ更佳,表明低分子质量比例高及高水解度酶解产物的益生效果更佳,这是由于复合酶Ⅱ酶解产物组分中含有更多寡肽和游离氨基酸,可为细胞提供必需氨基酸[39],直接被益生菌吸收,从而促进细菌生长繁殖。而对动物双歧杆菌(图4(B)),酶解产物的模拟消化产物则在6、12 h时有显著促进增殖作用,但不同酶解时间间无显著差异(>0.05)。葛俊苗[39]添加3 g/L草鱼皮酶解产物培养嗜热链球菌,随着酶解时间的增加,(600 nm)先升后降,由于其直接添加酶解产物进行培养,与本研究使用模拟消化产物不同。由于模拟消化后产物的水解度和低分子质量组分比例高于鲢鱼肉酶解产物,大部分多肽被酶解成寡肽和游离氨基酸,其发挥益生活性的成分含量变化较小,对益生菌促增殖作用并无显著变化。
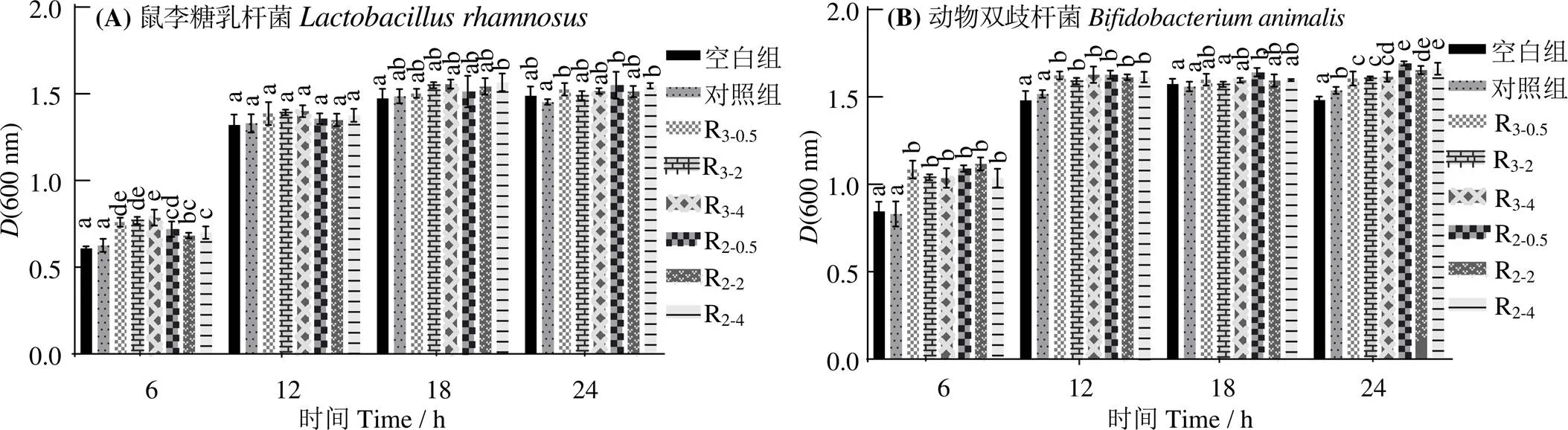
R2-0.5、R2-2、R2-4,复合酶Ⅰ酶解0.5、2、4 h的酶解产物模拟消化产物;R3-0.5、R3-2、R3-4,复合酶Ⅱ酶解0.5、2、4 h的酶解产物模拟消化产物;同一培养时间内,凡含一个相同字母则组间无显著差异(P > 0.05)
3 结论
本研究制备鲢鱼蛋白肽,复合酶Ⅱ对鲢鱼肉蛋白的酶解能力更强,可产生水解度更高、小分子肽更多的酶解产物,同时加入风味蛋白酶使酶解产物的苦味更轻,但酶解时间过长会导致酶解产物冻干粉末色泽更深。添加鲢鱼肉酶解产物的模拟消化产物5 g/L时有显著的益生元活性(< 0.05),故鲢鱼肉蛋白肽有益生元开发潜力,可提升鲢的经济效益和利用价值。
[1] 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021.
[2] 李慕菡, 郝瑞姣, 宋香荣. 中国-秘鲁水产品贸易竞争力的比较研究[J]. 中国渔业经济, 2019, 37(2): 87-92.
[3] WANG K, HAN L H, HONG H, et al. Purification and identification of novel antioxidant peptides from silver carp muscle hydrolysate after simulated gastrointestinal digestion and transepithelial transport[J]. Food Chemistry, 2021, 342: 128275.
[4] LIU Q J, LIU Y L, YU J, et al. Identification and characterization of cryoprotective peptides extracted from silver carp () hydrolysates[J]. International Journal of Food Properties, 2019, 22(1): 1011-1023.
[5] HONG H, ZHENG Y Y, SONG S J, et al. Identification and characterization of DPP-IV inhibitory peptides from silver carp swim bladder hydrolysates[J]. Food Bioscience, 2020, 38: 100748.
[6] ZHANG Y Q, LIU H G, HONG H, et al. Purification and identification of dipeptidyl peptidase IV and angiotensin-converting enzyme inhibitory peptides from silver carp () muscle hydrolysate[J]. European Food Research and Technology, 2019, 245(1): 243-255.
[7] 胡皓程. 黑木耳寡糖的提取、结构表征及生物活性研究[D]. 大连: 大连理工大学, 2021.
[8] ZEYNEB H, PEI H R, CAO X L, et al.study of the effect of quinoa and quinoa polysaccharides on human gut microbiota[J]. Food Science & Nutrition, 2021, 9(10): 5735-5745.
[9] 章萍萍. 紫薯花青素的提取、纯化及其抗氧化和益生元活性研究[D]. 合肥: 合肥工业大学, 2017.
[10] GE H F, CAI Z Z, CHAI J L, et al. Egg white peptides ameliorate dextran sulfate sodium-induced acute colitis symptoms by inhibiting the production of pro-inflammatory cytokines and modulation of gut microbiota composition[J]. Food Chemistry, 2021, 360: 129981.
[11] ZHANG C, XIA S Q, ZHANG Y X, et al. Identification of soybean peptides and their effect on the growth and metabolism ofLR08[J]. Food Chemistry, 2022, 369: 130923.
[12] BARTKIENE E, LELE V, SAKIENE V, et al. Improvement of the antimicrobial activity of lactic acid bacteria in combination with berries/fruits and dairy industry by-products[J]. Journal of the Science of Food and Agriculture, 2019, 99(8): 3992-4002.
[13] KAREB O, CHAMPAGNE C P, JEAN J, et al. Effect of electro-activated sweet whey on growth of,, andstrains under model growth conditions[J]. Food Research International (Ottawa, Ont), 2018, 103: 316-325.
[14] SPELLMAN D, MCEVOY E, O’CUINN G, et al. Proteinase and exopeptidase hydrolysis of whey protein: comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis[J]. International Dairy Journal, 2003, 13(6): 447-453.
[15] 王雨生, 冷云, 陈海华, 等. 黄鳍金枪鱼皮胶原肽酶解工艺及抗氧化活性研究[J]. 中国食品学报, 2015, 15(2): 72-78.
[16] QIN X Y, XU Y G, WEI Y, et al. Effects of topical application of different molecular weight marine fish skin collagen oligopeptides on UVB-induced photoaging rat skin[J]. Journal of Cosmetic Dermatology, 2021. 1-10. https://doi.org/10.1111/jocd.14349.
[17] BRODKORB A, EGGER L, ALMINGER M, et al. INFOGEST staticsimulation of gastrointestinal food digestion[J]. Nature Protocols, 2019, 14 (4): 991-1014.
[18] 张婷婷, 詹妙新, 张宾乐, 等. 牡蛎干酶法制备海鲜调味基料的研究[J]. 中国调味品, 2021, 46(9): 105-111.
[19] 杨丽媛. 碱性蛋白酶的分离纯化及其酶学特性的研究[D]. 长春: 东北师范大学, 2015.
[20] 蔡金秀, 夏姗姗, 马佳雯, 等. 马面鱼皮胶原抗氧化肽的分离制备及稳定性研究[J]. 核农学报, 2021, 35(11): 2569-2577.
[21] 夏天晴, 李晨豪, 李在禄, 等. 蛋白酶法制备低苦味低分子量南极磷虾蛋白肽混合物初探[J]. 齐鲁工业大学学报, 2021, 35(2): 21-27.
[22] 熊思佳, 王发祥, 俞健, 等. 鲢鱼酶解产物对酵母菌的抗冻保护作用[J]. 食品与机械, 2018, 34(2): 116-119.
[23] 刘平. 美拉德肽的形成机理及功能特性研究[D]. 无锡: 江南大学, 2012.
[24] 郑瑞生, 林雅萍, 孙秋琼, 等. 酶解马鲛鱼下脚料制备海鲜酱工艺优化[J]. 食品与机械, 2021, 37(6): 201-206.
[25] FU Y, LIU J, HANSEN E T, et al. Structural characteristics of low bitter and high umami protein hydrolysates prepared from bovine muscle and porcine plasma[J]. Food Chemistry, 2018, 257: 163-171.
[26] 张耀, 张露, 刘俊, 等. 青鱼肉活性肽的制备及其抗肿瘤活性研究[J]. 食品与发酵工业, 2021, 47(5): 35-42.
[27] 苗晓丹, 刘源, 马垒, 等. 结合感官评价与电子舌技术优化酶水解养殖暗纹东方鲀肌肉制备呈味肽[J]. 现代食品科技, 2015, 31(8): 268-272.
[28] 苏继磊, 李姣, 陈敏, 等. 响应面法优化太平洋褶柔鱼肌肉蛋白水解物的抗氧化活性[J]. 食品科技, 2021, 46(6): 121-128.
[29] 张弛. 鳙鱼肌肉蛋白肽的制备、分离纯化及生物活性的研究[D]. 北京: 中国农业大学, 2018.
[30] 杨玉亮, 衣大龙, 刘春雨, 等. 体外模拟消化对牦牛骨胶原蛋白肽抗氧化活性的影响[J]. 食品与发酵工业, 2021, 47(13): 79-84.
[31] 王丽波, 高婧宇, 李腾飞, 等. 硒化蒲公英多糖的制备、结构表征及益生菌促增殖活性[J]. 食品科学, 2021, 42(7): 169-175.
[32] 王智鼎, 刘艳秋, 李岳飞, 等. 鼠李糖乳杆菌GG(LGG)高密度培养基优化[J]. 食品科技, 2013, 38(11): 8-11.
[33] 李恪梅, 魏东, 王秉翔, 等. 人用布氏菌疫苗浓度测定分光光度法的建立[J]. 中国药事, 2011,25(3): 233-235.
[34] YU Y J, AMORIM M, MARQUES C, et al. Effects of whey peptide extract on the growth of probiotics and gut microbiota[J]. Journal of Functional Foods, 2016, 21: 507-516.
[35] 刘峰, 涂强, 袁学宾, 等. 玉米肽对益生菌增殖作用的研究[J]. 饲料研究, 2020, 43(11): 68-72.
[36] 胡凌豪. 凤尾鱼酶解产物对嗜热链球菌增殖作用及其生物活性研究[D]. 上海: 上海海洋大学, 2019.
[37] DIETHER N E, WILLING B P. Microbial fermentation of dietary protein: an important factor in Diet⁻Microbe⁻Host interaction[J]. Microorganisms, 2019, 7(1): 19.
[38] LAZZI C, MELI F, LAMBERTINI F, et al. Growth promotion ofandspecies by proteinaceous hydrolysates derived from poultry processing leftovers[J]. International Journal of Food Science & Technology, 2013, 48(2): 341-349.
[39] 葛俊苗. 草鱼皮酶解工艺优化及产物促进嗜热链球菌增殖和抗氧化性研究[D]. 上海: 上海海洋大学, 2019.
Physicochemical Properties and Potential Prebiotic Activity of Silver Carp () Protein Hydrolysates
HUANG Xin-rou, ZHANG Hui-juan, WANG Kai, LUO Yong-kang
(,,100083,)
【】 To investigate physicochemical properties and potential prebiotic activity of silver carp (protein hydrolysates onand.【】 Silver carp fillet was hydrolyzed respectively by mixed proteasesⅠ (enzyme activity ratio of neutrase to alcalase is 1∶1) and Ⅱ (enzyme activity ratio of neutrase to alcalase and flavourzyme is 1∶1∶0.5) for different durations of time. The degree of hydrolysis (DH), molecular mass and sensory evaluation of the hydrolysates were determined. The hydrolysates were submitted togastrointestinal digestion (GID) and the digested products were collected to cultureand, and the turbidity of the culture medium was measured. 【】 The DH of silver carp hydrolysates hydrolyzed by mixed protease Ⅱ was significantly higher than those hydrolyzed by mixed proteasesⅠ(< 0.05), with the maximum at 27.2%. In sensory evaluation, hydrolysates of mixed proteaseⅠ were bitter than that by mixed protease Ⅱ. The component of low molecular mass peptide (<2 ku) of silver carp hydrolysates afterGID is more than 90%. Compared with the control group (MRS medium), the concentration of 5 g/L of digestion products can promote the growth of probiotics in logarithmic phase significantly (< 0.05). 【】5 g/L of digestion products could promote the proliferation ofand, which indicated that silver carp protein hydrolysates had the potential to be a prebiotics.
; enzymatic hydrolysates; degree of hydrolysis; molecular mass distribution; probiotics
黄馨柔,张慧娟,王凯,等. 鲢蛋白酶解物理化特性及其对益生菌增殖的影响[J]. 广东海洋大学学报,2022,42(3):72-78.
TS254.4
A
1673-9159(2022)03-0072-07
10.3969/j.issn.1673-9159.2022.03.010
2021-12-02
财政部和农业农村部:国家现代农业产业技术体系资助(CARS-45);国家重点研发课题(2017YFD0400201)
黄馨柔(1997―),女,硕士研究生,专业方向为水产品加工及贮藏工程。E-mail:18811720833@163.com
罗永康,男,博士,教授,研究方向水产品加工及贮藏。E-mail:luoyongkang@cau.edu.cn
(责任编辑:刘庆颖)

