响应面法优化小新月菱形藻培养基
李 琦,张达娟,张树林,王泽斌,贾滢暄,黄兰英,梁鹏飞,陈 璇,龙成凤
响应面法优化小新月菱形藻培养基
李 琦,张达娟,张树林,王泽斌,贾滢暄,黄兰英,梁鹏飞,陈 璇,龙成凤
(天津农学院水产学院 / 天津市水产生态及养殖重点实验室,天津 300392)
【】优化小新月菱形藻()培养基,筛选其生长的最佳营养盐浓度。采用响应面法,筛选f/2培养基中的NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7浓度,优化小新月菱形藻的培养基配方并进行验证试验。【】根据单因素试验筛选出小新月菱形藻相对适宜的营养盐浓度:NaNO3为0.2、0.5和0.8 g/L,NaH2PO4·H2O为0.005、0.007 5和0.01 g/L,Na2SiO3为0.02、0.05和0.08 g/L,C6H8FeNO7为0.001、0.002和0.003 g/L;通过响应面优化,4种营养盐对小新月菱形藻生长的影响强弱依次为:NaNO3、NaH2PO4·H2O、C6H8FeNO7、Na2SiO3,最佳浓度分别为NaNO30.5 g/L,NaH2PO4·H2O 0.007 5 g/L,Na2SiO30.05 g/L,C6H8FeNO70.002 g/L,营养盐浓度过高或过低均会抑制小新月菱形藻生长;使用优化后的培养基培养该藻,藻细胞密度提高28.15%,显著高于f/2培养基组的细胞密度(< 0.05)。
小新月菱形藻;营养盐;藻细胞密度;响应面法
小新月菱形藻()不仅是海洋鱼、虾、贝类等生物的重要饵料,而且是岩藻黄素、金藻昆布糖和十二碳五烯酸(EPA)等生物活性物质的提取基质[1],亦可用于改善水质,形成良好的养殖水环境。夏建荣等[1]和马若欣等[2]用单因素试验法筛选小新月菱形藻培养基氮、磷浓度,发现小新月菱形藻生长速率随培养液中氮、磷浓度的升高而升高[2],但随着氮浓度的升高,藻密度先升后降,在照度为260 μmol/(m2·s)时生长速率最快[3]。李炳乾等[4]和任莉红[5]用正交试验筛选小新月菱形藻生长的最适营养盐浓度,发现影响生长的4因素先后顺序为N、Si、Fe、P[4];在NaNO30.3 g/L、NaH2PO4·H2O 0.03 g/L、Na2SiO30.1 g/L时,藻生长最快,密度最高[5]。可见,营养盐组成和培养条件对小新月菱形藻生长均有显著影响,但研究结论不尽一致,原因是培养基成分种类繁多,关系错综复杂。单因素法仅考虑一种因素影响,缺乏因素间交互性分析。正交试验法虽同时考虑多种因素,但不能得出因素和响应值间明确的函数表达式,无法求得整个区域中因素的最佳组合和最优值[6]。响应面法通过不断改变设计参数修改试验模型,直接通过大量试验数据,统计出所要拟合的函数[7]。本研究用响应面法优化小新月菱形藻培养基,筛选其生长的最佳营养盐浓度,为小新月菱形藻的高密度培养提供参考。
1 材料与方法
1.1 试验材料
小新月菱形藻购自上海光语生物科技有限公司,在f/2培养基于光照培养箱(日本三洋有限公司 MLR352-PC)中进行培养,盐度29,培养温度为(22±1)℃,照度为50 μmol/(m2·s),光暗比为12 h/12 h,每天摇瓶3次,防止沉淀。
1.2 试验设计与方法
1.2.1 单因素试验设计 以f/2培养基为基础,采用单因素试验法分别对氮、磷、硅和铁源进行筛选,各营养盐浓度见表1,各营养盐浓度梯度分别设3个平行。取对数生长期小新月菱形藻离心(5 000 r/min,5 min,4 ℃),去上清液,将藻泥加入经高温灭菌的上述各培养基,每个处理组中藻细胞初始密度均为1×106mL-1。试验进行14 d,培养条件同1.1,8 d时用血细胞计数板对藻细胞计数。
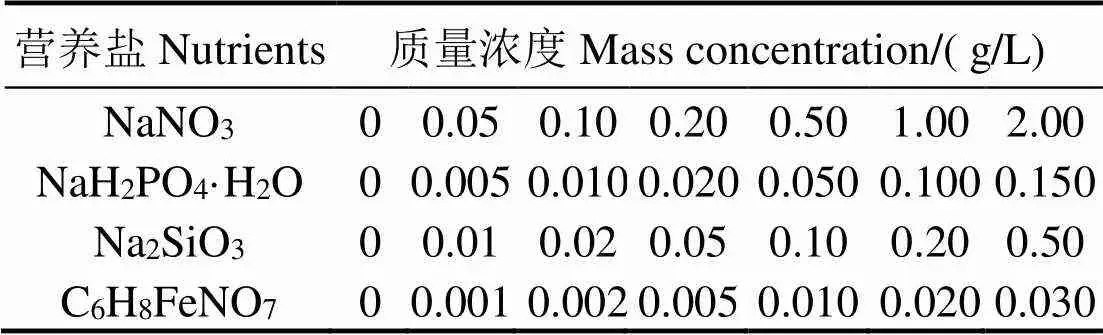
表1 营养盐单因素浓度水平
1.2.2 响应面法试验设计 单因素试验法筛选出NaNO3、NaH2PO4·H2O、Na2SiO3、C6H8FeNO7的适宜浓度,以此为基础分别设置3个浓度水平,以藻密度()为响应值,用Design Expert 11.0 响应面分析法优化试验[7-10],每组设置3个平行,共设计29个试验点(中心点重复5次,用于估计试验误差),以获取最佳营养盐浓度。
1.3 数据处理
数据用平均值±标准差表示,用Design-Expert 11.0绘制等高线和响应曲面图。用SPSS 17.0软件对数据进行单因素方差分析,用Original绘图。
2 结果与分析
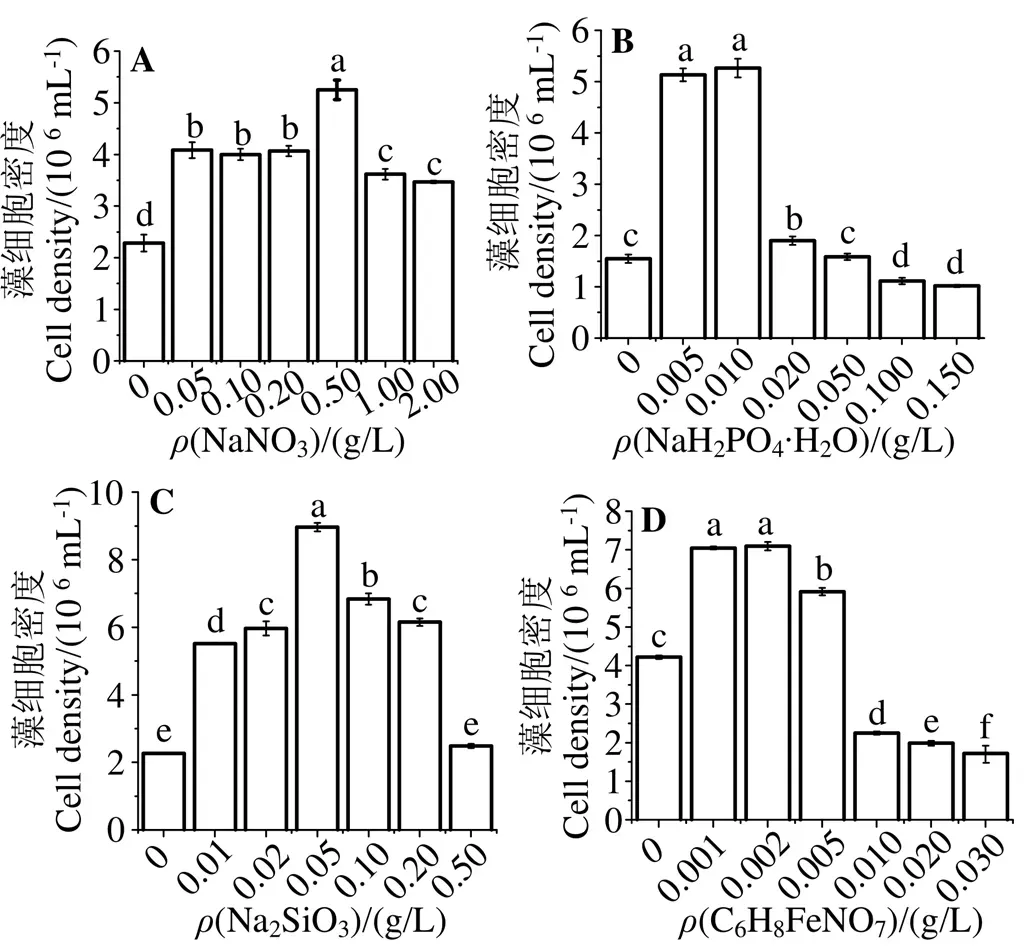
2.1 营养盐单因素试验
单一营养盐对小新月菱形藻生长的影响如图1所示。在培养8 d时,小新月菱形藻在NaNO3为0.50 g/L,NaH2PO4·H2O为0.005和0.010 g/L,Na2SiO3为0.05 g/L,C6H8FeNO7为0.001和0.002 g/L时密度最大,分别为5.25×106、5.26×106、8.96×106、7.1×106mL-1,均显著高于其他处理组(< 0.05),根据初步结果选择0.20、0.50和0.80 g/L的NaNO3,0.005 0、0.007 5和0.010 0 g/L的NaH2PO4·H2O,0.02、0.05和0.08 g/L的Na2SiO3及0.001、0.002和0.003 g/L的C6H8FeNO7进行响应优化。
2.2 响应面法试验
因素和水平设计见表2,响应面法试验结果见表3,经拟合,得到细胞密度()与NaNO3、NaH2PO4·H2O、Na2SiO3、C6H8FeNO7质量浓度(、、、)的回归方程为:
= 865.6 + 133.08 ×+ 57.33 ×- 20.25 ×+ 26.67 ×+ 43 ×- 6 ×+ 26.75 ×+ 47.5 ×+ 28 ×+ 72.75 ×- 152.18 ×2- 135.05 ×2- 98.92 ×2- 114.55 ×2。
不同字母表示组间差异显著(P < 0.05)
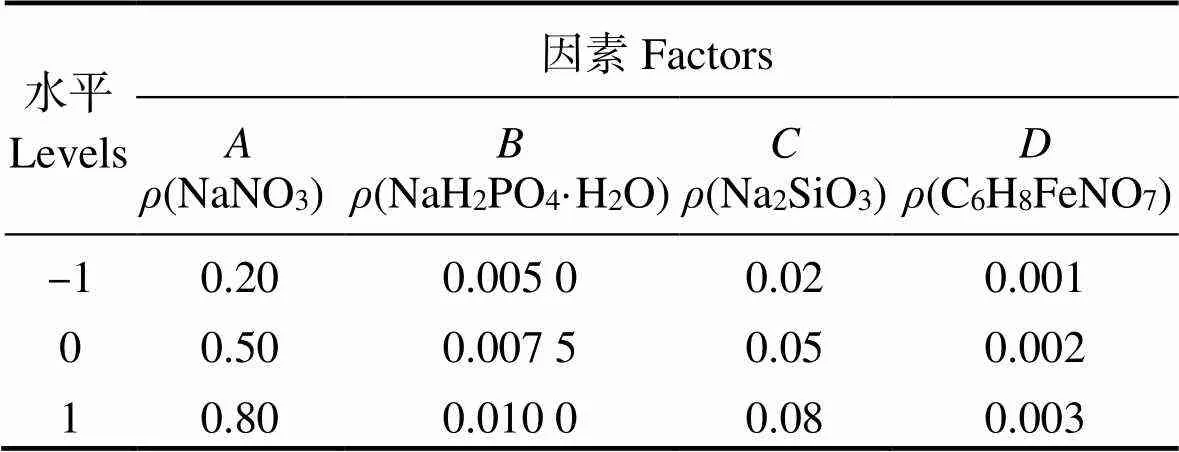
表2 Box-Behnken试验因素水平
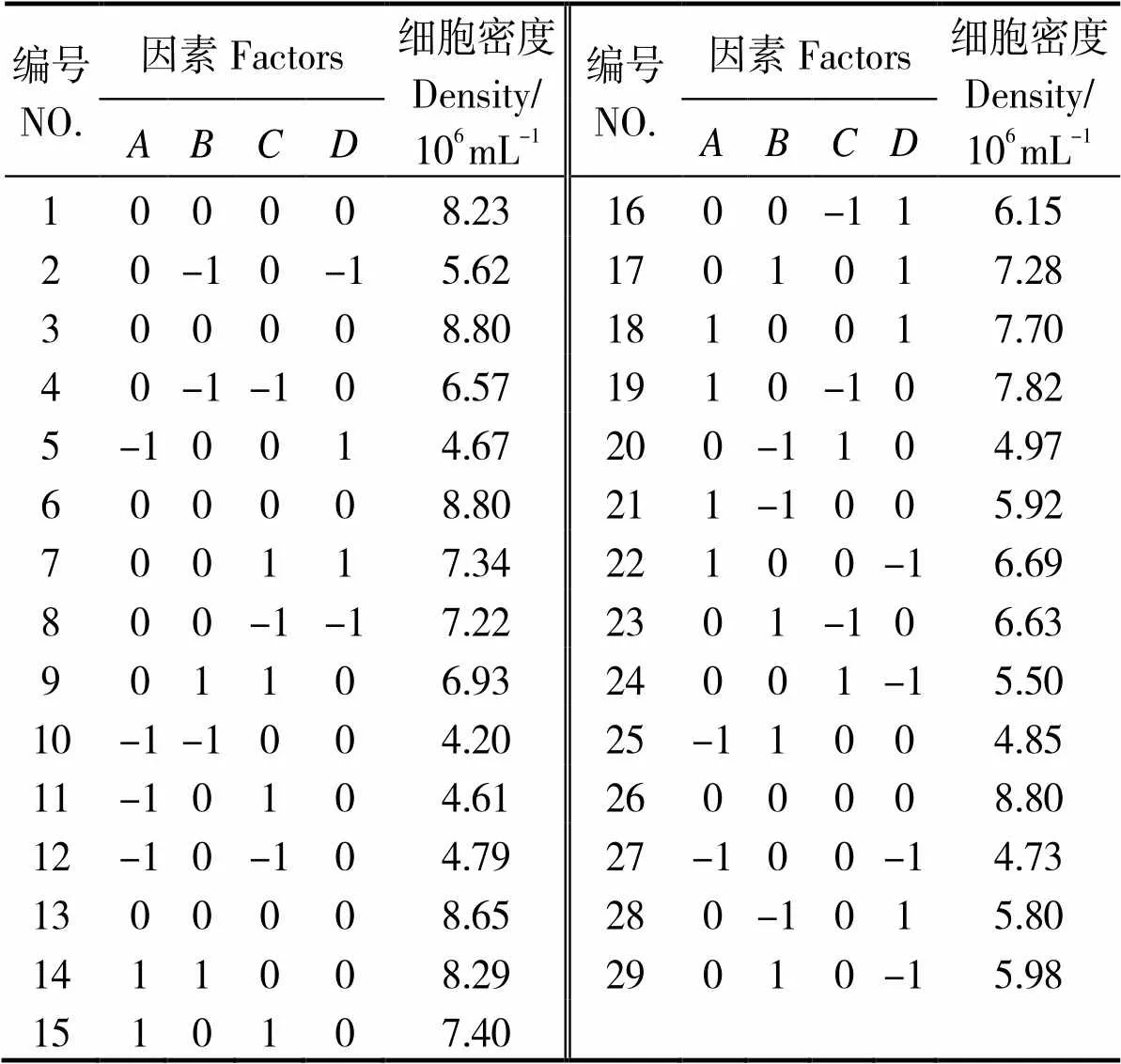
表3 响应面法试验结果
上述模型的方差分析结果如表4所示。该回归方程的值为80.45,< 0.000 1,模型极显著;经检验,、、、、、、、、、2、2、2和2项对细胞密度影响显著(< 0.05);拟合曲线方差分析结果中,决定系数2=0.987 7,矫正系数Adj2=0.975 4;该模型中精密度值为26.595 7,当精密度值大于4时可用。图2为残差的正态概率、预测值与试验实际值分布,可见各散点均靠近同一条直线。综上,该模型中细胞密度对NaNO3、NaH2PO4·H2O、Na2SiO3、C6H8FeNO7质量浓度的拟合性较佳。
NaNO3、NaH2PO4·H2O、Na2SiO3、C6H8FeNO7间交互作用的响应面分析见图3(a-e),结合表4可见< 0.05,等高线明显呈椭圆形且较密集,说明各因素间交互作用强,对密度影响极显著;随着浓度的增加,曲面呈先升后降趋势,在水平为0时,藻密度最大。从图3(f)可见等高线呈椭圆特征,说明NaNO3和Na2SiO3有交互作用,表4二因素>0.1,密度影响不显著,交互作用较弱。
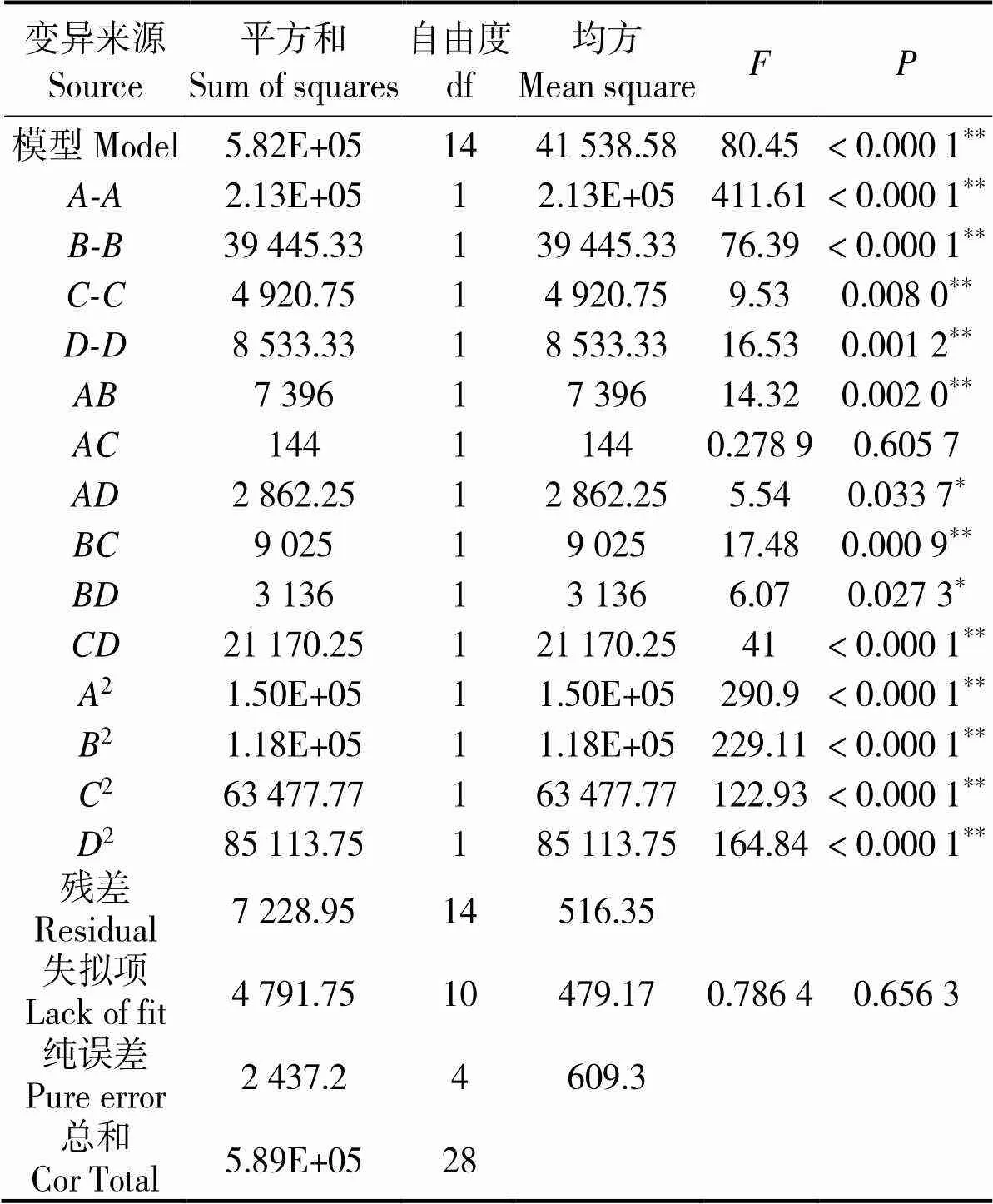
表4 回归模型方差分析
说明Notes:*,< 0.05 ;**,< 0.01。
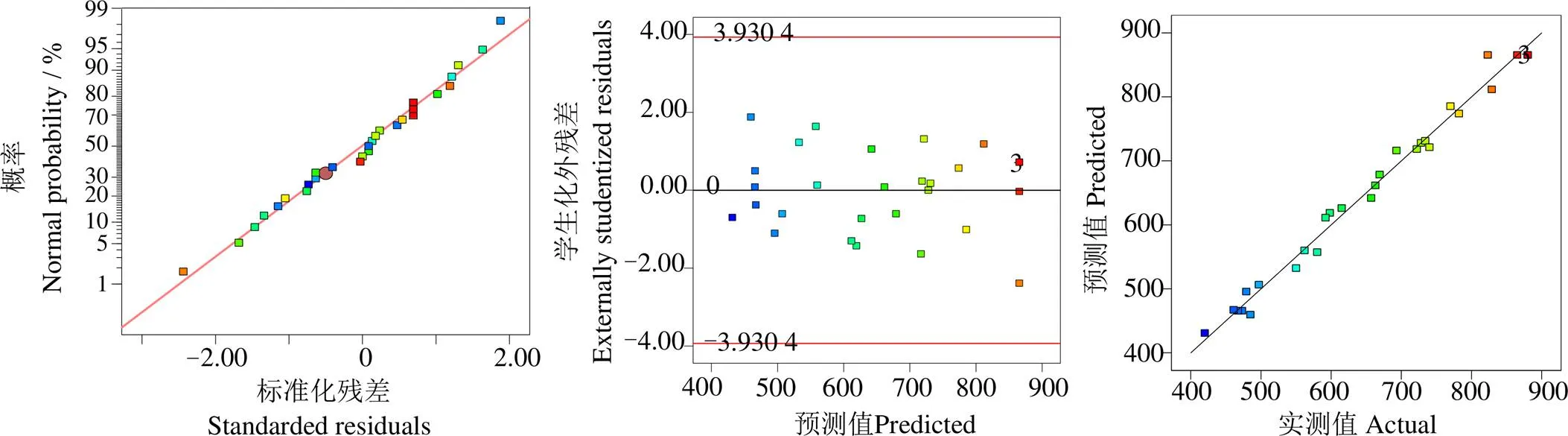
图2 模型的残差正态概率、残差与预测值分布以及实验预测值与实测值分布
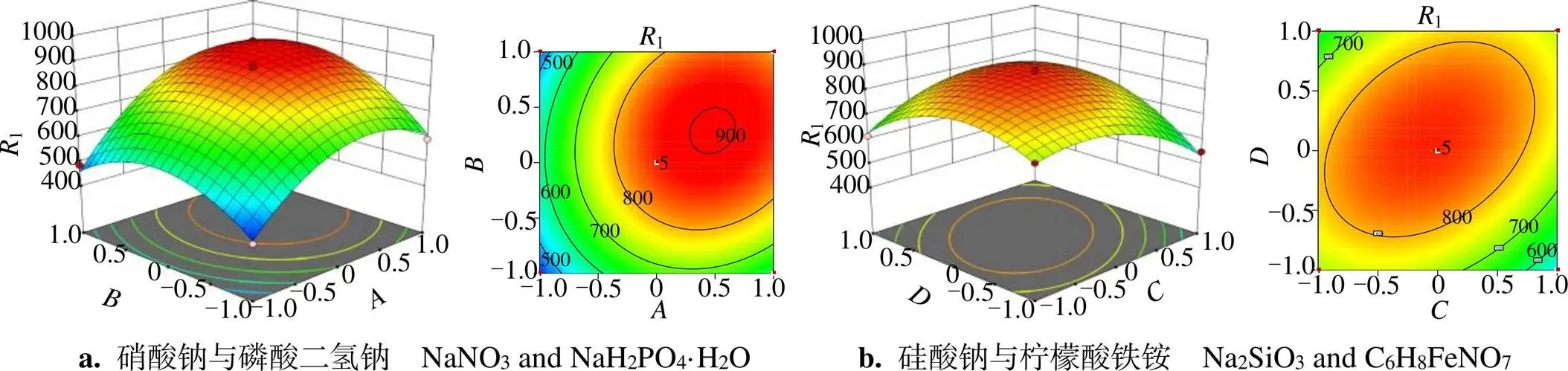
R1,藻细胞密度/(104 mL-1); A, ρ(NaNO3)/(g/L); B, ρ(NaH2PO4·H2O)/(g/L); C,ρ(Na2SiO3)/(g/L); D, ρ(C6H8FeNO7)/(g/L)
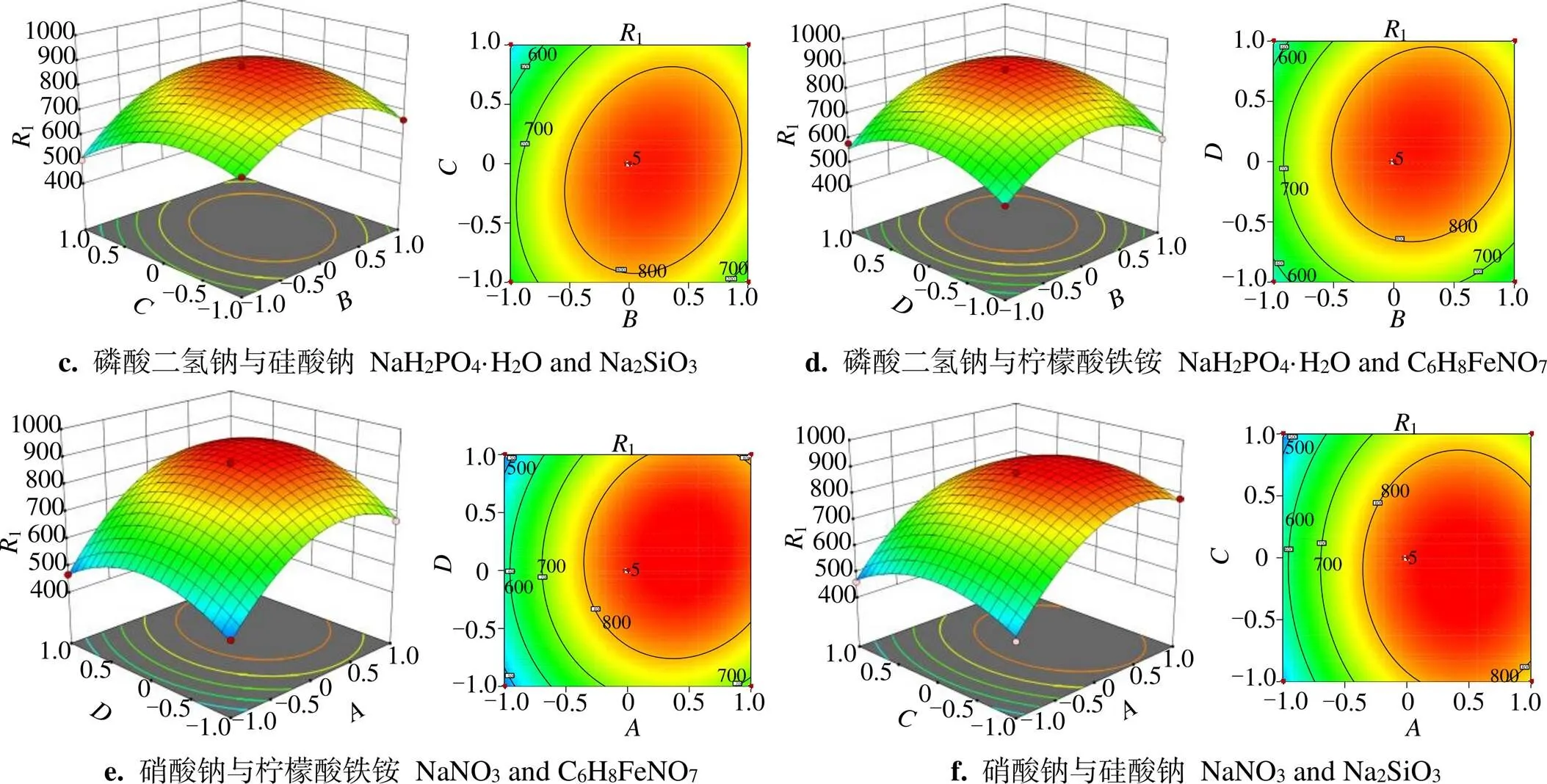
图3 (续)
3 验证
3.1 最佳营养盐浓度
通过响应面软件Design-Expert 11.0对数据进一步的拟合分析,得到NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7的最佳质量浓度分别为0.50、0.0075、0.05、0.002 g/L,藻细胞密度达到最大值。
3.2 结果验证
用优化后培养基培养小新月菱形藻12 d时,藻密度最大,为15.93×106mL-1,显著高于对照组的12.43×106mL-1,藻细胞密度提高28.15%(图4)。
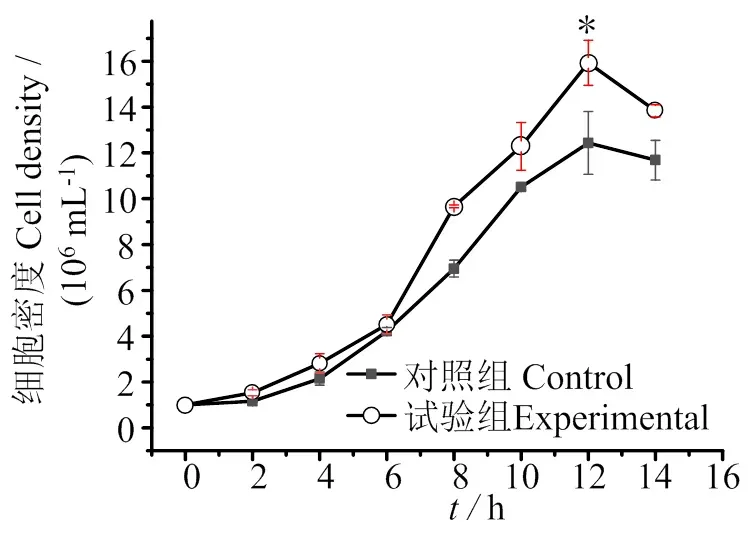
*,组间差异显著Significant difference between groups (P < 0.05)
4 讨论
本研究方差分析可见,4因素对小新月菱形藻均有极显著影响;从值可知,影响密度的因素强弱顺序为N、P、Fe、Si。李炳乾等[4]和任莉红[5]也认为N的影响最为显著,明显强于P、Fe和Si对小新月菱形藻生长的影响,起主导作用。
本研究先用单因素法筛选4种营养盐从低到高最适浓度范围,再采用响应面法进一步优化;李炳乾等[4]采用正交试验法对N、P、Si、Fe的浓度进行优化,直接设计试验浓度;王青岩等[3]采用单因素试验法对N、P、Si进行浓度筛选,其余等同f/2培养基。本研究得出的各营养盐最佳质量浓度分别为NaNO30.50 g/L、NaH2PO4·H2O 0.007 5 g/L、Na2SiO30.05 g/L、C6H8FeNO70.002 g/L,李炳乾等[4]得出的营养盐最佳质量浓度分别为NaNO30.3 g/L、NaH2PO4·H2O 0.015 g/L、Na2SiO30.12 g/L、C6H8FeNO70.001 575 g/L,王青岩等[3]认为N、P、Si的新培养基是旧培养基的4、0.5和8倍,本研究中,藻细胞密度在培养6 d时开始呈指数增长,12 d时达到最大值15.93×106mL-1,李炳乾等[4]研究发现,最高细胞密度出现在4 ~ 5 d,最大值为9.8×106mL-1;而王青岩等[3]发现,细胞前6 d呈指数增长,在10 d时达到最大值6.5×106mL-1。本研究的藻细胞密度远大于前人研究结果,造成差异的原因可能是营养盐的浓度和种类不同,藻种来源和培养条件、方法的不同。任莉红[5]发现,NaNO3在0.3 g/L、NaH2PO4·H2O在0.03 g/L、Na2SiO3在0.1 g/L时,藻生长最快,藻密度最高,与本研究结果相近。氮可让硅藻大量繁殖,是硅藻成熟分裂的重要元素[11]。本研究单因素试验表明,随着N浓度的升高,藻细胞密度先上升后下降,表明N浓度过高或者过低均会抑制小新月菱形藻的生长。磷不仅是细胞膜的重要组成部分,还可调节酸碱平衡,对培养基起缓冲作用[11]。本研究表明,小新月菱形藻更适于在低浓度磷条件下生长,与李炳乾等[4]的最适磷0.015 g/L、任莉红[5]的磷源最适质量浓度0.02 ~ 0.03 g/L结果相近。硅是细胞壁的主要组成部分,同时参与生长代谢过程[11]。Shifrin等[12]研究发现,微藻在缺硅条件下1周时,细胞即停止分裂甚至死亡。本研究中,Na2SiO3质量浓度为0.05 g/L时藻密度达到8.96×106mL-1,当硅质量浓度逐渐增加时,藻密度先升后降,趋势比较缓慢,李炳乾等[4]发现,最适硅源质量浓度为0.12 g/L,任莉红[5]发现最适硅源质量浓度为0.1 g/L,与本研究结果有一定偏差,表明营养盐浓度及配比对藻类代谢活动和生长速率有显著的影响[13]。铁是藻类生长过程中不可或缺的元素,也是藻细胞中某些还原酶的组成部分,缺铁会抑制藻的生长。本研究中,C6H8FeNO7质量浓度为0.002 g/L时藻密度最大,与李炳乾等[4]的C6H8FeNO70.001 575 g/L结果相近。
微藻大量培养所需的培养基不仅要符合藻类的自然生长特性,还要注意各种营养因素的最佳用量和各因素之间的平衡关系。本研究用Box-Behnken响应面法优化小新月菱形藻培养基,弥补了传统方法中非线性关系的深度不足并考虑了误差,同时对局部最具特征的点进行试验,又在点的基础上对整体的“面”进行精准预测,回归拟合整体范围内各因素间的相互关系[14-15],首先从单因素试验结果中筛选出培养基各营养盐的适宜浓度,通过软件找出优化方向,最后求得优化结果,有试验次数少、精度高、性能优[16]的优点。响应面反映的是NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7等4因素中任意2个因素取零水平时,剩余2个因素相互作用对小新月菱形藻藻细胞密度的影响。得出NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7的最佳质量浓度分别为0.50、0.007 5、0.05、0.001 g/L,与原培养基比较,藻细胞密度提高28.15%。但响应面法也存在一定不足,当变量数较多时,不易准确构建一个近似多项式进行确定性分析;另外,当模型非线性强或误差分布呈非正态分布时,寻找合适的优化设计极为困难[17]。
[1] 夏建荣, 黄瑾. 氮、磷对小新月菱形藻无机碳利用与碳酸酐酶活性的影响[J]. 生态学报, 2010, 30(15): 4085-4092.
[2] 马若欣, 王学魁, 曹春晖. 氮浓度和光照强度对小新月菱形藻生长和总脂含量的影响[J]. 天津科技大学学报, 2009, 24(3): 31-34.
[3] 王青岩, 陈书秀. 小新月菱形藻培养基优化研究[J]. 科学养鱼, 2018(9): 27-28.
[4] 李炳乾, 刘颖芬, 刘洪岩, 等. 小新月菱形藻生长条件及半连续培养条件研究[J]. 水产科技情报, 2012, 39(2): 55-58.
[5] 任莉红. 新月菱形藻的高密度培养[D]. 烟台: 烟台大学, 2008.
[6] 褚以文. 微生物培养基优化方法及其OPTI优化软件[J]. 国外医药(抗生素分册), 1999, 20(2): 58-60; 66.
[7] 王立原. 响应面法在结构优化应用上的研究[D]. 上海: 上海海洋大学, 2018.
[8] 郝学财, 余晓斌, 刘志钰, 等. 响应面方法在优化微生物培养基中的应用[J]. 食品研究与开发, 2006, 27(1): 38-41.
[9] 孙晓富, 董超, 李文静, 等. 响应面法优化纳豆芽孢杆菌发酵制备多肽螯合钙工艺[J]. 中国酿造, 2021, 40(6): 119-123.
[10] 宋立立, 李志国. 响应面法优化枯草芽孢杆菌产蛋白酶的发酵条件[J]. 饲料研究, 2020, 43(7): 81-85.
[11] 张力. 底栖硅藻的规模化培养及其在刺参育苗中的应用[D]. 扬州: 扬州大学, 2013.
[12] SHIFRIN N S, CHISHOLM S W. Phytoplankton lipids: interspecific differences and effects of nitrate, silicate and light-dark cycles1[J]. Journal of Phycology, 1981, 17(4): 374-384.
[13] 于瑾, 蒋霞敏, 梁洪, 等. 氮、磷、铁对牟氏角毛藻生长速率的影响[J]. 水产科学, 2006, 25(3): 121-124.
[14] 如扎·哈布都拉, 王萍, 王阳, 等. Box-Behnken响应面法优化阿里红总多糖水提醇沉工艺[J]. 化学与生物工程, 2020, 37(3): 29-36.
[15] 许天阳, 董坤园, 宋凤媛, 等. Box-Behnken响应面法优化炒赤芍炮制工艺[J]. 中国药房, 2019, 30(20): 2845-2850.
[16] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索, 2015, 34(8): 41-45.
[17] 王永菲, 王成国. 响应面法的理论与应用[J]. 中央民族大学学报(自然科学版), 2005, 14(3): 236-240.
Optimization of Culture Medium ofby Response Surface Methodology
LI Qi, ZHANG Da-juan, ZHANG Shu-lin, WANG Ze-bin, JIA Ying-xuan,HUANG Lan-ying, LIANG Peng-fei, CHEN Xuan, LONG Cheng-feng
(,/,300392,)
【】 To optimize the culture medium of, and screen for optimal nutrient concentration suitable for the microalgae growth. 【】The concentration of NaNO3,NaH2PO4·H2O,Na2SiO3and C6H8FeNO7were screened among f/2medium by single factor test and the response surface methodology and verified test, and the medium formula ofwas optimized,. 【】In accordance with single factor, the nutrient concentrations suitable forare: NaNO3is 0.2,0.5 and 0.8 g/L, and NaH2PO4·H2O is 0.005, 0.007 5 and 0.01 g/L, and Na2SiO3is 0.02, 0.05and 0.08 g/L, and C6H8FeNO7is 0.001, 0.002 and 0.003 g/L. After being optimized by responding surface, the order of above 4 nutrients influencinggrowth is: NaNO3>NaH2PO4·H2O>C6H8FeNO7>Na2SiO3, and the optimal concentration of them are: NaNO30.5 g/L, NaH2PO4·H2O 0.007 5 g/L, Na2SiO30.05 g/L and C6H8FeNO70.002 g/L. Too high or too lownutrient concentration will inhibit the growth of. Cell density ofoptimizedculture medium group enhances 28.15%,significantly higher than that of f/2 medium group (< 0.05).
; nutrient; algal cell density; response surface methodology
李琦,张达娟,张树林,等. 响应面法优化小新月菱形藻培养基[J]. 广东海洋大学学报,2022,42(3):133-138
S917.1;Q949.27.8
A
1673-9159(2022)03-0133-06
10.3969/j.issn.1673-9159.2022.03.018
2021-12-29
国家自然科学基金项目(32172978);中央引导地方(天津)科技发展专项(21ZYCGSN00500;天津市淡水养殖产业技术体系创新团队-养殖水环境调控岗位(ITTFRS2021000-009);天津市教委科研计划项目(2020ZD06,2021KJ110);甘肃省科技计划项目民生科技专项(21CX6NP223)
李琦(1997―),男,硕士研究生,主要从事养殖水环境调控研究。E-mail:lqdengdeng@163.com
张树林(1963―),男,博士,教授,主要从事养殖水环境调控研究。E-mail:shulin63@sina.com
(责任编辑:刘庆颖)

