羊栖菜抑制乙酰胆碱酯酶活性油脂成分的提取优化
黎燕媚,聂影影,刘亚月,周龙建,宋 采,洪鹏志,4,张永平,胡雪琼,张 翼,,4
羊栖菜抑制乙酰胆碱酯酶活性油脂成分的提取优化
黎燕媚1,聂影影2,3,刘亚月1,周龙建1,宋 采1,洪鹏志1,4,张永平1,胡雪琼1,张 翼1,2,3,4
(1. 广东海洋大学食品科技学院 / 广东省水产品加工与安全重点实验室 / 广东省海洋生物制品工程实验室 / 广东省海洋食品工程技术研究中心 / 水产品深加工广东普通高等学校重点实验室 / 广东省现代农业科技创新中心 / 湛江市脑健康海洋药物与营养品重点实验室 / 海洋药物研究所,广东 湛江 524088 ;2. 广东海洋大学深圳研究院海洋医药研发中心,广东 深圳 518120 ;3. 大连工业大学海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;4. 南方海洋科学与工程广东省实验室(湛江市),广东 湛江 524006)
【】建立药食同源海藻羊栖菜抑制乙酰胆碱酯酶(Acetylcholinesterase,AChE)活性油脂成分的优化提取工艺,探明其主要活性组分的具体化学成分。以提取物质量浓度1 mg/mL下的乙酰胆碱酯酶抑制率× 提取物质量为指标,比较各个溶剂比、料液质量体积比、超声时间和提取次数等四个单因素水平下的抑制AChE活性成分提取效果,确定各个单因素中的最优水平范围,进而设计正交实验优化提取工艺条件;按最优提取工艺条件下提取制备粗浸膏,运用硅胶柱色谱法、薄层层析等方法对粗浸膏进行分离纯化并追踪其活性组分,运用气相色谱-质谱联用GC-MS进行成分分离与鉴定。羊栖菜抑制AChE活性成分的最优提取条件为:溶剂乙酸乙酯、石油醚体积比为5∶5,料液质量(g)体积(mL)比为1∶10,超声时间30 min,提取次数3次。此条件下对应的提取物质量浓度1 mg/mL下乙酰胆碱酯酶抑制率(%) × 提取物质量(g)的值为7.078 ± 1.038。从该粗提物中分离得到两个具有抑制AChE活性的组分Fr2和Fr3,主要成分为花生四烯酸、亚油酸、油酸等脂肪酸,Fr3还含有十四烷等多种烷烃。其抑制IC50值分别为2.69 mg/mL和5.31 mg/mL。本研究确定的基于石油醚-乙酸乙酯混合溶剂的超声提取工艺可得到较高产量的羊栖菜抑制AChE活性成分,其主要成分为脂肪酸,可能在改善记忆方面具有一定应用价值。
羊栖菜;正交实验;阿尔茨海默症;抑制乙酰胆碱酯酶活性;脂肪酸
阿尔茨海默病(Alzheimerʼs Disease,AD)是一种神经退行性疾病,其特征是神经元的破坏性改变,包括神经纤维缠结和淀粉样斑块,导致认知障碍。发病机制包括胆碱能缺失假说、基因学说、氧化应激与自由基损伤学说、炎性免疫学说、Aβ异常沉积、Tau蛋白异常磷酸化、神经血管假说以及细胞周期假说等多种假说[1, 2]。其中胆碱能缺失学说是目前治疗AD药物研发的主要机制。胆碱能缺失假说认为神经递质乙酰胆碱(Acetylcholine,ACh)的缺失在AD病理学中起关键作用,ACh是处理记忆和学习过程必不可少的一种神经递质[3]。ACh存储在神经元的突触囊泡中,当突触囊泡发生胞外作用时,ACh被释放到突触间隙并与ACh受体结合产生信号传导作用[4],乙酰胆碱酯酶(Acetylcholinesterase,AChE)可将ACh分解为胆碱和醋酸盐从而终止神经传导信号的发生[5]。
羊栖菜(,也称),别名鹿角尖、海菜芽、羊奶子、海大麦等,属褐藻类马尾藻科,食用和药用价值越来越受到重视[6]。目前对羊栖菜的功能活性成分的研究主要集中在抗肿瘤[7]、抗氧化[8]、治疗心血管疾病和提高免疫力方面[9]。研究表明,羊栖菜中多种提取成分与治疗AD也具有密切关系。羊栖菜多糖可能通过调控和基因的表达来抑制细胞凋亡从而可以干预AD的发生[10];羊栖菜多酚通过增强体内抗氧化能力,减少氧化产物的堆积以降低脑组织的损伤来预防AD的发生[11];羊栖菜中甾醇24(S)-Saringosterol的抗炎作用可能有助于预防认知能力下降[12]。可见羊栖菜在开发改善记忆、防治阿尔茨海默症的功能食品或药物方面也具有较好应用前景。
本实验室前期从产自浙江洞头的食用海藻羊栖菜中发现了一种功能性油脂HFFO(functional oil),其具有较强的抑制AChE活性,且主要的活性化合物为花生四烯酸和11,14,17-二十碳三烯酸[13]。但前期研究采用的溶剂系统(氯仿-甲醇)对功能食品的溶剂使用许可及实际生产中可能会造成的残留等问题考虑不足,且提取工艺也未经优化。基于此,本研究考虑到今后可能的功能食品用途,采用没有足够毒性资料的第四类溶剂[14]石油醚和对人类风险较低的第三类溶剂[15]乙酸乙酯作为溶剂体系,通过考察溶剂比、料液质量体积比、超声提取时间、提取次数等因素对羊栖菜中HFFO提取效果的影响,优化HFFO粗品提取的工艺条件,对在此条件下进一步纯化分离得到的HFFO进行抑制AChE活性评价和具体成分的分析,旨在为大规模制备HFFO成分用于深入的动物模型功效研究提供理论依据。
1 材料与方法
1.1 材料
羊栖菜,2020年08月购自浙江省温州市洞头金海水产,为养殖产品;HFFO(作为本研究提取物的抑制AChE活性的对照,实验室原保存),采用氯仿甲醇混合溶液提取,经过柱层析分离纯化,详细制备方法见文献[13];石油醚(分析纯,国药集团化学试剂有限公司,批号20200620);乙酸乙酯(分析纯,广东光华科技股份有限公司,批号20200516);正己烷(分析纯,广东光华科技股份有限公司,批号20200509);溴甲酚绿(天津市北辰方正试剂厂);乙酰胆碱酯酶(AChE)(Sigma-Aldrich公司,批号C3389);碘化硫代乙酰胆碱(ATCI)(Sigma-Aldrich公司,批号A0048);5,5-二硫代二硝基苯甲酸(DTNB)(Sigma-Aldrich公司,批号D8130);牛血清白蛋白(BSA)(上海源叶生物科技有限公司,批号L27M11S113313);GF254硅胶高效薄层层析板,购自德国默克公司;酶标板(NEST®品牌96孔平孔板-300 μL,无锡耐思生命科技股份有限公司)。
1.2 仪器
400Y型粉碎机(铂欧五金制品有限公司);KH-300ZDE型超声波清洗机(昆山禾创有限公司);SB-1300型旋转蒸发仪(上海爱朗仪器有限公司);WFH-201B型多功能紫外透射仪(上海精科实业有限公司);HPX-9082MBE型电热恒温培养箱(上海博讯实业有限公司);Biotek Epoch2型酶标仪(美国博腾有限公司);GCMS-QP2010 Ultra型气质联用仪(日本岛津公司)。
2 方法
2.1 样品预处理
将羊栖菜除去杂质后,置于烘箱内40 ℃干燥1 h,放入粉碎机中粉碎(粉末粒度约1 mm),4 ℃下密封保存备用。
2.2 羊栖菜中抑制乙酰胆碱酯酶活性样品成分的提取工艺条件
2.2.1 单因素实验的设计 称取羊栖菜粉末每份25 g于500 mL锥形瓶中,加入一定比例的乙酸乙酯和石油醚混合溶液后静置常温浸泡12 h后,固定超声功率360 W。考虑到样品活性强度和得率均为重要目标,故以1 mg/mL剂量下的AChE抑制率×提取物质量为指标,分别考察提取溶剂比(石油醚、乙酸乙酯体积比10∶0,石油醚、乙酸乙酯体积比8∶2,石油醚、乙酸乙酯体积比5∶5,石油醚、乙酸乙酯体积比3∶7,石油醚、乙酸乙酯体积比0∶10),料液质量(g)体积(mL)比(1∶8、1∶10、1∶12、1∶16),超声时间(0、10、20、30、40 min),提取次数(1、2、3、4)对羊栖菜中抑制AChE活性油脂成分的提取效果的影响。每个考察因素均设4 ~ 5个水平,3个平行。
2.2.2 正交实验的设计 通过单因素实验确定溶剂比、料液质量体积比、超声时间、提取次数各因素的最优实验范围,因素水平表见表1。在单因素实验的基础上采用四因素三水平L9(34)表进行正交试验优化。由于考虑到正交表L9(34)各列均被因素排满,表中未留下空列,也无历史资料提供经验误差,为了避免增加试验次数,不使用更大的正交表,故参照文献[16]设置重复实验,估算实验误差,以进行方差分析。每项实验平行重复3次,以1 mg/mL剂量下的AChE抑制率(%)×提取物质量(g)为指标,确定羊栖菜中抑制AChE活性油脂成分的最佳提取条件。按最佳提取条件进行提取,评定提取效果。

表1 正交实验因素水平
2.2.3 羊栖菜粗浸膏得率的测定方法 称取25 g羊栖菜粉末于500 mL锥形瓶中,按照一定的条件进行提取,提取结束后进行常压过滤,将滤液在真空旋转蒸发仪上进行浓缩后,得羊栖菜粗浸膏。然后根据以下公式计算羊栖菜粗浸膏的质量。
羊栖菜粗浸膏的质量 =2–1,
式中,2为浓缩样品后瓶子的总质量,1为空旋蒸瓶质量。
2.2.4 羊栖菜粗浸膏薄层层析及生物自显影分析 参照文献[17],略有改动。对各因素水平下获得的羊栖菜粗浸膏以石油醚、乙酸乙酯体积比4∶1为展开剂进行薄层层析(Thin Layer Chromatography,TLC)展开,记录254 nm紫外图像、365 nm荧光图像、乙酰胆碱酯酶抑制活性自显影图像和溴甲酚绿显色图像。溴甲酚绿显色实验步骤:0.1 g溴甲酚绿溶于500 mL乙醇中,缓慢加入0.1 mol/L NaOH溶液,至刚好出现蓝色沉淀。用配制好的溴甲酚绿显色剂均匀喷在GF254板子上,脂肪酸类物质会在蓝色背景产生黄色斑点,然后拍照记录即时图像。
2.2.5 羊栖菜粗浸膏中抑制AChE活性的测定 参照文献[17],略有改动。每孔的反应体系均为100 µL,先将各因素水平下获得的羊栖菜粗浸膏样品用DMSO配制成100 mg/mL溶液,设置四个组,样品组(A1):加入配好的待测样品1 µL + 49 µL 磷酸盐缓冲液PBS(100 mmol/L)+ 10 µL AChE溶液(0.2 U/mL)+ 20 µL DTNB(5 mmol/L),将板子置于控温培养箱中,37 ℃孵育10 min,然后加入20 µL底物ATCI(10 mmol/L),再放入37 ℃培养箱中恒温孵育20 min ;样品对照组(A2)将AChE溶液换成BSA(1 mg/mL),其它操作同样品组;空白组(A3):不加入样品,其它同样品组;空白对照组(A4):不加入样品,其它同样品对照组。全部孵育完成,将96孔板置于酶标仪,测定其在405 nm波长下的光密度值,根据公式计算AChE抑制率(%):
AChE抑制率 = [(A3A4)-(A1A2)]/(A3A4),
式中,A1为样品组溶液的光密度;A2为样品对照组溶液的光密度;A3为空白组溶液的光密度;A4为空白对照组溶液的光密度。
2.3 羊栖菜粗浸膏中抑制乙酰胆碱酯酶活性成分的分离纯化
2.3.1 常压正相硅胶柱(硅胶粒径为0.048 mm ~ 0.075 mm)分离活性组分 称取200 g羊栖菜粉末按照2.2.2节的步骤得到的最佳提取条件进行提取得到粗浸膏。运用硅胶柱色谱方法,将粗浸膏进行初步分离纯化以除去色素。分离纯化步骤如下:依次用石油醚、98%(体积分数,本节同)石油醚、95%石油醚、90%石油醚、85%石油醚、80%石油醚、70%石油醚、100 %乙酸乙酯进行洗脱,得到8个组分Fr1 ~ Fr8。采用2.2.4节方法确定活性组分。
2.3.2 活性组分抑制乙酰胆碱酯酶活性IC50的测定 活性组分溶解于DMSO中并配成系列浓度(1.000 0、0.500 0、0.250 0、0.125 0、0.062 5、0.031 3、0.015 6 mg/mL),测定步骤同2.2.5节,在酶标板中分别测定活性组分系列浓度的AChE抑制率,盐酸多奈哌齐作为阳性对照。IC50值是化合物对AChE抑制率为50%所对应的浓度。以抑制率为纵坐标和浓度对数(ln)为横坐标导入Origin 8.0软件。通过3次多项式回归方程拟合得到浓度对数曲线,并计算得到ln(IC50)和IC50。
2.4 羊栖菜粗浸膏中抑制乙酰胆碱酯酶活性组分的气质联用分析
2.4.1 样品前处理(甲酯化) 根据活性结果,分别称取抑制AChE抑活性最强的组分Fr2和组分Fr3各40 mg,用1 mL的正己烷溶解,加入1 mL 0.4 mol/L的氢氧化钠-甲醇溶液,充分振荡,置于70 ℃水浴中超声1 h。静置后,取出上层清液,加入饱和食盐水至9 mL,于5 000 r/min条件下离心10 min。静置后,样品分3层(上层为甲酯化产物,中层为未甲酯产物,下层为水层),取出上层溶液,在旋转蒸发仪上浓缩干燥后称其质量,用正己烷配成1 mg/mL溶液,过孔径0.22 μm有机滤膜,备用。
2.4.2 气相色谱-质谱联用GC-MS条件 柱温箱80 ℃,进样口温度280 ℃,分流比为5,载气为He,升温程序如下:0 ~ 2 min,80 ℃;2 ~ 6 min,80 ~ 120 ℃;6 ~ 11 min,120 ℃;11 ~ 16 min,120 ~ 180 ℃;16 ~ 22 min,180 ℃;22 ~ 32 min,180 ~ 280 ℃;32 ~ 60 min,280 ℃。离子源温度为250 ℃,接口温度为280 ℃,质荷比m/z范围为50 ~ 500。通过与美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)谱图库和中国科学院南海海洋研究所的GC-MS 系统谱图库比对来确定化合物的成分。
2.5 数据统计方法
本研究中所有实验重复3次,单因素实验结果分析均用Graphpad Prism 8.0作图,采用One-way ANOVA和Dunnett′s post hoc检验评价每个因素中不同水平之间的差异。正交试验的方差分析用软件SPSS 25进行分析处理。
3 结果与分析
3.1 不同提取条件羊栖菜粗浸膏中抑制乙酰胆碱酯酶活性成分比较
如图1(A3~D3)所示,着色背景上的空白斑点为抑制AChE活性成分所在,结果表明各单因素的不同水平下羊栖菜粗浸膏抑制AChE活性均较强,活性组分均分布在f(活性组分的迁移距离与展开剂的迁移距离之比)为0.5左右,相应活性位置的溴甲酚绿显色均为黄色(图1(A4-D4)),可初步判定此位置上的活性物质为具有抑制AChE活性的脂肪酸类物质,可见不同提取条件对活性产物的成分种类可能影响不大,但从抑制斑点面积看主要影响其产率,故进一步通过定量评价提取效果的单因素分析和正交试验。

A1 ~ D1: 254 nm紫外图像;A2 ~ D2: 365 nm荧光图像;A3 ~ D3: 抑制AChE活性自显影;A4 ~ D4: 溴甲酚绿显色。
3.2 不同条件对羊栖菜抑制乙酰胆碱酯酶活性成分提取的影响(单因素实验)
3.2.1 溶剂比对羊栖菜抑制AChE活性成分提取的影响 结果如图2所示,随着乙酸乙酯比例的增大,1 mg/mL 剂量下AChE抑制率×粗浸膏质量的值随之增大,当溶剂石油醚、乙酸乙酯体积比为0∶10时达到最大的值。因此选取溶剂石油醚、乙酸乙酯体积比为5∶5、3∶7、0∶10为正交实验的水平范围值。

料液质量(g)体积(mL)比为1∶10,超声时间20 min,提取1次。与溶剂体积比10∶0 比较,*表示P < 0.05,**表示P <0.01,***表示P < 0.001。
3.2.2 料液质量体积比对羊栖菜抑制AChE活性成分的影响 结果如图3所示,当料液质量(g)体积(mL)比为1∶10时,1 mg/mL剂量下AChE 抑制率×粗浸膏质量的值达到最大。因此,选取料液质量(g)体积(mL)比1∶8、1∶10、1∶12为正交实验的水平范围值。
3.2.3 超声时间对羊栖菜抑制AChE活性成分提取的影响 结果如图4所示,随着超声时间的增加,1 mg/mL 剂量下AChE抑制率×粗浸膏质量的值随之增大,当超声时间为30 min时,达到最大值。因此,选取超声时间20、30、40 min作为正交实验的水平范围值。
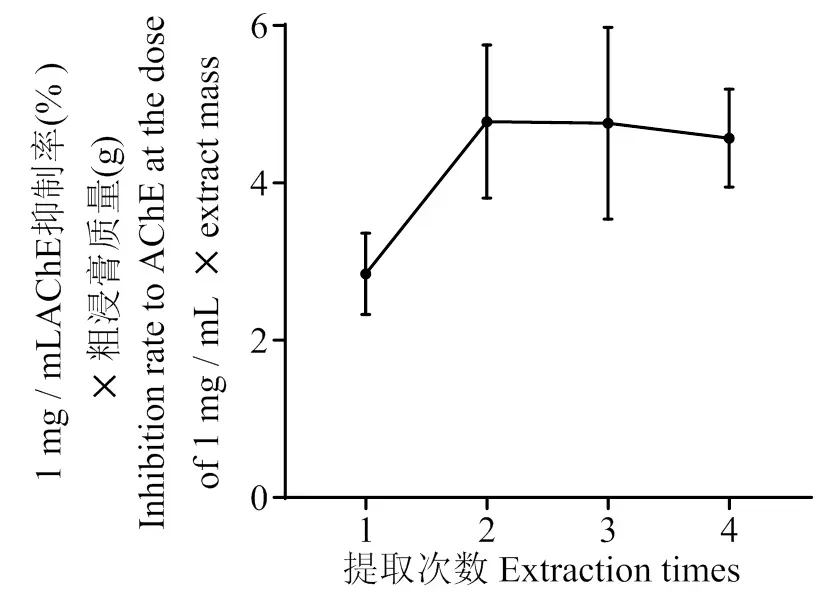
3.2.4 提取次数对羊栖菜抑制AChE活性成分提取的影响 结果如图5所示,随着提取次数的增加,1 mg/mL 剂量下AChE 抑制率×粗浸膏质量的值随之增大。当提取次数为3次时,达到最大值。因此,选取提取次数2、3、4次作为正交实验的水平范围值。
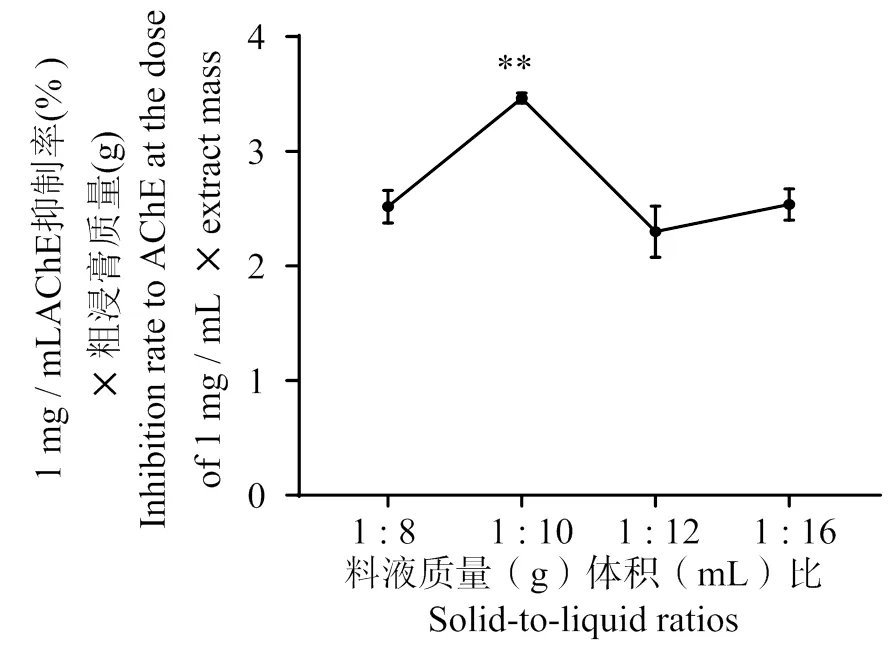
溶剂体积比为5∶5,超声时间20 min,提取1次。与料液质量比1∶12 比较,**表示P < 0.01。
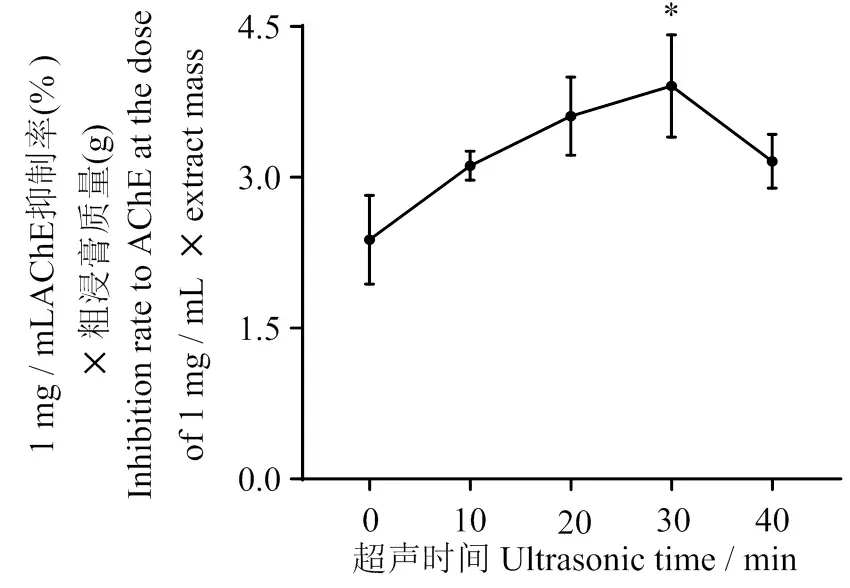
溶剂体积比为5∶5,料液质量体积比为1∶10,提取1次。与超声时间0 min比较,*表示P < 0.05。
3.3 不同条件对羊栖菜抑制乙酰胆碱酯酶活性成分提取的影响(正交实验)
正交实验结果如表2、3。由正交实验结果值可知,以1 mg/mL 剂量下AChE抑制率×粗浸膏质量的值为指标考察羊栖菜抑制乙酰胆碱酯酶活性成分的最佳提取条件为1222,即溶剂石油醚、乙酸乙酯体积比为5∶5,料液质量(g)体积(mL)比为1∶10,超声时间为30 min,提取次数3次。由正交实验结果值和方差分析结果可知,四个因素对结果的影响顺序依次为:溶剂比()>超声时间()>提取次数()>料液比()。
按照确定的最佳提取工艺1222,即溶剂石油醚、乙酸乙酯体积比为5∶5,料液质量(g)体积(mL)比1∶10,超声时间30 min,提取次数3次,此提取条件下羊栖菜粗浸膏质量为(0.240±0.014)g,1 mg/mL粗浸膏的AChE抑制率为(25.251±1.157)%,1 mg/mL粗浸膏的AChE抑制率×粗浸膏质量的值为6.061±0.414,指标值高于正交实验中其他试验号,说明该工艺可靠、稳定。
溶剂体积比为5∶5,料液质量体积比为1∶10,超声时间20 min。
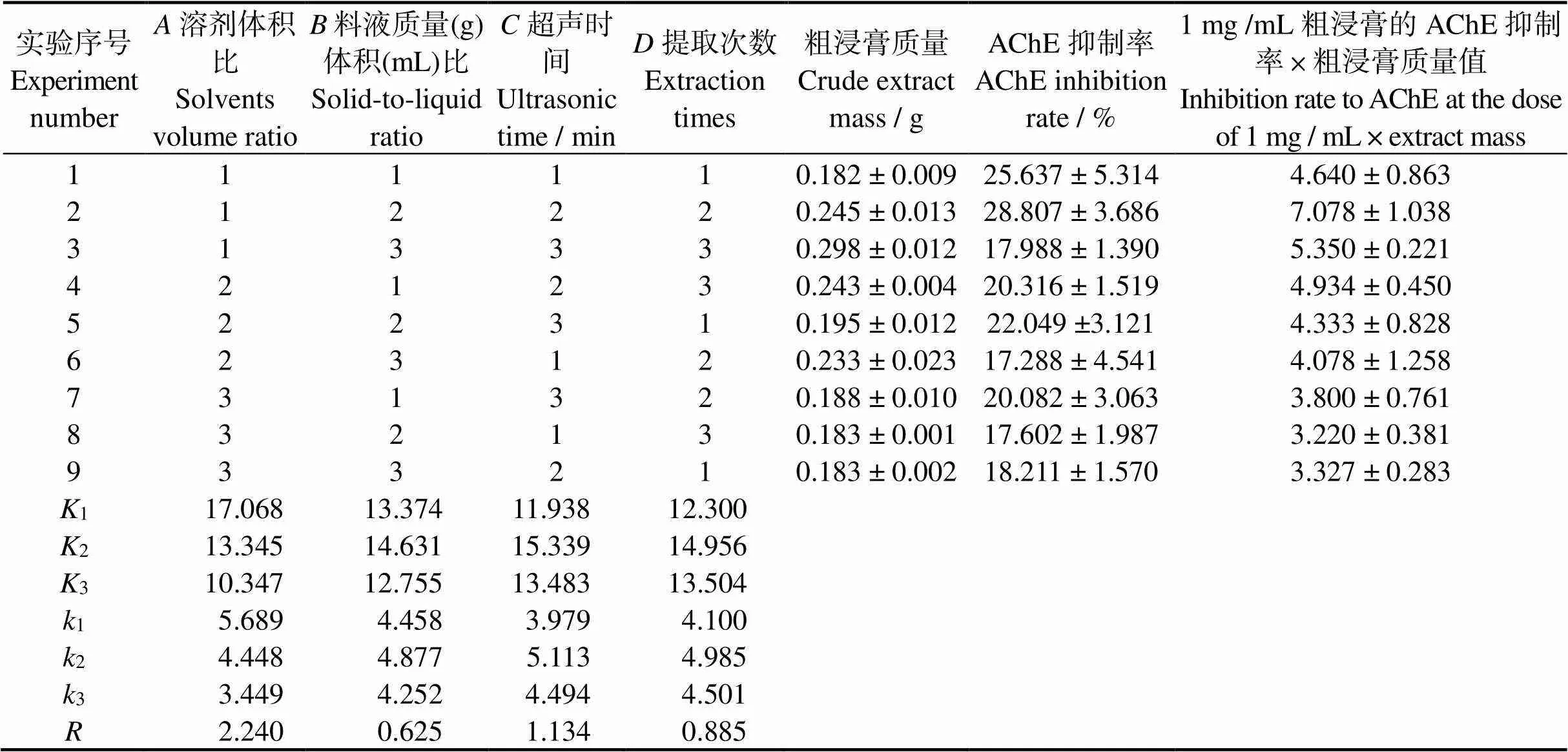
表2 羊栖菜中抑制乙酰胆碱酯酶活性成分提取工艺正交实验结果

表3 羊栖菜中抑制乙酰胆碱酯酶活性成分提取工艺正交实验方差分析
注Note: ***表示差异极显著highly significant difference(< 0.001)。
3.4 羊栖菜粗浸膏中抑制乙酰胆碱酯酶活性组分分离纯化
由图6(C、D)可知,羊栖菜抑制AChE活性成分可能存在于 Fr2 ~ Fr4组分中,但是组分Fr4已经有比较重的色素成分(图6(B)),为避免色泽对后续保健功能食品开发的影响,暂不对Fr4组分进行下一步的研究。由表4可知,组分Fr2的抑制AChE的IC50值为2.69 mg/mL,组分Fr3的抑制AChE的IC50值为5.31 mg/mL,两者均有一定的AChE抑制活性,因此后续的分析主要集中在组分Fr2和Fr3中。

A:254nm紫外图像;B:365nm荧光图像;C:乙酰胆碱酯酶抑制活性自显影;D:溴甲酚绿显色

表4 各组分的抑制AChE活性
3.5 羊栖菜抑制乙酰胆碱酯酶活性组分分析
3.5.1 亚组分Fr2的气质联用分析 经过活性引导分离得到一个具有一定抑制AChE活性的亚组分Fr2,对其进行GC-MS分析,结果见表5。其不饱和脂肪酸占比为64.54%,其成分主要有亚油酸(23.08%)、油酸(31.73%)、花生四烯酸(7.04%)、二十碳五烯酸(2.69%)。饱和脂肪酸中,棕榈酸成分最大,占比17.37%。

表5 GC-MS分析揭示经过甲酯化处理的Fr2主要成分
3.5.2 亚组分Fr3的气质联用分析 活性亚组分Fr3的主要成分中,不饱和脂肪酸占比为8.92%,其中花生四烯酸占主要成分,占比5.25%。其余组分为烷烃类(30.49%)、2,4-(1,1-二甲基乙基)-苯酚(3.42%)、1-丁基-2-(8-甲基壬基)-邻苯二甲酸酯(2.18%)、6,6ʼ-双(2-叔丁基-3-甲基苯酚)甲烷(3.16%)等(表6)。
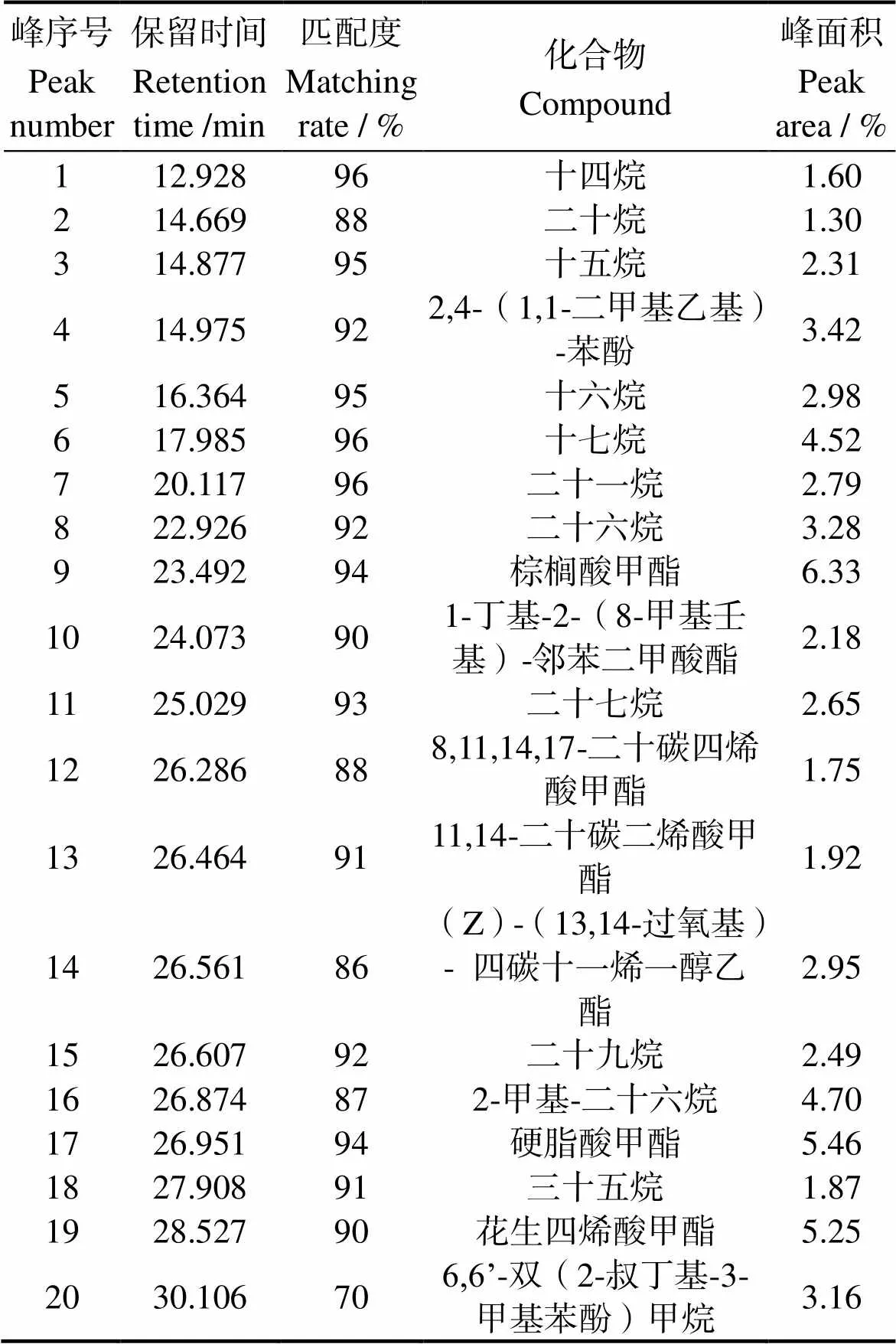
表6 GC-MS分析揭示经过甲酯化处理的Fr3组分主要成分
4 讨论与结论
本研究表明,羊栖菜抑制AChE活性油脂成分的最优提取条件:溶剂石油醚、乙酸乙酯体积比为5∶5,料液质量(g)体积(mL)比为1∶10,超声时间为30 min,提取次数3次。周佩佩等[18]研究表明,超声结合溶剂浸提法能够更好提取海藻中的总脂成分。常用的溶剂有石油醚、乙醚、乙酸乙酯、氯仿、甲醇等两种或多种溶剂的组合等,本实验考虑到后续功能食品等方面的应用,未采用本实验前期HFFO提取方法中的氯仿、甲醇等溶剂,而改用了相对安全的石油醚-乙酸乙酯混合溶剂[14,15]。在基于石油醚-乙酸乙酯的溶剂提取单因素实验结果分析中,随着乙酸乙酯用量的增加,1 mg/mL下的乙酰胆碱酯酶抑制率×提取物质量值随之增加,这可能是因为乙酸乙酯比石油醚更加能溶解羊栖菜中的油脂成分。张秀研等[19]研究表明,乙酸乙酯作为提取溶剂时,油脂产率比石油醚的高。本研究中,当料液质量(g)体积(mL)比在1∶10时,1 mg/mL下的乙酰胆碱酯酶抑制率×提取物质量值达到最大值,随着料液比的增大,其值反而下降。通常适当的料液比可使原料浸泡更加充分,达到更好的分离效果,当溶剂量达到一定程度后,物料与溶剂之间会趋于平衡[20]。夏梦露等[21]在对影响铜藻()多不饱和脂肪酸的提取因素的研究中发现,适当的料液比可增加铜藻中多不饱和脂肪酸的提取量,而料液比过大,铜藻中多不饱和脂肪酸的提取量反而减少。而且,在保证能达到足够得率后,采用更高的料液比也会造成实际生产中成本的增加,故本研究中最终采用1∶10的料液比。在本研究中,当超声时间为30 min时,1 mg/mL下的乙酰胆碱酯酶抑制率×提取物质量值达到最大值,之后随着超声时间的增加,其值反而下降,出现下降的原因可能是由于油脂中存在一些挥发性成分[22],在提取时间过长,超声热效应过大,温度过高时,挥发性成分会损失,导致油脂提取率下降。且超声过长不仅增加成本,还可能会使油脂的成分受到影响。超声的空泡效应可能导致羟基自由基的产生,过强的超声处理会导致多酚等易氧化植物活性成分的破坏[23]。在脂质提取中也有类似现象报道,Hadiyanto等[24]在研究超声辅助渗透压冲击法提取钝顶螺旋藻中脂质组分中发现,随着超声时间的延长,脂质提取率增大,当超声时间35 min时达到最大值,之后随着超声时间延长,脂质提取率下降。夏梦露等[21]也发现,适当的超声提取时间可提高铜藻中多不饱和脂肪酸的提取率,而超声时间过长反而导致多不饱和脂肪酸提取率的下降。
本研究分离得到亚组分Fr2和Fr3的成分主要包括棕榈酸、油酸、亚油酸、花生四烯酸、二十碳五烯酸等,前期实验室分离得到的HFFO样品主要含有花生四烯酸、11,14,17-二十碳三烯酸、棕榈酸和植物醇等[13]。两者在成分上有一定的差异,出现这种差异的原因可能有:1)很多研究表明[25-27],海藻中的脂肪酸种类和含量会随着生长地域、环境、季节等变化而呈现显著差异。2)考虑到实验室前期研究所用的溶剂体系与本研究不同,这也可能导致实验室HFFO样品成分与亚组分Fr2和Fr3在成分上有较大的差异。前期实验室分离得到的HFFO抑制AChE的IC50值为1.09 mg/mL,且生物活性追踪证实AChE抑制活性主要来自花生四烯酸和11,14,17-二十碳三烯酸。亚组分Fr2和Fr3的AChE抑制IC50值分别为2.69 mg/mL、5.31mg/mL,Fr3的AChE抑制IC50值拟合方程2距离1有较大偏离,可能是因为Fr3的AChE抑制活性比较弱,测量误差较大导致的。亚组分Fr2和Fr3主要的活性来源也可能是花生四烯酸。另外Fr2组分中油酸、亚油酸也为主要的成分,它们不仅是构成人体组织的重要组成成分,还具有预防心血管疾病的作用,也曾被报道过具有温和的抑制AChE活性,其抑制AChE的IC50值分别为12.01 μg/mL和18.17 μg/mL[28]。
相对于前人关于羊栖菜的多糖、多酚、甾醇等抗AD成分研究开发[10-12],本研究更注重其不饱和脂肪酸的利用,且本研究在安全提取溶剂方面进行了有益探索。季节对活性成分化学组成差异的影响有待进一步研究,其确切体内功效还有待深入的动物模型实验验证。
综上所述,本研究建立了一种药食同源海藻羊栖菜中抑制AChE活性组分HFFO的优化提取与纯化制备工艺,验证了优化工艺下提取产物的抑制AChE活性,发现基于石油醚-乙酸乙酯超声提取羊栖菜中抑制AChE活性组分HFFO的最优提取条件为溶剂乙酸乙酯、石油醚体积比5∶5,料液质量(g)体积(mL)比1∶10,超声时间30 min,提取次数3次,将此提取条件下提取得到的羊栖菜粗浸膏结合柱层析法分离纯化制备得到了两个活性油脂组分Fr2和Fr3,其抑制AChE的IC50值分别为2.69 mg/mL和5.31 mg/mL,并通过GC-MS揭示了Fr2和Fr3活性组分主要富含花生四烯酸、油酸、亚油酸等成分,在制备辅助改善记忆的功能食品方面可能具有一定的应用价值。
[1] 余茂强, 吴绍长, 杨华. 阿尔茨海默病的病机相关性研究概况[J]. 中国现代医生, 2020, 58(17): 183-187.
[2] AZIZI G, MIRSHAFIEY A. The potential role of proinflammatory and antiinflammatory cytokines in Alzheimer disease pathogenesis[J]. Immunopharmacology and Immunotoxicology, 2012, 34(6): 881-895.
[3] FRANCIS P T. The interplay of neurotransmitters in Alzheimer's disease[J]. CNS Spectrums, 2005, 10(11 Suppl 18): 6-9.
[4] RUFF R L. Neurophysiology of the neuromuscular junction: overview[J]. Annals of the New York Academy of Sciences, 2003, 998(1): 1-10.
[5] NEKOEINIA M, YOUSEFINEJAD S. QSAR analysis of the acetylcholinesterase inhibitory activity of some tertiary amine derivatives of cinnamic acid[J]. Structural Chemistry, 2021, 32(3): 1123-1132.
[6] 李时珍. 本草纲目[M]. 北京: 燕山出版社, 2007: 1718-1721.
[7] 丁浩淼, 洪嘉瑶, 陈雪佳, 等. 羊栖菜多糖抗肿瘤及其作用机制研究进展[J]. 海洋科学, 2020, 44(3): 129-137.
[8] 何丹, 张旭, 肖保衡, 等. 羊栖菜多糖的提取和抗氧化活性研究[J]. 海洋科学, 2016, 40(12): 24-29.
[9] 阮积惠. 羊栖菜的药用功能研究现状[J]. 中国野生植物资源, 2001, 20(6): 8-10.
[10] 汤从容, 曹高忠, 叶晓兰. 羊栖菜多糖对老年痴呆模型大鼠和基因表达的分析[J]. 中华中医药学刊, 2012, 30(8): 1832-1834.
[11] 旷明丽, 张骏. 羊栖菜褐藻多酚对D-半乳糖致小鼠老年痴呆模型的干预作用[J]. 广东医学, 2014, 35(13): 1984-1986.
[12] MARTENS N, SCHEPERS M, ZHAN N, et al. 24(S)-saringosterol prevents cognitive decline in a mouse model for Alzheimer's disease[J]. Marine Drugs, 2021, 19(4): 190.
[13] YANG W C, ZHANG Y Y, LI Y J, et al. Chemical composition and anti-Alzheimer's disease-related activities of a functional oil from the edible seaweed[J]. Chemistry & Biodiversity, 2020, 17(8): e2000055.
[14] 李平, 迟颖红, 陈东英. 药物中石油醚残留量的气相色谱检测方法学探讨[J]. 药物分析杂志, 2008, 28(3): 427-430.
[15] LEE J M, MICHAEL Z, THAO T, et al. Headspace gas chromatography-flame ionization detector method for organic solvent residue analysis in dietary supplements[J]. Journal of AOAC International, 2006, 89(6): 1475-1482.
[16] 汤明辉, 寇俊萍, 朱丹妮. 正交设计-重复试验法优选当归芍药散的提取工艺[J]. 中国中药杂志, 2000, 25(11): 668.
[17] 张翼, 鲍海燕, 聂影影, 等. 海洋真菌抗老年痴呆相关活性成分的筛选与追踪研究[J]. 现代食品科技, 2016, 32(11): 63-71.
[18] 周佩佩. 海藻中脂肪酸的提取和分析方法研究[D]. 温州: 温州大学, 2016.
[19] 张秀妍. 海鞘油脂提取工艺及其氧化稳定性的研究[D]. 大连: 大连理工大学, 2004.
[20] SICAIRE A G, VIAN M A, FINE F, et al. Ultrasound induced green solvent extraction of oil from oleaginous seeds[J]. Ultrasonics Sonochemistry, 2016, 31:319-329.
[21] 夏梦露. 铜藻中多不饱和脂肪酸的提取和纯化方法研究[D]. 杭州: 浙江工商大学, 2020.
[22] 张敏. 五种经济海藻代谢成分及代谢机制的初步研究[D]. 苏州: 苏州大学, 2011.
[23] 姬长舟, 任建武. 超声空化效应及其对植物活性成分抗氧化性的影响[J]. 绿色科技, 2017(4): 148-151.
[24] HADIYANTO H, ADETYA N P. Response surface optimization of lipid and protein extractions fromusing ultrasound assisted osmotic shock method[J]. Food Science and Biotechnology, 2018, 27(5): 1361-1368.
[25] DA COSTA E, DOMINGUES P, MELO T, et al. Lipidomic signatures reveal seasonal shifts on the relative abundance of high-valued lipids from the brown algae[J]. Marine Drugs, 2019, 17(6): 335.
[26] MOREIRA A S P, DA COSTA E, MELO T, et al. Seasonal plasticity of the polar lipidome ofcultivated in a sustainable integrated multi-trophic aquaculture[J]. Algal Research, 2020, 49: 101958.
[27] MOHY EL-DIN S M. Temporal variation in chemical composition ofand[J]. International Journal of Environmental Science and Technology, 2019, 16(10): 5783-5796.
[28] 吴青. 酸枣仁中乙酰胆碱酯酶抑制剂的筛选研究[D]. 长沙: 湖南师范大学, 2013.
Extraction Optimization of Acetylcholinesterase Inhibitory Active Oils from
LI Yan-mei1, NIE Ying-ying2,3, LIU Ya-yue1, ZHOU Long-jian1, SONG Cai1, HONG Peng-zhi1,4, ZHANG Yong-ping1, HU Xue-qiong1, ZHANG Yi1,2,3,4
(1.,,,,,,,,,,524088,; 2.,,518120,; 3.,,116034,; 4.(),524006,)
【】To establish an optimized extraction process for acetylcholinesterase (AChE) inhibitory components fromand to analyze and identify the chemical constituents. 【】Taking the product of inhibition rate to AChE at the dose of 1 mg/mL and extract mass (PIREM) as indicator, the optimal level range of each single factor was determined by comparing the extraction effects under different ratios of solvents, ratios of solid to liquid, ultrasonic times, and extraction times. Then, the extraction process was optimized by orthogonal experiment design. Under the optimal extraction condition,was extracted to obtain the crude extract, which was separated and purified to trace the active components by silica gel column chromatography and thin layer chromatography. Finally, the constituents of the product was analyzed by gas chromatography-mass spectrometry. 【】The results showed that the optimal extraction condition was, volume ratio of ethyl acetate topetroleum ether is 5∶5 as solvent, solid-liquid ratio = 1∶10 (g/mL), ultrasonical extraction for 30 min and three times. The PIREM value was 7.078 ± 1.038 for the crude extract obtained under this condition. From this extract, two main active components Fr2 and Fr3 were prepared with inhibitory IC50values of 2.69 mg/mL and 5.31 mg/mL, respectively. Their main constituents were revealed to be fatty acids like arachidonic acid, linoleic acid, oleic acid and also rich alkanes like tetradecane in Fr3. 【】By the supersonic extraction process based on mixed solvent of petroleum ether and ethyl acetate in this study, high yield of AChE inhibitory components can be prepared from. This product mainly contains fatty acids and may be applicable for improving memory.
; orthogonal experiment; Alzheimer's disease; acetycholinesterase inhibition; fatty acid
黎燕媚,聂影影,刘亚月,等. 羊栖菜抑制乙酰胆碱酯酶活性油脂成分的提取优化[J]. 广东海洋大学学报,2022,42(3):97-106.
Q547
A
1673-9159(2022)03-0097-10
10.3969/j.issn.1673-9159.2022.03.013
2021-12-30
广东省科技专项资金-基础与应用基础研究专题(2021A05240);广东省普通高校重点领域专项(生物医药与健康)(2021ZDZX2064);深圳市大鹏新区科技研发项目(KJYF202001-07);深圳市科创委基础研究面上项目(JCYJ20190813105005619);深圳市大鹏新区产业发展资金(KY20180203);国家自然科学基金(21807015);广东省扬帆计划引进紧缺拔尖人才项目(201433009);湛江市海洋经济创新发展示范市建设项目(湛海创XM-202008-01B1);广东省高等学校科技创新团队项目(2021KCXTD021)。
黎燕媚(1994―)女,硕士研究生,研究方向为海洋天然产物。E-mail:guangdongliyanmei@163.com
张翼(1978―),男,博士,教授,研究方向为海洋天然产物。E-mail:hubeizhangyi@163.com
(责任编辑:刘朏)

