不同方法制备豌豆-草鱼双蛋白的热诱导凝胶特性比较
周小虎,章超桦,赵良忠,周晓洁,黄展锐,周春霞,曹文红,郑惠娜
不同方法制备豌豆-草鱼双蛋白的热诱导凝胶特性比较
周小虎1,2,章超桦1,3,赵良忠2,周晓洁2,黄展锐2,周春霞1,3,曹文红1,3,郑惠娜1,3
(1.广东海洋大学食品科技学院 // 广东省水产品加工与安全重点实验室,广东 湛江 524088;2.邵阳学院食品与化学工程学院 // 豆制品加工与安全控制湖南省重点实验室,湖南 邵阳 422000;3.大连工业大学/海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
【】基于热诱导凝胶特性评价共混合法和共沉淀法制备豌豆(L.)-草鱼()双蛋白的优劣。以豌豆和草鱼为原料,采用等电点共沉淀法制备豌豆分离蛋白(PPI)、草鱼分离蛋白(CPI)和豌豆-草鱼共沉淀双蛋白(Co);将PPI与CPI以质量比1∶1直接混合得到豌豆-草鱼共混合双蛋白(BL)。以单一蛋白PPI、CPI为对照,分析4种蛋白质的理化性质和热诱导蛋白凝胶品质,比较BL和Co的热诱导凝胶结构和性质。与BL比较,Co的游离巯基含量更高(<0.05),表面疏水性更低(<0.05),vicilin与legumin α+β光密度比值是BL的2.82倍。Co热诱导凝胶品质较好,持水性和硬度分别为91.75%、42.60 g,显著高于BL、PPI、CPI(<0.05),微观结构均匀、致密,凝胶性质总体优于PPI、CPI、BL,体现协同增强作用;BL则表现出一定的拮抗效应。共沉淀法制备的双蛋白热诱导凝胶特性优于共混合法。
双蛋白;共沉淀;共混合;凝胶特性;豌豆蛋白;草鱼蛋白
目前,优质动物蛋白质如肉、蛋、乳的需求不断增加,但高动物蛋白膳食模式会导致温室气体过度排放。植物蛋白更为经济,但植物蛋白难以全面满足必需氨基酸需求,纯素膳食不适合所有消费群体[1,2]。动植物蛋白混合属于“蛋白质互补”,能较好满足营养和环保的需求。我国提出“双蛋白工程”战略,在《国民营养计划》将双蛋白描述为:以优质动物、植物蛋白为主要营养基料制成的食品[3]。
双蛋白按制备方法可分为共混合双蛋白(Protein blends,BL)和共沉淀双蛋白(Protein co-precipitates,Co)[4]。BL指分离蛋白直接混合制成的蛋白。研究表明豌豆与鳕()分离蛋白BL的乳化性比单一蛋白更好,体现协同效应[5]。而研究证实,BL由于蛋白来源不同,其分子物理构型(植物球蛋白、动物肌纤维蛋白)不相容产生的空间位阻会破坏凝胶结构,导致凝胶特性出现拮抗效应[6,7]。Co采用等电点-共沉淀法制备而成,具体是在pH的驱动下,不同来源的蛋白质在同一体系中同时溶解和沉淀,促进异源蛋白之间的相互作用,生成二硫键,改变蛋白质亚基组成、表面电荷、溶解性和表面疏水性,从而有效改善功能性质[8]。豆类和油菜籽Co比单一蛋白具有更好的营养和功能特性[9],大豆和乳清Co具有较高的持水和成胶能力[10]。可见BL和Co的凝胶在功能特性上存在明显差异。
豌豆分离蛋白(Pea protein isolate,PPI)是优质植物蛋白,低价易得,且具有较好的成胶能力,有助于锁住水分、风味成分等[11],目前主要与多糖或其他蛋白复配使用[12]。草鱼()是四大家鱼之一,富含蛋氨酸。在大宗淡水鱼中,草鱼分离蛋白(Grass carp protein isolate,CPI)凝胶强度最高[13],应用时需进行修饰或与其他蛋白混合[14]。课题组前期研究豌豆-草鱼双蛋白的溶解、起泡、乳化性质发现,BL和Co相比单一蛋白均有一定协同效应,且Co优于BL[15];同时发现大豆-罗非鱼()Co的凝胶性质在部分条件下优于单一蛋白[16]。目前,尚未见到对BL与Co凝胶性质比较的研究报道,并鲜见植物蛋白高比例替代动物蛋白的研究报道。基于此,本研究选择豌豆蛋白与草鱼蛋白质量比均为1∶1的BL和Co两种双蛋白为研究对象,以单一蛋白PPI、CPI作为对照,通过分析热诱导凝胶特性,评价共混合法和共沉淀法制备双蛋白的优劣,探讨豌豆蛋白与草鱼蛋白相互作用对凝胶结构和性质的影响,以期为改进豆类-鱼类双蛋白制备方法提供理论参考。
1 材料与方法
1.1 材料与试剂
去皮豌豆购自佛山金诺一农产品加工厂;草鱼购自广东省湛江市湖光市场,取背部的白色肌肉,除尽血水后置于-20 ℃冷冻,48 h内处理完毕;MD1477透析袋购于上海源叶生物科技有限公司;快速电泳试剂盒购自中国上海碧云天生物科技有限公司;ANS荧光探针和DTNB购自上海阿拉丁生化科技有限公司;Lowry法蛋白质含量测定试剂盒购自上海荔达生物科技有限公司;2-巯基乙醇和三羟甲基氨基甲烷Tris购自国药集团化学试剂有限公司;甘氨酸Gly和其他试剂均为分析纯,购自广州化学试剂厂。
1.2 主要仪器设备
Avanti J-26sxp高效离心机,美国Beckman公司;ALPHA1-2LD plus台式冻干机,德国Christ公司;G9800A荧光分光光度计,美国Agilent公司;Gemini 300型扫描电镜,德国ZEISS公司;TENSOR27傅里叶变换红外光谱仪,德国Bruker公司;TA-1质构仪,美国AMETEK有限公司。
1.3 实验方法
1.3.1 PPI、CPI、BL和Co制备 PPI、CPI、Co参考本课题组前期研究[15]采用等电点沉淀法制备。将去皮豌豆磨成粉末,过孔径150 μm筛。将豌豆粉与4 ℃去离子水按质量比1∶9的比例混合。用1 mol/L NaOH调节pH至10.0,搅拌溶解30 min,然后在10 000、4 ℃条件下离心20 min,除去沉淀。在上清液中缓慢加入1 mol/L HCl,充分搅拌,调pH调至5.0,同样条件离心,取沉淀。用去离子水冲洗沉淀,调整pH值至7.0,透析。冷冻干燥48 h后得到PPI。将鱼背部白肉剪切打浆后,重复PPI制作步骤制备CPI。将豌豆粉与鱼肌肉混合,按照PPI制作步骤制备Co。将PPI与CPI的干粉直接混合得到BL。本研究中BL和Co中豌豆与草鱼蛋白质量比为1∶1。
1.3.2 热诱导凝胶制备 将4种蛋白粉样品配制为质量分数12%的蛋白溶液,置于恒温水浴锅中,按升温速度1 ℃/min升温至90 ℃保持30 min,后快速冷却,将凝胶样品在4 ℃下存放6 h,待用。
1.3.3 游离巯基含量 蛋白质样品中游离SH含量参照Beveridge等[17]改进的Ellman法测定。取样品100 mg溶解于10 mL含8 mol/L尿素的Tris-gly缓冲液(0.086 mol/L Tris,0.09 mol/L Gly,0.04 mol/L EDTA,pH 8.0)中,缓慢搅拌,放置6 h,备用。游离SH含量测定:取1 mL上述蛋白溶液,加入4 mL Tris-Gly缓冲液,再加入0.05 mL Ellman(5,5-二硫基双2-硝基苯甲酸DTNB,4 mg/mL)混合,反应5 min后在412 nm 波长下测定光密度。游离巯基摩尔质量浓度(μmol/g)计算方法如下:
SH = 73.53 ×(412 nm) × 1 000 ÷,
式中,为样品质量浓度(mg/mL);1 000为稀释倍数;73.53由106/(1.36×104mol•L-1•cm-1)计算得到,1.36×104为摩尔吸光系数。
1.3.4 表面疏水性 参照文献[15]采用ANS荧光探针法对蛋白质表面疏水性进行测定。
1.3.5 蛋白质亚基组成 采用非还原十二烷基硫酸钠-聚丙烯酰胺凝胶电泳SDS-PAGE表征BL和Co的蛋白质亚基原始组成。条件为:样品质量分数1%;浓缩胶(上层胶)体积分数5%,分离胶(下层胶)体积分数12%;不添加还原剂二硫苏糖醇(DTT);蛋白Marker 16 ~ 270 ku;染色剂考马斯亮蓝R-250。蛋白条带丰度通过ImageLab软件测定。
1.3.6 分子间作用力 采用蛋白质溶解度法,参考刘书成等[18]方法分析蛋白质分子间作用力。将2 g凝胶样品加入提取液(10 mL 0.6 mol/L NaCl),以5 000 r/min均质3 min后在4 ℃下静置30 min,然后在4 ℃、10 000条件下离心25 min,上清液置于4 ℃待用(此时蛋白溶液记为S1),取沉淀进行后续操作。S2、S3、S4重复上述操作,提取液分别为S2(10 mL 1.5 mol/L尿素、0.6 mol/L NaCl),S3(10 mL 8 mol/L尿素,0.6 mol/L NaCl),S4(10 mL 0.5 mol/L 2-巯基乙醇、0.6 mol/L NaCl、8 mol/L尿素,pH 7.0)。为减少对蛋白质含量测定的干扰,将S1、S2、S3、S4与质量分数20%三氯乙酸溶液等体积混合,然后在4 ℃、4 000条件下离心15 min,弃去上清液,取沉淀溶于5 mL 1 mol/L NaOH中,采用lowry法[19]测定其蛋白质含量。溶解于S1、S2、S3、S4的蛋白质质量分数分别代表体系中离子键、氢键、疏水相互作用、二硫键在体系中对蛋白质分子间作用力的贡献。
1.3.7 持水性 称取约8 g的凝胶样品,两层滤纸包裹置于离心管后称取总质量,于4 ℃、5 000条件下离心10 min,取出凝胶并称其质量。持水力(WHC)计算公式如下:
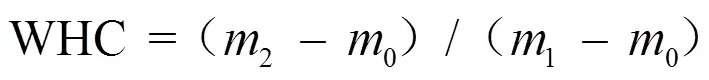
式中0为离心管质量(g);1为离心前凝胶和离心管总质量(g);2为离心后凝胶和离心管总质量(g)。
1.3.8 质构分析(Texture Profile Analysis,TPA) 对样品进行TPA,主要参数设定:P35圆柱型平底探头测定,样品表面平整高度为20mm,设定测前、中、后速度分别为4.0、3.0和4.0mm/s,下压距离为样品高度的40%,中间停留时间为5 s,触发力为5 g。每个样品重复6次。
1.3.9 微观结构观察 凝胶样品切成5 mm × 2 mm × 2 mm,置于带盖容器中,用体积分数2.5% pH 7.2的戊二醛磷酸缓冲液在4 ℃条件下固定浸泡8 h以上,再用0.1 mol/mL pH 7.2磷酸盐缓冲液洗涤3次,每次10 min。用体积分数50%、70%、80%、90%乙醇溶液梯度洗脱,每次10 min。用100%的无水乙醇继续洗脱3次,每次10 min。取三氯甲烷对脱水后的样品进行脱脂1 h,用体积比为1∶1的乙醇和叔丁醇混合液置换15 min,用100%的叔丁醇溶液置换15 min后冻干。采用离子溅射镀膜法对样品镀金,用扫描电子显微镜在5 000×视野下观察样品表面形貌。
1.3.10 数据处理 实验均至少进行3次。统计分析均采用SPSS 25.0进行。两组间的统计差异采用单因素方差分析(ANOVA)和Duncans多范围检验(0.05)。结果用平均数±标准差(SD)表示。
2 结果与分析
2.1 蛋白质游离巯基含量和表面疏水性指数(H0)
4种蛋白质的游离巯基含量和表面疏水性如图1所示。CPI的巯基质量摩尔浓度最高,为(29.35 ± 0.75)μmol/g,Co显著高于BL(<0.05)。游离巯基是蛋白质最活跃的基团,在热诱导成胶时随着蛋白质三级结构打开,其会逐渐暴露并氧化生成—S—S—共价键。—S—S—共价键是交联的强作用力,对凝胶硬度至关重要,能促进蛋白的聚集和交联,形成凝胶网络。而二硫键含量与凝胶硬度正相关[22],可见Co的成胶性能优于BL。表面疏水性与蛋白质的功能性质密切相关。ANS荧光探针法可用于表征蛋白质中疏水基团的暴露情况[20,21]。PPI、CPI、BL的表面疏水性无显著差异(>0.05),均大于Co(<0.05)。可能是因为共沉淀法使豌豆蛋白和草鱼蛋白之间通过疏水作用结合,在解折叠-折叠过程中比共混合法埋藏了更多的疏水基团,发生了“疏水坍塌”[23]。Co的表面疏水性指数表现为非线性叠加,比BL更低。溶解性与表面疏水性呈负相关,结合前期研究[15]可知Co的溶解度更好,而溶解是蛋白从溶胶转变为凝胶的必要条件。可见Co有较好的凝胶网络形成基础。
2.2 蛋白质亚基组成
非还原SDS-PAGE分析BL和Co的蛋白组成情况如图2和表1所示。两种双蛋白均包含肌球蛋白重链(MHC,约200 ku),convicilin(约70 ku),豆球蛋白(legumin,约62 ku),vicilin(约50 ku),肌动蛋白(AC,约42 ku),legumin α(约38 ku),原肌球蛋白(TM,约34 ku),legumin β(约22 ku)以及聚集体(顶部条带),与文献报道一致[24,25]。可见两种双蛋白均有效复合来自豌豆和草鱼的蛋白质,可用于进一步的试验。
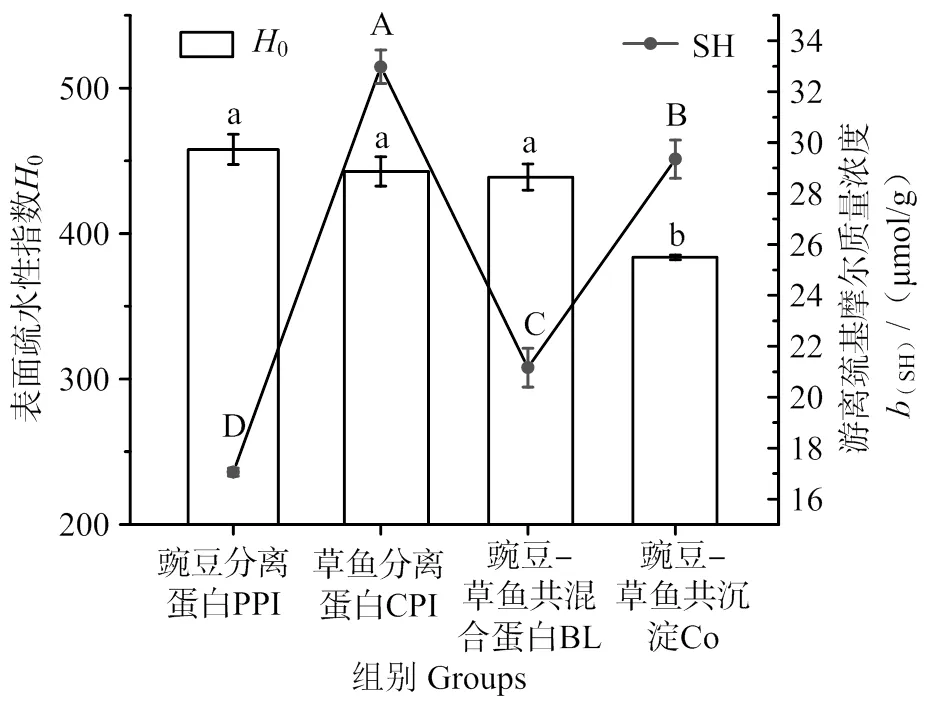
凡含一个相同字母表示不同蛋白间差异不具统计学意义(P > 0.05)
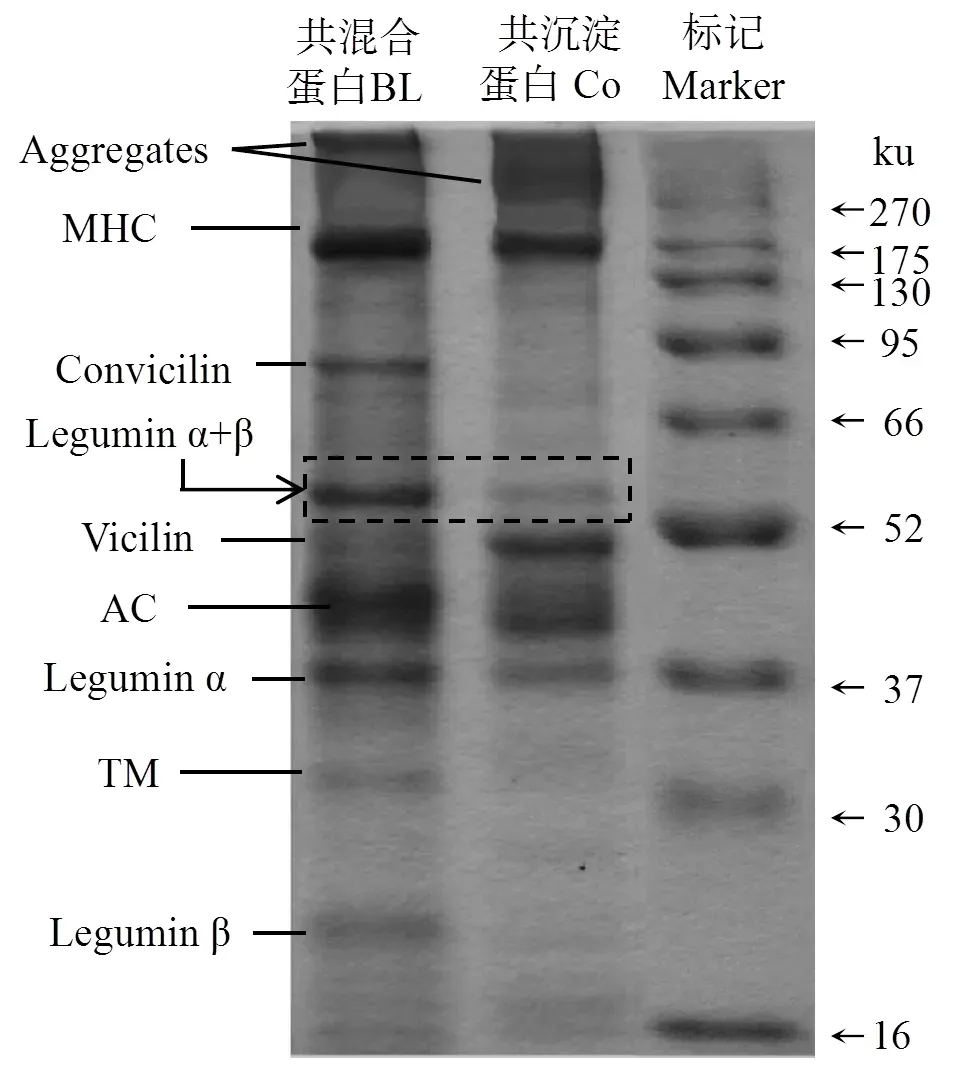
图2 共混合双蛋白和共沉淀双蛋白的非还原电泳图谱
非还原电泳可反映混合蛋白中各种蛋白质的原始组成情况[26]。蛋白样品制备时,BL和Co中蛋白来源控制为豌豆草鱼质量比1∶1,而电泳图中二者蛋白条带差异明显,说明Co和BL中的豌豆和草鱼蛋白的亚基交联或变性的程度不同。类似研究认为,其差异的原因可能是等电点沉淀法制取Co时,蛋白质之间静电相互作用、疏水相互作用、二硫键的作用不一样[8]。观察到分离胶顶部有部分聚集物,结合之前研究[15],说明不同源蛋白之间通过二硫键互作聚集;并且Co与BL相比,聚集程度更为明显,表明Co新生成了更多的二硫键。可溶性聚集物是热凝胶过程中稳定网络结构的重要因素[6]。vicilin和legumin是豌豆球蛋白的主要成分。vicilin是一种柔性蛋白质,而legumin属于“刚性”球蛋白,对凝胶形成的空间位阻更大[27]。表1可知,vicilin与legumin α+β光密度比值Co(2.04)高于BL(0.72),达2.82倍。已有研究证实,豌豆蛋白的vicilin与legumin α+β光密度比值与溶解、乳化、凝胶等功能性质存在正相关[28]。由蛋白组成分析可得到重要提示,Co的凝胶特性可能优于BL。
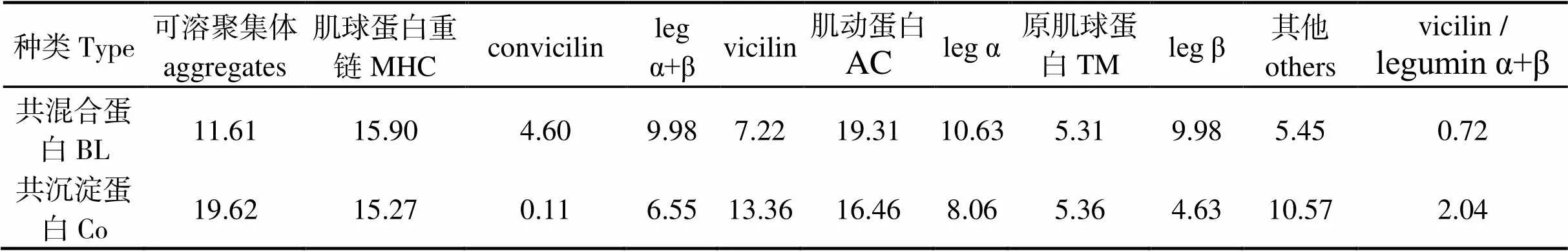
表1 豌豆-草鱼共混合蛋白和共沉淀蛋白的电泳条带光密度
2.3 凝胶的分子间作用力
蛋白质的高级结构受热解折叠,会引发聚集和交联,实现分子间作用力的重构。这些作用力可被特定的化学试剂破坏,通过测试不同化学试剂中蛋白溶解度占比,以表征蛋白凝胶中分子间作用力的贡献情况[29]。图3所示,疏水相互作用和离子键是PPI热诱导凝胶的主要作用力,二硫键和疏水相互作用是CPI凝胶的主要作用力,BL主要是疏水相互作用、二硫键和离子键,而Co则主要是二硫键和疏水相互作用,说明蛋白质种类以及不同的混合方式影响着凝胶的分子间相互作用。离子键的破坏而使蛋白质发生聚集和凝胶化[18]。离子键对4种蛋白成胶的贡献不高,PPI最大(33.90%),Co最低(10.79%),主要原因是本实验条件(pH = 7)下,蛋白体系均带负电存在静电斥力,PPI和CPI等电点分别为4.5和5.2,PPI的电负性更大,使蛋白热变性后结构伸展带电基团静电作用更强。
经比较,4种蛋白凝胶的氢键贡献率均为最低。氢键在热变性时会出现断裂和重建[30]。从40 ℃到90 ℃的凝胶化过程中氢键贡献是降低的,并且认为氢键不是维持其凝胶结构的主要作用力[31]。BL的氢键贡献率显著高于其它3种蛋白凝胶(<0.05),说明BL通过氢键将PPI和CPI结合,或者蛋白的共混合促进了其中某一种蛋白的氢键作用。
比较4种蛋白凝胶的疏水键贡献度,发现BL较高(43.45%),这与氢键类似,说明在热变性温度以上时,蛋白疏水基团充分暴露并聚集,成为热诱导BL形成凝胶的主要机制之一。此外,与蛋白质表面疏水性测量结果相比,BL的疏水键贡献率相对较高,是因为两种蛋白的热诱导凝胶网络由于分子构型不相容(植物球蛋白、动物肌纤维蛋白),空间位阻造成相互“挤占”行为,更大尺度的凝胶网络出现“互拆”现象,必然导致蛋白质分子间距较大;其他的蛋白质分子作用力最多只有5 nm左右,而疏水键的作用长度可达约100 nm[32],这可能是疏水键贡献率较大的原因。疏水聚合属于热力学熵驱动,其键能很低,不能决定凝胶最终品质[33]。
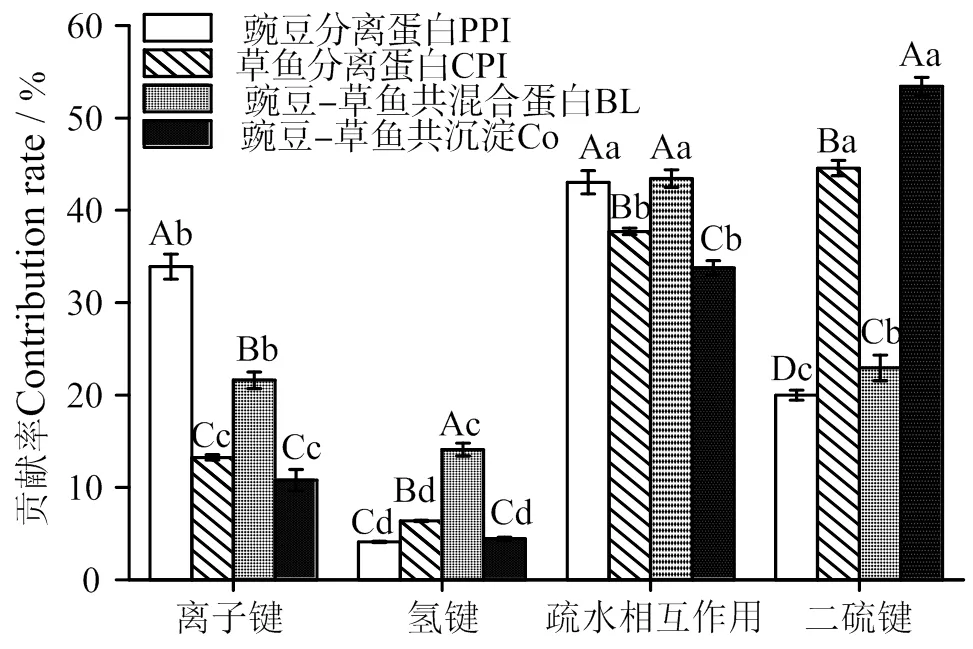
凡含一个相同字母表示不同蛋白间差异不具统计学意义(P > 0.05)。大写字母表示同一作用力不同蛋白间的比较,小写字母表示同一蛋白不同作用力间的比较
CPI和Co的热诱导凝胶二硫键贡献占比分别为53.42%、44.57%,显著高于PPI和BL(<0.05),这与巯基含量测定和蛋白亚基组成分析结果基本一致。二硫键属于强共价键,决定蛋白凝胶最终品质[34]。Co的巯基含量低于CPI,其二硫键却显著高于CPI,说明共沉淀法制备双蛋白的过程中保留了更多的活性巯基,在受热条件下能生成更多的二硫键,巩固凝胶结构,增加凝胶强度[35],提示共沉淀法双蛋白热诱导凝胶品质存在优势。
2.4 凝胶持水性
图4所示,Co凝胶的持水性为91.75%,显著高于CPI、PPI、BL(<0.05),表现出不同蛋白质混合的协同增强效应。BL略低于PPI(>0.05),表现为一定程度的拮抗作用。持水性对食品的质构和感官至关重要,是衡量凝胶优劣的重要指标[36]。蛋白质凝胶的持水性通常取决于凝胶微观结构和硬度。电泳分析可知,Co的可溶性聚集物明显多于BL。有研究发现,具有细小结构的凝胶比粗糙的凝胶有利于产生更多蛋白质-水之间的相互作用[37],具有更高的持水能力。同时,Co和CPI的二硫键贡献率较高,意味着更大的凝胶硬度以及提升凝胶网络束缚水分子的能力,在离心条件下水分子不易游离出来,能提高蛋白凝胶的持水性。

凡含一个相同字母表示不同蛋白间差异不具统计学意义(P > 0.05)
2.5 凝胶质构特性
PPI、CPI、BL和Co热诱导蛋白凝胶的质构测试结果如图5所示。与持水性测定结果类似,Co凝胶的硬度最高,达到524.60 g,这是因为共沉淀法使蛋白分子间二硫键增多,豌豆蛋白和草鱼蛋白之间交联的增加[38]。即在中性pH条件下,共沉淀法双蛋白相对单一蛋白而言,提高了凝胶硬度,可见共沉淀法能有效解决植物蛋白以较高比例替代动物蛋白后凝胶硬度降低的加工难题。此外,4种凝胶的弹性无显著差异(>0.05),其中BL的弹性较高,但硬度最低,这是因为鱼肌原纤维蛋白变性温度较低,受热后蛋白质分子优先聚集,而过快的聚集速度会导致分子链在还未完全展开时便发生随机交联,形成结构较为粗糙的凝胶。可见BL在食品加工中应用会受到一定限制。
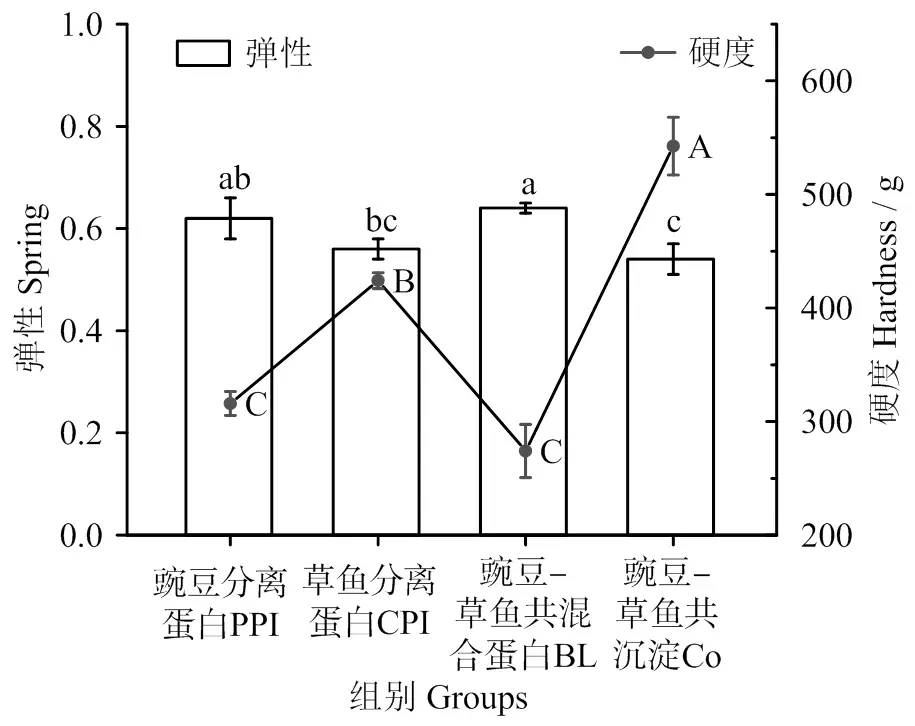
凡含一个相同字母表示不同蛋白间差异不具统计学意义(P > 0.05)
2.6 凝胶微观结构
采用扫描电镜观察蛋白凝胶微观结构如图6所示,4种蛋白均有明显差异。PPI因球蛋白vicilin和legumin的热变性温度不同,二者在程序式升温的热凝胶条件下无法同时展开球蛋白结构进行交联,因此凝胶网络延展性不够,孔洞较多,导致持水性和硬度不理想。CPI的凝胶网络整体呈现有规律纤维状,较为均匀致密,对应着较高的持水性和硬度。这是因为肌球蛋白分子热诱导凝胶的形成机制是肌球蛋白分子的头-头交联、头-尾交联和尾-尾交联。凝胶聚集结点可能是头-头交联区域,定向纤维可能是头-尾和尾-尾的交联区域[39]。BL凝胶网络存在较大孔洞,孔口周围排列大量非网络蛋白的聚集物,必然造成持水性和硬度差,表现为拮抗效应。这是因为球蛋白和纤维蛋白分子构型不相容,形成空间位阻效应使其难以交联形成凝胶网络;同时因为不同蛋白热变性温度相差较大,如PPI为80 ~ 90 ℃[40],而CPI的肌球蛋白在40 ~ 50 ℃即开始变性[41],导致聚集过程和展开过程不同步,不易形成致密的交联结构,甚至出现相分离[6,42]。Co凝胶的微观结构较为均匀、致密,使其具有更好的良好持水性和硬度。这是因为相比BL,共沉淀法制备的双蛋白的巯基较多,而Co在热诱导成胶时生成了较多二硫键,同时变性温度与肌纤维蛋白接近的vicilin含量更高,两种蛋白结构交织在一起形成均匀的网状结构,高密度孔隙结构且稳定的凝胶可以有效的固定水分和提升质构性。
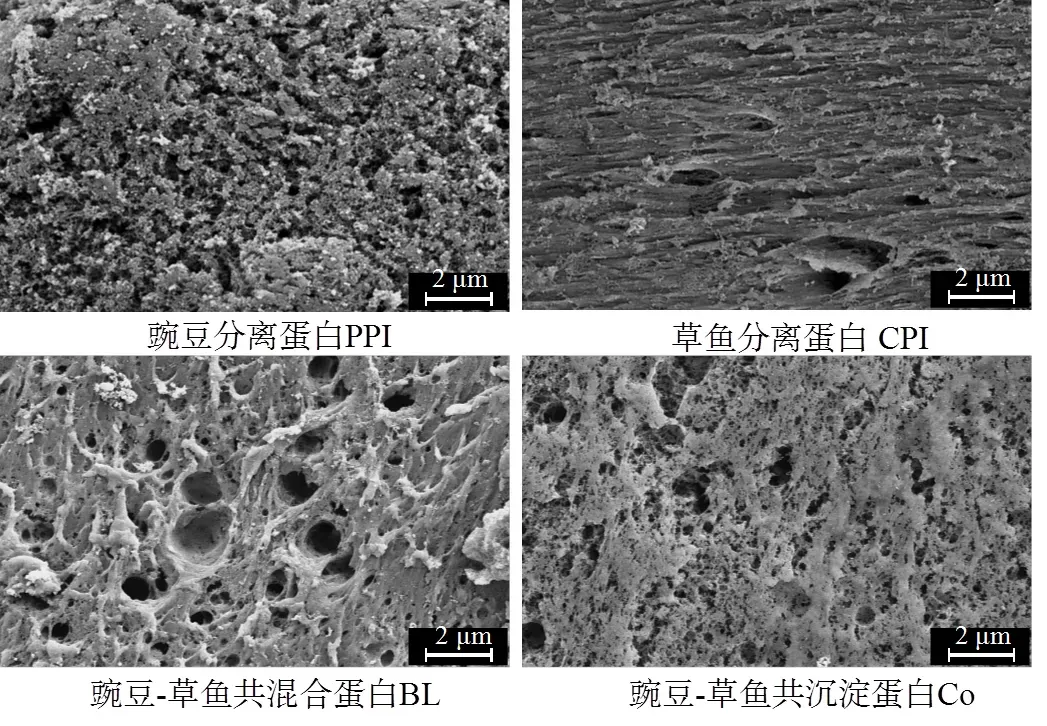
图6 4种热诱导蛋白凝胶的微观结构
3 结论
Co热诱导凝胶中二硫键对稳定凝胶结构的贡献率最高,持水性、质构、微观结构等全面优于单一蛋白和BL,发挥了协同作用,而BL表现一定的拮抗效应。共沉淀法制备Co使不同来源蛋白质进行了亚基重组,改变了巯基含量和疏水性。因此,从凝胶性质而言,共沉淀法制备的双蛋白比共混合法更有优势。
[1] AIKING H. Future protein supply[J]. Trends in Food Science & Technology, 2011, 22(2/3): 112-120.
[2] PIMENTEL D, PIMENTEL M. Sustainability of meat-based and plant-based diets and the environment[J]. The American Journal of Clinical Nutrition, 2003, 78(3): 660S-663S.
[3] 中华人民共和国国务院办公厅. 国民营养计划(2017—2030年)[R/OL].(2017-06-30)[2022-01-15]. http://www.gov.cn/zhengce/content/2017-07/13/content_5210134.htm
[4] WU C, WANG T, REN C, et al. Advancement of food-derived mixed protein systems: Interactions, aggregations, and functional properties[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1): 627-651.
[5] TOMÉ A S, PIRES C, BATISTA I, et al. Protein gels and emulsions from mixtures of cape hake and pea proteins[J]. Journal of the Science of Food and Agriculture, 2015, 95(2): 289-298.
[6] NICOLAI T.Gelation of food protein-protein mixtures[J]. Advances in Colloid and Interface Science, 2019, 270: 147-164.
[7] WU C, YAN X Y, WANG T, et al. A self-sorted gel network formed by heating a mixture of soy and cod proteins[J]. Food & Function, 2019, 10(8): 5140-5151.
[8] KRISTENSEN H T, CHRISTENSEN M, HANSEN M S, et al. Protein-protein interactions of a whey-pea protein co-precipitate[J]. International Journal of Food Science & Technology, 2021, 56(11): 5777-5790.
[9] YOUSSEF A M, ABU-FOUL N S, MOHARRAM Y G. Preparation and characteristics of coprecipitate proteins fromoilseeds and legumes seeds[J]. Food / Nahrung, 1995, 39(5/6): 475-482.
[10] ALU’DATT M H, ALLI I, NAGADI M. Preparation, characterization and properties of whey-soy proteins co-precipitates[J]. Food Chemistry, 2012, 134(1): 294-300.
[11] FISCHER E, CACHON R, CAYOT N.vs, a comparative review of nutritional, physicochemical, and sensory properties for food uses[J]. Trends in Food Science & Technology, 2020, 95: 196-204.
[12] GE J, SUN C X, CORKE H, et al. The health benefits, functional properties, modifications, and applications of pea (L.) protein: current status, challenges, and perspectives[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4): 1835-1876.
[13] 杨京梅, 夏文水. 大宗淡水鱼类原料特性比较分析[J]. 食品科学, 2012, 33(7): 51-54.
[14] LUO Y K, SHEN H X, PAN D. Gel-forming ability of surimi from grass carp (): influence of heat treatment and soy protein isolate[J]. Journal of the Science of Food and Agriculture, 2006, 86(5): 687-693.
[15] ZHOU X H, ZHANG C H, CAO W H, et al. A comparative functional analysis of pea protein and grass carp protein mixture via blending and co-precipitation[J]. Foods, 2021, 10(12): 3037.
[16] 齐慧红. 罗非鱼—豆粕共沉淀蛋白的制备及性质研究[D]. 湛江: 广东海洋大学, 2018.
[17] BEVERIDGE T, TOMA S J, NAKAI S. Determination of sh- and ss-groups in some food proteins using ellman's reagent[J]. Journal of Food Science, 1974, 39(1): 49-51.
[18] 刘书成, 郭明慧, 刘媛, 等. 高密度CO2处理过程中虾肌球蛋白分子间作用力的变化[J]. 食品科学, 2018, 39(7): 153-159.
[19] LOWRY O, ROSEBROUGH N, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[20] 邵俊花, 吴菊清, 周光宏, 等. 巯基和疏水性对蛋白质乳化及凝胶特性的影响[J]. 食品科学, 2013, 34(23): 155-159.
[21] HASKARD C A, LI-CHAN E C Y. Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged (PRODAN) and anionic (ANS-) fluorescent probes[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2671-2677.
[22] ARNTFIELD S D, MURRAY E D, ISMOND M A H. Role of disulfide bonds in determining the rheological and microstructural properties of heat-induced protein networks from ovalbumin and vicilin[J]. Journal of Agricultural and Food Chemistry, 1991, 39(8): 1378-1385.
[23] CHI E Y, KRISHNAN S, RANDOLPH T W, et al. Physical stability of proteins in aqueous solution: mechanism and driving forces in nonnative protein aggregation[J]. Pharmaceutical Research, 2003, 20(9): 1325-1336.
[24] CHEN M S, LU J H, LIU F, et al. Study on the emulsifying stability and interfacial adsorption of pea proteins[J]. Food Hydrocolloids, 2019, 88: 247-255.
[25] XU Y X, WANG R, ZHAO H L, et al. Binding of aldehydes to myofibrillar proteins as affected by two-step heat treatments[J]. Journal of the Science of Food and Agriculture, 2020, 100(3): 1195-1203.
[26] XU Y S, XIA W S, JIANG Q X, et al. Acid-induced aggregation of actomyosin from silver carp ()[J]. Food Hydrocolloids, 2012, 27(2): 309-315.
[27] MESSION J L, CHIHI M L, SOK N, et al. Effect of globular pea proteins fractionation on their heat-induced aggregation and acid cold-set gelation[J]. Food Hydrocolloids, 2015, 46: 233-243.
[28] KIMURA A, FUKUDA T, ZHANG M L, et al. Comparison of physicochemical properties of 7S and 11S globulins from pea, fava bean, cowpea, and French bean with those of soybean: French bean 7S globulin exhibits excellent properties[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10273-10279.
[29] CHENG Y, WANG J T, CHI Y, et al. Effect of dry heating on egg white powder influencing water mobility and intermolecular interactions of its gels[J]. Journal of the Science of Food and Agriculture, 2021, 101(2): 433-440.
[30] 李杰, 汪之和, 施文正. 鱼糜凝胶形成过程中物理化学变化[J]. 食品科学, 2010, 31(17): 103-106.
[31] 刘海梅, 熊善柏, 谢笔钧, 等. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J]. 中国水产科学, 2008, 15(3): 469-475.
[32] Fennema. Owen R. 食品化学[M]. 北京:中国轻工业出版社, 2013. 9.
[33] RAYMENT I, RYPNIEWSKI W R, SCHMIDT-BÄSE K, et al. Three-dimensional structure of myosin subfragment-1: a molecular motor[J]. Science, 1993, 261(5117): 50-58.
[34] BOURAOUI M, NAKAI S, LI-CHAN E.investigation of protein structure in Pacific whiting surimi and gels using Raman spectroscopy[J]. Food Research International, 1997, 30(1): 65-72.
[35] 王苑. 不同处理方式对肌原纤维蛋白和大豆分离蛋白混合凝胶特性的影响[D]. 南京: 南京农业大学, 2007.
[36] 吴满刚, 熊幼翎, 陈洁. 不同淀粉对肌纤维蛋白流变学性质和凝胶持水性的影响[J]. 食品工业科技, 2010, 31(10): 92-94.
[37] CHANTRAPORNCHAI W, MCCLEMENTS D J. Influence of NaCl on optical properties, large-strain rheology and water holding capacity of heat-induced whey protein isolate gels[J]. Food Hydrocolloids, 2002, 16(5): 467-476.
[38] ROESCH R, JUNEJA M, MONAGLE C, et al. Aggregation of soy/milk mixes during acidification[J]. Food Research International, 2004, 37(3): 209-215.
[39] YAMAMOTO K. Characterization of H-protein, a component of skeletal muscle myofibrils[J]. The Journal of Biological Chemistry, 1984, 259(11): 7163-7168.
[40] 梁晗妮. 豆类蛋白质的乳化性质及其结构—功能相关性研究[D]. 广州: 华南理工大学, 2014.
[41] 王嵬, 仪淑敏, 李学鹏, 等. 鱼糜凝胶的形成机制及混合鱼糜研究进展[J]. 食品安全质量检测学报, 2016, 7(1): 231-237.
[42] PENG I C, DAYTON W R, QUASS D W, et al. Studies on the subunits involved in the interaction of soybean 11S protein and myosin[J]. Journal of Food Science, 1982, 47(6): 1984-1990.
Comparative Analysis of Heat-induced Gel Properties of Pea-grass Carp Dual-protein Prepared by Different Methods
ZHOU Xiao-hu1,2, ZHANG Chao-hua1,3, ZHAO Liang-zhong2, ZHOU Xiao-jie2, HUANG Zhan-rui2, ZHOU Chun-xia1,3, CAO Wen-hong1,3, ZHENG Hui-na1,3
(1.,//,524088,; 2.//,422000,; 3.,y,116034,)
【】The advantages and disadvantages of preparation of dual-protein by blending and co-precipitation are to be evaluated based on the properties of heat-induced gel.【】Pea protein isolate (PPI), grass carp protein isolate (CPI) and pea-carp protein co-precipitates (Co) were prepared from pea and grass carp by isoelectric solubilization/co-precipitation method. PPI and CPI were blended at a mass ratio of 1∶1 to get pea-grass carp protein blended (BL). Using single protein PPI and CPI as control, the physicochemical properties of the four proteins and quality indexes of the four heat-induced protein gels were analyzed, and the structure and properties of heat-induced gel of BL and Co were compared.【】Compared with BL, Co has higher sulfhydryl content (<0.05), lower surface hydrophobicity (<0.05), its value of vicilin / legumin α+β was 2.82 times that of BL. Co heat-induced gel had better quality, and its water holding capacity and hardness were 91.75% and 42.60 g respectively, which were significantly higher than those of BL, PPI and CPI (<0.05). The microstructure of Co is uniform and dense, and the gel properties of Co are generally superior to those of BL, PPI and CPI, reflecting the synergistic strengthening effect. BL showed antagonistic effect to some extent.【】The heat-induced gels of dual-protein prepared by co-precipitation were superior to those prepared by blending.
dual-protein; co-precipitation; blending; gel properties; pea protein; grass carp protein
周小虎,章超桦,赵良忠,等. 不同方法制备豌豆-草鱼双蛋白的热诱导凝胶特性比较[J]. 广东海洋大学学报,2022,42(3):79-86.
TS254.4
A
1673-9159(2022)03-0079-08
10.3969/j.issn.1673-9159.2022.03.011
2022-02-09
广东普通高等学校水产品高值化加工与利用创新团队项目(GDOU2016030503)
周小虎(1989―),男,博士研究生,讲师,研究方向为水产品与豆制品加工。E-mail:foodxiaohu@hnsyu.edu.cn
章超桦(1956―),男,博士,教授,研究方向为水产品加工与贮藏。E-mail:zhangch2@139.com
(责任编辑:刘朏)

