低氧胁迫对香港牡蛎摄食和代谢的影响
马 元,张兴志,何苹萍,官俊良,韦嫔媛,张 立,李 蔚,朱 鹏,许尤厚,严雪瑜,陈晓汉,彭金霞
低氧胁迫对香港牡蛎摄食和代谢的影响
马 元1,2,张兴志2,何苹萍2,官俊良2,韦嫔媛2,张 立2,李 蔚2,朱 鹏1,许尤厚1,严雪瑜1,陈晓汉2,彭金霞2
(1. 北部湾大学海洋学院,广西 钦州 535011;2. 广西水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
【】探究不同氧浓度胁迫对香港牡蛎()摄食和代谢的影响。比较0.5、1、2、3 mg/L等低氧和常氧条件下,香港牡蛎的摄食率()、个体摄食率(ind)、单位体质量的摄食率(mass)、耗氧率(O)和排氨率(N)的变化规律,并进一步分析急性低氧和48 h持续低氧对香港牡蛎摄食和代谢的影响。不同低氧条件下,香港牡蛎各项指标均随溶解氧(Dissolved oxygen,DO)质量浓度的下降而降低,并且急性低氧处理组摄食和代谢强度下降幅度均大于持续低氧48 h组。急性低氧组溶解氧浓度与摄食率的相关关系为1= 31.225 ln(DO) + 35.509,² = 0.980 5,ind、mass、0、N的变化范围分别为5 × 107~ 4.8 × 108个/(只∙h)、7 × 107~ 4.8 × 108个/(g∙h)、0.1 ~ 0.7 mg/(g∙h)、4 ~ 25 µg/(g∙h)。持续低氧48 h组溶解氧质量浓度与摄食率的相关关系为2= 36.439 ln(DO) + 19.163,² = 0.839 7,ind、mass、0、N的变化范围分别为1.2 × 108~ 5.3 × 108个/(只∙h)、1.1 × 108~ 4.8 × 108个/(g∙h)、0.2 ~ 0.8 mg/(g∙h)、18 ~ 32 µg/(g∙h)。香港牡蛎的摄食和代谢受水环境中溶解氧质量浓度影响,氧质量浓度越低,摄食和代谢水平越低,经低氧环境适应48 h后,摄食和代谢能力可产生一定水平恢复,但仍低于常氧水平。
香港牡蛎;低氧胁迫;摄食;耗氧率;排氨率
低氧作为造成海洋贝类死亡的重要原因之一,长期受到了广大学者的关注[1–4]。研究表明,胁迫时间的长短对贝类机体适应低氧机制的影响有不同[5-7]。
香港牡蛎(),原称近江牡蛎,俗称“大蚝”“白蚝”,属于双壳纲(Bivalvia)珍珠贝目(Pteriodae)牡蛎科(Osteridae),主产自广西、广东和福建沿海[8]。低氧会导致香港牡蛎大量死亡[9]。因此,研究香港牡蛎低氧耐受性和适应机制,找出解决香港牡蛎养殖中低氧损失的方案尤为重要。现有对香港牡蛎的研究在遗传育种、摄食和生理代谢方面较多[10-14],而有关香港牡蛎对低氧耐受性的研究仅在探究昼夜循环缺氧和盐度变化对香港牡蛎血细胞免疫功能的影响中有报道[15]。为此,本研究以香港牡蛎为对象,分别测定其在不同溶解氧质量浓度下的摄食率、耗氧率和排氨率,评估其低氧耐受能力,旨在为香港牡蛎养殖产业的健康发展提供参考依据。
1 材料与方法
1.1 实验生物
香港牡蛎取自广西北海香港牡蛎良种场,为同一环境下生长的2龄牡蛎。出水后迅速放入泡沫箱密封,内置冰袋和湿毛巾,1 h内运回实验室,除去体表附着物后于盐度30的天然砂滤海水中暂养7 d。暂养期间持续充氧,水温(30 ± 1)℃,每天投喂饵料2次,隔天换水1次。实验前1 d停止投喂。
1.2 低氧胁迫方法
水温和盐度保持与暂养时一致。胁迫实验分为两组,分别为急性低氧胁迫2 h(A组)和持续低氧胁迫48 h(S组)。参考Baker等[16]的方法,低氧环境通过向水体中连续充氮气和氧气的方式实现。两组分别设置5个溶解氧质量浓度:3.0、2.0、1.0和0.5 mg/L及常氧(5 mg/L,对照)。实验在5 L塑料桶中进行,每个DO下设置4个重复和1个空白对照(不放置牡蛎,消除饵料自然沉降的影响),每个重复1个牡蛎。当下降到目标溶解氧的浓度后,在实验桶上紧贴水面覆盖一层塑料膜,隔绝水体与外界空气的气体交换。实验中,用YSI Professional Plus测定不同的实验组的DO。
1.3 摄食实验
摄食实验前,每个实验桶加入等体积等密度的叉鞭金藻(sp)和海水混合液,调节溶解氧,预留50 mL水样用于测定初始藻浓度。记录香港牡蛎摄食时间,开口时计时,实验结束后取出牡蛎,同时每桶各取50 mL水样,鲁戈试剂固定。摇匀固定后的水样,参照张许峰等[17]的方法计数饵料密度。测量牡蛎壳高、壳长等数据,去除双壳,烘箱60 ℃烘干软体组织至恒质量,称质量记录(精确到0.01 g)。
分别计算香港牡蛎摄食率()、个体摄食率(ind)、单位体质量的摄食率(mass),计算公式:
=(0-) /0, (1)
ind=(0-)×/ (×), (2)
mass=(0-)××(1 /)/, (3)
式中,0、分别为摄食前后水中的藻密度(个/L);为实验水体体积(L);为实验牡蛎数;为实验时长(h);为实验牡蛎软体组织干质量(g);为体质量系数,根据广西水产科学研究院贝类研究团队前期关于香港牡蛎对浮游植物摄食率的研究结果[18],取值0.62。
1.4 耗氧率、排氨率实验
实验采用静水法[19]测定耗氧率和排氨率,纳氏试剂分光光度法测定NH4+-N[20]。每桶加入等体积过滤海水,预留50 mL水样用于测定初始氨氮浓度。记录牡蛎开口时间,以首次开口开始计时,实验结束后取出牡蛎同时用虹吸法抽取每桶水样进行DO和NH+-N的测定。记录牡蛎壳高、壳长等数据,去除双壳,烘箱60 ℃烘干软体组织至恒质量,称质量记录(精确到0.01 g)。
分别计算香港牡蛎单位软体部干质量耗氧率(0)和排氨率(N),计算公式:
0= [(DO)0-(DO)] ×/ (×),(4)
N=(-0)×/(×), (5)
式中,(DO)0、(DO)分别为实验结束时空白组和实验组的溶解氧质量浓度(mg/L);为实验水体体积(L);为实验牡蛎软体组织干质量(g);为实验时长(h);0、分别为实验前后的NH4+-N质量浓度(mg/L)。
1.5 数据处理
实验数据为4个平行组的平均值,以平均值±标准差(mean ± S.D.)表示,用Excel 2016统计作图,采用SPSS 23.0软件对数据进行单因素方差分析(One-Way ANOVA),显著性水平= 0.05。
2 结果
2.1 实验香港牡蛎的生物学参数
实验用香港牡蛎的壳高、壳长、壳宽和软组织干质量等参数如下:
A组牡蛎壳高(85.25 ± 5.93) mm,软组织干质量(0.97 ± 0.27) g。S组牡蛎壳高(85.20 ± 9.46) mm,软组织干质量(1.06 ± 0.27) g。胁迫实验组之间壳高和软组织干质量相比均无显著差异(> 0.05)。
2.2 低氧对摄食的影响
由图1可知,低氧胁迫下,香港牡蛎摄食率在急性低氧和持续低氧48 h胁迫下变化趋势一致,由大到小依次为3.0 > 2.0 > 1.0 > 0.5 mg/L,A组摄食率从69%下降到7%,S组摄食率从74%下降到17%。两实验组香港牡蛎摄食率除DO为3 mg/L时与常氧无显著差异,在0.5、1.0和2.0 mg/L时的单位质量摄食率与常氧相比均存在显著差异(< 0.05)。同一质量浓度DO下,持续48 h低氧的香港牡蛎较急性低氧下的香港牡蛎摄食强度大。拟合溶解氧质量浓度与摄食率之间的关系式为:
1= 31.225 ln(DO) + 35.509,² = 0.980 5;(A组)
2= 36.439 ln(DO) + 19.163,² = 0.839 7。(S组)

图1 低氧胁迫对香港牡蛎摄食率的影响
图2和图3分别为A组和S组处于不同质量浓度DO时的摄食率情况。A组溶解氧在3、2、1和0.5 mg/L时,单位质量摄食率均比5 mg/L低,整体呈现下降趋势,从4.8 × 108个/(g∙h)下降至7×107个/(g∙h),且3、2、1和0.5 mg/L之间存在显著差异(< 0.05)。S组结果中3、2、1和0.5mg/L之间也存在显著差异(< 0.05),单位质量摄食率从4.8×108个/(g∙h)下降到1.1×108个/(g∙h)。A组与S组组间的单位质量摄食率无显著差异,但是A组对香港牡蛎的影响更大,除3 mg/L外,同一低氧质量浓度下其单位质量摄食率较S组低。
由图3可见,低氧胁迫下,单位个体摄食率结果与单位质量摄食率相似,A和S组溶氧胁迫下的单位质量摄食率均低于常氧,呈下降趋势,变化范围分别为0.5×107~ 4.8×108、1.2×108~ 5.3×108个/(只∙h)。同一实验组组内4种低氧浓度胁迫香港牡蛎对叉鞭金藻的单位个体摄食率有显著差异(< 0.05),由高到低依次为3、2、1和0.5 mg/L。同一质量浓度DO时,S组的香港牡蛎单位个体摄食率明显高于A组。
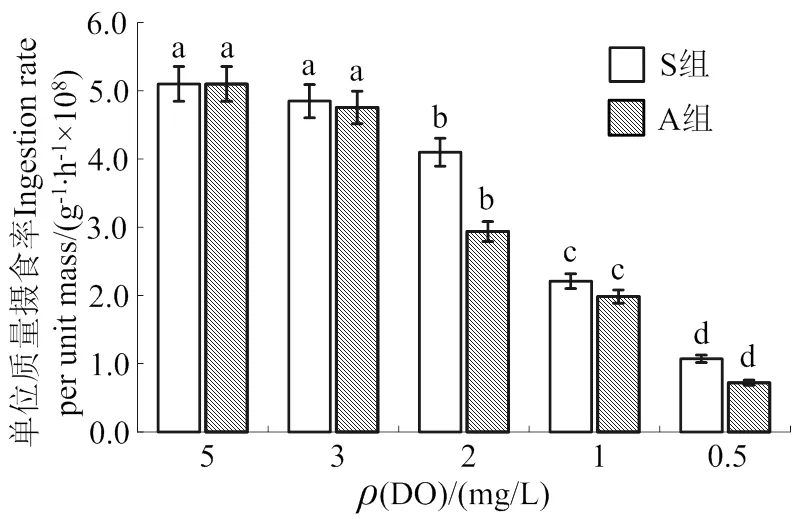
同一处理组中不同溶氧胁迫之间不同字母表示差异显著(P< 0.05)
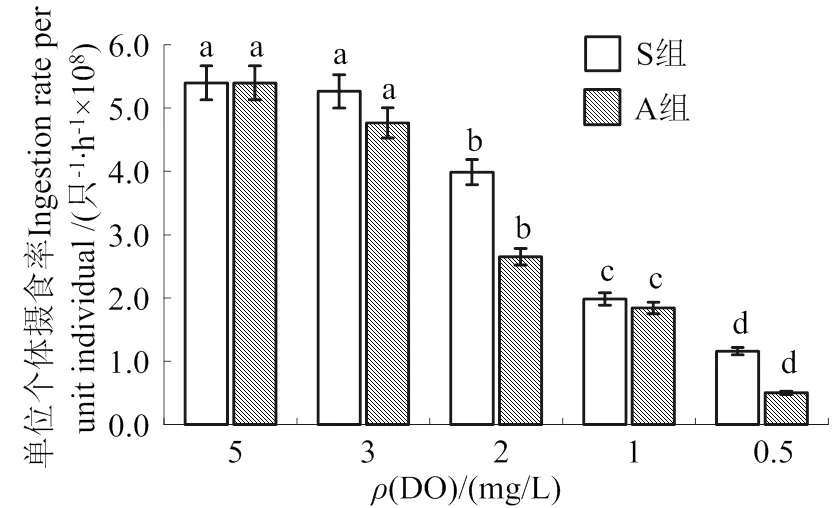
同一处理组中不同溶氧胁迫之间不同字母表示差异显著(P< 0.05)
2.3 低氧对代谢的影响
耗氧率结果趋势与摄食率相似(图4),A和S组变化范围分别为0.1 ~ 0.7、0.2 ~ 0.8 mg/(g∙h)。其中,S组的2、3 mg/L和A组的3 mg/L均较5 mg/L耗氧率均无显著差异。同一低氧浓度下,A组对香港牡蛎的影响更大,耗氧率比S组低。
从图5可见,急性低氧和持续低氧48 h处理的香港牡蛎排氨率变化趋势与摄食率和耗氧率相似:溶解氧质量浓度越低,排氨率越小;同一质量浓度DO时,A组排氨率偏低。其中,5 mg/L时排氨率最高[64 µg/(g∙h)],且显著高于两实验组4个低氧下的值(< 0.05)。香港牡蛎在DO质量浓度为3、2、1和0.5 m/L的低氧胁迫下,A组排氨率变化范围为4 ~ 25 µg/(g∙h),S组排氨率变化的范围为18 ~ 32 µg/(g∙h)。
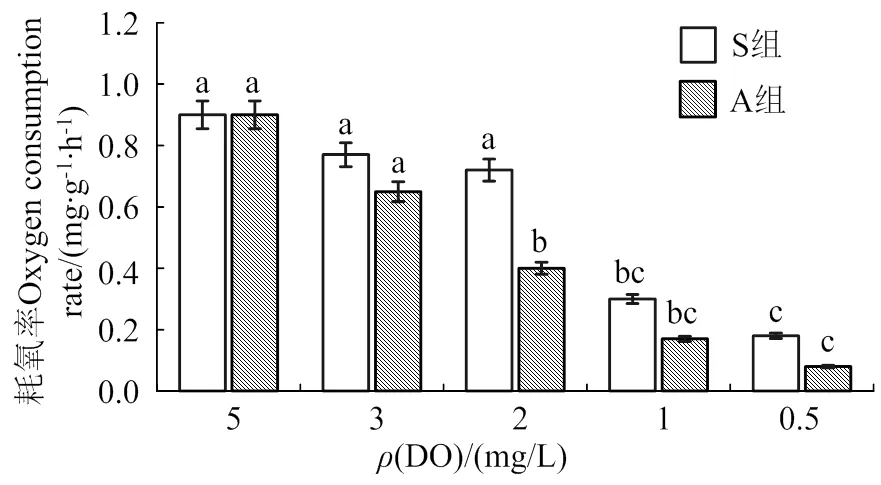
同一处理组中不同溶氧胁迫之间不同字母表示差异显著(< 0.05)
For the same treatment, different letters represent significant differences among different hypoxia stress (< 0.05)
图4 低氧胁迫对香港牡蛎耗氧率的影响
Fig. 4 Effect of hypoxia stress on oxygen consumption rate of
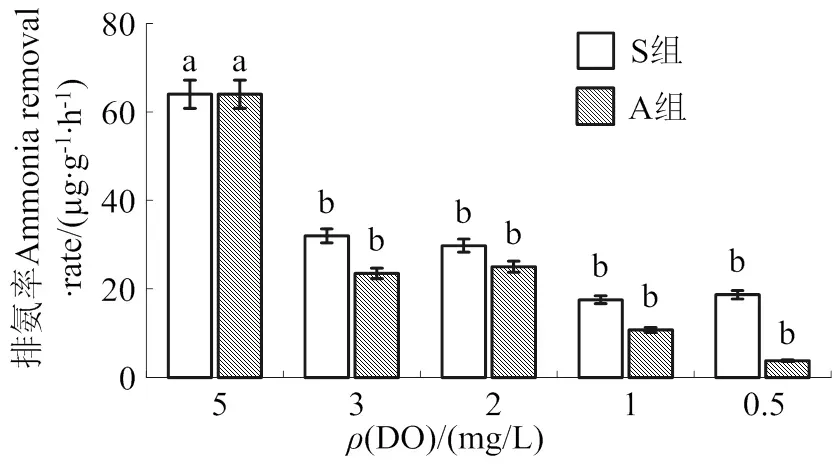
同一处理组中不同溶氧胁迫之间不同字母表示差异显著(P< 0.05)
3 讨论
3.1 低氧对香港牡蛎摄食的影响
低氧胁迫是影响水生动物摄食生理变化的主要因素之一[21-22]。摄食率、单位个体摄食率和单位质量摄食率是反映水生动物摄食生理的动态指标,直接受身处环境的生物和非生物因子的影响。Pichavant等[23]研究表明,大菱鲆()幼鱼的摄食量受水体低氧影响,在DO质量浓度为3.5 mg/L的缺氧水体中时摄食量减半,而持续低氧会导致其停止摄食活动。本研究结果表明,在DO质量浓度为3、2、1和0.5 mg/L时,香港牡蛎的摄食率、单位质量摄食率和单位个体摄食率均低于常氧。Widdows等[1]探究美洲牡蛎()幼体对低氧耐受性的研究中发现,正常溶氧质量浓度下单个幼虫的摄食率为5 ~ 8 个/10 min,而降低氧分压后,摄食率迅速下降至2 个/10 min,与本研究结果相一致。这可能与消化相关的酶活性降低有关,如纤维素酶、淀粉酶和脂肪酶[24],导致香港牡蛎新陈代谢减慢,能量供应不足,摄食器官活力下降,从而导致摄食率下降。另外,多项研究已证实,低氧会抑制机体的新陈代谢[25],降低胃消化功能以及能量摄入量[26],最终会导致胃消化细胞氧化应激和能量短缺[27]。江天棋等[28]对厚壳贻贝()的研究表明,溶解氧质量浓度下降至4 mg/L时,滤水率会显著降低。本研究显示,在0.5 ~ 3 mg/L的低氧水环境中,溶解氧质量浓度越低,牡蛎的摄食率也越低,在3、2、1和0.5 mg/L时的摄食率之间存在显著差异(< 0.05),说明香港牡蛎的摄食率受不同低氧程度影响,这与以上研究结果相近。
低氧作为一种应激因素,能明显抑制贝类的正常生命活动,其影响程度取决于胁迫时间长短、强度和发生的快慢[1,29-30]。本研究中,持续低氧48 h组的摄食率、单位个体摄食率和单位质量摄食率在同一溶解氧质量浓度时均明显大于急性低氧组。因此香港牡蛎在外环境突然刺激下,短时间内摄食活动强烈抑制,而持续刺激后会有所恢复,但较正常状态还有差距。Remen等[31]对大西洋鲑()的研究表明,低氧对摄食量的影响在整个实验过程中持续存在,表现为前1周明显下降,后两周逐渐恢复并稳定在一个低于常氧时的摄食量,与本研究结果一致。
3.2 低氧对香港牡蛎耗氧率和排氨率的影响
水环境中的溶解氧水平是影响水生动物呼吸和代谢的重要因子之一。在低溶解氧水环境中代谢率降低被认为是水生动物适应低氧的重要反应,这在中国明对虾()[32-33]、斑节对虾()[34]等无脊椎动物中得到证实。本研究显示,与常氧比较,在低氧水环境下香港牡蛎的耗氧率和排氨率明显受到抑制。李峤等[35]研究发现,菲律宾蛤仔()在1和2 mg/L溶解氧质量浓度下时,较对照组没有表现出显著的耗氧率差异,0.5 mg/L时出现显著抑制现象,而排氨率在2 mg/L溶解氧质量浓度下时较对照组没有显著差异,低于1 mg/L时出现显著的抑制现象。张文斌等[7]研究发现,菲律宾蛤仔在2 mg/L的低氧胁迫下,耗氧率在2、5、10、20 d时低于常氧,且在2 d时耗氧率最低,排氨率在低氧胁迫后也显著降低。
不同低氧胁迫程度对贝类呼吸和代谢的影响不同。Li等[5]在对栉孔扇贝()低氧胁迫中发现,其耗氧率随水体溶解氧质量浓度降低会显著下降。低氧胁迫对虾夷扇贝()的影响结果表明,1 mg/L和2 mg/L低氧组扇贝的耗氧率及排氨率显著低于溶解氧质量浓度为4 mg/L和7 mg/L组[6]。本研究结果也显示,在0.5 ~ 3 mg/L范围内随溶解氧质量浓度的降低,香港牡蛎的耗氧率和排氨率呈下降趋势。另外,在水生动物研究[36-38]中发现,代谢率的变化有个临界点(COL),当DO质量浓度在COL之上,代谢率不随质量浓度DO的变动而变化,而当DO质量浓度低于COL时,代谢率随DO质量浓度的下降降低。本研究未观察到这一转折点,这可能与实验气候为高温有关,原产地海域溶解氧持续偏低(为5 mg/L左右),其COL可能超过了本实验所设定的最高低氧(即3 mg/L)。
低氧耐受性研究[39]表明,动物机体需经过系列调控来抑制代谢,降低ATP流通,减少细胞内蛋白质合成等才能顺利度过代谢减退期。对菲律宾蛤仔的研究[7]发现,在2 mg/L的低氧胁迫下,其耗氧率一直低于常氧,随着时间推移逐渐小幅度回升,排氨率在120 h有小幅度回升,推测这可能与菲律宾蛤仔在一定溶解氧质量浓度范围内对环境的张力变化有一定适应能力有关。本研究表示,相比急性低氧实验组,香港牡蛎持续低氧48 h后耗氧率、排氨率有回升趋势,说明低氧胁迫使香港牡蛎代谢受抑制,但随着时间推移,机体逐渐适应这种环境张力变化。
4 结论
低氧胁迫对香港牡蛎的摄食和能量代谢有显著影响。经历低氧胁迫的牡蛎摄食率、耗氧率和排氨率显著低于常氧,且溶解氧质量浓度越低,代谢强度越低。经低氧环境适应48 h后,牡蛎摄食和代谢能力会有一定水平恢复,但仍低于常氧水平。
[1] WIDDOWS J, NEWELL R I E, MANN R. Effects of hypoxia andon survival, energy metabolism, and feeding of oyster larvae (, Gmelin)[J]. The Biological Bulletin, 1989, 177(1): 154-166.
[2] DAVID E, TANGUY A, PICHAVANT K, et al. Response of the Pacific oysterto hypoxia exposure under experimental conditions[J]. The FEBS Journal, 2005, 272(21): 5635-5652.
[3] PORTER E T, BREITBURG D L. Eastern oyster,, valve gape behavior under diel-cycling hypoxia[J]. Marine Biology, 2016, 163(10): 1-12.
[4] LI Q, SUN S, ZHANG F, et al. Effects of hypoxia on survival, behavior, metabolism and cellular damage of Manila clam ()[J]. PLoS One, 2019, 14(4): e0215158.
[5] LI Q, ZHANG F, WANG M X, et al. Effects of hypoxia on survival, behavior, and metabolism of Zhikong scallopJones et Preston 1904[J]. Journal of Oceanology and Limnology, 2020, 38(2): 351-363.
[6] 夏玉莹, 张继红, 刘毅. 低氧胁迫下虾夷扇贝的行为特征及生理生化响应[J]. 中国水产科学, 2021, 28(10): 1319-1358.
[7] 张文斌, 吕振波, 张莹, 等. 缺氧胁迫对菲律宾蛤仔()生理代谢的影响[J]. 生态学杂志, 2014, 33(9): 2448-2453.
[8] 王海艳, 郭希明, 刘晓, 等. 中国近海“近江牡蛎”的分类和订名[J]. 海洋科学, 2007, 31(9): 85-86.
[9] 王婷. 长牡蛎低氧信号通路分子作用机制研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2017.
[10] 潘英, 夏朝林, 谢卫著. 人工诱导香港巨牡蛎雌核发育单倍体的研究[J]. 热带海洋学报, 2008, 27(3): 55-60.
[11] 李咏梅, 陈秀荔, 彭敏, 等. 基于线粒体COI基因序列探讨广西钦州湾牡蛎的遗传分化[J]. 西北农林科技大学学报(自然科学版), 2009, 37(3): 60-65.
[12] 霍忠明, 王昭萍, 梁健, 等. 香港巨牡蛎与近江牡蛎杂交及回交子代早期生长发育比较[J]. 水产学报, 2013, 37(8): 1155-1161.
[13] 林丽华, 廖文崇, 谢健文, 等. 盐度对香港巨牡蛎摄食和代谢的影响[J]. 广东农业科学, 2012, 39(11): 10-14.
[14] 廖文崇, 朱长波, 张汉华, 等. 水温对香港巨牡蛎摄食和代谢的影响[J]. 广东农业科学, 2011, 38(1): 7-11.
[15] XIE Z, WEI S S, DONG H M, et al. Hemocyte responses of the oysterexposed to diel-cycling hypoxia and salinity change[J]. Frontiers in Marine Science, 2021, 8: 749623.
[16] BAKER S M, MANN R. Effects of hypoxia andon larval settlement, juvenile growth, and juvenile survival of the oyster[J]. The Biological Bulletin, 1992, 182(2): 265-269.
[17] 张许峰, 吴小平, 欧阳珊, 等. 四种淡水贝的摄食率和耗氧率的实验研究[J]. 海洋湖沼通报, 2008(3): 144-154.
[18] 付家想, 蓝文陆, 李天深, 等. 香港巨牡蛎对3种浮游植物摄食率和滤清率的研究[J]. 海洋学报, 2017, 39(08): 62-69.
[19] 杨俭, 魏伟, 唐保军. 温度胁迫对文蛤耗氧率和排氨率的影响[J]. 渔业信息与战略, 2018, 33(4): 279-283.
[20] 张云景. 用纳氏试剂分光光度法测饮用水中的氨氮[J]. 疾病监测与控制, 2012, 6(6): 366.
[21] 孙健, 贺锋, 吴振斌, 等. 影响草鱼摄食水生植物因素的研究进展[J]. 水产学杂志, 2019, 32(3): 53-57.
[22] PAPOUTSOGLOU S E, TZIHA G. Blue tilapia () growth rate in relation to dissolved oxygen concentration under recirculated water conditions[J]. Aquacultural Engineering, 1996, 15(3): 181-192.
[23] PICHAVANT K, PERSON-LE-RUYET J, BAYON N L, et al. Effects of hypoxia on growth and metabolism of juvenile turbot[J]. Aquaculture, 2000, 188(1):103-114.
[24] GU H X, HU M H, WEI S S, et al. Combined effects of toxicand hypoxia on the digestive enzyme activities of the triangle sail mussel[J]. Aquatic Toxicology, 2019, 212: 241-246.
[25] HU M H, WU F L, YUAN M Z, et al. Combined effects of toxic cyanobacteriaand hypoxia on the physiological responses of triangle sail mussel[J]. Journal of Hazardous Materials, 2016, 306: 24-33.
[26] AMADO L L, MONSERRAT J M. Oxidative stress generation by microcystins in aquatic animals: why and how[J]. Environment International, 2010, 36(2): 226-235.
[27] PRIETO A I, PICHARDO S, JOS Á, et al. Time-dependent oxidative stress responses after acute exposure to toxic cyanobacterial cells containing microcystins in tilapia fish () under laboratory conditions[J]. Aquatic Toxicology, 2007, 84(3): 337-345.
[28] 江天棋, 张杨, 姜亚洲, 等. 不同溶解氧水平下厚壳贻贝的贝壳开放行为和呼吸代谢[J]. 中国水产科学, 2021, 28(10): 1329-1336.
[29] 周作强, 丁晴晴, 刘其根, 等. 缺氧对贝类的胁迫效应及对其免疫系统的影响[J]. 生态毒理学报, 2013, 8(3): 324-330.
[30] GREENWAY S C, STOREY K B. Seasonal change and prolonged anoxia affect the kinetic properties of phosphofructokinase and pyruvate kinase in oysters[J]. Journal of Comparative Physiology B, Biochemical, Systemic, and Environmental Physiology, 2000, 170(4): 285-293.
[31] REMEN M, OPPEDAL F, TORGERSEN T, et al. Effects of cyclic environmental hypoxia on physiology and feed intake of post-smolt Atlantic salmon: initial responses and acclimation[J]. Aquaculture, 2012, 326/327/328/329: 148-155.
[32] 韦柳枝. 低溶解氧对中国明对虾生长的影响及其机制的实验研究[D]. 青岛: 中国海洋大学, 2010.
[33] 臧维玲, 朱振国, 戴习林, 等. 中国对虾瞬时耗氧速率与海水比重及溶氧水平的相关[J]. 水产科技情报, 1992, 19(4): 100-103.
[34] LIAO I, MURAI T. Effects of dissolved oxygen, temperature and salinity on the oxygen consumption of the grass shrimp,[J]. 1986.
[35] 李峤. 经济贝类对低氧耐受性的研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2019.
[36] RENAUD M L. Detecting and avoiding oxygen deficient sea water by brown shrimp,(Ives), and white shrimp(Linnaeus)[J]. Journal of Experimental Marine Biology and Ecology, 1986, 98(3): 283-292.
[37] PATERSON B D, THORNE M J. Measurements of oxygen uptake, heart and gill bailer rates of the callianassid burrowing shrimpDana and its responses to low oxygen tensions[J]. Journal of Experimental Marine Biology and Ecology, 1995, 194(1): 39-52.
[38] ROSAS C, MARTINEZ E, GAXIOLA G, et al. The effect of dissolved oxygen and salinity on oxygen consumption, ammonia excretion and osmotic pressure of(Linnaeus) juveniles[J]. Journal of Experimental Marine Biology and Ecology, 1999, 234(1): 41-57.
[39] 任庆印. 刺参()在夏眠过程中生理代谢调控机制的研究[D]. 青岛: 中国海洋大学, 2012.
Effects of Hypoxia Stress on Ingestion and Metabolism of
MA Yuan1,2, ZHANG Xing-zhi2, HE Ping-ping2, GUAN Jun-liang2, WEI Pin-yuan2, ZHANG Li2, LI Wei2, ZHU Peng1, XU You-hou1, YAN Xue-yu1, CHEN Xiao-han2, PENG Jin-xia2
(1.,,535011,; 2.,,530021,)
【】To explore the effects of different oxygen concentration stress on ingestion and metabolism of Hong Kong oyster ().【】Comparing the changes of ingestion rate (), unit individual ingestion rate (ind), unit mass ingestion rate (mass), oxygen consumption rate (O) and ammonia excretion rate (N) of the oysters under hypoxia conditions of 0.5, 1, 2 and 3 mg/L, and oxygen concentration of the control group is ≥ 5 mg/L The effects of acute hypoxia and 48 h continuous hypoxia on feeding and metabolism ofwere further analyzed.【】Under different hypoxia conditions, all indexes ofdecreased with the decrease of dissolved oxygen (DO), and the decrease of feeding and metabolic intensity in acute hypoxia treatment group was greater than that in continuous hypoxia for 48 hours. The correlation between dissolved oxygen concentration and feeding percentage in acute hypoxia group was1= 31.225ln(DO) + 35.509,² = 0.980 5, The variation ranges ofind,mass,O,Nwere 0.5 - 4.8 ind-1∙h-1, 7×107- 4.8×108ind-1∙h-1, 0.1 - 0.7 mg/(g∙h), 4 - 25 µg/(g∙h). The relationship between the concentration of dissolved oxygen and the percentage of ingestion in 48 h in continuous hypoxia group was2= 36.439ln(DO) + 19.163,² = 0.839 7, The variation ranges ofind,mass,O,Nwere 1.2 - 5.3 ind-1∙h-1, 1.1×108- 4.8×108g-1∙h-1, 0.2 - 0.8 mg/(g∙h), 18 - 32 µg/(g∙h) respectively.【】The feeding and metabolism ofwere affected by the concentration of dissolved oxygen in the water, and the lower the oxygen concentration was, the lower the feeding and metabolism rate was. After 48 hours of adapting to the low-oxygen environment, the feeding and metabolism capacity could recover to a certain level, but lower than those at the normal oxygen level.
; hypoxia stress; feeding; oxygen consumption rate; ammonia removal rate
马元,张兴志,何苹萍,等. 低氧胁迫对香港牡蛎摄食和代谢的影响[J]. 广东海洋大学学报,2022,42(3):127-133.
S917.4
A
1673-9159(2022)03-0127-07
10.3969/j.issn.1673-9159.2022.03.017
2021-12-28
广西重点研发项目(桂科AB21196030);广西自然科学基金青年基金(2019GXNSFBA245081);广西创新驱动发展专项(桂AA17204094-3);国家现代农业(贝类)产业技术体系建设项目(CARS-49)
马元(1997-),男,硕士研究生,研究方向为水产遗传育种。E-mail:1039135848@qq.com
张兴志(1987-),男,助理研究员,研究方向为水产遗传育种。E-mail:xingzhi.zh@foxmail.com
陈晓汉(1962-),男,研究员,研究方向为水产遗传育种。E-mail:chnxhn@163.com
彭金霞(1981-),女,研究员,研究方向为水产遗传育种。E-mail:269679250@qq.com
(责任编辑:刘岭)

