腌制叶用芥菜发酵菌分离鉴定及应用研究
胡丹丹 吴祖芳 孙志栋,* 陈山乔 翁佩芳
(1 宁波大学食品与药学学院,浙江 宁波 315800;2 宁波市农业科学研究院,浙江 宁波 315040)
叶用芥菜(leaf mustard,BrassicajunceaCoss var. foliosa Bailey)简称叶芥菜,属于十字花科芸薹属作物,是世界上重要的蔬菜作物及调料作物[1]。叶用芥菜原产于我国,为我国长江流域普遍栽培的腌制蔬菜,是芥菜中适应性较强的一个变种,类型和品种丰富,有大叶芥菜(var.rugosaBailey)、花叶芥菜(var.multisectaBailey)、雪里蕻(var.multicepsT sen et Lee)、茎瘤芥(var.tumidaT sen et Lee)和包心芥菜(var.capitataHart ex Li)等多种类型[2]。叶用芥菜作为人们日常食用的新鲜蔬菜,因其水分活度高而容易腐败,难以贮藏,通过盐渍加工成咸菜或酸菜是叶用芥菜常用的贮藏方式。我国大部分地区采用的传统自然发酵方法,存在发酵时间长、蔬菜含盐量高、亚硝酸盐累积量大、质地软等缺点[3]。研究表明,通过人工接种发酵剂的方式可以降低发酵蔬菜中亚硝酸盐含量、缩短发酵时间并改善蔬菜口感[4]。
发酵菌是食品在发酵过程中所应用的微生物,目前应用于蔬菜发酵的主要是乳酸菌。乳酸菌代谢糖类产生有机酸如乳酸,分解蛋白质产生肽类和氨基酸,是发酵蔬菜的有益微生物。Won等[5]从韩国泡菜中分离出的清酒乳杆菌ADM14菌株可显著降低前脂肪细胞3T3-L1内甘油三酯含量,对酸和胆盐也有良好的耐受性,具有作为益生菌和替代治疗性补充剂的潜力。Chi等[6]从135株乳酸菌中筛选低盐泡菜发酵剂并应用到泡菜中,表明应用发酵剂发酵能够加速风味形成并缩短泡菜的成熟期。据报道,从发酵食品(如腌菜)中分离出的乳酸菌对健康有多种益处,包括预防便秘、结肠炎、肝损伤和糖尿病等[7-10]。从已有的研究成果来看,腌制蔬菜中人工接种所用到的发酵剂多见于乳酸菌,而酵母菌则能产醇产酯并有利于风味的形成,如唐红梅等[11]从川南腌菜中筛选出4株耐盐、产香能力强的酵母菌株。我国有学者对发酵蔬菜的微生物生态研究表明,乳酸菌和酵母菌是发酵蔬菜中的优势菌群[12]。叶用芥菜在腌制过程中,乳酸菌和酵母菌混合使用则较少,同时因地域、原材料等限制,微生物菌群也表现出复杂多样性。
本研究从自然发酵的叶用芥菜中分离筛选、鉴定乳酸菌和酵母菌,研究其特性,以期为腌制蔬菜发酵菌剂的开发应用奠定理论基础,为实现腌制蔬菜的加工和增值提供技术支撑。
1 材料与方法
1.1 材料与试剂
腌制叶用芥菜,购自浙江省宁波市鄞州区新紫云堂公司。
乳酸细菌培养基(DeMan Rogosa and Sharpe agar,MRS)以及肉汤、孟加拉红培养基、改良马丁培养基,杭州微生物试剂有限公司;脱脂奶粉、氯化钠、氢氧化钠、盐酸、酚酞均为分析纯,国药集团化学试剂有限公司;乳酸菌DNA提取试剂盒、酵母菌DNA提取试剂盒、通用引物乳酸菌正向引物27f:5′-A G A G T T T G A T C C T G G C T C AG-3′与反向引物1492r:5′-A A G G A G G T G A T C C A G CC-3′、通用引物酵母菌正向引物ITS1:5′-T C C G T A G G T G A A C C T G C GG-3′与反向引物ITS4:5′-T C C T C C G C T T A T T G A T A T GC-3′,生工生物工程(上海)股份有限公司;食盐,购于华润万家超市。
1.2 主要仪器与设备
SW-CJ-2D型双人单面净化工作台,苏州净化设备有限公司;PHS-3C型pH计,上海圣科仪器设备有限公司;Spectramax190型全波长酶标仪,美国美谷分子仪器(Molecular Devices)有限公司;5804R型高速大容量冷冻离心机,德国Eppendorf公司;LD2F-50L-II型立式高压蒸汽灭菌器,上海申安医疗器械厂;JYL-C19V九阳多功能搅拌机,佛山市秋实电器有限公司;腌制桶,购于宁波邱隘市场。
1.3 试验方法
1.3.1 发酵菌的分离纯化 采用梯度稀释涂布法对腌制芥菜中的乳酸菌、酵母菌进行分离筛选。取25 mL腌制芥菜汁加入225 mL生理盐水中,振荡摇匀,并逐级稀释至10-1~10-6CFU·mL-1。乳酸菌:分别吸取0.1 mL涂布于含2%碳酸钙的MRS固体培养基中,37℃培养48 h,挑取溶钙圈大的菌落。酵母菌:分别吸取0.1 mL涂布于孟加拉红培养基,28℃培养48~72 h,挑取典型的酵母菌菌落。对挑取的所有菌落反复分离纯化,直至得到纯菌落,进行斜面保藏并编号备用。
1.3.2 发酵菌的筛选
1.3.2.1 乳酸菌 生长曲线测定:将活化好的菌株按1%的接种量分别接入灭菌的MRS液体培养基中,37℃培养24 h,从0 h开始取样,以未接种的MRS液体培养基作为空白对照,每隔2 h测一次波长600 nm下的吸光度值(optical density, OD),每个样品重复3次,观察各菌株的OD值随发酵时间的变化。
产酸性能测定:将活化好的菌株按1%的接种量分别接入灭菌的MRS液体培养基中,37℃培养24 h,从0 h开始取样,以未接种的MRS液体培养基作为空白对照,每隔4 h测一次pH值,每个样品重复3次,观察各菌株的pH值随发酵时间的变化。
亚硝酸盐降解率测定:亚硝酸盐降解率参照刘芳等[13]的方法(温度修改为37℃),根据盐酸萘乙二胺法[14]测定亚硝酸盐含量,计算亚硝酸盐降解率:亚硝酸盐降解率=(亚硝酸盐原含量-降解后亚硝酸盐含量)/亚硝酸盐原含量×100%。
1.3.2.2 酵母菌 产气能力检测:吸取1%酵母菌的新鲜培养物加入含有杜氏小导管的豆芽汁液体培养基中,每隔12 h观察杜氏小导管产气情况,对酵母菌的产气能力进行初步判断,进一步筛选出性状良好的优良菌株。
蛋白酶活性检测:将根据产气能力筛选出的酵母菌菌株进行活化,按照1%的接种量均匀涂布于蛋白酶检测固体培养基中,放置于28℃培养箱培养48 h, 观察菌落周围是否出现透明环,有透明环表明该菌株具有蛋白酶活性。
产酯测定:将具有蛋白酶活性菌株按照1%的接种量加入豆芽汁培养基中,放置于28℃摇床中培养48 h 后,采用回流皂化方法[15]测定培养液中的总酯含量。
1.3.3 发酵菌的微观形态学鉴定 根据发酵性能筛选出的优势乳酸菌和酵母菌进行增菌处理,吸取1 mL菌液于1.5 mL离心管中,以3 500 r·min-1离心3 min, 用生理盐水冲洗2~3遍并再次离心,最后用2.5%的戊二醛进行固定,于浙江大学测试中心进行扫描电镜和透射电镜成像。
1.3.4 发酵菌分子生物学鉴定 根据发酵性能筛选出的优势乳酸菌和酵母菌通过试剂盒进行总DNA提取后,以细菌通用引物对乳酸菌进行16SrDNA扩增,其正向引物27f:5′-A G A G T T T G A T C C T G G C T C AG-3′;反向引物1492r:5′-A A G G A G G T G A T C C A G CC-3′。以真菌通用引物对酵母菌进行18SrDNA扩增,其正向引物 ITS1:5′-T C C G T A G G T G A A C C T G C GG-3′;反向引物ITS4:5′-T C C T C C G C T T A T T G A T A T GC-3′。
PCR扩增体系:乳酸菌:2×EasyTaq PCR Super Mix 25 μL,上下游引物各1 μL,模板DNA 2 μL,ddH2O补至50 μL。酵母菌:2×EasyTaq PCR Super Mix 25 μL,上下游引物各2.5 μL,模板DNA 2 μL,ddH2O补至50 μL。
PCR扩增条件:乳酸菌:94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸90 s,循环30次;72℃终延伸20 min,4℃保温。酵母菌:94℃预变性5 min;94℃变性1 min,54℃退火1 min,72℃延伸1 min,循环34次;72℃终延伸10 min,4℃保温。
PCR扩增产物由琼脂糖凝胶电泳检测后,测序工作由生工生物工程(上海)股份有限公司完成。
1.3.5 系统发育树的构建 将菌株测定的序列提交至NCBI进行 BLAST[16]比对,比对结果用MEGA 4软件中的 Neighbor-Joining 法构建系统发育树,以确定该菌株的分类地位。
1.3.6 发酵菌株的应用 将筛选出的优良菌株应用到新鲜的芥菜中,测定发酵芥菜的理化指标,并与自然发酵的芥菜作比较。
1.3.7 理化指标测定
pH值:采用PHS-3C型pH计直接测定;
总酸:参考《GB/T 12456-2008食品安全国家标准 食品中总酸的测定》测定[17];
氨基酸态氮:参考《GB/T 5009.235-2016食品安全国家标准 食品中氨基酸态氮的测定》测定[18];
亚硝酸盐含量:采用南京建成生物工程研究所亚硝酸盐测试盒测定。
1.4 数据处理
每组试验均进行3次生物学重复,所有数据用SPSS 26.0软件进行差异显著性(P<0.05)分析,采用OriginPro 9.0 软件作图。
2 结果与分析
2.1 发酵菌的分离
试验根据溶钙圈大小共纯化分离出11株乳酸菌,依次编号为L1~L11。根据酵母菌菌落形态和菌落特征差异共分离纯化出9株酵母菌,依次编号为Y1~Y9。
2.2 发酵菌的筛选
2.2.1 乳酸菌的筛选
2.2.1.1 生长曲线的测定结果 通常以600 nm波长下的吸光度值变化来反映菌株的生长和繁殖情况,在对11株乳酸菌进行活化过程中,L11生长较慢,故将其淘汰。剩下的10株乳酸菌生长曲线测定结果见图1。所有菌株均在 4 h 后进入对数生长期。在2 h时,L8与L3、L9之间差异达显著水平(P<0.05)。在14 h时L3、L8和L9菌体量较大,多数菌株均在16 h进入稳定期,进入稳定期后的L3、L8和L9生长繁殖速度与其他菌株相比较快,其中L9的生长情况比L8略好,且在6、14以及16 h时,L9与L3、L8之间差异均达显著水平(P<0.05)。L10的生长繁殖速度较慢,菌体量较少,在24 h时的OD值仅为1.2。
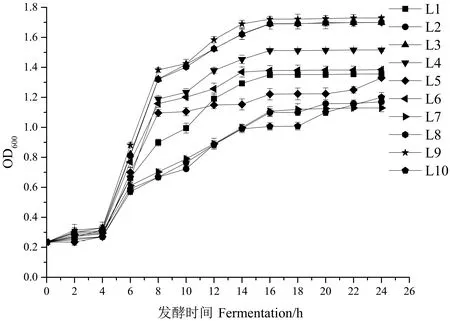
图1 各菌株的生长曲线Fig.1 Growth curve of each strain
2.2.1.2 产酸性能的测定结果 产酸能力决定着蔬菜发酵周期,也是评判菌种发酵活力的重要指标[19]。每隔4 h测一次pH值,得到各菌株pH值随发酵时间的变化曲线见图2。结果表明,L8、L9产酸快,且产酸能力相近,尤其是在4~8 h时,L8、L9产酸速度明显,pH值分别达到4.52、4.31;在12 h时,L3、L4产酸快,pH值分别达到4.32、4.31,L7和L10产酸慢,pH值分别达到4.76、4.70,且L3、L8、L9在8 h和12 h时,三者之间均达显著性差异(P<0.05);各菌株在培养24 h后,pH值均达到稳定值,说明各菌株均可使pH下降,但发酵液的最终pH值不同,按照由低到高顺序排列为L9(3.68)、L3(3.79)、L4(3.79)、L8(3.81)、L5(3.82)、L2(4.08)、L6(4.08)、L7(4.31)、L10(4.40)。
2.2.1.3 亚硝酸盐降解率的测定结果 亚硝酸盐含量是影响腌制菜品质的重要因素,研究亚硝酸盐降解能力高的乳酸菌对指导腌渍菜生产有重要意义[20]。由图3可知,L8降解亚硝酸盐的能力最强,降解率达到78.96%,其次是L9,降解率为76.72%,两者之间差异不显著(P>0.05);再次是L1和L3,降解率分别为73.44%、74.41%,L8与L1、L3之间降解亚硝酸盐的能力达到显著水平(P<0.05)。L10降解率最低,仅为47.73%。
综合图1~3,根据各菌株的生长曲线、产酸速度以及亚硝酸盐降解率,最终从10株乳酸菌中确定L8、L9为本试验所筛选出的优势乳酸菌。
2.2.2 酵母菌的筛选
2.2.2.1 产气能力检测结果 由于过多的气体会使泡菜变软[21],影响泡菜的口感和质地。根据表1可知,Y4、Y5以及Y7产气能力较强,尤其是Y7,在28℃条件下发酵48 h,产气量已充满整个杜氏小管,而菌株Y1、Y2、Y3、Y6、Y8、Y9在72 h内均不产气,因此将这6株菌作为复筛的出发菌株。
2.2.2.2 蛋白酶活性检测结果 具有蛋白酶活性的菌株在蔬菜发酵过程中对风味形成有重要影响[22],

表1 不同菌株杜氏小导管产气效果Table 1 Gas production in the Durham tube of different strains
可以分解蛋白质产生游离氨基酸,游离氨基酸对食品的滋味贡献较大。根据表2可知,Y1、Y2、Y6、Y9菌落周围均出现了透明环,均具有蛋白酶活性,因此将这4株菌株作为下一步的复筛菌株。

表2 酵母菌蛋白酶活性检测结果Table 2 Yeast protease activity test results
2.2.2.3 产酯检测结果 酯类作为酵母发酵产物中主要的呈香物质[11],是香气的来源,是评价酵母生香能力的重要指标,在蔬菜发酵过程中对风味有着有利的影响。由图4可知,各菌株在培养48 h后,发酵液中Y9总酯含量最高,为0.386 3 g·100 mL-1,其次是Y1,总酯含量达到0.325 4 g·100 mL-1;Y2、Y6总酯含量相对较少,Y9菌株的总酯含量与Y1、Y2、Y6之间差异均达显著水平(P<0.05)。表明Y9的产酯能力最强,适合发酵。
根据菌株的产气能力、蛋白酶活性检测以及产酯能力逐级筛选,最终从9株酵母菌中确定Y9为本试验所筛选出的优势酵母菌。

图4 各菌株的产酯能力Fig.4 Ester production capacity of each strain
2.3 选取的发酵菌鉴定
2.3.1 宏观形态学鉴定 将筛选确定的3株优势发酵菌L8、L9以及Y9在平板上培养,观察其菌落特征,结果见表3和图5。

表3 菌落形态特征描述Table 3 Description of colony morphology characteristics
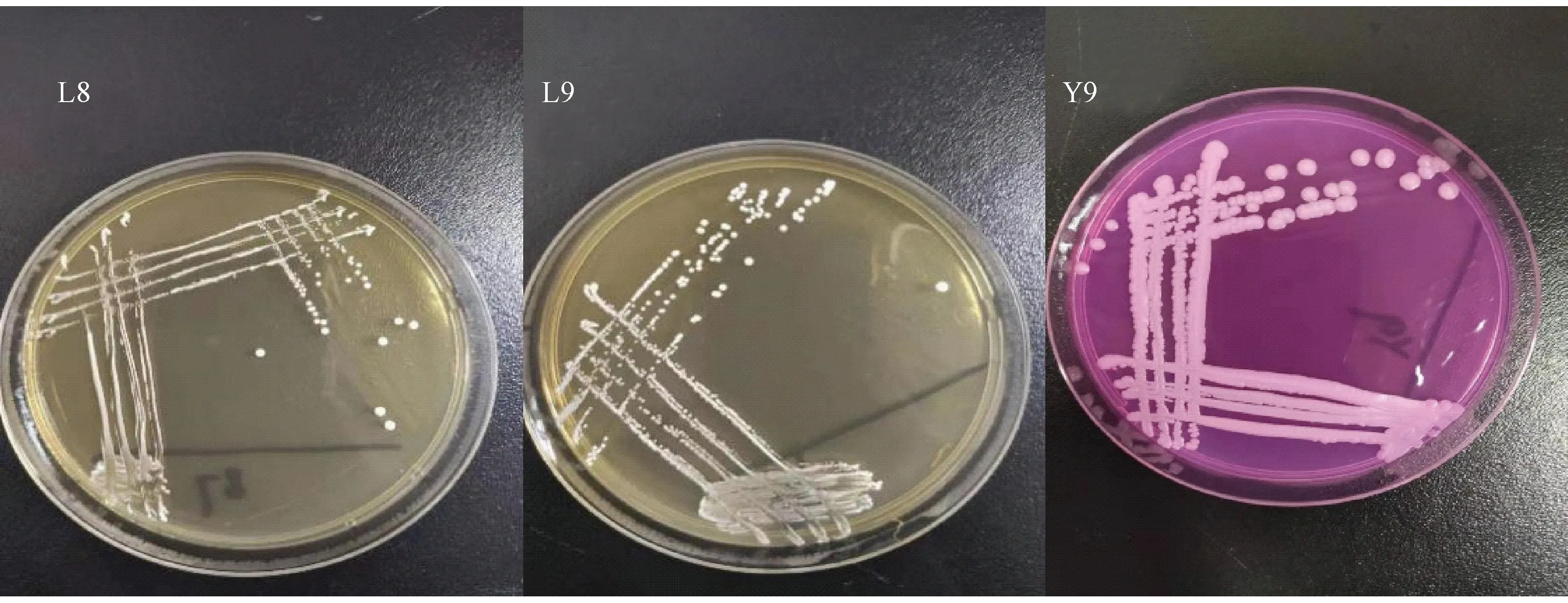
图5 菌株菌落形态Fig.5 Strain colony morphology

图6 发酵菌株的电镜成像Fig.6 Electron microscopy imaging of fermented strains
2.3.2 微观形态学鉴定 将筛选的优势发酵菌L8、L9以及Y9进行扫描电镜(scanning electron microscope,SEM)和透射电镜(transmission electron microscope,TEM)观察,结果如图6所示。综合观察发酵菌株的扫描电镜和透射电镜成像发现,L8、L9菌体均呈杆状,可以对L8、L9进行初步判断,两者可能均为乳杆菌,而Y9菌体呈卵圆形,为酿酒酵母菌的可能性较大。
2.3.3 分子生物学鉴定 菌株序列扩增电泳图如图7所示。测序结果在NCBI基因序列库通过BLAST进行序列比对,得到相似性为99%~100%的序列,从中随机选取100%典型菌株的序列用MEGA4软件构建系统发育树,结果见图8。可以判定L8为短乳杆菌(Lactobacillusbrevis)、L9为植物乳杆菌(Lactobacillusplantarum),Y9为酿酒酵母菌(Saccharomycescerevisiae),这也与微观形态学鉴定结果相符合。
2.4 接菌对叶用芥菜发酵的影响
将筛选出的优良菌株均按1.5%(种子液菌体浓度约为107CFU·mL-1)的接种量接种至叶用芥菜中,与自然发酵的叶用芥菜对比部分理化指标,结果见图9。pH值和总酸是评估发酵蔬菜成熟度的2个主要参数,大多数腌菜成熟时的pH值和总酸分别在3.2~4.2、0.6~2.4 g·100g-1范围内,这与我国成熟的发酵蔬菜特征相对应[23]。由图9-A、B可知,与自然发酵的叶用芥菜相比,接菌发酵降低了pH值、提高了总酸含量,在发酵终点时分别达到3.485、0.957 6 g·100g-1,且与自然发酵差异均达到显著水平(P<0.05)。食品中氨基酸的含量是感官呈味的一项重要指标。由图9-C可知,接菌发酵氨基酸态氮含量均高于自然发酵,氨基酸主要来源于腌制菜中蛋白质分解,一定浓度的发酵菌种有利于蛋白质分解,产生更多的游离氨基酸。亚硝酸盐含量是评价发酵蔬菜和腌制蔬菜安全性的重要指标。由图9-D可知,发酵初期,自然发酵与接菌发酵的亚硝酸盐含量均呈上升趋势,并且均有亚硝酸盐峰值的出现,但接菌发酵组的亚硝酸盐峰值远低于自然发酵组,且接菌发酵与自然发酵两者之间在发酵4、9及15 d时具有显著性差异(P<0.05)。在发酵后期,接菌发酵的亚硝酸盐含量仅为0.22 mg·kg-1。
从自然发酵和接菌发酵两组的理化指标可以看出,接入优良的发酵菌株可以提高腌制叶用芥菜的品质和安全性。
3 讨论
蔬菜的发酵主要是由附着在蔬菜中的微生物经过一系列代谢活动引起,有研究表明,乳酸菌可以改善产品风味和质地,提高消化率[24],具有高耐酸性和益生菌特性[25]。同时在发酵蔬菜环境中存在着由蔬菜原料带入的酵母菌,酵母菌在无氧环境下将糖类物质分解为乙醇,可以抑制发酵环境中腐败菌的生长繁殖,还可以与发酵后期产生的有机酸发生酯化反应生成芳香族化合物,增加发酵成品的芳香气味。研究表明,乙醇含量过多,会消耗大量糖类,降低发酵蔬菜的营养价值[26],因此在蔬菜发酵过程中,酵母菌的应用通常没有乳酸菌广泛。蔬菜发酵过程中的部分理化指标对发酵产品品质有重要作用,如氨基酸是发酵蔬菜重要的营养成分,氨基酸含量的高低代表着发酵蔬菜营养成分多少,且多种氨基酸会给发酵蔬菜提供丰富有层次感的鲜味和甜味[27]。亚硝酸盐含量是评价发酵蔬菜和腌制蔬菜安全性的重要指标[28]。食用亚硝酸盐含量较高的发酵蔬菜可引起中毒或增加癌症患病几率,因此国家标准发酵蔬菜中的亚硝酸盐含量有着严格的要求[14]。本研究中接菌发酵的理化指标均优于自然发酵,但对成品的营养价值和风味还有待进一步研究。
利用形态和生理生化特征鉴定菌种的传统方法耗时长、过程繁琐、不易确定菌种。本研究对目标菌株乳酸菌L8、L9和酵母菌Y9进行鉴定时,通过微观形态学观察结合分子生物学技术鉴定,包括以核酸为基础,结合PCR扩增、凝胶电泳以及测序等现代分子生物学技术,充分显示出鉴定方法的高效、快速及准确性,加快了优良发酵菌种的筛选进程。
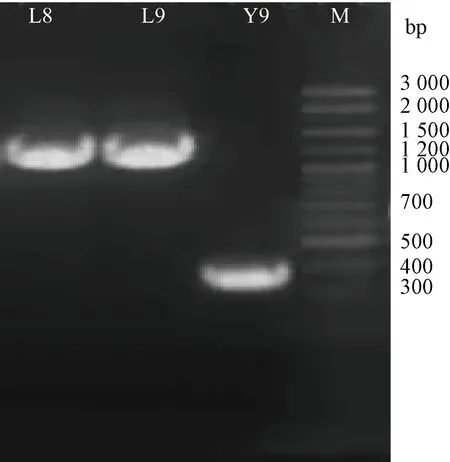
注:M为Maker。Note: M is Maker.图7 发酵菌株扩增电泳图Fig.7 Amplification electrophoresis diagram of fermentation strains
在对目标菌株进行筛选时,设置可靠灵敏的系统尤为重要,刘沁源等[29]、程凯森等[30]均通过可靠灵敏的系统筛选出优良菌株。本试验筛选出2株发酵性能良好的乳酸菌,分别是L8短乳杆菌(Lactobacillusbrevis)、L9植物乳杆菌(Lactobacillusplantarum)。陈荷凤等[27]研究腌渍菜植物乳杆菌的分离鉴定特性发现,蔬菜在腌渍初期,产酸少繁殖快,以不耐酸的肠膜明串珠菌占优势,中后期主要转为植物乳杆菌和短乳杆菌。本试验是从自然发酵的芥菜盐水产品中筛选菌株,属于发酵中后期,筛选的2株乳酸菌与陈荷凤等的研究较为一致。根据逐级筛选,筛选出的1株酵母菌是Y9酿酒酵母菌(Saccharomycescerevisiae),酿酒酵母菌常用于酿酒、制作面包以及饼干等[31],其呈现风味的主要物质为酯类,可以为产品带来良好的香气,但在蔬菜发酵中应用较少。本研究未利用诱变等手段对分离

图8 发酵菌株的系统发育树Fig.8 Phylogenetic tree of fermenting bacteria

注:不同小写字母表示同一发酵时间不同处理间差异显著(P<0.05)。Note: Different lowercase letters indicate significant differences at 0.05 level between different treatments at the same fermentation time.图9 两组芥菜发酵过程中pH值(A)、总酸(B)、氨基酸态氮(C)、亚硝酸盐(D)的变化Fig.9 Changes of pH value(A), total acid (B), amino acid nitrogen (C) and nitrite (D) during the fermentation of two groups of mustard
筛选出的发酵菌株进行改良,因此对利用该菌种发酵提高发酵蔬菜的特征以及功能性成分尚有待进一步研究。
4 结论
本研究通过设置可靠灵敏的筛选系统,筛选出发酵性能优良的3株菌种,即L8短乳杆菌(Lactobacillusbrevis)、L9植物乳杆菌(Lactobacillusplantarum)以及Y9酿酒酵母菌(Saccharomycescerevisiae),其中,L8的亚硝酸盐降解率最高,为78.96%,L9的生长情况最好,但pH值最低,仅为3.68,Y9不产气且具有蛋白酶活性,总酯含量达到0.386 3 g·100mL-1。将筛选出的3株优良菌种应用于叶用芥菜腌制发酵,与自然发酵相比,接菌发酵的pH值、亚硝酸盐含量降低了2.22%和88.13%,总酸含量、氨基酸态氮含量分别增加了9.02%和28.09%,提高了腌制叶用芥菜的营养和安全性。本研究结果为发酵叶用芥菜的优势益生菌菌种选择提供了新的来源,为今后工业化生产奠定了技术基础。

