裸脚菇0612-9提取物对柑橘青、绿霉的抑菌活性及作用机制
霍光华 张先吉 颜俊清 崔朝宇 龙昊知 张林平 胡殿明 彭文文
(江西农业大学, 江西省菌物资源保护与利用重点实验室, 江西 南昌 330045)
由意大利青霉(Penicilliumitalicum)和指状青霉(P.digitatum)引起的柑橘青、绿霉病是目前柑橘贮运、保藏过程中最常见的病害[1]。这两种病原菌引起贮藏期柑橘果实腐烂变质,严重影响柑橘品质[2]。目前,柑橘采后保鲜、防病的主要手段仍是采用甲基托布津、多菌灵、噻菌灵、咪鲜胺、抑霉唑等化学杀菌剂进行浸果处理[3],长期使用化学杀菌剂,不仅容易导致病原菌产生耐药性,影响病害防治效果,还会造成农药残留等问题,对消费者健康和安全造成威胁[4]。因此,开发新型安全、高效的防治药剂来替代化学杀菌剂具有重要的现实意义。
2014年,江西农业大学生物科学与工程学院制药工程与霍光华课题组在江西省南昌市梅岭山区林地木材上采集到一株野生大型真菌0612-9,鉴定为祼脚菇属种,命名为裸脚菇(Gymnopussp.)0612-9[5-6]。吴胜等[7]对该菌株发酵液的抑菌活性进行了研究,表明该菌种发酵液对意大利青霉(P.italicum)、指状青霉(P.digitatum)、水稻纹枯病菌(Rhizoctoniasolani)、灰葡萄孢(Botrytiscinerea)等13种植物病原真菌均具有抑制活性,其中对意大利青霉和指状青霉的抑制效果最佳。随后,吴天福等[8]对菌株0612-9发酵液中活性物质的稳定性进行了系统分析,证实分离获得的活性物质I在高温、紫外光、氧化和极端pH等条件下均较稳定;花纪等[9]系统研究了该菌株代谢产抑菌活性物质的液体发酵条件,其最佳液体菌种培养基组成为玉米粉30 g·L-1、麦芽糖10 g·L-1、蛋白胨15 g·L-1、KH2PO42 g·L-1、 MgSO4·7H2O 1 g·L-1,最佳培养条件为起始pH值5、接种3×Ф7 mm菌块、装液量100 mL/250 mL三角瓶、温度28℃、转速160 r·min-1。但目前关于裸脚菇0612-9发酵液中活性物质抑制意大利青霉和指状青霉的作用机制尚鲜见研究报道。
本研究以意大利青霉和指状青霉菌丝体为试验对象,采用菌丝生长速率法测定裸脚菇0612-9提取物(extract of fermentation broth fromGymnopussp. 0612-9, GSFE)对病原菌的抑菌活性;利用扫描电镜和透射电镜观察GSFE对病原菌菌丝形态和细胞结构的影响;并测定GSFE对病原菌菌丝相对电导率,核酸、可溶性蛋白含量和麦角固醇合成的影响;揭示GSFE拮抗意大利青霉和指状青霉的作用机制,以期为新型微生物源柑橘采后保鲜剂的开发提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 裸脚菇0612-9,保藏于中国普通微生物菌种保藏管理中心,编号CGMCC15375;意大利青霉和指状青霉由江西省果蔬保鲜与无损检测重点实验室提供。
1.1.2 培养基 马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA):去皮马铃薯200 g·L-1、葡萄糖20 g·L-1、琼脂粉15 g·L-1;马铃薯葡萄糖肉汤培养基(potato dextrose broth, PDB):PDA培养基中不加琼脂粉;种子培养液:玉米粉30 g·L-1、麦芽糖10 g·L-1、蛋白胨15 g·L-1、磷酸二氢钾2 g·L-1、硫酸镁1 g·L-1,pH值7.0;发酵培养液:去皮马铃薯280 g·L-1、葡萄糖30 g·L-1、 麸皮8.25 g·L-1、磷酸二氢钾2 g·L-1、硫酸镁0.41 g·L-1,pH值7.0。
1.2 仪器与设备
N-1200B型旋转蒸发仪,东京理化器械株式会社;BLK-FD-0.5型真空冷冻干燥机,江苏博莱客冷冻科技发展有限公司;EMU C7型超薄切片机,德国Leica公司;H-3000 N型扫描电子显微镜、H-7650型透射电子显微镜,日本Hitachi公司;Ti-S倒置荧光显微镜,日本Nikon公司;E2695型高效液相色谱,美国Waters公司;UV759型紫外可见分光光度仪,上海奥谱勒仪器有限公司。
1.3 GSFE的制备
将斜面保存的裸脚菇0612-9接种至PDA平板中,28℃培养箱中培养7 d,然后用5 mm打孔器沿菌落边缘打孔,挑取菌饼接种于100 mL种子培养液中,于28℃、180 r·min-1条件下振荡培养9 d;按10%比例将种子液接种至5 L发酵培养液中,振荡培养5 d后即为裸脚菇发酵液。用滤纸滤除发酵液中的菌丝,随后将发酵上清液浓缩至1 L左右,加入等体积的乙酸乙酯超声萃取3次,取上层乙酸乙酯相,合并后旋转蒸发浓缩成浸膏,取适量浸膏加入甲醇溶解,制成质量浓度为2.5 mg·mL-1的GSFE母液,0.22 μm无菌微孔滤膜过滤,于4℃条件下保存备用。
1.4 GSFE抑菌活性的测定
1.4.1 室内毒力测定 参考易磊等[10]的方法,采用菌丝生长速率法测定并计算毒力方程。将2.5 mg·mL-1的GSFE母液稀释成1 250、625、312.5、156.3和78.2 μg·mL-1的不同质量浓度的溶液,在无菌条件下,将不同浓度GSFE溶液和培养基按1∶9的比例混合分别制成250、125、62.5、31.25、15.63和7.82 μg·mL-1含药培养基,用直径6.5 mm的打孔器取活化好的病原菌边缘菌块,接种至含药培养基中央,以添加等量甲醇溶液为空白对照。每个处理重复3次,28℃条件下培养7 d,用十字交叉法测量菌落直径,计算抑菌率。将菌丝生长抑制率换算成机率值y,药剂浓度换算成浓度对数x,求得毒力回归方程y=a+bx,并由毒力方程计算出半最大效应浓度(concentration for 50% of maximal effect, EC50)值和相关系数r值[11]。
1.4.2 最小抑菌浓度测定 参考Yahyazadeh等[12]的方法。首先配制125、150、175、200、225和250 μg·mL-1含药PDA平板,用直径6.5 mm的打孔器取活化好的病原菌边缘菌块,接种至含药培养基中央。每个处理重复3次,28℃下培养2 d后观察病原菌生长情况。以无病原菌生长的PDA平板的含药浓度为最小抑菌浓度(minimum inhibitory concentration, MIC)。
1.5 GSFE对意大利青霉和指状青霉菌丝和细胞形态的影响
1.5.1 菌丝培养 取0.5 mL病原菌孢子悬浮液(106个·mL-1) 接种至30 mL的PDB培养液中,于28℃、180 r·min-1条件下振荡培养2 d,加入不同浓度的GSFE,共设置3个浓度梯度,分别为0、EC50、MIC,继续振荡培养1 d后取样,备用。
1.5.2 扫描电镜观察病原菌菌丝形态的变化 参考Palma-Guerrero等[13]的方法,取上述菌丝分别浸泡在2.5%的戊二醛溶液中,4℃冰箱内固定过夜。然后将戊二醛吸出,用0.05 mol·L-1的PBS缓冲液(pH值7.0)清洗样品3次,每次20 min。用1%的锇酸溶液固定样品2 h,将锇酸溶液取出并回收,用0.05 mol·L-1的PBS缓冲液(pH值7.0)清洗样品3次,每次20 min。用梯度浓度为30%、50%、70%、80%、90%和95%的乙醇溶液对样品进行脱水处理,每种浓度处理20 min,再用100%的乙醇脱水处理45 min,酒精脱水后将样品置于真空冷冻干燥仪中进行干燥处理,喷金处理后于扫描电镜(scanning electron microscope, SEM)下观察,并记录不同处理条件下病原菌菌丝形态变化情况。
1.5.3 透射电镜观察病原菌细胞形态的变化 参考Zhou等[14]的方法,菌丝样品固定、脱水步骤同1.4.2,经置换、浸透、包埋处理后,由EMU C7型超薄切片机切得70~90 nm的切片,切片经铀、铅双染后于透射电镜(transmission electron microscope, TEM)下进行观察,并记录不同处理条件下病原菌细胞形态变化情况。
1.6 GSFE对病原菌细胞膜通透性的影响
1.6.1 荧光显微镜下观察GSFE对病原菌细胞膜通透性的影响 参考Huang等[15]的方法,取0.5 mL病原菌孢子悬浮液(106CFU·mL-1)接种至30 mL的PDB培养液中,于28℃、180 r·min-1条件下振荡培养48 h后,添加GSFE使其终浓度分别为0、EC50和MIC,继续培养8 h。取出5 mL菌液转移至新的离心管中,8 000 r·min-1离心5 min收集菌体,用0.05 mol·L-1的PBS缓冲液(pH值7.0)清洗3次以去掉残余培养液,加入500 μL 10 μg·mL-1的碘化丙啶避光染色30 min,离心收集菌体,用PBS缓冲液清洗3次,加入2 mL PBS缓冲液悬浮菌体,取20 μL悬浮液于载玻片上,盖上盖玻片,于荧光显微镜下(激发波长BP 546/12 nm,发射波长LP 590 nm)观察并拍照。
1.6.2 菌丝胞外电导率的测定 取0.5 mL病原菌孢子悬浮液(106CFU·mL-1)接种至30 mL的PDB培养液中,于28℃、180 r·min-1条件下振荡培养2 d。取出菌丝体,用布氏漏斗抽干其表面培养液和水分,并用PBS缓冲液冲洗3次,称取1 g菌丝转移至25 mL试管中,加入10 mL终浓度为0、EC50和MIC的GSFE;分别在GSFE处理0.5、1、2、4、6和8 h时测定各处理液的电导率,并按以下公式计算相对电导率[16]:
相对电导率=
1.6.3 菌丝蛋白质和核酸类物质外渗的测定 在含有不同浓度GSFE的PDB培养液中培养病原菌菌丝,分别在培养0.5、1、2、4、6和8 h后吸取2 mL菌液,14 000 r·min-1离心5 min,收集上清液,采用紫外分光光度计分别测定260 nm和280 nm波长下的吸光度值[17],OD260和OD280分别表示上清液中核酸类和蛋白质类物质的相对含量。
1.7 GSFE对病原菌作用靶位预测分析
1.7.1 对病原菌菌丝麦角固醇含量的影响 取0.5 mL病原菌孢子悬浮液(106CFU·mL-1)接种至30 mL的PDB培养液中,于28℃、180 r·min-1条件下振荡培养2 d,加入GSFE使其终浓度为EC50,继续振荡培养48 h,收集菌丝,加入无菌蒸馏水冲洗数次,洗掉残余培养液并抽滤,称取0.5 g菌丝放入研钵中,参考吴志明等[18]的方法提取各菌丝样品中的麦角固醇。
通过高效液相色谱(high performance liquid chromatography, HPLC)检测麦角固醇含量。精确称取5 mg麦角固醇用分析纯乙醇溶解并定容至10 mL,配置成浓度分别为250、125、100、50、25和5 μg·mL-1的麦角固醇液相检测标准液。用微量进样器吸取上述麦角固醇样品15 μL,注入液相色谱仪测定麦角固醇含量,HPLC条件:色谱柱为Thermo Scientific Hypersil BDS C18、流动相为色谱级纯甲醇、紫外检测器(Waters 2487)检测波长282 nm、柱温25℃、流速0.9 mL·min-1、 进样量15 μL,以峰面积为纵坐标(y),浓度为横坐标(x),绘制HPLC标准曲线。根据标准曲线计算各样品中的麦角固醇含量。以添加等量无菌0.05 mol·L-1的PBS缓冲液(pH值7.0)培养的意大利青霉和指状青霉为空白对照。
1.7.2 两性霉素B和GSFE复配抑菌效果评价 将两性霉素B与GSFE按照一定比例混配,按照1.4.1的方法测定两性霉素B、GSFE及两者混剂对意大利青霉和指状青霉菌丝生长的抑制作用。采用Wadley方法计算混配药剂的增效系数(synergistic ratio,SR),评价混配药剂的联合作用类型[19]。
EC50(th)=(a+b)/(a/EC50A+b/EC50B)
SR=EC50(th)/EC50(ob)
式中,a,b分别代表A药(两性霉素B)和B药(GSFE)在混剂中所占比例。EC50(th)为理论值,EC50(ob)为实测值。SR<0.5为拮抗作用,0.5≤SR≤1.5为相加作用,SR>1.5为增效作用[19]。
1.7.3 对病原菌麦角固醇合成途径影响 取0.5 mL病原菌孢子悬浮液(106CFU·mL-1)接种至30 mL的PDB培养液中,于28℃、180 r·min-1条件下振荡培养2 d,随后分别加入GSFE、两性霉素B以及二者混剂,各供试药剂终浓度为EC50,继续振荡培养48 h,收集菌丝,加入无菌蒸馏水冲洗数次,洗掉残余培养液并抽滤。对各菌丝样品中麦角固醇、甾醇类化合物进行提取。采用薄层色谱法对各样品进行检测,以麦角固醇标准品作为对照。
薄层色谱和扫描条件:展开剂为环己烷∶乙酸乙酯(4∶1),蒸汽饱和30 min,展开8 cm;分别取标准品及各样品溶液20 μL点于高效硅胶板上展开;10%硫酸乙醇溶液喷雾,110℃显色60 min。
1.8 数据分析
采用DPS 7.05软件进行数据处理,使用GraphPad Prism 8软件绘制图片。
2 结果与分析
2.1 GSFE对意大利青霉和指状青霉的抑制活性
由表1可知,GSFE对意大利青霉和指状青霉菌丝的抑制率随着GSFE浓度的升高而增强,其中GSFE对意大利青霉的毒力线性回归方程为y=2.067 6+1.347 0x, 相关系数为0.987 0,EC50为116.76 μg·mL-1; 对指状青霉的毒力线性回归方程为y=2.016 6+1.375 1x,相关系数为0.990 8,EC50为147.74 μg·mL-1。
当GSFE浓度达250 μg·mL-1时,其对意大利青霉和指状青霉抑制率均达100%(表1),推测GSFE对意大利青霉和指状青霉的最小抑菌浓度应介于125~250 μg·mL-1之间。为测定其最小抑菌浓度,配制GSFE浓度为125、150、175、200、225和250 μg·mL-1含药平板,观察意大利青霉和指状青霉在含药平板上的生长状况。结果显示,意大利青霉和指状青霉在GSFE浓度为125、150、175 μg·mL-1的含药平板上均能生长,而在GSFE浓度为200、225和250 μg·mL-1含药平板上均不能生长。因此,GSFE对意大利青霉和指状青霉的最小抑菌浓度均为200 μg·mL-1。
2.2 GSFE对病原菌菌丝形态的影响
经扫描电镜观察,GSFE处理的意大利青霉和指状青霉菌丝形态发生了明显变化。在对照组(未加入GSFE)中,2种病原真菌菌丝均形态饱满、表面均匀光滑、粗细均匀、隔膜清晰(图1-A1、B1);而经GSFE处理后,意大利青霉和指状青霉菌丝表面均出现塌陷皱缩,菌丝体出现畸形干瘪(图1-A2、A3、B2、B3);经MIC浓度的GSFE处理后,部分菌丝出现较严重的扭曲,甚至呈螺旋状(图1-A3、B3)。结果表明,GSFE对意大利青霉和指状青霉菌丝产生了严重影响,造成菌丝脱水、皱缩。
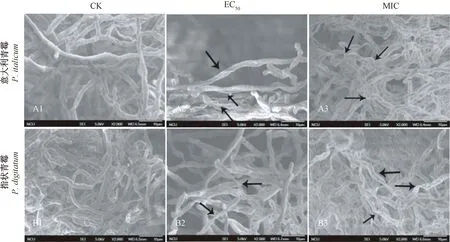
注:A1、B1:未加入GSFE培养的菌丝;A2、B2:用终浓度为EC50的GSFE培养的菌丝;A3、B3:用终浓度为MIC的GSFE培养的菌丝。下同。图中箭头表示菌丝损伤部位。Note: Mycelia were incubated in PDB without GSFE (A1、B1) or at final concentrations of EC50 (A2、B2) or MIC (A3、B3). The same as following. The arrow in the figure shows the damage site of mycelium.图1 GSFE对意大利青霉(A)和指状青霉(B)菌丝形态的影响Fig.1 Effects of GSFE on mycelial morphology of P. italicum (A) and P. digitatum (B)
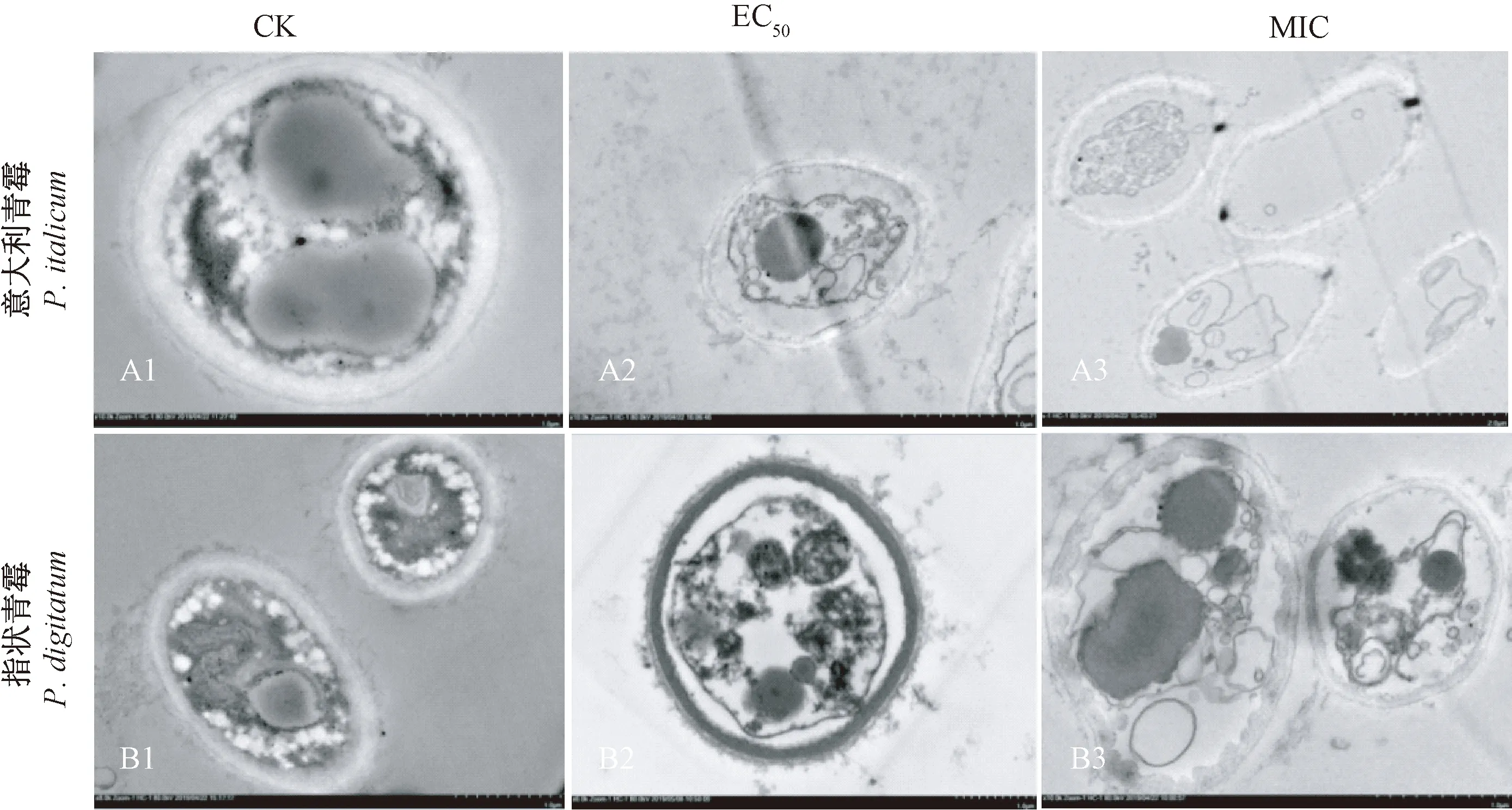
图2 GSFE对意大利青霉(A)和指状青霉(B)细胞超微结构的影响Fig.2 Effects of GSFE on cell ultrastructure of P. italicum (A) and P. digitatum (B)
2.3 GSFE对病原菌细胞超微结构的影响
经透射电镜观察,在对照组中,2种病原真菌菌丝均细胞饱满、结构清晰、层次清楚、胞外无渗透物;细胞壁、细胞膜连续且完整;其中细胞壁规则完整,质地致密,并且厚薄均匀;细胞膜结构也紧密且完整;细胞器丰富完整,细胞核、核仁等细胞器清晰可见(图2-A1、B1)。而经GSFE处理后,2种病原真菌的菌丝细胞发育明显受到抑制,细胞的超微结构也受到破坏,细胞壁出现变形,部分细胞壁增厚(图2-B2),且出现明显的质壁分离现象(图2-A2、B2);细胞膜则内折形成层状结构,出现明显的皱缩(图2-A2、A3、B2、B3);细胞器组成紊乱,结构模糊不明显,胞质不均匀。此外,当GSFE浓度达MIC时,胞内细胞器呈现碎渣样(图2-B3);部分菌丝内甚至呈现空腔状(图2-A3)。由此可见,GSFE处理后,意大利青霉和指状青霉菌丝细胞完整性丧失、细胞器出现损伤、内含物大量流失。
2.4 GSFE对病原菌细胞膜通透性的影响
2.4.1 荧光显微镜下观察GSFE对病原菌细胞膜通透性的影响 碘化丙啶(propidium iodide, PI)是一种核酸染料。它不能穿透完整的细胞膜,但凋亡晚期和死细胞由于细胞膜通透性增加,其能够透过细胞膜而将细胞核染色[17-18]。
荧光显微镜结果表明,经PI染色的2种病原真菌菌丝对照组胞内显示红色荧光(图3-B1、D1);而经EC50、MIC浓度GSFE处理后的多数菌丝体胞内则呈现出荧光现象(图3-B2、B3、D2、D3)。对比EC50浓度GSFE处理的菌丝体荧光强度(图3-B2、D2),MIC浓度处理的菌丝体红色荧光明显更强(图3-B3、D3)。结果表明,GSFE造成意大利青霉和指状青霉的细胞膜损伤,引起细胞膜通透性增加,最终导致PI染料能够进入菌体对细胞核进行染色。

图3 GSFE对意大利青霉(A、B)和指状青霉(C、D)菌丝体细胞膜通透性的影响Fig.3 Effects of GSFE on membrane permeability of mycelium of P. italicum (A、B) and P. digitatum (C、D)
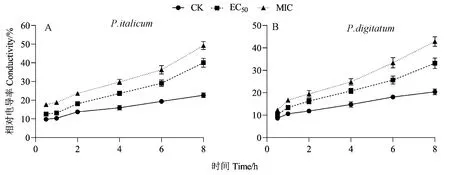
图4 GSFE对意大利青霉(A)和指状青霉(B)菌丝相对电导率的影响Fig.4 Effects of GSFE treatment on the conductivity of P. italicum (A) and P. digitatum (B) mycelia
2.4.2 对菌丝胞外电导率的影响 电导率可间接反映病原菌菌丝细胞膜的损伤程度,电导率越大,表明电解质渗漏量越多,细胞膜的损伤程度越严重[20]。由图4可知,在一定范围内,相对电导率随着时间的延长及GSFE浓度的增高而逐渐增大,并且各时间点的相对电导率均高于对照组。其中,在处理8 h时,经EC50和MIC浓度处理的意大利青霉相对电导率分别达到40.07%和49.23%,对照组仅为22.67%(图4-A);而经EC50和MIC浓度处理的指状青霉相对电导率则达到33.13%和42.86%,对照组仅为20.38%(图4-B)。综上,经GSFE处理后,意大利青霉和指状青霉电解质泄露量增加,造成反应液中电导率上升,说明GSFE处理对2种病原菌细胞膜造成破坏,从而导致细胞膜通透性增加。
2.4.3 对细胞内容物泄露的影响 当病原菌细胞膜遭到破坏时,核酸、蛋白质等大分子物质均会从细胞膜中释放出来[21],因此,可通过测定上清液中核酸、蛋白质含量的变化来评估GSFE处理后意大利青霉和指状青霉细胞膜通透性的损伤程度。如图5所示,意大利青霉和指状青霉在不同浓度(EC50、MIC)GSFE处理后,培养液中蛋白质和核酸含量均高于对照组,并且随着GSFE处理时间的延长,蛋白质和核酸向外渗透量更为明显,处理6 h时,病原菌培养液中可溶性蛋白和核酸的含量是对照组的2~3倍。

图5 GSFE对意大利青霉(A)和指状青霉(B)菌丝体内容物渗漏的影响Fig.5 Effects of GSFE treatment on the leakage of cell contents of P. italicum (A) and P. digitatum (B) mycelia
2.5 GSFE在病原菌上作用靶位的分析
2.5.1 GSFE和两性霉素B复配增效系数测定结果 在毒力测定试验中,单用两性霉素B对意大利青霉的毒力线性回归方程为y=2.976 1+1.106 9x,相关系数为0.987 8,EC50值为67.38 μg·mL-1; 而GSFE与两性霉素按1∶1比例混合后,复配药剂对意大利青霉的毒力线性回归方程为y=2.005+1.427x,相关系数为0.990 7,测得EC50(实际)值为88.54 μg·mL-1; 利用Wadley评价方法计算得出EC50(理论)值为85.45 μg·mL-1, SR为1.048,介于0.5~1.5之间,为相加作用。
单用两性霉素B对指状青霉的毒力线性回归方程为y=3.181 0+0.972 6x,相关系数为0.989 2,EC50为74.15 μg·mL-1;而复配药剂对指状青霉的毒力线性回归方程为y=2.193 6+1.419 7x,相关系数为0.991 5,测得EC50(实际)值为94.19 μg·mL-1;利用Wadley评价方法计算得出EC50(理论)值为98.70 μg·mL-1, SR为0.95,介于0.5~1.5之间,为相加作用。
GSFE与两性霉素B抑制意大利青霉和指状青霉具有相加作用,说明这两类物质可能具有相同的病原作用靶位。两性霉素B作用真菌病原靶位是其细胞膜上的麦角固醇,因此,GSFE作用青、绿霉病原作用靶位可能也为其细胞膜上的麦角固醇。
2.5.2 对病原菌麦角固醇含量的影响 根据不同浓度麦角固醇标准品与其对应的HPLC检测峰面积数据,以峰面积为纵坐标(y),浓度为横坐标(x)绘制HPLC标准曲线,求得其回归方程为y=11 296x+13 110,相关系数为0.999 8。由图6-A可知,麦角固醇标准品与样品吸收峰均能与其他杂质峰呈现较好的分离,且保留时间基本一致,均为7 min左右,表明该检测方法切实可行,可用于菌丝样品麦角固醇含量检测。
在意大利青霉处理组中,对照组峰面积为372 891, 经浓度为EC50的GSFE处理后的菌丝中麦角固醇含量显著降低,仅为对照组的17.92%(图6-B);在指状青霉处理组中,对照组峰面积为324 980,处理组中菌丝中麦角固醇含量也仅为对照组的20.13%(图6-C)。结果表明,GSFE不仅有类似两性霉素B作用病原菌细胞膜上麦角固醇靶位,而且还有类似氟康唑等引起病原菌细胞膜上麦角固醇合成受阻作用,可能与GSFE具有多种抗菌活性成分有关。
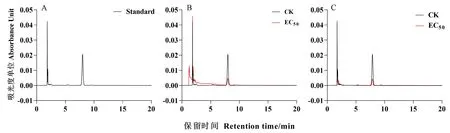
注:A:麦角固醇标准品;B:经GSFE(EC50)处理过的意大利青霉中的麦角固醇;C:经GSFE(EC50)处理过的指状青霉中的麦角固醇。Note: A: Ergostrol standard. B: Ergosterol in P. italicum treated EC50 of GSFE. C: Ergosterol in P. digitatum treated with EC50 of GSFE.图6 GSFE对意大利青霉和指状青霉菌丝麦角固醇含量的影响Fig.6 Effects of GSFE treatment on the ergosterol content of P. italicum and P. digitatum mycelia
3 讨论
我国野生大型真菌资源丰富,种类繁多,是重要的天然药物资源库[22]。由于大型真菌天然代谢产物结构多样且抑菌活性显著,一些来源于大型真菌的发酵产物已在植物病害生物防治工作中得以应用。近年来,从大型真菌中发掘抑菌活性成分、探索活性成分抑菌机制已成为热门的研究方向[23]。裸脚菇0612-9是采集自南昌市梅岭山区的一株野生大型真菌,目前已经从裸脚菇0612-9发酵液中分离并鉴定出两种类胡萝卜烷型化合物fulvoferruginin和5-epi-fulvoferruginin,两者均具有抑制柑橘青、绿霉病病原菌的活性[24]。据报道,来源于海藻附生真菌绿木霉(Trichodermavirens)Y133发酵产物的一种胡萝卜烷倍半萜类化合物具有抑制微藻生长的活性[25];此外,从五味子属植物鹤庆五味子Schisandrawilsoniana中提取的胡萝卜烷型倍半萜具有抗乙型肝炎病毒活性[26]。本研究证明GSFE在意大利青霉和指状青霉等病原菌上的作用位点是细胞膜上的麦角固醇,这与两性霉素B等真菌药物的作用靶点一致,但裸脚菇0612-9中几种已知的胡萝卜烷型化合物与两性霉素B结构存在一定的差异,其产生靶位竞争的作用机制还有待进一步研究。
本研究中,GSFE处理引起意大利青霉和指状青霉细胞膜通透性增加、麦角固醇含量降低,这一结果表明麦角固醇可能是GSFE作用靶位之一。麦角固醇是真菌细胞膜上的特异组分,其主要功能是维持细胞膜结构和功能的稳定性。麦角固醇的缺乏会导致菌丝细胞膜完整性受损,因此麦角固醇也成为许多真菌药剂的作用靶位[27-28]。如柠檬醛、新型农抗N2等均通过影响菌丝细胞膜麦角固醇合成途径使细胞膜通透性改变,引起细胞内物质外渗,导致点状青霉和水稻纹枯病菌等病原真菌的死亡[18,29]。为明确GSFE中与麦角固醇互作的活性组分,后续有必要对活性物质进行分离纯化,并对活性成分与麦角固醇互作机制进行深入研究。
4 结论
GSFE对意大利青霉和指状青霉菌丝生长均有较强的抑制活性。经GSFE处理后,意大利青霉和指状青霉的菌丝均发生严重的皱缩、干瘪,胞内空泡状;细胞质大量减少,细胞膜通透性增加,菌体内核酸、可溶性蛋白及麦角固醇含量显著降低。此外,含量分析及靶位竞争试验显示GSFE对意大利青霉和指状青霉作用靶位之一为麦角固醇。

