牛粪酵母菌的分离鉴定及其碳源代谢分析
邹光进 谢红炼 汪汉成 刘畅 黄宇 陈乾丽


摘要:牛粪中的酵母菌是重要的资源,在牛粪发酵的过程中具有重要作用。为了分离、鉴定牛粪中可培养的酵母菌,并研究其碳源代谢指纹图谱,以发酵牛粪为材料,采用稀释涂布平板法分离牛粪中的酵母菌,经菌落观察和镜检后,采用Biolog全自动微生物鉴定系统对分离菌株进行鉴定。结果表明,从发酵牛粪中共分离得到7株酵母菌,并且鉴定到了种水平,其中有3株为白吉利毛孢子菌(Trichosporon beigelii),2株为约翰逊锁掷孢酵母(Sporidiobolus johnsonii),1株为菱形伊萨酵母(Issatchenkia scutulata),1株为隐球酵母属的Cryptococcus tsukubaensis。分离得到的4种酵母菌的碳源代谢能力和同化能力存在差异,Trichosporon beigelii能够利用的碳源种类最多,具有较强的环境适应性,其次为Issatchenkia scutulata、Sporidiobolus johnsonii、Cryptococcus tsukubaensis;糊精是能被大部分酵母菌代谢的唯一碳源。牛粪中酵母菌代谢的特征性碳源信息及优势酵母菌菌株对于牛粪的快速腐熟堆肥具有一定的指导意义。
关键词:牛粪;酵母菌;Biolog微生物自动鉴定系统;鉴定
中图分类号: S182 文献标志码: A
文章编号:1002-1302(2020)14-0305-05
牛粪自古以来都是农作物的一种高效的有机肥,它养分全、肥效期长,所含微生物能够促进植物对根际营养的吸收;牛粪还能够减少土壤中养分的固定,提高化肥的肥效,也可以调节土壤理化性状,改善土壤结构[1]。此外,牛粪还作为饲料原料出现在各种动物饲料中。研究发现,新鲜牛粪中含有22.56%干物质、3.10%粗蛋白、0.37%粗脂肪、9.84% 粗纤维、5.18%无氮浸出物、0.32%钙、0.08% 磷;发酵后的牛粪具有酵母的特殊气味,粗蛋白、粗脂肪含量分别增加了27.3%、5.1%,粗纤维含量减少,含有较多的营养物质[2-3]。从牛粪中挖掘优良酵母菌并加以开发利用,对于牛粪在植物肥料和饲料原料方面的应用具有重要意义。目前,尚无牛粪中酵母菌分离与鉴定的报道。
基于形态特征、生理学特性等传统的酵母菌鉴定方法耗时费力,且操作不方便[4]。近年来,酵母菌快速鉴定系统不断更新换代,出现了如API20C AUX、ATB32C、Vitek YBC和API Candid等系统[5-6]。由于这些鉴定系统主要应用于临床酵母菌的鉴定,因此针对性较强,但是能鉴定的酵母菌种类有限。目前,由美国Biolog公司开发的Biolog全自动微生物分析系统已经能鉴定52个属、267个种酵母菌,并且该系统能与计算机软件连用进行数据分析,自动化和标准化程度高,鉴定速度快[7-8],因而该系统在国际上常用于酵母菌的分类鉴定[9-10]。本研究旨在使用Biolog微生物全自动分析系统对腐熟牛粪中的优势酵母菌进行分离鉴定,并根据酵母菌在Biolog YT微孔板上的表型对其碳代谢特征进行初步研究,以期在微生物种类方面为商品牛粪和牛粪饲料的工业化开发提供理论依据。
1 材料与方法
1.1 材料与试剂
试验材料为充分腐熟的牛粪,采自奶牛场,经自然发酵获得。BUY培养基,购自美国Biolog公司。配制时称取60 g BUY培养基,加入1 000 mL蒸馏水中,加热搅拌溶解,待自然冷却后调节pH值至5.6左右,于1×105 Pa条件下高压蒸汽灭菌 20 min,倒制平板、备用。
1.2 试验方法
1.2.1 酵母菌的分离、纯化 称取5 g牛粪,加入装有50 mL无菌水和适量玻璃珠的锥形瓶中,在 26 ℃、黑暗、转速为130 r/min的条件下振荡培养30 min,取上清液进行稀释,依次稀释成10-2、10-3、10-4、10-5、10-6、10-7系列浓度梯度的菌悬液。分别取100 μL不同浓度的菌悬液进行涂布,每个浓度设3个重复,将平板置于26 ℃黑暗条件下培养,48 h 后根据菌落形态特征及镜检形态特征对酵母菌进行初步鉴定。将菌株于BUY平板纯化后接种于BUY斜面上,并于4 ℃低温保存。
1.2.2 酵母菌的鉴定 将经过纯化后的酵母菌采用BUY平板转接2代,置于26 ℃黑暗条件下培养48 h。将保存于4 ℃条件下的Biolog YT微孔鉴定板(图1)和装有无菌水的浊度管从冰箱中取出,使其自然恢复至室温。调节浊度仪,使其在关机状态下的读数为0;开机后,使其测量无菌水的读数为100%,测量YT浊度标准管的读数为47%。用无菌水润湿Biolog专用棉签后蘸取新鲜菌体,沿着接种液管内壁使菌体附着于内壁上,并倾斜接种液管使菌体在接种液中混合均匀,通过向接种液中加入无菌水或者菌体来调节其浊度,使最终浊度为(47±3)%。将制备好的加菌接种液倒入无菌加样槽中,用8头移液器将接种液分别加至YT鉴定板的各孔内,每孔100 μL。将鉴定板置于无菌、保湿的自封袋中,于26 ℃黑暗条件下培养。分别在培养24、48、72 h时,将鉴定板放置于Biolog全自动微生物鉴定系统中进行鉴定,采用MicroLog 3软件读取数据,并与数据库中的数据进行自动化比对,得到4个最大匹配度的菌种名称,获得酵母菌的鉴定结果。
1.2.3 酵母菌的表型代謝分析 酵母菌于微孔板中培养72 h后,观察酵母菌在YT微孔板中的代谢反应,从而得出各种酵母菌的碳源代谢情况,随后进行碳源代谢特征的分析。
2 结果与分析
2.1 牛粪酵母菌的分离
利用涂布稀释法从发酵牛粪中分离得到了酵母菌,通过观察发现,高浓度(10-2、10-3)稀释液培养基上长出的菌落较多,10-4、10-5和10-6低浓度稀释液培养基上鲜有酵母菌长出。挑取不同性状、颜色和生长速度的7株酵母进行纯化培养,并依次编号为NF-1、NF-2、NF-3、NF-4、NF-5、NF-6和NF-7。
2.2 牛粪酵母菌的鉴定
用Biolog MicroLog 3软件读取96孔微孔板的浊度,并与数据库中的数据进行匹配,得到4个匹配度最高的酵母菌种类,结果中包括3个参数,即可能性(probability,简称PROB)、相似性(similarity,简称SIM)和位距(distance,简称DIS),其中PROB表示鉴定结果的可能性大小,SIM表示读取的数据与数据库中数据的匹配程度。酵母菌在培养24 h时,SIM应≥0.75,在培养48、72 h时,SIM应≥0.50。当DIST≤5.0、SIM越接近1.00时,鉴定结果的准确度越高。如表1所示,7株酵母菌在Biolog YT板中培养48 h后得到了准确鉴定,其中有3株为白吉利毛孢子菌(Trichosporon beigelii),2株为约翰逊锁掷孢酵母(Sporidiobolus johnsonii),1株为菱形伊萨酵母(Issatchenkia scutulata),1株为隐球酵母属的Cryptococcus tsukubaensis。
2.3 牛粪酵母菌的碳源代谢特征分析
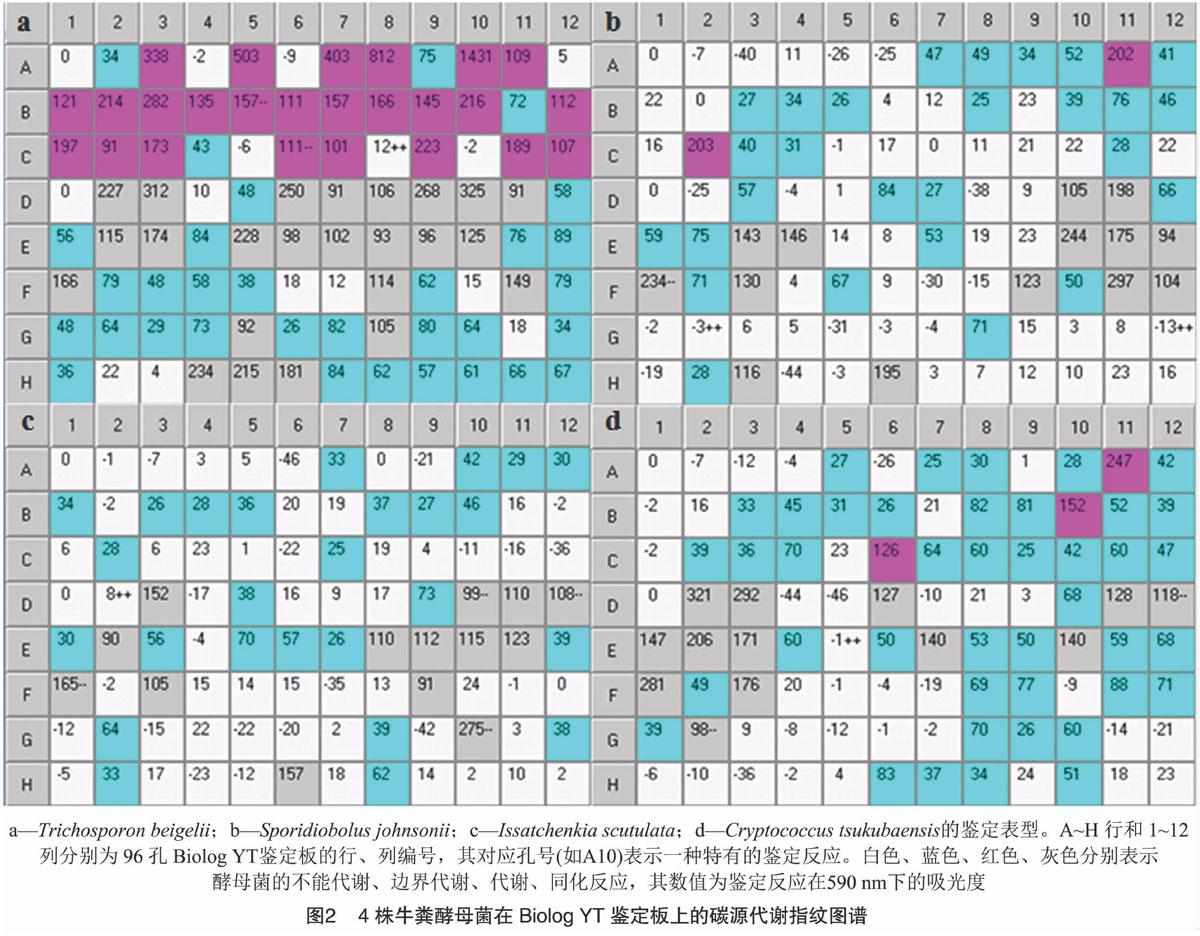
96孔微孔鉴定板含有多种脱水碳源,Biolog酵母菌全自动鉴定系统通过在96孔微孔板中培养酵母菌,使其发生氧化还原反应和同化反应,图1中 A~C行的结果基于显色反应原理,D~H行的结果基于反应浊度差异原理。当酵母菌利用微孔中的碳源时,A~C行孔内的四唑紫染色剂会由无色被还原成紫色;当酵母菌同化D~H行微孔中的碳源时,相应微孔中的浊度会增加。因此,用Biolog YT微孔板鉴定可以得到酵母菌碳源代谢的特征性“指纹图谱”。
Trichosporon beigelii、Sporidiobolus johnsonii、Issatchenkia scutulata和Cryptococcus tsukubaensis在Biolog YT微孔板上的鉴定结果见图2。可以看出,Trichosporon beigelii代谢的碳源种类最多,有25种,主要包括α-D-葡萄糖酸、L-谷氨酸、琥珀酸、L-天冬氨酸和甲酸等,不能代谢的碳源有7种,处于代谢边界值的有4种;Cryptococcus tsukubaensis可以代谢的碳源数量次之,有3种,包括糊精、蔗糖和水杨苷,不能代谢的碳源有11种,处于代谢边界值的有22种;Sporidiobolus johnsonii能代谢的碳源仅有糊精、α-D-葡萄糖2种碳源,不能代谢的碳源有19种,处于代谢边界值的有15种;Issatchenkia scutulata不能代谢的碳源有23种,处于代谢边界值的有13种。
此外,4种酵母菌对碳源的同化能力有较大差异,其中Trichosporon beigelii可以同化的碳源种类最多(24种),主要包括L-苹果酸、D-葡萄糖酸、2-酮基-D-葡萄糖酸、L-谷氨酸、D-松三糖、反丁烯二酸等,不能同化的碳源有8种,处于边界值的有28种;Issatchenkia scutulata可以同化的碳源有14种,主要包括L-阿拉伯糖、N-乙酰基-D-葡萄糖胺、D-海藻糖、蔗糖、L-蘋果酸、糊精+D-木糖等,不能同化的碳源有33种,处于边界值的有13种;Sporidiobolus johnsonii可以同化的碳源有14种,主要包括熊果苷、N-乙酰-D-葡萄糖胺、糊精、蔗糖、糊精+D-木糖、D-海藻糖等,不能同化的碳源有34种,处于边界值的有12种;Cryptococcus tsukubaensis可以同化的碳源有13种,主要包括反丁烯二酸、L-苹果酸、龙胆二糖、麦芽糖、N-乙酰基-D-葡萄糖胺、α-D-葡萄糖、糊精等,不能同化的碳源有27种,处于边界值的有20种。
3 讨论
酵母菌为单细胞真菌,主要由担子菌亚门、子囊菌亚门真菌组成。传统的酵母菌鉴定方法包括形态学特征及生理生化测试等,但程序繁琐,工作量大。基于26S rDNA的D1/D2区和内转录间隔区(ITS)序列是目前酵母菌分子鉴定常用的比对目标,虽然可以鉴定大部分酵母菌,但这些区域数据库目前仍在发展完善中,许多酵母菌的种间差异仍不能够完全区分[11]。基于碳代谢机制的Biolog微生物鉴定技术可以弥补这一不足,然而Biolog酵母菌鉴定板仅能鉴定其数据库中包含的酵母菌,而不能鉴定Biolog全自动鉴定系统数据库中没有的酵母菌种类,因此该数据库还有待进一步完善和补充[12]。在今后的研究中,Biolog微生物自动鉴定系统可与PCR检测结果互相验证,互为补充[13]。本研究首次采用Biolog微生物鉴定系统对牛粪中可培养酵母菌进行了鉴定研究,为牛粪酵母菌的资源化开发奠定了基础。
目前,酵母菌已被广泛应用于食品生产、酿酒工业、饲料等多个领域。发酵是酵母菌的主要功能之一,它可以缩短馒头、面包等的发酵时间,还能酿造出酱、醋、葡萄酒、饮料等多种产品,酵母菌还可以作为饲料添加物用于家畜饲料生产。随着我国有机(类)肥料的发展,肥料微生物的研究与应用越来越被重视,报道较多的有细菌、放线菌和真菌,而很少有酵母菌相关的报道,特别是关于家畜粪便及其堆肥中酵母菌的研究。吴媛等于2011年报道,鸽粪中的酵母菌主要有隐球酵母菌(Cryptococcus)、红酵母菌(Rhodotorula)、线黑粉酵母菌(Filobasidium)、假丝酵母菌(Candida)、汉斯德巴氏酵母菌(Debaryomyces hansenii)和酿酒酵母菌(Saccharomyces)[14]。本研究首次分离了腐熟牛粪中的酵母菌,获得的酵母菌与上述酵母菌均不相同,这可能与牛粪特殊的营养载体及其所处环境有关。本研究中的Trichosporon beigelii和Sporidiobolus johnsonii在腐熟牛粪中占有一定优势,它们可能是牛粪中的优势酵母菌。至于4种牛粪中的酵母菌在牛粪腐熟、发酵过程中起什么作用、其种群变化趋势等方面还值得进一步研究。
选取4株酵母菌进行Biolog碳源利用分析发现,糊精能被所有酵母菌株利用,说明它是牛粪酵母菌的“喜好”性碳源,这可为分离、培养牛粪酵母菌的培养基设计提供依据。本研究发现,白吉利毛孢子菌的代谢碳源种类丰富,有L-苹果酸、D-葡萄糖酸、糊精、反丁烯二酸、龙胆二糖等25种,充分表明该酵母菌具有较强的环境适应性,具有用于生物有机肥开发利用的潜力;C. tsukubaensis、约翰逊锁掷孢酵母和伊萨酵母代谢碳源种类较少,这种差异与菌株的代谢能力受到生存环境的密切影响相关。此外文献检索结果表明,本研究所得4种牛粪酵母菌均属于非致病性微生物,安全风险低。
参考文献:
[1]Esteve-Zarzoso B,Belloch C,Uruburu F,et al. Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. International Journal of Systematic Bacteriology,1999,49(1):329-337.
[2]王会群,史鹏飞,傅 彤,等. 集约化奶牛场奶牛粪中营养素测定[J]. 江苏农业科学,2010(5):486-487.
[3]孙海英,许修宏. 接种纤维素分解菌与固氮菌对牛粪堆肥发酵的影响[J]. 东北农业大学学报,2009,40(10):52-54.
[4]Kurtzman C P,Robnett C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek,1998,73:331-371.
[5]Praphailong W,van Gcstel M,Fleet G H,et al.Evaluation of the Biolog system for the identification of food and beverage yeasts[J]. Letters in Applied Microbiology,1997,24(6):455-459.
[6]Deak T,Beuchat L R. Comparison of the SIM,API 20C,and ID 32C systems for identification of yeast isolated from fruit juice concentrates and beverages[J]. Journal of Food Protection,1993,56(7):585-592.
[7]Markus N T,Adrianne V R,David W B. Yeasts in peatlands:a review of richness and roles in peat decomposition[J]. Wetlands,2007,27(3):761-773.
[8]Naidu Y,Meon S,Kadir J,et al. Microbial starter for the enhancement of biological activity of compost tea[J]. International Journal of Agriculture & Biology,2010,12(1):51-56.
[9]Yang S H,Wang P H.Three species of yeasts new to Taiwan[J]. Taiwania,2003,48(2):99-105.
[10]Kang H Y,Kim Y S,Kim G J,et al. Screening and characterization of flocculent yeast,Candida sp.HY200,for the production of xylitol from D-xylose[J]. Journal of Microbiology and Biotechnology,2005,15(2):362-367.
[11]Hierro N,González ,Mas A,et al. New PCR-based methods for yeast identification[J]. Journal of Applied Microbiology,2004,97(4):792-801.
[12]McGinnis M R,Molina T C,Pierson D L,et al. Evaluation of the Biolog MicroStation System for yeast identification[J]. Journal of Medical and Veterinary Mycology,1996,34(5):349-352.
[13]Morgan M C,Boyette M,Goforth C,et al. Comparison of the Biolog OmniLog Identification System and 16S ribosomal RNA gene sequencing for accuracy in identification of atypical bacteria of clinical origin[J]. Journal of Microbiology Methods,2009,79(3):336-343.
[14]吳 媛,李文革,卢金星. 143份鸽粪中酵母菌的分离鉴定[J]. 疾病监测,2011,26(2):88-91.
收稿日期:2020-01-20
基金项目:中国博士后科学基金(编号:2017M610585);中国烟草总公司科技项目[编号:110202001035(LS-04)];贵州省科技厅优秀青年人才培养计划(编号:黔科合平台人才[2017]5619);中国烟草总公司贵州省公司科技项目(编号:201711、201714、201914)。
作者简介:邹光进(1968—),男,贵州黔东南人,农艺师,主要从事烟草生长管理方面的工作,E-mail:zouguangjin1@163.com;共同第一作者:谢红炼(1996—),女,湖北黄冈人,硕士研究生,主要研究方向为植物保护学,E-mail:xiehonglian0901@163.com。
通信作者:汪汉成,博士,研究员,主要从事烟草植物保护学方面的工作。E-mail:xiaobaiyang126@hotmail.com。

