谷物及制品中修饰型真菌毒素的风险与防控
杨虹,曹文明,陈何妍,卫学青,束莉丹,李彤
谷物及制品中修饰型真菌毒素的风险与防控
杨虹,曹文明*,陈何妍,卫学青,束莉丹,李彤
丰益(上海)生物技术研发中心有限公司,上海 200137
修饰型真菌毒素是重要的食品安全危害因子。通过综述修饰型真菌毒素的形成机制、种类、污染水平、毒理研究、代谢规律、分析检测、脱毒方法等方面的进展,识别已知风险、潜在风险以及分析风险防控措施。已知风险包括:谷物及制品中修饰型真菌毒素的阳性检出率高,浓度跨度大,其存在会增加人群真菌毒素膳食暴露的风险。毒理学研究表明,有的修饰型真菌毒素在体内代谢转化为原型而产生与原型同等毒性,有的本身则具有毒性。潜在风险包括:代谢转化而成的多种修饰型真菌毒素共存时会引起毒性机制和毒性作用不明。在农作物代谢或食品加工中也可产生结构、性质、毒性均未知的修饰型真菌毒素。受分析技术和质量控制手段的制约,难以获得其准确可靠的定性定量结果,使毒理学数据十分匮乏,导致毒理学性质引起争议。风险防控措施包括:从源头抓起,培育抗病品种,规范标准体系和检测体系,严把农产品收购、储藏、生产及产品加工关。另外,在生产加工环节中,要加强产后脱毒技术的研究。
修饰型真菌毒素; 原型; 谷物及制品; 风险; 防控措施
0 引言
修饰型真菌毒素(modified mycotoxins)是在生物体(植物、真菌、哺乳动物)代谢或食品加工过程中产生的真菌毒素衍生物,类型见图1[1]。修饰型真菌毒素往往与其原型(parent mycotoxins)共存于谷物及制品中。与原型相比,修饰型真菌毒素的化学结构、分子质量、极性和溶解性等理化性质均发生了改变。在传统的分析检测方法下易被漏检。随着人工攻毒或化学合成制备毒素手段的推进,以及对其提取、分离、纯化、分析检测等技术的不断成熟,一些修饰型真菌毒素不再“隐蔽”,已被报道的修饰型真菌毒素共3类5种,第一类单端孢霉烯族毒素修饰型(modified trichothecenes forms),包括:(1)A型:如T-2毒素修饰型(T-2 modified mycotoxin,modified T-2)[2-4];(2)B型:如雪腐镰刀烯醇修饰型(nivalenol modified mycotoxin,modified NIV)[2,5]和脱氧雪腐镰刀烯醇修饰型(deoxynivalenol modified mycotoxin,modified DON)[2,6-8];第二类玉米赤霉烯酮毒素修饰型(zearalenone modified mycotoxin,modified ZEN)[2,9-10];第三类伏马毒素修饰型(fumonisin modified mycotoxin,modified FB)[2,11-16]。

图1 修饰型真菌毒素的分类[1]
近年来,修饰型真菌毒素已引起食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)和欧盟食品安全局(European Food Safety Agency,EFSA)的高度重视。2017年,JECFA首次将脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(deoxynivalenol-3-glucoside,DON-3-Glc)作为人群脱氧雪腐镰刀烯醇(deoxynivalenol,DON)膳食暴露的新增贡献因子[17]。同年,EFSA也建议DON类家族真菌毒素每日摄入耐容量(tolerant daily intake,TDI)为每天1 μg·kg-1体重,包含DON、3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyl-deoxynibalenol,3-AcDON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15- acetyl-deoxynibalenol,15-AcDON)、DON-3-Glc的总和,即将3种DON修饰型真菌毒素纳入TDI的重要组成部分进行风险监控,以免低估真菌毒素的总量而造成食品安全风险[18]。
2005—2020年,欧、亚国家展开了修饰型真菌毒素的风险评估,包括小麦、玉米、面包、谷物早餐(谷物片、粥)、婴幼儿谷类辅助食品和膨化休闲食品(爆米花、饼干、脆片)等7种谷物及制品,所获数据反映出其阳性检出率高,浓度跨度大。经人群真菌毒素膳食暴露评估发现,婴幼儿等特殊人群对脱氧雪腐镰刀烯醇类家族毒素、玉米赤霉烯酮和伏马毒素的暴露值高于每日摄入耐容量TDI限值,属于高危人群,而修饰型真菌毒素的存在会增加真菌毒素的暴露风险。多项毒理学研究表明,有的修饰型真菌毒素在体内代谢过程中会转化为原型,从而产生与原型同等毒性或者毒性未知的衍生物,还有的修饰型真菌毒素本身就具有生殖发育等生理毒性[19-23]。多种毒素共存可能会导致毒性累加或/和增强或/和协同效应[24],导致毒性机制和毒性作用不明。另外,真菌毒素种类繁多,结构中具有多种活性位点,在农作物代谢或食品加工过程中可与一些极性较强的物质结合产生结构、性质、毒性均未知的修饰型真菌毒素。目前,修饰型真菌毒素的检测主要以液相色谱与质谱联用(liquid chromatography,LCMS)为主。此方法利用了高效液相色谱与质谱的优势互补,具有预处理简单、检测速度快、分离效果良好、选择性强、灵敏度高以及较高的结构鉴定能力等优点,适用于复杂基质样品中多组分真菌毒素的定性和准确定量。但是,LC-MS的离子源是一种“软电离”源,轰击结构不同的化合物所产生的离子碎片和丰度存在差异。分析不同基质样品时,所产生的基质效应也不同,缺乏商业化修饰型真菌毒素的标准品和质量控制样品,特别是同位素内标,使得定性定量的结果存在不确定性。分析技术和质量控制手段的制约,有关修饰型真菌毒素的毒理学数据极其匮乏[24-28],至今对其毒理学性质仍存在争议和不确定性[24]。
本文拟通过对修饰型真菌毒素产生机制、种类以及近22年来国内外对谷物及制品中主要修饰型真菌毒素的污染水平、毒理研究、代谢规律、分析检测、脱毒方法等方面的进展进行综述,识别风险,并分析降低谷物及制品中修饰型真菌毒素污染风险的防控措施,关键是从源头控制,降低农作物真菌毒素感染的风险,抑制真菌毒素的表达合成。
1 修饰型真菌毒素的已知风险
1.1 污染水平
2005年奥地利首次报道了小麦和玉米中修饰型真菌毒素的污染情况,其中,DON-3-Glc/DON含量百分比分别为4%—29%和10%—11%[29]。2015年,芬兰报道了95份大麦、燕麦和小麦样品中DON-3-Glc、3-AcDON、NIV-3-Glc和HT2-3-葡萄糖苷(HT2-3-Glc)的污染情况,其中燕麦中DON-3-Glc的检出率达87.5%,最高浓度可达6 600 μg·kg-1[30]。2007年中国报道了谷物中修饰型真菌毒素的污染情况,在河南、河北、广西、安徽、四川、重庆和江苏7个省采集的336份国产小麦和玉米样品中,DON-3-Glc、3-AcDON和15-AcDON几乎均被检出。小麦和玉米中DON-3-Glc/DON含量百分比的均值分别是71%和22%[31]。
修饰型真菌毒素也广泛存在于谷物制品中,例如面包、谷物早餐(谷物片、粥),婴幼儿谷类辅助食品和膨化休闲食品(如爆米花、饼干、脆片)等,其浓度有时甚至超过加工食品中真菌毒素原型的水平(表1)[29-47]。
单端孢霉烯族修饰型毒素研究关注度远远高于其他类型毒素,如对ZEN修饰型毒素展开研究的仅有4个欧洲发达国家,分析的样本数量及多样性也略显不足。单端孢霉烯族修饰型的平均检出率11%—92%,ZEN修饰型的平均检出率3.5%—60%。单端孢霉烯族(HT2除外)修饰型以及-ZEL的阳性检出率高至100%。单端孢霉烯族修饰型的均浓度范围5.7—568 μg·kg-1。其中DON-3-Glc和NIV-3-Glc均值上限浓度分别达到1 080和1 042 μg·kg-1。ZEN修饰型的均浓度范围1.6—116 μg·kg-1。-ZEL、-ZEL-4-Glc、-ZEL-4-Glc、ZEN-14- Glc的均浓度上限分别达到97、283、152和174 μg·kg-1,均超出了相应原型的国标限量值(DON 1 000 μg·kg-1,ZEN 60 μg·kg-1)[48]。修饰型/原型的含量百分比反映共存状态下的修饰型真菌毒素的占比,单端孢霉烯族与玉米赤霉烯酮类的修饰型/原型的含量百分比的均比值上限分别为5.4和2.6。DON-3-Glc的比值最高达到16[38],而其中-ZEL、-ZEL、-ZEL-14-Glc和ZEN-14-Glc与ZEN含量百分比上限超出玉米赤霉烯酮类的修饰型与ZEN含量百分比的均比值。如此高的比值也进一步表明,在谷物及制品中,与原型共存的修饰型真菌毒素具有较大的潜在安全风险。小麦和燕麦是DON-3- Glc、NIV-3- Glc、HT2-3-Glc暴露的主要来源,日本、芬兰是受污染最严重的国家。玉米和谷物制品主要是3-AcDON、15-AcDON、-ZEL、-ZEL-4-Glc、-ZEL、-ZEL-4-Glc和ZEN-14-Glc污染严重,中国、比利时影响明显。
1.2 人群膳食暴露水平
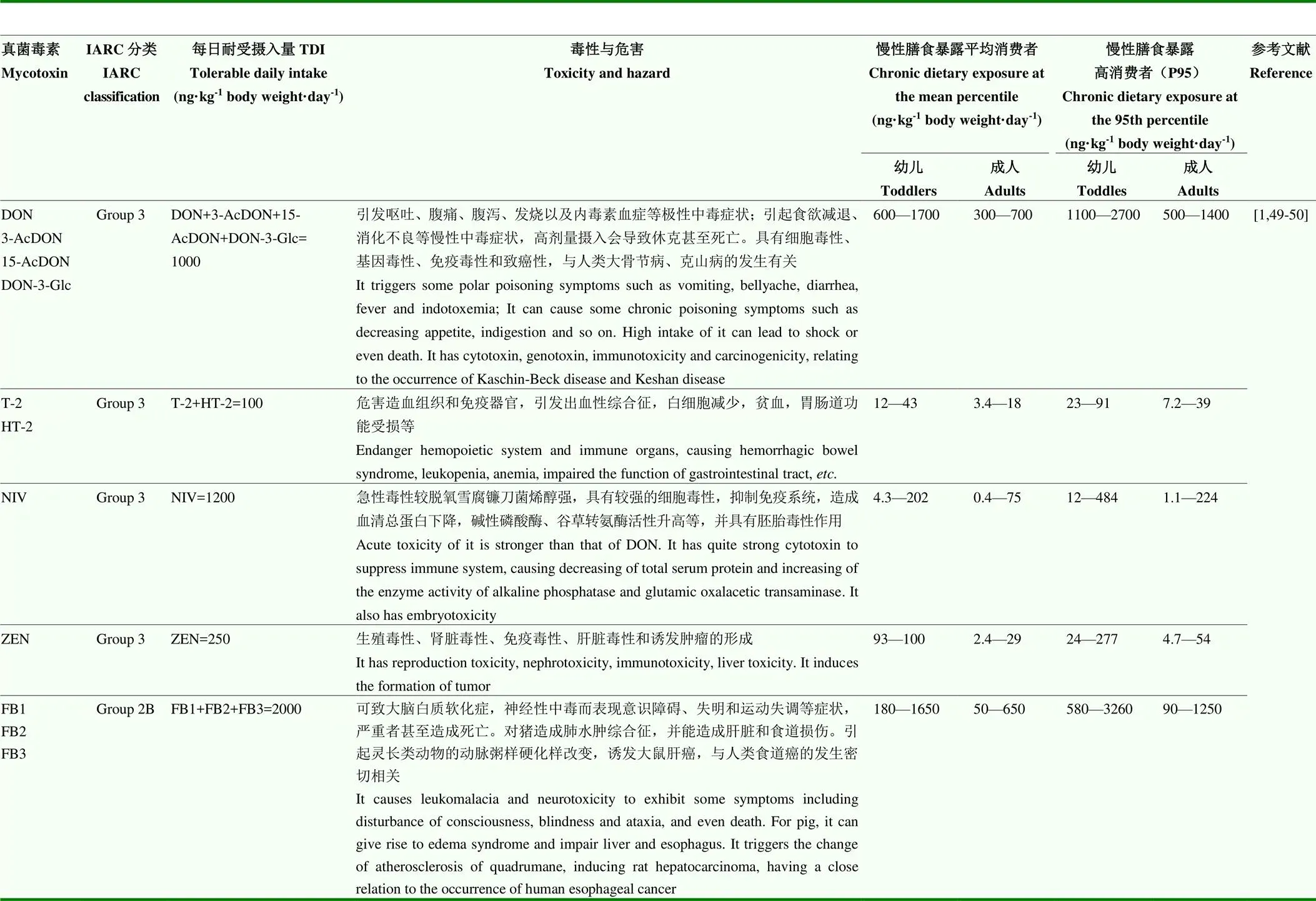
根据欧洲国家对成人和幼儿的玉米赤霉烯酮(zealenone,ZEN)、伏马毒素(fumonisins,FB)、DON、雪腐镰刀烯醇(nivalenol,NIV)和T-2慢性膳食暴露的统计调查结果发现,尽管幼儿的食物消费量低于成人,但由于饮食结构单一,自身体重较小,仍属于膳食暴露的高危人群。幼儿(1—3岁)和成人(18—65岁)对DON类家族真菌毒素的平均暴露水平分别为600—1 700和300—700 ng·kg-1·d-1,高暴露水平(P95)为1 100—2 700和500—1 400 ng·kg-1·d-1。由此可见,幼儿对DON类家族毒素平均暴露值上限以及幼儿和成人对DON类家族毒素P95暴露值上限高于TDI限值。幼儿对ZEN和FB的P95暴露值上限也高于TDI限值,详见表2。修饰型真菌毒素的存在会增大真菌毒素的暴露风险。因此,量化谷物及制品中DON,ZEN和FB修饰型真菌毒素的含量并根据不同消费人群制定相应的限量值,在最大限度地降低食品安全风险和保障公众健康中非常必要。
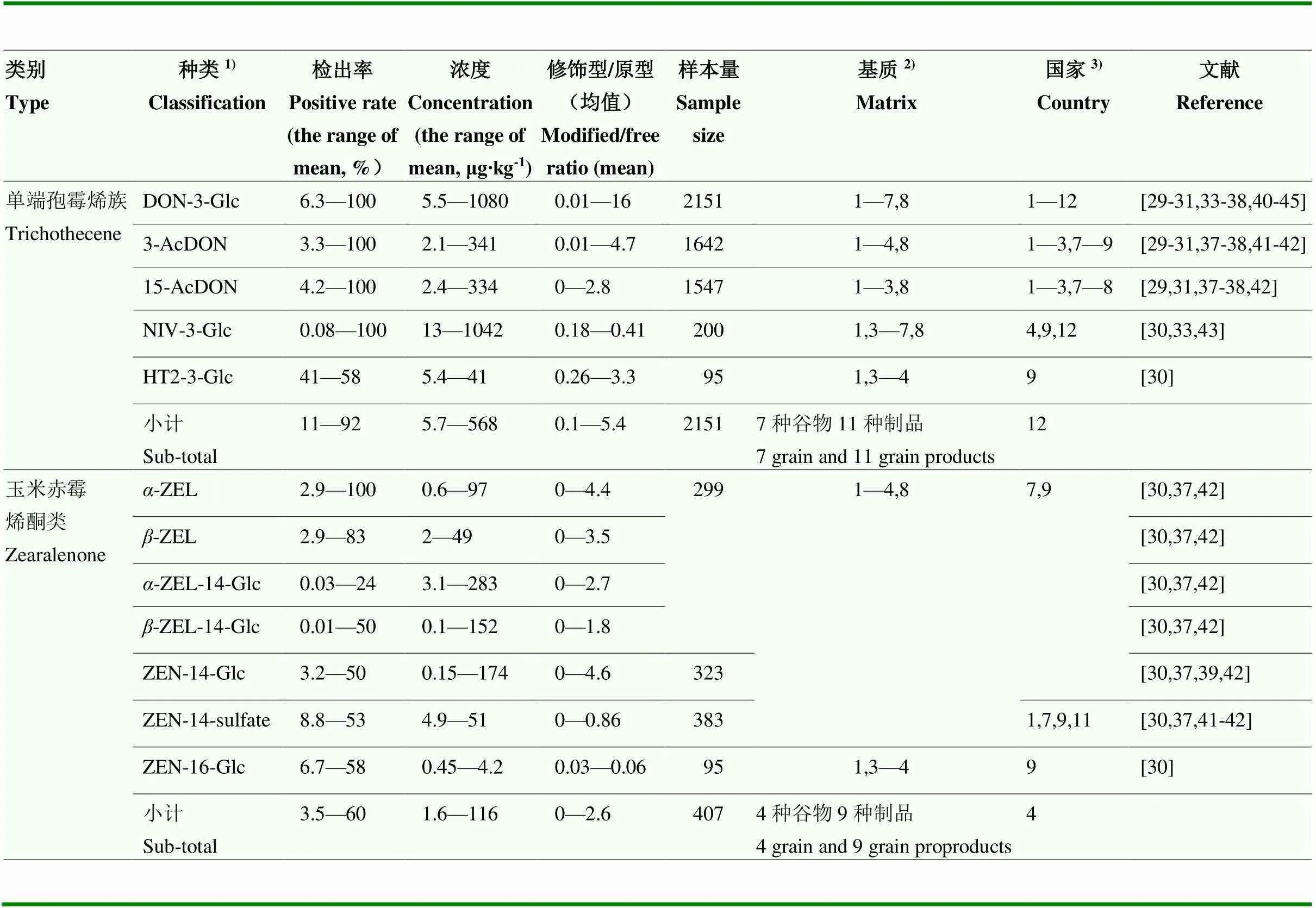
表1 谷物及制品中主要的修饰型真菌毒素分布概况
1):DON-3-Glc:脱氧雪腐镰刀烯醇-3-葡萄糖苷 Deoxynivalenol-3-glucoside;3-AcDON:3-乙酰-脱氧雪腐镰刀烯醇 3-acetyl-deoxynibalenol;15-AcDON:15-乙酰-脱氧雪腐镰刀烯醇 15-acetyl-deoxynibalenol;NIV-3-Glc:雪腐镰刀烯醇-3-葡萄糖苷 Nivalenol-3-glucoside;HT2-3-Glc:HT-2-3-葡萄糖苷 HT2-3-glucoside;-ZEL:-玉米赤霉烯醇-zearalenol;-ZEL:-玉米赤霉烯醇-zearalenol;-ZEL-14-Glc:-玉米赤霉烯醇-14-葡萄糖苷-zearalenol-14-glucoside;-ZEL-14-Glc:-玉米赤霉烯醇-14-葡萄糖苷-zearalenol-14-glucoside;ZEN-14-Glc:玉米赤霉烯酮-14-葡萄糖苷 Zearalenone-14-glucoside;ZEN-14-sulfate:玉米赤霉烯酮-14-硫酸酯 Zearalenone-14-sulfate;ZEN-16-Glc:玉米赤霉烯酮-16-葡萄糖苷 Zearalenone-16-glucoside
2):谷物及制品编号 Code of grain and grain products:1:小麦 Wheat;2:玉米Corn;3:燕麦 Oat;4:大麦 Barley;5:小米 Millet;6:薏米 Seed of Job’s tears;7:高粱 Sorghum;8:谷物制品 Cereal products
3):国家编号 Country code:1:奥地利 Austria;2:德国 Germany;3:斯洛伐克 Slovakia;4:日本 Japan;5:阿根廷 Argentina;6:波兰 Poland;7:比利时 Belgium;8:中国 China;9:芬兰 Finland;10:捷克共和国 Czech Republic;11:英国 England;12:韩国 Korea
1.3 产生与原型同等毒性
人和动物通过饮食暴露于多种真菌毒素及衍生物之下。真菌毒素原型毒性剧烈,产生“三致”毒性效应,已成为全球食品安全的主要问题之一(表2)[1,49-50]。部分修饰型真菌毒素可转化为原型。人体肠道内的修饰型真菌毒素转化为原型起到了关键作用[51]。其转化率与肠道微生物的多样化组成和密度高度相关[52]。在不同体内()和体外()模型中,DON-3-Glc的水解率在40%—100%,玉米赤霉烯酮-14-葡萄糖苷(zealenone- 14-glucose,ZEN-14-Glc)水解率在20%—97%[19-23]。宏基因组学分析表明,成人和婴儿的肠道菌群成分有明显区别,双歧杆菌和乳酸菌在婴儿体内的数量和占有率均高于成人,加大了婴儿体内修饰型真菌毒素转化为原型的风险[53]。
1.4 本身具有毒性
部分修饰型真菌毒素本身具有毒性。2011年,EFSA确定了ZEN主要不良反应是影响性激素(睾丸素、雌激素、黄体酮等)的合成与分泌。30多年来,学者们通过在子宫雌激素受体结合能力、人乳腺癌细胞增殖等试验中比较ZEN与ZEN修饰型真菌毒素相对雌激素效能,发现不同的ZEN修饰型真菌毒素体内雌激素的效力存在差异,其中-ZEL高出ZEN 9—2 200多倍,其生理毒性对人和动物产生了极大的健康危害性[27,54-55]。
表2 谷物及制品中常见真菌毒素的毒性及欧洲人群的慢性膳食暴露量
Table 2 The toxicity and chronic dietary exposure in European of mycotoxins found in grain and its products
在碱处理的玉米粉薄烙饼中,FB1易水解酯键连接的两个丙三羧酸,形成氨基酚骨架AP1。FB1和AP1由于结构与鞘氨醇碱相似,在神经鞘脂类的代谢过程中竞争性地结合神经鞘氨醇N-2酰基转移酶,从而抑制了神经鞘氨醇的生物合成,阻碍了鞘脂类代谢,引发各种疾病。同时,神经鞘氨醇N-2酰基转移酶也可酰化AP1,形成棕榈酰AP(N-palmitoyl-AP1,PAP1)。通过在人结肠细胞系-HT29细胞的毒理研究表明,PAP1的毒性相当于FB1或AP1的10倍[28]。
2 修饰型真菌毒素的潜在风险
2.1 毒性复杂
真菌毒素在体内解毒代谢过程中,产生结构复杂且多样的修饰型真菌毒素,它们经常同时参与不同类型的化学反应,即是产物,又是反应物。ROGOWSKA等[55]发现ZEN在动物肝脏的两条主要解毒途径中,生物转化可产生18种ZEN修饰型真菌。主要涉及的化学反应有:1)在原型基础上“做加法”,结合极性基团形成共轭态,如糖苷化、糖酸化、磺化、硫化、酰化等;2)在原型基础上“做减法”,如水解和降解(热、光等);3)与原型“划约等号”,即自身转化(氧化、还原、异构化等)[2,32,56]。修饰型真菌毒素的毒性与其化学结构和理化性质密切相关。本文以人群暴露风险较高的DON、ZEN和FB为例,收集了22年间(1998年—2020年)关于其修饰型真菌毒素的文献报道,从总体数量、分析方法、毒性和反应类型进行统计及归纳(表3)[2,6,14,22,26-28,32,54,57-60]。除了DON-3-Glc、3-AcDON、15-AcDON毒性与DON相当外,部分DON修饰型真菌毒素可能为降毒或低毒物质,主要原因为:1)极性增强,易随尿液、粪便排出体外,如DON-diGlc、DON-3-GlcA、ZEN-14-GlcA;2)与解毒物质结合成为一种解毒产物,如DON-glutathione;3)在光、热、酸或碱等条件下,化学结构经一定程度修饰后,使DON母核上与毒性相关的分子结构遭到破坏,如C12—C13位环氧键,C9—C10位双键结构和C3位、C7位和C15位羟基结构,如norDON A、DOMs。多种毒素共存可能会导致毒性累加或/和增强或/和协同效应[24],毒性机制更复杂,毒性作用未知。
2.2 未知修饰型真菌毒素的形成
修饰型真菌毒素在体内代谢中会重新转化为原型、已知修饰型真菌毒素或其他新的真菌毒素衍生物,如T-2 toxin-glucoside经体外消化模型消化24 h后转化为T2(13%)、HT2(30%)和其他未知代谢物(33%)[4,20]。因对未知代谢物的结构和理化性质完全未知,无法对其毒性产生评估,可能产生潜在风险。目前发现的真菌毒素多达300多种,但根据真菌物种存在数量,没有发现的二次代谢物数量还十分巨大[61]。随着气候变化,产毒真菌谱及真菌毒素发生显著变化,新兴真菌毒素也不断被发现,如白僵菌素和恩镰孢菌素B[62]。当谷物受到此毒素污染进行体内解毒代谢时,也可能产生新兴的修饰型真菌毒素。
采用不同工艺条件加工不同种类和品质的谷物原料,所产生的原型和修饰型真菌毒素类型和含量也不尽相同。在啤酒加工过程中,大麦浸泡可降低DON的含量,而发芽过程由于镰刀菌的生长和繁殖,麦芽中DON及DON-3-Glc增加,尤其是DON-3-Glc增加显著,这是因为在麦芽发芽过程中,产生高浓度的葡萄糖苷转移酶有利于DON-3-Glc的生产。酿造过程使DON含量进一步增加,原因是DON-3-Glc在啤酒中转化为DON[63]。面团制备环节,面包改良剂中的酶释放了谷物细胞壁中一些结合态毒素,使DON-3-Glc的含量显著增加145%。在240℃烘烤14 min后,DON和DON-3-Glc含量分别降低了13%和10%,并在面包皮中检测到DON-3-Glc的热降产物norDON-3-Glc A、norDON-3-Glc B、norDON-3-Glc C、norDON-3-Glc D和norDON-3-Glc-lactone,DOG的热降解产物为norDON A、norDON B、norDON C、norDON D、norDON E、norDON F,DON lactone和9-hydroxymethyl DON lactone。同样,谷物在加工过程中,受热、力、酸或碱等外界条件作用,真菌毒素原型与基质中存在的极性物质结合,也会新生成大量的修饰型真菌毒素。谷物原料(小麦、玉米)及制品中ZEN修饰型与ZEN含量百分比的结果表明,原料中ZEN修饰型/ZEN的含量百分比仅占30%,而加工后的谷物制品(高纤维面包、谷物类早餐、燕麦片)中ZEN修饰型/ZEN含量百分比竟高达100%—110%。玉米片和无麸质制品中的hidden FB(隐蔽型伏马毒素)/FB(伏马毒素)的含量百分比高出玉米原料中hidden FB/FB含量百分比近一倍[1](表4)。由此可见,为避免产生更大的食品安全隐患,应尽可能从源头抓起,使用品质良好的原料进行产品加工。同时,规范生产标准体系和检测体系,在整个生产过程中,包括生产、加工、包装、储藏、运输、销售等环节对原型和修饰型真菌毒素进行有效监控,以免低估产品中真菌毒素真实的污染水平。
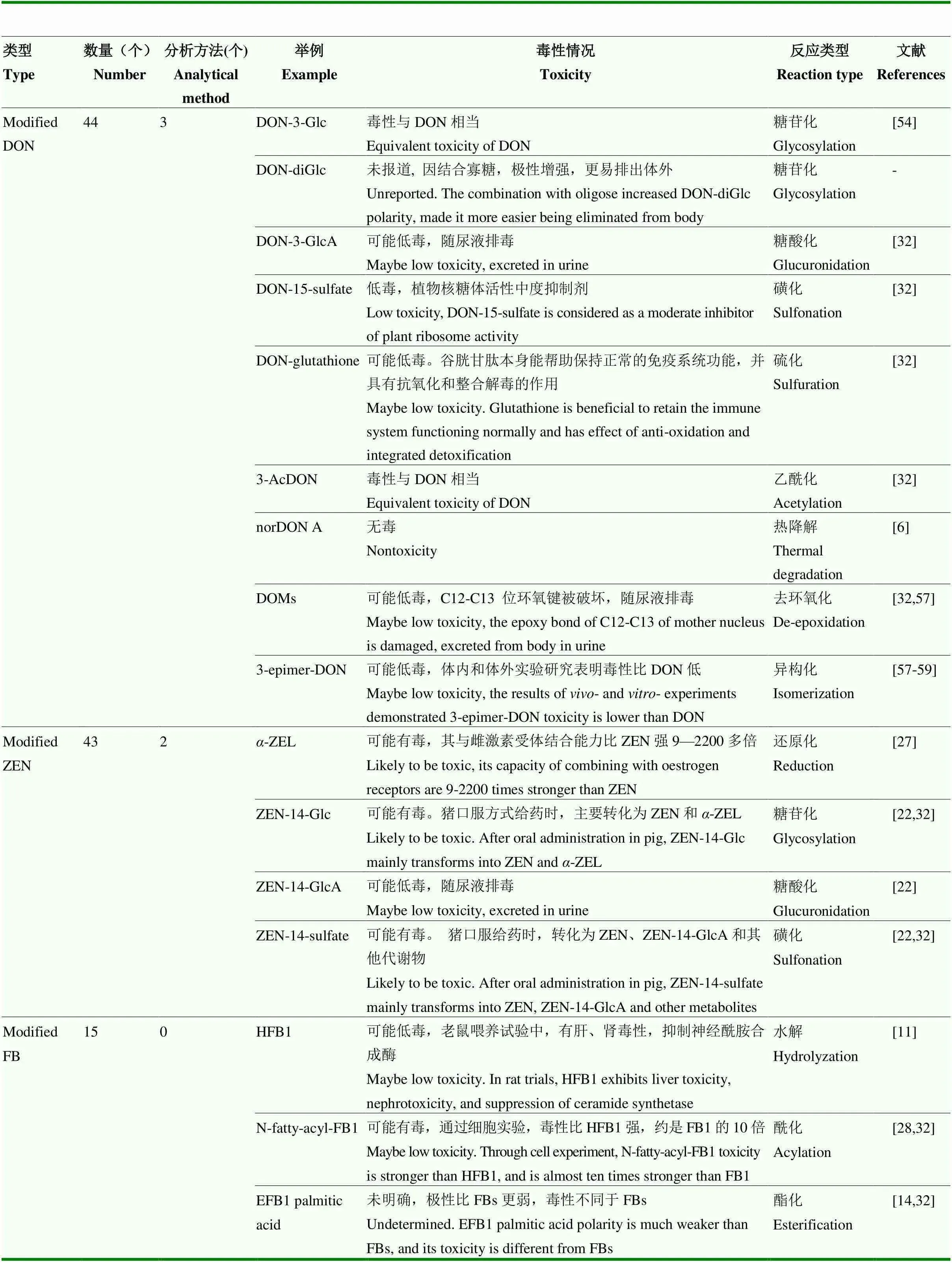
表3 脱氧雪腐镰刀烯醇修饰型、玉米赤霉烯酮修饰型和伏马毒素修饰型的数量、潜在毒性及涉及反应类型

表4 玉米赤霉烯酮和伏马毒素修饰型在谷物及制品中的污染情况
2.3 分析技术和质量控制手段的制约
欧、亚国家在展开修饰型真菌毒素风险评估时多采用LC-MS/MS分析手段[29-31,33-38,40-45],此法具有预处理简单、检测速度快、分离效果良好、选择性强、灵敏度高以及较高的结构鉴定能力等优点,适用于复杂基质样品中多组分真菌毒素的定性和准确定量,但浓度跨度大,原因可能有:1)一般在闷热、多雨、地势低地区的谷物及制品易滋生霉菌,产生毒素,因此,不同地区的样品本身所含有的真菌毒素存在差异。2)谷物及制品通常是固体,均质性差,而LC-MS/MS属于痕量分析,取样量较少,取样不均易导致结果波动。3)LC-MS/MS的离子源是一种“软电离”源,受仪器状态波动的影响,轰击结构不同的化合物所产生的离子碎片和丰度存在差异。分析不同类型样品时,所产生的基质效应不同。因缺乏商业化的修饰型真菌毒素标准品,采用一种标准品或者结构相似物去定量检测多种目标物时,结果易出现较大偏差。4)缺乏质量控制样品,无法展开实验室的质量控制计划以及对所测数据实施有效性评价。对谷物及制品中修饰型真菌毒素进行系统的风险评估是确保食品安全的重要任务,因此,完善修饰型真菌毒素的分析方法刻不容缓。
2.4 毒理学数据的匮乏
ZEN具有雌激素作用,主要危害动物的生殖系统。植物体受ZEN感染后,在第一阶段解毒过程中通过还原和氧化作用,生产一系列可以相互转化的代谢物,如-玉米赤霉烯醇(-ZEL)、-玉米赤霉烯醇(-ZEL)、-玉米赤霉醇(-ZAL)、-玉米赤霉醇(-ZAL)、玉米赤霉酮(ZAN)[9]。EFSA基于20多年不同实验室关于ZEN第一阶段代谢物雌激素效力的体内试验结果,建立了其对应的相对效能因子(relative potencies factors,RPFs)。大部分ZEN第一阶段代谢物具有雌激素活性,且型与雌激素受体亲和性更强,危害性远大于ZEN,而型毒性大大减弱,雌激素效力排序大致为-ZEL>-ZAL≈--ZEL> ZEN≈ZAN≈-ZEN≈-ZAL≈--ZEL>-ZEL[27]。第二阶段解毒过程中,在酶的作用下,将ZEN或第一阶段的产物与极性较强的物质相结合,形成各种第二阶段代谢物,在消化道内,又部分水解成ZEN和ZEN第一阶段代谢物[22]。因此,EFSA建议将ZEN与ZEN修饰型真菌毒素进行联合风险监控。但由于标准品的缺失,无法获得关于ZEN第二阶段代谢物雌激素效力的可靠数据,基于理论考虑,假设ZEN第二阶段代谢物在肠道中完全水解释放出它们的母体,并代入其各自母体化合物的RPFs,这种方式可能导致它们的毒性作用被高估。事实上,绝大部分修饰型真菌毒素的毒理学性质仍不确定。原因在于目前仅有不到5%的修饰型真菌毒素具有定性定量的分析方法,导致毒理学研究极其匮乏,以至于毒理学性质存在争议。将修饰型真菌毒素与原型视为同等毒性为一种权宜之计。国际组织认为研究修饰型真菌毒素的毒性具有毒理学意义[1]。因此,完善修饰型真菌毒素的分析方法显得尤为重要和必需。
3 修饰型真菌毒素的风险防控措施
修饰型真菌毒素往往与其原型共存于谷物及制品中,因此,对其预防及控制通常也是一个具有连续效应的过程。
3.1 加速抗病育种进程
真菌毒素的污染与作物的品种和基因型有很大关系,不同基因型的玉米品种对真菌毒素的抗性有所不同[64]。种皮变薄更容易受到昆虫的侵害,从而增加真菌的侵染[65]。因此,育种和种植对产毒真菌具有抗性的农作物品种,是从源头防控真菌毒素的一种有效途径。
3.2 严把农产品收购、储藏、生产及产品加工关
良好的田间管理来抑制真菌毒素的产生被认为是最有效的真菌毒素防控策略。杀真菌剂与杀虫剂是传统的防控真菌毒素污染的方法,应用的种类很多,但这些化学试剂受限于本身的毒性残留和产生耐药性的问题。目前,研究者开展了生物技术防控真菌毒素的策略研究。在玉米田间播撒一种不能产生毒素的黄曲霉,基于生存竞争原理,有效地降低了玉米中黄曲霉毒素的污染,消除率达85%—88%[66]。
生产原料在收购、储藏时,严格按照良好农业规范和作业规范(GAP/GMP)操作。农产品收购之前做好真菌毒素抽检普查工作,在收购过程中,严格按照验收标准,确保收购到的农产品安全可靠。储藏前测定农作物水分,确保足够干燥。对储藏环境条件严格控制,把握好温湿度等条件,避免在真菌容易滋生的条件下储藏农产品。从源头控制来获取低真菌毒素污染的生产原料,为确保成品的质量提供基本保障。
在食品加工中,多采用煮、烤、蒸、炸、挤压膨化、发酵等工艺。科学控制工艺过程中的温湿度、时间、热、力和酸碱浓度等因素,避免真菌毒素原型在高温下热降解为其他修饰型真菌毒素或再次与其他原料结合形成“隐蔽”的修饰型真菌毒素,而导致潜在的食品安全问题[67]。同时,也应当监控整个生产环节中使用的其他原料不会引入真菌毒素的污染。
3.3 加强真菌毒素脱毒技术的研究
加深对于修饰型真菌毒素的认识,继续努力寻找可在大规模生产环节中实施的有效方法或组合方法,将真菌毒素原型从主要的修饰型真菌毒素中释放,而后脱除毒素。真菌毒素的产后防控策略主要是采用不同的处理方法将真菌毒素高效、安全地清除。对于真菌毒素的清除,目前国内外较为普遍的方法主要有物理去除及吸附、化学处理等。因真菌毒素在农作物中分布不均匀,外壳、种皮或胚芽中含量高,可采用脱壳、剥皮等物理脱除方法进行去除。物理吸附(活性碳、硅铝酸盐、酵母细胞壁及提取物等)效果则不稳定,容易出现解析现象,而且容易吸附一些营养成分,造成营养物质损失。化学处理可能存在毒性更强的副产物产生,威胁健康或有毒性残留,造成二次污染,破坏生态环境。生物脱毒技术(微生物吸附及酶制剂降解)为成功控制真菌毒素的污染提供了新的思路[68],但微生物吸附脱毒毒素代谢产物复杂,安全性存在问题。因此,国内外有关真菌毒素酶制剂降解的研究正成为热点。生物降解中生物酶催化方法专一性强、转化效率高[68]。研究较为深入的DON生物降解技术主要通过4条途径展开,将DON分别转化为D3G[69]、3-keto-DON[70]、3-epi-DON[71]和DOM-1[72]等。由此可见,这种转化也仅是将DON原型转为不同类型的DON修饰型真菌毒素。同时,由于酶专一性强,酶制剂对于真菌毒素感染后的农作物自身解毒机制所产生的其他修饰型真菌毒素无作用位点而无法起到脱毒作用。这些修饰型真菌毒素同样也因标准品缺失和分析方法的不完善使其脱毒产物的毒理学和稳定性等研究数据匮乏,仍存在风险和不确定性。生产加工环节的产后脱毒技术仍需进一步加强。
4 结论与展望
修饰型真菌毒素的安全风险不可忽视。近22年来,对12个国家7种谷物及制品中,2 175个样品中主要修饰型真菌毒素的分布及毒性展开分析发现,修饰型真菌毒素在谷物及制品中真实存在,但因采集样本有限,加上分析方法各异,并无统一标准方法参考,导致所得数据仍存在不确定性。同时,收集整理相关文献资料,对已报道的修饰型真菌毒素的数量、分析方法、毒性、化学类型和作用位点进行统计及归纳,发现结构复杂且多样的修饰型真菌毒素在真菌毒素的代谢过程中形成。多种毒素共存可能会导致毒性累加或/和增强或/和协同效应,引起毒性机制和毒性作用不明[24]。真菌毒素在结构中存在多个活性位点,在农作物代谢或食品加工过程中可与一些极性较强的物质结合产生结构、性质、毒性均未知的修饰型真菌毒素。另外,谷物受自然环境、技术环境、经济环境等因素的影响,可能产生更多未知的新兴修饰型真菌毒素,引发风险。受标准品的缺乏,绝大部分毒素的分析方法仍处于缺失状态,使生物利用率与毒理学数据极其匮乏,无法明确定论出其真实完整的毒性。综上所述,亟待解决的问题就是完善修饰型真菌毒素定性定量分析方法,为毒理代谢、污染状况、风险监测、脱毒技术等科学研究提供扎实可靠的数据支撑。
从修饰型真菌毒素分析研究工作的实际情况出发,开展以下5个方面的工作将有助于有效提升其风险监控能力:
一是完善现实风险中高阳性检出率的多种修饰型真菌毒素同时定量的分析方法。所面临的难点是修饰型真菌毒素数量多,结构复杂,理化性质差异显著,缺乏商业化标准品等,随着分析技术手段的不断进步和科研人员在合成、纯化修饰型真菌毒素标准品技术上的突破,有望加快攻坚步伐,采用已商品化的标准品和同位素内标建立更高质量的分析方法。
二是进一步建立已报道但分析方法缺失的修饰型真菌毒素的分析方法。所面临的难点是由于这类毒素来源复杂,经特定条件的转化形成,有的属于食品加工过程中的热降解产物,有的属于谷物解毒过程的代谢产物,通常含这类毒素的阳性物质不易获得;另外,因原型母核上结合位点较多,存在较多的同分异构体。因此,需要通过针对性的收集或制备阳性样品和合成标准物质相结合的方式,“双管齐下”才能攻克难点。
三是进一步拓展质谱筛查确证数据库。质谱鉴定的成功与筛查确证数据库的全面性密切相关。如果数据库信息容量不足,导致检索不到匹配的物质,将使整个鉴定工作受到影响。因此,更全面地收集新化合物、代谢物的结构信息,并将其纳入数据库中,对确证未知风险具有重要意义。
四是随着越来越多的新方法被开发,可获得更多准确可靠的生物利用率和毒理学数据,应当同时开展谷物及制品污染情况调查和符合我国国情的膳食暴露风险评估研究,进而加快标准制修订的步伐,其间应慎重考虑为特殊人群设计谷物制品中真菌毒素的限量值,最大限度地降低真菌毒素对公众健康的影响。
五是加强抗病育种进程和严把农产品收购、储藏、生产及产品加工关,从源头控制好原料的安全性。谷物及制品中真菌毒素的控制和脱毒领域近年来已探索出许多新的成果,但这些处理有的仅将原型转化成各种修饰型真菌毒素,反而使毒性变得更为复杂,增加了谷物及制品的安全风险。因此,对脱毒物质的分离、纯化、鉴定和其毒理学研究,还需进一步深入,以期早日实现更高效、安全、绿色的脱毒技术。
[1] European Food Safety Authority.Scientific Opinion on the risks for human and animal health related to the presence of modified forms of certain mycotoxins in food and feed.EFSA Journal, 2014, 12(12): 3916.
[2] LU Q, QIN J A, FU Y W, LUO J Y, LU J H, LOGRIECO A F, YANG M H.Modified mycotoxins in foodstuffs, animal feed, and herbal medicine: A systematic review on global occurrence, transformation mechanism and analysis methods.Trends in Analytical Chemistry, 2020, 133: 116088.
[3] NATHANAIL A V, VARGA E, MENG-REITERE J, BUESCHL C, MICHLMAYR H, MALACHOVA A, FRUHMANN P, JESTOI M, PELTONEN K, Adam G, LEMMENS M, SCHUHMACHER R, BERTHILLER F.Metabolism of themycotoxins T-2 toxin and HT-2 toxin in wheat.Journal of Agricultural and Food Chemistry, 2015, 63: 7862-7872.
[4] MCCORMICK S P, KATO T, MARAGOS C M, BUSMAN M, LATTANZIO V M T, GALAVERNA G, DALL-ASTA C, CRICH D, PRICE N P J, KURTZMAN C P.Anomericity of T-2 toxin-glucoside: Masked mycotoxin in cereal crops.Journal of Agricultural and Food Chemistry, 2015, 63: 731-738.
[5] BRETZ M, KNECHT A, GӧCKLER S, HUMPF H U.Structural elucidation and analysis of thermal degradation products of themycotoxin nivalenol.Molecular Nutrition & Food Research, 2005, 49: 309-316.
[6] BRETZ M, BEYER M, CRAMER B, KNECHT A, HUMPF H U.Thermal degradation of themycotoxin deoxynivalenol.Journal of Agricultural and Food Chemistry, 2006, 54(17): 6445-6451.doi: 10.1021/jf061008g.
[7] ZACHARIASOVA M, VACLAVIKOVA M, LACINA O, VACLAVIK L, HAJSLOVA J.Deoxynivalenol oligoglycosides: New “masked” fusarium toxins occurring in malt, beer, and breadstuff.Journal of Agricultural and Food Chemistry, 2012, 60(36): 9280-9291.doi:10.1021/jf302069z.
[8] WARTH B, FRUHMANN P, WIESENBERGER G, KLUGER B, SARKANJ B, LEMMENS M, HAMETNER C, FRöHLICH J, ADAM G, KRSKA R, SCHUHMACHER R.Deoxynivalenol-sulfates: Identification and quantification of novel conjugated (masked) mycotoxins in wheat.Analytical and Bioanalytical Chemistry, 2015, 407(4):1033-1039.
[9] European Food Safety Authority.Risks for animal health related to the presence of zearalenone and its modified forms in feed.EFSA Journal, 2017, 15(7): 4851.
[10] BERTHILLER F, WERNER U, SULYOK M, KRSKA R, HAUSER M T, SCHUHMACHER R.Liquid chromatography coupled to tandem mass spectrometry (LC-MS/MS) determination of phase II metabolites of the mycotoxin Zearalenone in the model plant.Food Additives & Contaminants, 2006, 23(11): 1194-1200.doi: 10.1080/02652030600778728.
[11] HUMPF H U, VOSS K A.Effects of thermal food processing on the chemical structure and toxicity of fumonisin mycotoxins.Molecular Nutrition & Food Research, 2004, 48(4): 255-269.doi: 10.1002/mnfr.200400033.
[12] KIM E K, SCOTT P M, LAU B P Y.Hidden fumonisins in corn flakes.Food Additives and Contaminants, 2003, 20: 161-169.
[13] SEEFELDER W, KNECHT A, HUMPF H U.Bound fumonisin B1: Analysis of fumonisin-B1 glyco and amino acid conjugates by liquid Chromatography-Electrospray Ionization-Tandem mass spectrometry.Journal of Agricultural and Food Chemistry, 2003, 51(18): 5567-5573.doi: 10.1021/jf0344338.
[14] BARTóK T, TöLGYESI L, MESTERHáZY Á, BARTOK M, SZECSI A.Identification of the first fumonisin mycotoxins with three acyl groups by ESI-ITMS and ESI-TOFMS following RP-HPLC separation: palmitoyl, linoleoyl and oleoyl EFB1 fumonisin isomers from a solid culture of Fusarium verticillioides.Food Additives and Contaminants, 2010, 27(12): 1714-1723.
[15] PARK J W, SCOTT P M, LAU B P Y, LEWIS D A.Analysis of heat-processed corn foods for fumonisins and bound fumonisins.Food Additives & Contaminants, 2004, 21(12): 1168-1178.doi: 10.1080/ 02652030400021873.
[16] DALL’ASTA C, MANGIA M, BERTHILLER F, MOLINELLI A, SULYOK M, SCHUHMACHER R, KRSKA R, GALAVERNA G, DOSSENA A, MARCHELLI R.Difficulties in fumonisin determination: the issue of hidden fumonisins.Analytical and Bioanalytical Chemistry, 2009, 395(5): 1335-1345.doi: 10.1007/s00216-009-2933- 3.
[17] JECFA.Evaluation of certain contaminants in food.72nd Report of the Joint FAO/WHO Expert Committee on Food Additives (JECFA).WHO Technical Report Series, 2011, 959: 1-115.
[18] EFSA PANEL ON CONTAMINANTS IN THE FOOD CHAIN (CONTAM), KNUTSEN H K, ALEXANDER J, BARREGÅRD L, BIGNAMI M, BRÜSCHWEILER B, CECCATELLI S, COTTRILL B, DINOVI M, GRASL-KRAUPP B, HOGSTRAND C, HOOGENBOOM L R, NEBBIA C S, OSWALD I P, PETERSEN A, ROSE M, ROUDOT A C, SCHWERDTLE T, VLEMINCKX C, VOLLMER G, WALLACE H, DE SAEGER S, ERIKSEN G S, FARMER P, FREMY J M, GONG Y Y, MEYER K, NAEGELI H, PARENT-MASSIN D, RIETJENS I, VAN EGMOND H, ALTIERI A, ESKOLA M, GERGELOVA P, RAMOS BORDAJANDI L, BENKOVA B, DÖRR B, GKRILLAS A, GUSTAVSSON N, VAN MANEN M, EDLER L.Risks to human and animal health related to the presence of deoxynivalenol and its acetylated and modified forms in food and feed.EFSA Journal European Food Safety Authority, 2017, 15(9): e04718.doi: 10.2903/j.efsa.2017.4718.
[19] NAGL V, WOECHTL B, SCHWARTZ-ZIMMERMANN H E, HENNIG-PAUKA I, MOLL W D, ADAM G, BERTHILLER F.Metabolism of the masked mycotoxin deoxynivalenol-3-glucoside in pigs.Toxicology Letters, 2014, 229(1): 190-197.doi: 10.1016/j.toxlet.2014.06.032.
[20] GRATZ S W, DINESH R, YOSHINARI T, HOLTROP G, RICHARDSON A J, DUNCAN G, MACDONALD S, LIOYD A, TARBIN J.Masked trichothecene and zearalenone mycotoxins withstand digestion and absorption in the upper GI tract but are efficiently hydrolyzed by human gut microbiota in vitro.Molecular Nutrition & Food Research, 2017, 61(4): 1600680.
[21] VIDAL A, CLAEYS L, MENGELERS M, VANHOORNE V, VERVAET C, HUYBRECHTS B, DE SAEGER S, DE BOEVRE M.Humans significantly metabolize and excrete the mycotoxin deoxynivalenol and its modified form deoxynivalenol-3-glucoside within 24 hours.Scientific Reports, 2018, 8(1): 5255.doi: 10.1038/ s41598-018-23526-9.
[22] BINDER S B, SCHWARTZ-ZIMMERMANN H E, VARGA E, BICHL G, MICHLMAYR H, ADAM G, BERTHILLER F.Metabolism of zearalenone and its major modified forms in pigs.Toxins, 2017, 9(2): 56.
[23] DELLAFIORA L, GALAVERNA G, RIGHI F, COZZINI P, DALL'ASTA C.Assessing the hydrolytic fate of the masked mycotoxin Zearalenone-14-glucoside - A warning light for the need to look at the “maskedome”.Food and Chemical Toxicology, 2017, 99: 9-16.doi: 10.1016/j.fct.2016.11.013.
[24] 赵琼晖, 袁梓洢, 王宏菊, 张建莹.食品中修饰型真菌毒素及其同时检测方法研究进展.食品工业科技, 2020, 41(2): 336-344.
ZHAO Q H, YUAN Z Y, WANG H J, ZHANG J Y.Progress on the modified mycotoxins and their simultaneous determination methods in food.Science and Technology of Food Industry, 2020, 41(2): 336-344.(in Chinese)
[25] KOVALSKY P, KOS G, NäHRER K, SCHWAB C, JENKINS T, SCHATZMAYR G, SULYOK M, KRSKA R.Co-occurrence of regulated, masked and emerging mycotoxins and secondary metabolites in finished feed and maize-an extensive survey.Toxins, 2016, 8(12): 363.
[26] LORENZ N, DÄNICKE S, EDLER L, GOTTSCHALK C, LASSEK E, MARKO D, RYCHLIK M, MALLY A.A critical evaluation of health risk assessment of modified mycotoxins with a special focus on Zearalenone.Mycotoxin Research, 2019, 35(1): 27-46.doi: 10.1007/ s12550-018-0328-z.
[27] STEINKELLNER H, BINAGLIA M, DALL'ASTA C, GUTLEB A C, METZLER M, OSWALD I P, PARENT-MASSIN D, ALEXANDER J.Combined hazard assessment of mycotoxins and their modified forms applying relative potency factors: Zearalenone and T2/HT2 toxin.Food and Chemical Toxicology, 2019, 131: 110599.doi: 10.1016/ j.fct.2019.110599.
[28] HUMPF H U, SCJMELZ E M, MEREDITHI F I, VESPER H, VALES T R, WANG E, MENALDINO D S, LIOTTA D C, MERRILL A H.Acylation of naturally occurring and synthetic 1- deoxysphinganines by ceramide synthase.The Journal of Biological Chemistry, 1998, 273(30): 19060-19064.
[29] BERTHILLER F, DALL'ASTA C, SCHUHMACHER R, LEMMENS M, ADAM G, KRSKA R.Masked mycotoxins: determination of a deoxynivalenol glucoside in artificially and naturally contaminated wheat by liquid chromatography-tandem mass spectrometry.Journal of Agricultural and Food Chemistry, 2005, 53(9): 3421-3425.doi: 10.1021/jf047798g.
[30] NATHANAIL A V, SYVÄHUOKO J, MALACHOVÁ A, JESTOI M, VARGA E, MICHLMAYR H, ADAM G, SIEVILäiNEN E, BERTHILLER F, PELTONEN K.Simultaneous determination of major type A and B trichothecenes, zearalenone and certain modified metabolites in Finnish cereal grains with a novel liquid chromatography-tandem mass spectrometric method.Analytical and Bioanalytical Chemistry, 2015, 407(16): 4745-4755.
[31] 李凤琴, 于钏钏, 邵兵, 王伟, 于红霞.2007-2008年中国谷物中隐蔽型脱氧雪腐镰刀烯醇及多组分真菌毒素污染状况.中华预防医学杂志, 2011, 45(1): 57-63.
LI F Q, YU C C, SHAO B, WANG W, YU H X.Natural occurrence of masked deoxynivalenol and multi-mycotoxins in cereals from China harvested in 2007 and 2008.Chinese Journal of Preventive Medicine, 2011, 45(1): 57-63.(in Chinese)
[32] FREIRE L, SANT'ANA A S.Modified mycotoxins: An updated review on their formation, detection, occurrence, and toxic effects.Food and Chemical Toxicology, 2018, 111: 189-205.doi: 10.1016/j.fct.2017.11.021.
[33] YOSHINARI T, SAKUDA S, FURIHATA K, FURUSAWA H, OHNISHI T, SUGITA-KONISHI Y, ISHIZAKI N, TERAJIMA J.Structural determination of a nivalenol glucoside and development of an analytical method for the simultaneous determination of nivalenol and deoxynivalenol, and their glucosides, in wheat.Journal of Agricultural and Food Chemistry, 2014, 62(5): 1174-1180.doi: 10.1021/jf4048644.
[34] SASANYA J J, HALL C, WOLF-HALL C.Analysis of deoxynivalenol, masked deoxynivalenol, andpigment in wheat samples, using liquid chromatography-UV-mass spectrometry.Journal of Food Protection, 2008, 71(6): 1205-1213.doi: 10.4315/ 0362-028x-71.6.1205.
[35] PALACIOS S A, ERAZO J G, CIASCA B, LATTANZIO V M T, REYNOSO M M, FARNOCHI M C, TORRES A M.Occurrence of deoxynivalenol and deoxynivalenol-3-glucoside in durum wheat from Argentina.Food Chemistry, 2017, 230: 728-734.doi: 10.1016/j.foodchem.2017.03.085.
[36] BRYLA M, KSIENIEWICZ-WO´ZNIAK E, WA´SKIEWICZ A, SZYMCZYK K, JEDRZEJCZAK R.Natural occurrence of nivalenol, deoxynivalenol, and Deoxynivalenol-3-Glucoside in polish winter wheat.Toxins, 2018, 10(2): 81.
[37] DE BOEVRE M, DI MAVUNGU J D, MAENE P, AUDENAERT K, DEFORCE D, HAESAERT G, EECKHOUT M, CALLEBAUT A, BERTHILLER F, VAN PETEGHEM C, DE SAEGER S.Development and validation of an LC-MS/MS method for the simultaneous determination of deoxynivalenol, Zearalenone, T-2-toxin and some masked metabolites in different cereals and cereal-derived food.Food Additives & Contaminants: Part A, 2012, 29(5): 819-835.doi: 10.1080/19440049.2012.656707.
[38] WANG W, MA J J, YU C C, LIN X H, JIANG H R, SHAO B, LI E Q.Simultaneous determination of masked deoxynivalenol and some important type B trichothecenes in Chinese corn kernels and corn-based products by ultra-performance liquid chromatography- tandem mass spectrometry.Journal of Agricultural and Food Chemistry, 2012, 60(46): 11638-11646.doi: 10.1021/jf3038133.
[39] SCHNEWEIS I, MEYER K, ENGELHARDT G, BAUER J.Occurrence of Zearalenone-4--d-glucopyranoside in wheat.Journal of Agricultural and Food Chemistry, 2002, 50(6): 1736-1738.doi: 10.1021/jf010802t.
[40] MALACHOVA A, DZUMAN Z, VEPRIKOVA Z, VACLAVIKOVA M, ZACHARIASOVA M, HAJSLOVA J.Deoxynivalenol, deoxynivalenol-3-glucoside, and enniatins: The major mycotoxins found in cereal-based products on the Czech market.Journal of Agricultural and Food Chemistry, 2011, 59(24): 12990-12997.doi: 10.1021/jf203391x.
[41] VENDL O, CREWS C, MACDONALD S, KRSKA R, BERTHILLER F.Occurrence of free and conjugatedmycotoxins in cereal-based food.Food Additives & Contaminants: Part A, 2010, 27(8): 1148-1152.doi: 10.1080/19440041003801166.
[42] DE BOEVRE M, JACXSENS L, LACHAT C, EECKHOUT M, DI MAVUNGU J D, AUDENAERT K, MAENE P, HAESAERT G, KOLSTEREN P, DE MEULENAER B, DE SAEGER S.Human exposure to mycotoxins and their masked forms through cereal-based foods in Belgium.Toxicology Letters, 2013, 218(3): 281-292.doi: 10.1016/j.toxlet.2013.02.016.
[43] LEE S Y, WOO S Y, TIAN F, SONG J, MICHLMAYR H, KIM J B, CHUN H S.Occurrence of deoxynivalenol, nivalenol, and their glucosides in korean market foods and estimation of their population exposure through food consumption.Toxins, 2020, 12: 89.
[44] RAHIMI E, SADEGHI E, BOHLOULI S, KARAMI F.Fates of deoxynivalenol and deoxynivalenol-3-glucoside from wheat flour to Iranian traditional breads.Food Control, 2018, 91: 339-343.
[45] JIN Z, ZHOU B, GILLESPIE J, GROSS T, BARR J, SIMSEK S, BRUEGGEMAN R, SCHWARZ P.Production of deoxynivalenol (DON) and DON-3-glucoside during the malting ofinfected hard red spring wheat.Food Control, 2018, 85: 6-10.
[46] BERTHILLER F, CREWS C, DALL’ASTA C, SAEGER S D, HAESAERT G, KARLOVSKY P, OSWALD I P, SEEFELDER W, SPEIJERS G, STROKA J.Masked mycotoxins: A review.Molecular Nutrition & Food Research, 2013, 57: 165-186.
[47] PASCARI X, GIL-SAMARRA S, MARIN S, RAMOS A J, SANCHIS V.Fate of zearalenone, deoxynivalenol and deoxynivalenol- 3-glucoside during malting process.Food Science and Technology, 2019, 99: 540-546.
[48] 中华人民共和国卫生部.食品安全国家标准食品中真菌毒素限量: GB 2761—2017.北京: 中国标准出版社, 2017.
Ministry of Health of the PRC.National food safety standard limit of mycotoxin in food: GB 2761-2017.Beijing: China Standards Press, 2017.(in Chinese)
[49] STOEV S D.Foodborne mycotoxicoses, risk assessment and underestimated hazard of masked mycotoxins and joint mycotoxin effects or interaction.Environmental Toxicology and Pharmacology, 2015, 39(2): 794-809.doi:10.1016/j.etap.2015.01.022.
[50] 吴限鑫, 林秋君, 郭春景, 王建忠, 王雪鑫, 李广.国内外主要粮油产品中真菌毒素限量、检测标准及风险评估现状分析.中国粮油学报, 2019, 34(9): 130-138.
WU X X, LIN Q J, GUO C J, WANG J Z, WANG X X, LI G.Analysis of limits, testing standards and risk assessment of mycotoxins in major grain and oil products at home and abroad.Journal of the Chinese Cereals and Oils Association, 2019, 34(9): 130-138.(in Chinese)
[51] BERTHILLER F, KRSKA R, DOMIG K J, KNEIFEL W, JUGE N, SCHUHMACHER R, ADAM G.Hydrolytic fate of deoxynivalenol- 3-glucoside during digestion.Toxicology Letters, 2011, 206(3): 264-267.doi: 10.1016/j.toxlet.2011.08.006.
[52] ABBOTT A.Microbiology: Gut reaction.Nature, 2004, 427(6972): 284-286.doi: 10.1038/427284a.
[53] HATTORI M, TAYLOR T D.The human intestinal microbiome: A new frontier of human biology.DNA Research, 2009, 16(1): 1-12.doi: 10.1093/dnares/dsn033.
[54] ZHANG Z Q, NIE D X, FAN K, YANG J H, GUO W B, MENG J J, ZHAO Z H, HAN Z.A systematic review of plant-conjugated masked mycotoxins: Occurrence, toxicology, and metabolism.Critical Reviews in Food Science and Nutrition, 2020, 60(9): 1523-1537.doi: 10.1080/10408398.2019.1578944.
[55] ROGOWSKA A, POMASTOWSKI P, SAGANDYKOVA G, BUSZEWSKI B.Zearalenone and its metabolites: Effect on human health, metabolism and neutralisation methods.Toxicon, 2019, 162: 46-56.doi:10.1016/j.toxicon.2019.03.004.
[56] NAGL V, SCHATZMAYR G.Deoxynivalenol and its masked forms in food and feed.Current Opinion in Food Science 2015, 5: 43-49.
[57] HE J W, BONDY G S, ZHOU T, CALDWELL D, BOLAND G J, SCOTT P M.Toxicology of 3-epi-deoxynivalenol, a deoxynivalenol- transformation product bymutans 17-2-E-8.Food and Chemical Toxicology, 2015, 84: 250-259.doi: 10.1016/j.fct.2015.09.003.
[58] YAO Y, LONG M.The biological detoxification of deoxynivalenol: A review.Food and Chemical Toxicology, 2020, 145: 111649.doi: 10.1016/j.fct.2020.111649.
[59] BRACARENSE A P F L, PIERRON A, PINTON P, GEREZ J R, SCHATZMAYR G, MOLL W D, ZHOU T, OSWALD I P.Reduced toxicity of 3-epi-deoxynivalenol and de-epoxy-deoxynivalenol through deoxynivalenol bacterial biotransformation:analysis in piglets.Food and Chemical Toxicology, 2020, 140: 111241.doi:10.1016/j.fct.2020.111241.
[60] DALL'ASTA C, GALAVERNA G, MANGIA M, SFORZA S, DOSSENA A, MARCHELLI R.Free and bound fumonisins in gluten-free food products.Molecular Nutrition & Food Research, 2009, 53(4): 492-499.doi: 10.1002/mnfr.200800088.
[61] 张晓明,杨治彪,高升成.农产品中真菌毒素的管控.现代农业科技, 2016(3): 322-323.
ZHANG X M, YANG Z B, GAO S C.Control of mycotoxins in agricultural products.Modern Agricultural Science and Technology, 2016(3): 322-323.(in Chinese)
[62] 周贻兵, 李磊, 吴玉田, 刘利亚.小麦粉中2种新型真菌毒素含量测定方法.食品工业, 2021, 42(5): 448-451.
ZHOU Y B, LI L, WU Y T, LIU L Y.Determination method of two new mycotoxins in wheat flour.The Food Industry, 2021, 42(5): 448-451.(in Chinese)
[63] LANCOVA K, HAJSLOVA J, POUSTKA J, KRPLOVA A, ZACHARIASOVA M, DOSTALEK P, SACHAMBULA L.Transfer ofmycotoxins and ‘masked’ deoxynivalenol (deoxynivalenol- 3-glucoside) from field barley through malt to beer.Food Additives & Contaminants: Part A, 2008, 25(6): 732-744.doi: 10.1080/ 02652030701779625.
[64] NERVA L, CHITARRA W, SICILIANO I, GAIOTTI F, CIUFFO M, FORGIA M, VARESE G C, TURINA M.Mycoviruses mediate mycotoxin regulation in.Environmental Microbiology, 2019, 21(6): 1957-1968.doi: 10.1111/1462-2920.14436.
[65] HOENISCH R W, DAVIS R M.Relationship between kernel pericarp thickness and susceptibility toear rot in field corn.Plant Disease, 1994, 78(5): 517-519.
[66] DORNER J W.Efficacy of a biopesticide for control of aflatoxins in corn.Journal of Food Protection, 2010, 73(3): 495-499.doi: 10.4315/ 0362-028x-73.3.495.
[67] WU Q H, KUČA K, HUMPF H U, KLÍMOVÁ B, CRAMER B.Fate of deoxynivalenol and deoxynivalenol-3-glucoside during cereal- based thermal food processing: a review study.Mycotoxin Research, 2017, 33(1): 79-91.doi: 10.1007/s12550-016-0263-9.
[68] 吕聪, 邢福国, 刘阳.国内外真菌毒素防控新技术.中国猪业, 2017, 12(6): 27-32.
LÜ C, XING F G, LIU Y.New technologies of mycotoxin prevention and control at home and abroad.China Swine Industry, 2017, 12(6): 27-32.(in Chinese)
[69] TIAN Y, TAN Y L, LIU N, YAN Z, LIAO Y C, CHEN J, DE SAEGER S, YANG H, ZHANG Q Y, WU A B.Detoxification of deoxynivalenol via glycosylation represents novel insights on antagonistic activities ofwhen confronted with.Toxins, 2016, 8(11): 335.
[70] SHIMA J, TAKASE S, TAKAHASHI Y, IWAI Y, OCHI K.Novel detoxification of the trichothecene mycotoxin deoxynivalenol by a soil bacterium isolated by enrichment culture.Applied and Environmental Microbiology, 1997, 63(10): 3825-3830.
[71] 何伟杰, 刘易科, 朱展望, 张静伯, 高春保, 廖玉才.镰刀菌毒素脱氧雪腐镰刀菌烯醇脱毒菌及脱毒酶研究进展.植物病理学报, 2019, 49(5): 577-589.
HE W J, LIU Y K, ZHU Z W, ZHANG J B, GAO C B, LIAO Y C.Recent progress on microbial and enzymatic detoxification ofmycotoxin deoxynivalenol.Acta Phytopathologica Sinica, 2019, 49(5): 577-589.(in Chinese)
[72] GUAN S, HE J W, YOUNG J C, ZHU H H, LI X Z, JI C, ZHOU T.Transformation of trichothecene mycotoxins by microorganisms from fish digesta.Aquaculture, 2009, 290(3): 290-295.
Risks and Their Prevention and Control of Modified Mycotoxins in Grain and Its Products
YANG Hong, CAO WenMing*, CHEN HeYan, WEI XueQing, SHU LiDan, LI Tong
Wilmar Biotechnology Research & Development Center (Shanghai) Co., Ltd., Shanghai 200137
Modified mycotoxins are a principal group of food safety hazards.In this study, based on reviews of the formation mechanism, classification, pollution status, toxicological research, metabolic rule, and analytical and detoxification methods of modified mycotoxins, the known and potential risks were identified, and risk prevention and control measures were analysed.The known risks were: in grain and its products, there was a high positive detection rate of modified mycotoxins, with a wide range of concentrations, which increased the risk of exposure to mycotoxins.Toxicological research on modified mycotoxins demonstrated that some modified mycotoxins transform back into their parent form during the process of metabolism and produced toxic effects equal to their parent form.Additionally, some other modified mycotoxins were toxic in themselves.The potential risks were: the coexistence of a diversity of metabolized toxins might lead to obscure toxicological mechanisms and effects.Some new modified mycotoxins with unknown structures, properties, or toxicities could be produced in the process of crop metabolism or food processing.Because it was restricted by a lack of analytical technology and quality control methods, it was difficult to obtain accurate and reliable qualitative and quantitative results for modified mycotoxins.Thus, the toxicological data for modified mycotoxins were extremely scarce, resulting in disputes over toxicological properties.The risk prevention and control measures were: starting from the source, the new varieties should be bred that were resistant to mycotoxin infection, normalize standards and testing systems should be built, and the purchase, storage, and production of agriculture products should be strictly controlled.In the food processing stage, more detailed research into detoxification technology after mycotoxin infection needs was required.
modified mycotoxins; parent mycotoxins; grain and its products; risk; prevention and control measures
2021-06-24;
2021-12-17
杨虹,Tel:18918156745;Fax:021-58487667;E-mail:yanghong7@cn.wilmar-intl.com。通信作者曹文明,Tel:18017491779;Fax:021-58487667;E-mail:caowenming@cn.wilmar-intl.com
(责任编辑 赵伶俐)

