蛋白质组装体辅助的酶固定:精准构建有机相高效生物催化剂
翟婷婷,顾宏周,樊春海
(上海交通大学化学化工学院,上海 200240)
酶是一类具有高度特异性和高催化效率的生物催化剂,在化工生产、药物制备和食品加工等领域具有广泛的应用[1]。然而,酶的催化反应主要发生在一定条件下的水相环境中,温度和pH 值的变化以及有机介质的存在等往往会导致酶催化活性降低,限制其在工业生产中的实际应用[2]。例如,药物生产中疏水性底物参与的化学反应通常需要添加有机溶剂作为反应介质,而该操作会显著降低酶的催化效率。因此,提高酶在有机溶剂中的催化活性和稳定性具有重要的研究价值。
酶固定化技术是采用固体材料将酶束缚或限制在一定区域内,从而维持有机相中酶活性和稳定性的有效手段[3]。与游离酶相比,固定化酶结构刚性提升,可维持更为稳定的三维活性构象。与此同时,固相载体也能为酶提供特定物理化学性质的微反应环境。因而,固定方法以及所用载体是决定固定化酶催化性质的关键因素。随着固定化酶技术的飞速发展,吸附法、交联法、共价结合法和包埋法等被广泛用于游离酶的固定。但是在这些方法中,酶通常是被随机固定在载体表面,存在取向性差的缺陷,导致酶活性的降低[4]。自组装蛋白纳米结构是一种新兴的酶固定化支撑材料。通过蛋白质工程和自组装技术,游离酶可以被定向附着在蛋白纳米结构的表面[5-6]。蛋白质载体不仅保留了传统载体的优点,而且还能进一步保护酶的活性;此外,蛋白质载体的表面性质可通过氨基酸残基精确调控实现灵活的设计。因此,以自组装蛋白为载体的酶固定化策略为构建界面性质及空间取向可控的高活性固定化酶提供了可能性。
近期,中国科学院武汉病毒研究所/生物安全大科学研究中心的门冬课题组与中国科学院生物物理研究所张先恩课题组合作在ACS Catalysis上发表的研究性文章“Self-Assembled Enzymatic Nanowires with a ‘Dry and Wet’ Interface Improvethe Catalytic Performance of Januvia Transaminase in Organic Solvents”报道了一项以自组装蛋白质为载体,构建有机相下高催化活性固定酶的研究工作[7]。作者制备了一种具有亲水-疏水复合界面性质的自组装酶纳米线,可用于有效提高酶在有机相中的催化性能(图1)。Zhang等指出,与其他酶固定化的手段相比,利用具有自组装特性的蛋白为载体的酶固定化手段不仅可以实现酶的精准定向固定,还可基于蛋白质表面性质易修饰的特点,实现固定化酶界面生物化学性质的精确调制,大幅提高了固定化酶的环境适宜性。相关研究成果将为提高有机介质中酶分子催化活性和稳定性提供重要参考价值。
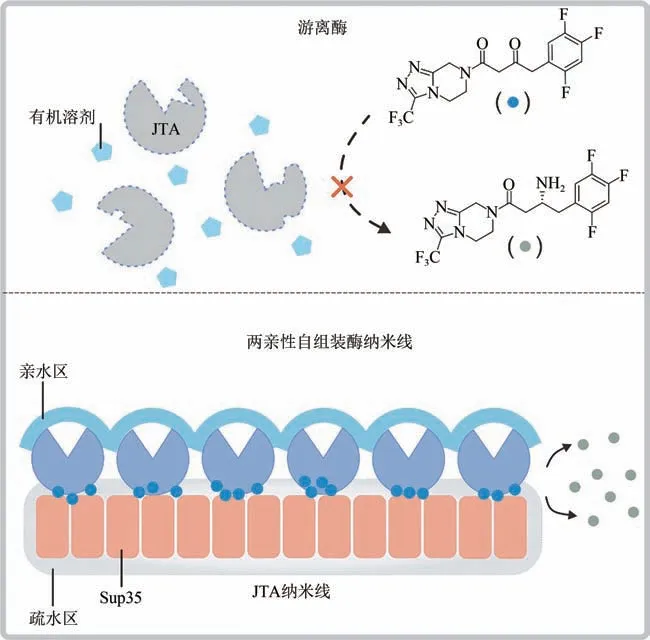
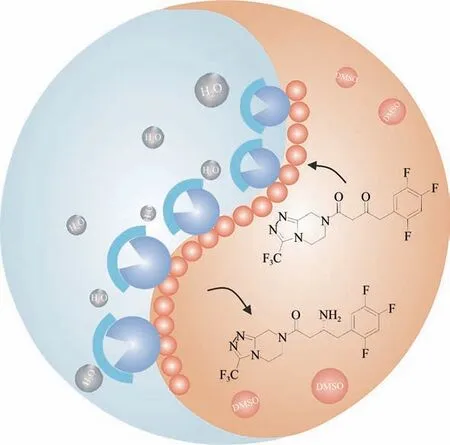
图1 Januvia转氨酶纳米线的结构设计及有机相高效底物催化示意图Fig.1 Design of Januvia transaminase nanowires for biocatalysis in organic solvents
在该项工作中,作者选用酿酒酵母蛋白Sup35作为酶固定化载体。Sup35 是一种淀粉样蛋白,其朊蛋白结构域在体外能自组装形成淀粉样蛋白纤维。Sup35 可以通过与蛋白配体的基因融合来构建功能化的纳米载体,随后基于蛋白质自组装机制形成具有交替性亲疏水界面的纳米线,为负载酶提供一种两亲性的微环境[8]。在示例性实验中,作者将合成西他列汀(糖尿病治疗药物)的关键酶Januvia转氨酶(JTA)与Sup35 自组装结构域(前61 个氨基酸)相融合,构建融合蛋白Sup35-JTA;然后利用Sup35 的自组装特性,进一步构建JTA 纳米线。研究证明,蛋白质的融合及自组装过程并不会影响底物与酶之间的亲和作用,与游离的JTA 相比[(7.088±0.351)×10−3s−1],JTA 纳米线的酶催化活性[(33.610 ± 2.406)×10−3s−1]提高了3.7 倍以上,90%转化率所需时间由游离JTA的24 h缩短到4.5 h以下。
文章进一步对JTA纳米线在有机相中催化活性提高的机理进行了阐述。作者指出, JTA 纳米线显现出一定程度的丁达尔现象,能够很好地溶解在缓冲液中,是一种介于溶液和胶体状态的纳米材料。与游离的JTA 相比,JTA 纳米线中酶与Sup纳米线相互作用形成了两亲性复合界面,可以明显提升固定酶的疏水性质。基于此,JTA 纳米线呈现出与疏水性的Sup纳米线相似的结合疏水分子的能力。另一方面,测试结果显示与游离JTA 相比,JTA纳米线的表观米氏常数(Km)并没有发生明显的变化。因此,作者推断JTA纳米线催化活性的提升源自于JTA 纳米线结构的亲水-疏水杂合性质,这一特性改善了酶和底物间的相互作用,具体可能包括以下两方面:首先,JTA 本身是一种亲水性蛋白质,其催化活性高度依赖于自身三维活性构象的稳定性,而结合水分子是保持酶活性构象的必要条件之一。酶分子通过与水分子间的非共价作用(氢键相互作用、范德华相互作用等),使酶的最低自由能达到一个极小值,进而维持酶的稳定状态。一旦维持酶分子活性结构的水分子被去除,酶分子与水分子间的相互作用消失,酶活性构象则易发生改变,从而发生酶失活[9]。由Sup35和JTA组成的纳米线表面富含极性氨基酸,可以很好地结合水分子, 为JTA 纳米线提供较好的亲水微环境,从而提高固定在蛋白质纳米线表面酶的稳定性,亲水性微环境还可以进一步提高固定化JTA 的溶解性。其次,催化效率(Kcat/Km)数据显示,由Sup35纳米线形成的疏水微环境可以诱导疏水性底物普罗西格列汀酮向JTA 纳米线表面扩散,在提高底物局域浓度的同时也能增强底物与酶的接触能力,进而最大限度地提高反应速率和催化效率。作者在文章中还指出,与游离酶相比,JTA纳米线酶不仅具有更高的酶活性,而且还具有更好的热稳定性、pH 稳定性及有机溶剂适应性,表现出更优异的综合催化性能。
自组装蛋白纳米结构作为一种新兴的酶固定化支撑基质,具有广阔的应用前景。由于通过基因操纵和融合蛋白的自组装可以实现对载体表面酶的固定位点的精确操控,因而相比于常见的化学修饰固定法,蛋白质自组装策略能够更大程度地保持酶的本征催化能力;同时,与基于有机/无机支撑基质的纳米酶相比,蛋白质载体界面的物理化学性质具有更强的可设计性,可通过灵活改变蛋白质载体的结构和微环境,增强固定酶的催化活力和应用普适性;此外,自组装酶促纳米结构的特定界面可通过成熟的蛋白质工程来实现,具备工业化生产和应用的潜力。总而言之,以自组装蛋白质为载体的酶固定化策略可为多类型工业生产催化剂的开发提供有利的新思路。

