DNA纳米技术与合成生物学
施茜,吴园园,杨洋
(上海交通大学医学院附属仁济医院,分子医学研究院,上海 200127)
1 从经典生物学到合成生物学
生命经过亿万年的自然选择,已经进化成为高度复杂、高度动态、高度集成的体系,对于生命奥秘的认识与研究是人类在科学道路上最近发生的事情,虽然成果斐然,但仍任重道远。人类在与自然界的接触中,历经了从认识、理解,到改造甚至创造世界的过程。经典生物学作为人们认识与理解世界的阶段,往往从现象和表型出发,探求生命是什么与为什么:自林奈至达尔文,物种间静态的相似性和动态的进化联系得以描述和阐释;自孟德尔至摩尔根,生物体性状背后的基因本质得以揭示,而其物质基础也呼之欲出;沃森和克里克通过对DNA 结构的正确认识,为基因找到了分子载体,使得生命科学的大厦终于可以与物理和化学科学的大厦连通。分子生物学的时代接踵而至,无论是从基于生物催化剂“酶”的生化反应出发还是从经典有机化学的反应机制出发,人类对于DNA的合成、复制、剪切和连接等操作都渐渐驾轻就熟直至炉火纯青。而相应地,在人类进行世界改造与创造的追求驱使下,以设计与构造为出发点的新的生物学研究模式也进入了快车道。
随着经典生物学对自然界认知的不断深入,合成生物学(synthetic biology)的概念应运而生(图1)。“合成生物学”的名词首次出现于1910 年Stéphane Leduc 的著作中,在接下来的100 年里逐步萌芽并不断发展:从20 世纪60 年代Jacob 和Monod 乳糖操纵子的经典研究,对利用分子组分组装新系统的大胆设想[1],到21 世纪初Nature杂志报道的通过结合大肠杆菌的基因合成的两种基因线路[2-3],再到最近剑桥生物学家们设计合成的命名为“Syn61”的首个人造大肠杆菌[4],合成生物学已经将人类带入了改造世界和创造世界的新征程。合成生物学是利用工程学思想,由生物学、物理学、化学和计算机科学等多学科进行交叉,以重编改造天然体系或设计合成新的生物体系为目标的新兴学科,主要通过基因拼接或分子组装,构建生物学配件和体系以模拟甚至在某些场景下替代自然生命体系。合成生物学被认为是面向未来的学科,从资本市场表现来看,合成生物行业正在走向爆发期,根据2020 年CB Insights 公司分析数据显示,2019 年全球合成生物学市场规模达53 亿美元。预计到2024 年,与2019 年相比,合成生物学市场规模的年复合增长率将增长28.8%,达到189亿美元[5]。合成生物学的迅速崛起将人类对于生命的认知、改造和创造能力提升到了一个全新的层次,也为解决一些全球性重大问题提供了重要途径,并且将在生命健康、食品、环境、能源等诸多方面有广泛应用。
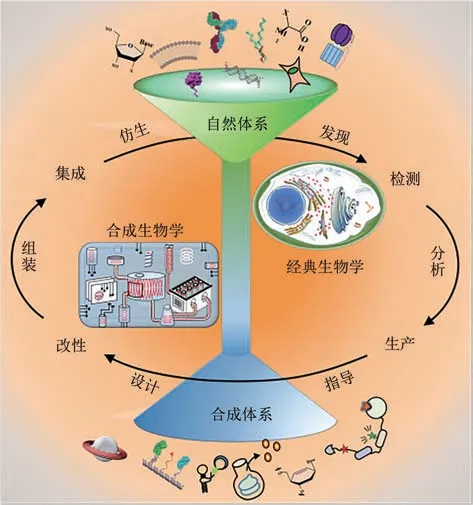
图1 经典生物学与合成生物学研究相应关系与侧重点概念图Fig.1 Schematic diagrams showing the relationship and key concepts of classical biology and synthetic biology
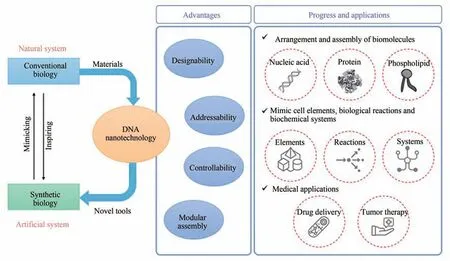
2 DNA 纳米技术:合成生物学的重要支持技术
合成生物学的支持技术主要包括人工染色体合成技术、人工蛋白组件设计合成技术、基因合成、编辑与测序技术、微流控技术、计算机建模与分子模拟技术等,它们帮助构建标准化的生物元件,并在合成系统中逐级利用这些生物元件[6]。本文着重介绍的DNA 纳米技术是一种人为设计并“自下而上”构建核酸纳米结构的技术,这里的DNA 分子被用作结构材料,而非遗传信息载体。由于在纳米级别的精确可控性,使得利用DNA 纳米技术构建“标准化”“模块化”的工具,以至未来利用这些工具构建工程化平台成为可能。DNA纳米技术在多个场景下服务于合成生物学,例如进行生物大分子的有序装配,构建细胞元件、生物装置和生化系统模拟甚至替代自然生命体系,构建核酸纳米药物和肿瘤疫苗,从而推动合成生物学底层技术的进步,很大程度上激发了其市场的增长势能,将人类对生命的认识和改造能力提升到一个全新的层次。由此可见,DNA 纳米技术已经成为合成生物学中不可或缺的重要盟友。
DNA 纳米技术自1982 年Nadrian Seeman[7]创立至今,已经经历了40 年的蓬勃发展,并且在生物、医学、材料、化学等领域具有极其广泛的应用[8]。2006 年DNA 折纸术[9]的出现降低了DNA纳米结构的设计难度,提升了其可编程性,从而大大拓展了DNA 纳米技术的应用场景[10]。DNA折纸术的基本原理是基于碱基互补配对原则,使用上百条称作订书钉链(staple strand)的短链DNA 将一条称作脚手架链(scaffold strand)的长链DNA折叠为预先设计的形状,如正方形、矩形、三角形、星星和笑脸等形状[9][图2(a)]。在随后十余年的发展中,DNA 折纸术在结构维度、结构曲率、拓扑编织、动态控制以及模块化超组装方面[11-15][图2(b)、(c)]不断取得突破,实现了更精细、更巨大、更复杂结构的组装。
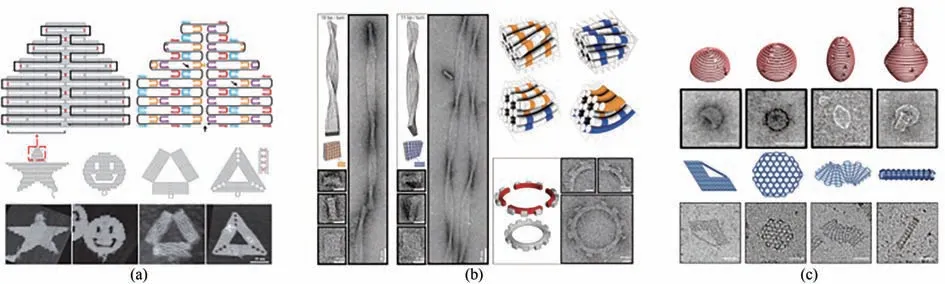
图2 DNA折纸术基本原理及其发展(标尺:50 nm)(a)DNA折纸术原理及二维组装[9];(b)三维组装与弯曲控制[11];(c)曲面设计与网状编织[12-13]Fig.2 Basic principle of DNA origami and its development(Scale bar:50 nm)(a)Principle for the 2D assembly of DNA origami[9];(b)3D structure assembly with the bending control[11];(c)Design for curved surface and DNA gridiron[12-13]
近年来,以DNA 折纸术为代表的DNA 纳米技术被逐步应用于合成生物学研究,并且具有以下独特优势:①高度可设计性,由于基于碱基互补配对原则进行自组装,可以很容易地通过核酸链的设计来控制结构的构象,目前已经可以实现一维到三维[16-18]、平直到弯曲[11-12]、孤立到复合[10,19]结构的自组装;②精确可寻址性,DNA 纳米结构还可以作为模板进一步指导其他纳米材料的精准组装,并且对数量、位置、距离等关键参数进行纳米级精确控制,这些纳米材料可以是无机材料,如金纳米颗粒(Au nanoparticle,AuNP)[20],也可以是生物大分子,如核酸[21]、蛋白[16]、磷脂[22]等;③生物亲和性,由于DNA 是天然存在的生物大分子,在构建纳米结构用于医学诊断和疾病治疗时具有低免疫原性、低毒性等优势,因此在生物医学领域具有较为广泛的应用前景;④模块化组装,通过模块化组装,可以大大提高结构尺度,为在合成生物学的应用提供了新的可能性。例如,DNA 砖块是可以作为模块的短链DNA,通过编程将它们像乐高积木那样搭扣拼装,可以将这些DNA 砖块组装成精确的形状[23],用于构建(0.1~1)×109Da 的三维结构[24]。近日,meta-DNA(元-DNA)策略的出现极大地推动了DNA 结构的模块化组装,其组装方式类似于短DNA 链的自组装,可用于构建更多宏观规模的DNA 结构,尺度可达亚微米-微米级[25],甚至进行链置换反应[26],未来有望在合成生物学和光电子学方面进行应用。
3 DNA纳米技术服务于合成生物学
3.1 利用框架核酸实现生物大分子的有序装配
DNA 纳米技术由于具有高度的可设计性和空间可寻址性,已经成熟地应用于对无机材料进行有序装配,例如AuNP、碳纳米管、高分子聚合物等。AuNP 可以通过与巯基修饰的DNA 形成硫金键结合在DNA 纳米结构上,实现在一维、二维或三维的DNA 框架上数量、位置可控的排列[27]。碳纳米管通过末端修饰或中段绑定,也可以在DNA纳米结构上实现可控角度、位置的组装[28-30],甚至可以在酶的催化下实现固定长度的切割[31]。此外,聚(2,5-二烷氧基)对苯乙烯-DNA 刷状聚合物[32]、聚多巴胺[33]等也可以在DNA折纸结构上实现定位与排列。
除了无机材料和人工高分子材料,DNA 纳米结构也大量应用于生物大分子的有序装配。由于能够精确控制装配材料的数量、距离和方向,DNA 纳米结构在对生物大分子进行有序装配方面具有极大的优势。以下将从分子类型的角度,分别介绍基于DNA 折纸结构的核酸装配、蛋白装配和磷脂装配等方向的进展。
3.1.1 核酸装配
DNA 折纸结构自身的核酸属性为其作为模板对靶分子核酸片段的进一步装配提供了便捷条件,利用折纸结构特定位置上订书钉链延伸出相应序列,即可通过分子杂交的方法实现溶液中靶标核酸分子(包括DNA 和RNA)的识别与结合。2005 年,Lund 等[21]设计了3×3 的纳米网格,并在每个网格节点伸出的9 nt的黏性末端上各杂交一段不同的寡核苷酸链作为该节点的标签,应用链亲和素标记的方法实现了原子力显微镜(atomic force microscopy,AFM)下对节点的精确定位。Ke 等[34]利用DNA 折纸术构建了矩形核酸探针模块,表面伸出的单链DNA 片段能够通过“V 字形”连接的方法与溶液中的RNA 形成DNA-RNA 杂交链,从而实现了RNA 在纳米尺度的有序装配[图3(a)],被用于多种RNA序列的无标记检测。

图3 核酸分子装配及应用(a)RNA识别阵列[34];(b)DNA机器与分子搬运[46]Fig.3 Assembly and applications of nucleic acid molecules(a)RNA recognition array[34];(b)DNA machines and molecular handling[46]
由于核酸互补杂交反应是基于多重氢键和碱基堆叠的多弱相互作用,因此可以根据核酸链的长度和序列进行精准细致的调节,这一优势为核酸的动态结合提供了基础,并用于构建纳米条形码、分子计算机和分子步行器(DNA walker)。实现动态组装的第一种方式是利用短链DNA 瞬时概率性的互补杂交,在DNA 纳米结构模板的特定位置实现荧光闪烁,通过对荧光闪烁的持续记录、信号叠加以及基于泊松分布的位置计算,该位置可以以纳米级别的分辨率呈现出来,这一全新技术被称为DNA-PAINT(DNA points accumulation for imaging in nanoscale topography),它为超分辨荧光显微成像技术家族增添了新鲜血液。基于DNA-PAINT 技术,哈佛大学Lin 等[35]在一条含平行6 条双链螺旋的DNA 长棒上通过三色荧光构建了简易的条形码系统,在混合荧光的应用下实现了216种独立条码的高分辨成像。
基于DNA的分子计算是动态DNA纳米技术的前沿领域,其基础是链置换反应,该反应起始于目标结构的单链区(toehold),加入的启动链可以通过分支迁移取代掉预先杂交DNA 链,置换下的DNA 链又可以作为下个链取代反应的启动链。Seelig 等[36]首先基于链取代反应设计了逻辑门,包括与门(AND)、或门(OR)和非门(NOT)。随后,Qian和Winfree[37]在此基础上设计了一种新的逻辑门,由130 条DNA 链构成,可以实现四位二进制数的开方运算。上述DNA 计算往往基于若干条寡核苷酸链彼此之间结合或解体的竞争过程,而其表征依赖于荧光信号的增强或衰减曲线的解读,因此并不利于直观观察。DNA 结构组装技术为DNA计算的可视化提供了新思路,当DNA模块间的组装行为被逻辑运算法则所规定的时候,其运算结果可以以图案的形式展现。在过去几年中,Qian 的团队通过正方形DNA 折纸模块的边界信息编辑,实现了随机迷宫[38]、蒙娜丽莎、公鸡、电子线路等图样的组装[14];利用“模块置换反应”(tile displacement)让DNA 自行运行井字格游戏(tic-tac-toe game)[39];利用“赢者通吃”的神经网络策略实现了基于DNA 逻辑线路的图像识别[40]。2019 年,Winfree 和哈佛大学的尹鹏[41]合作利用355 条单链DNA 模块实现了连续逻辑线路的生长和图像化,这些逻辑线路可以携载6 个bit 的算法,进行随机游走、乘法、排序、选举等操作,并将数字化的结果直接以组装出的条带在原子力显微镜下呈现出来。这些进步展示了抽象算法与具象分子组装之间的完美契合,也代表了一类基于DNA模板的核酸装配的发展方向。
DNA 分子步行器是可以沿着特定路线或轨道行走的DNA 纳米结构。基于前文所述的链置换反应,DNA 结构通过不同结构域在轨道上的先后结合和解体,即可实现步进式的定向运动。早在2004 年,Sherman 等[42]即通过分步加入DNA 链,实现了两足结构在既定的线性轨道上前进或后退。Gu 等[43]利用类似的原理在DNA 折纸结构的模板上实现了一个三角形结构的步进控制,并在步进过程中完成了结构搭载和释放金纳米颗粒货物的应用。另一类自动步进器抛开了复杂低速的链置换反应,而是通过酶切反应消耗轨道上的核酸燃料驱动结构运动。Tian 等[44]设计了一种包含DNA酶的DNA 纳米结构,可以不断地从底物分子(RNA)中提取化学能,并利用这种能量来推动DNA 装置在一维轨道上的单向运动。基于相同原理,Lund 等[45]设计了一款分子蜘蛛(molecular spider),可以通过感应和修饰二维DNA 折纸上的底物分子的轨迹,来实现包括“起始”“跟随”“转弯”“停止”的定向运动。值得注意的是,上述装置由于在运动过程中擦除了轨道,从而无法逆向或可控运行,是一类一次性运动器件。而2017 年Qian 和Winfree 课题组[46]设计的新型分子机器利用双脚在二维模板上交替站稳的策略,一定程度上牺牲了分子机器运动的定向性,但实现了轨道的无损使用[图3(b)]。采用这一系统分子机器仍然可以在随机游走的过程中,利用结合能力差异将分子货物从起始点分选并运送到目的地。
3.1.2 蛋白装配
在细胞表面以及细胞内,蛋白的协同作用并不是空间上随机的,它们往往需要一定的空间排布和种类数量才可以高效行使功能。然而,以往的技术在纳米级对蛋白进行有序装配存在相当大的困难,而DNA 可以和蛋白进行有效结合,这样利用DNA 纳米结构的可寻址性,可以在预先设计的位置进行修饰,完成对蛋白的精确排布,操作较为简单。
目前,对DNA 进行蛋白装配的方法主要包括非共价偶联和共价偶联(表1)。非共价偶联主要利用DNA 上修饰的配体和蛋白之间的相互作用形成DNA-蛋白复合物,主要包括以下方式:生物素-链亲和素[47]、Ni-NTA-Histag[48]、抗体-抗原[49]、核酸适配体-蛋白[50]、DNA结合蛋白[51](例如锌指蛋白)、RNA-病毒蛋白[52]、DNA-衣壳蛋白[53]等。非共价偶联的优点是具有可逆性,然而在特定状态下,这种结合并不稳定,这就需要共价偶联的方式获得更加稳定的DNA-蛋白复合物。共价偶联的方式又分为非特异性的和特异性的。N-琥珀酰亚氨基3-(2-吡啶基二硫代)-丙酸盐[N-succinimidyl 3-(2-pyridyldithio)-propionate,SPDP][54]和磺基丁二酰亚胺-4-(N-马来亚胺甲基)-环己烷-1-羧酸酯[Nsuccinimidyl 3-(2-pyridyldithio)-propionate,Sulfo-SMCC][55]作为小分子交联剂,可以通过连接蛋白质表面的赖氨酸残基和DNA 上的巯基将蛋白质和DNA 进行非特异性共价偶联。而进行特异性共价偶联则通常会引入一个tag蛋白,tag蛋白通过融合到目标蛋白来提供自催化反应位点,用以和小分子标记的DNA 进行反应。常用的tag 蛋白包括人O6-烷基鸟嘌呤-DNA 烷基转移酶(SNAP-tag)[56]和卤代烷脱卤酶[57](Halo-tag)。
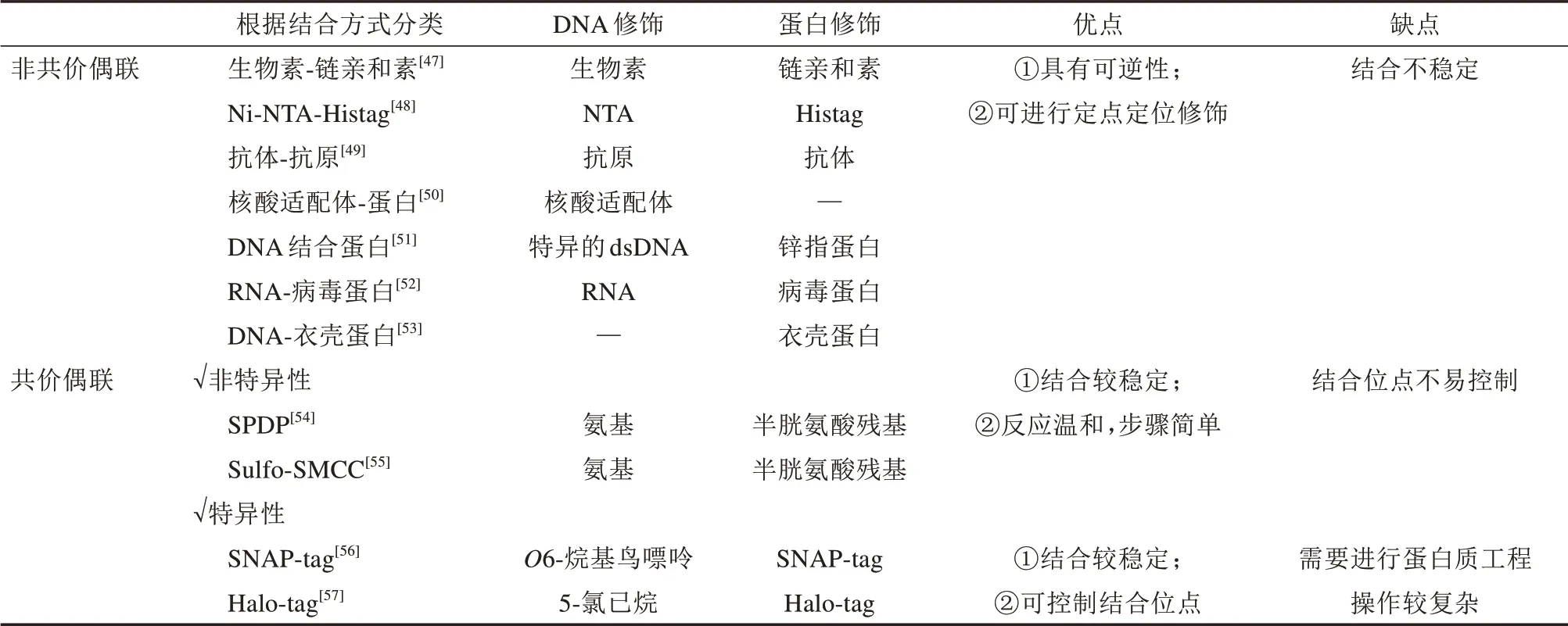
表1 蛋白装配的分类Tab.1 Classification of protein assembly
解决了修饰问题,人们便可以通过设计DNA框架,精确控制蛋白类研究对象的种类、数量、间距等重要参数,实现对蛋白位置和功能的调控。Voigt 等[58]构建了矩形DNA 纳米结构,并在选定位置的订书钉链上进行生物素修饰,这样单个化学键的形成或断裂将导致生物素-链亲和素复合物的附着或去除,这一过程可以运用AFM 进行表征,通过不同的蛋白分子排布,实现对单分子化学反应的表征。Rinker 等[59]将多亲和力的核酸适配体装配在矩形DNA 纳米结构上,它们可以作为“钳子”来捕获和展示纳米阵列上的凝血酶分子,并通过AFM 研究了“钳子”宽度对捕获效率的影响,加深了对适配体-蛋白相互作用的认识。摆臂(swinging arm)是许多天然存在的多酶复合物中多步催化转化的关键功能部分,它能通过柔性接头(linker)共价连接于酶复合物上,从而使底物分子在复合物的多个活性位点之间直接转移。而利用DNA 纳米技术可以实现对这些位点距离的精确调控,这种纳米级别对位置参数的控制是其他技术较难达到的。Fu等[60]将葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6pDH) 和苹果酸脱氢酶(malic dehydrogenase,MDH)装配在DX 结构模块(double crossover tile)两端,并在其中间放置了辅酶NAD+修饰的人工摆臂,实现了这两种脱氢酶之间的氢化物转移和级联反应效率的提高,并且可以利用DNA 纳米结构的可寻址性,精确控制关键参数(包括位置、化学计量和酶间距离)以获得最佳活性。Ke等[61]进一步引入乳酸脱氢酶(lactate dehydrogenase,LDH)并将该体系拓展放置在矩形的DNA 折纸结构上,把辅酶NAD+参与的两套酶联反应路径以前置G6pDH酶为中心向两侧排列,通过链置换反应把NAD+摆臂选择性锚定在不同的路径上,即可相应开启该酶联通路[图4(a)]。这些研究利用DNA 纳米技术对蛋白进行精确装配,推动了蛋白功能研究甚至级联生化反应的功能研究,为酶促反应的精细研究和调控提供了全新的平台。
3.1.3 磷脂装配
除了对核酸和蛋白质进行有序装配,对于磷脂这一双亲性生物大分子,DNA纳米框架可以实现对诱导生长出的人工脂质体大小、形状的精确控制。2016年,Yang等[62]利用刚性DNA纳米环指导磷脂分子作为种子(seed)进行有序装配,随后利用透析法在纳米环内诱导生长出大小可控、均一化的人工脂质体[图4(b)],提供了新的脂质双层膜指导形成的方法,为囊泡运输和药物递送的研究提供了有价值的研究工具。利用同样的诱导脂质体生长的方法,还可以通过调节DNA 框架的几何结构以完成对其中纳米囊泡形状的精确控制。Zhang等[63]构建了模块化的DNA 纳米笼,通过改变纳米笼的排列和构象,诱导生长出了串珠、管状、螺旋状、环管状的人工脂质膜结构。相比三维球状的脂膜结构,平面可视化的二维平面膜(纳米脂盘)在膜蛋白的显微研究方面有着巨大的工具优势,而大面积的二维平面脂膜制备始终是一个难题。针对这一问题,哈佛大学的Zhao 等[64]利用环状刚性的DNA纳米框架定位组装了一圈小纳米盘并诱导它们生长充满了环内的二维平面,形成90 nm 直径的巨大纳米脂盘,并应用于通道蛋白VDAC-1和脊髓灰质炎病毒的展示和成像[图4(c)]。上述进展显示了DNA 纳米结构框架在制备、调控生物膜体系方面所具有的重要价值和应用潜力。
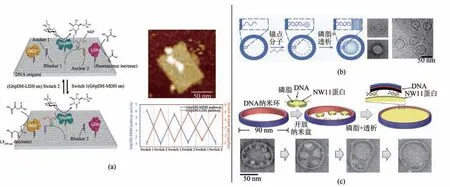
图4 蛋白组装与磷脂组装(a)酶促反应介导与调控[61];(b)可控尺寸囊泡组装[62];(c)二维磷脂膜组装[64]Fig.4 DNA nanoframe-directed assembly of proteins and phospholipids(a)DNA swing arm and regulation on cascade enzymatic reactions[61];(b)Vesicles with controllable sizes[62];(c)Two-dimensional lipid bilayer assembly[64]
3.2 利用DNA 纳米技术构建仿生细胞元件、生物装置和生化系统
合成生物学的一个重要研究任务是模拟自然界已有的生物学配件和体系,甚至在某些场景下替代自然生命体系。然而,由于细胞内结构的复杂性和各种生化活动的时空复合性,仅依靠传统技术对其模拟具有很大的困难。而DNA纳米技术由于在纳米级别的精确可控性,在模拟细胞的很多生物配件例如核孔、人工膜通道、网格蛋白等方面具有独特的优势;并且由于利用DNA纳米技术可以对生物大分子进行有序装配,使其对构建具有复合结构的生物装置和系统,模拟体内生物过程、体内合成体系具有较强的应用潜力。下文将从组装仿生细胞元件、模拟生物过程和构建生化系统三个方面进行介绍。
3.2.1 组装仿生细胞元件
核孔是核质与细胞质进行物质交换的重要通道,结构相当复杂,内径约40 nm,内部有一定数量无序的核孔蛋白(nucleoporins,nups),它们富含苯丙氨酸(FG)氨基酸残基,又称为FG-nups。为模拟天然核孔结构的大小和形态,Fisher 等[55]构建了内径为46 nm 的DNA 纳米环,该结构向内伸出多个锚定序列,可以再连接8个、16个、24个或32 个FG-nups[图5(a)],应用透射电子显微镜(transmission electron microscopy,TEM)和AFM对该人工核孔进行表征,深入研究了该人工核孔中FG 结构域的拷贝数和构型对“核孔”结构的影响,对探讨核孔结构通透性的建立有着重要的价值。类似的,Ketterer 等[65]设计了内径为34 nm 的人工核孔,该结构向内伸出不同数量的FG-nups或者其亲水突变体,探讨了数量和亲水突变体对核孔内部蛋白密度和电导率的影响。

图5 构建仿生细胞元件(a)模拟核孔复合体[55];(b)模拟细胞骨架蛋白[70]Fig.5 Mimic and construction of cell elements(a)Simulation of the nuclear pore complex [55];(b)Simulation of cytoskeleton protein and network [70]
另一DNA 纳米结构在仿生细胞元件上的重要应用是构建人工膜通道。天然的膜通道多由蛋白质构成,结构精巧,可以进行细胞内外的小分子和离子的被动扩散或者主动运输。目前,研究人员试图利用DNA 纳米技术构建人工膜通道,用来模拟天然离子通道,甚至向细胞内进行分子运输。2012 年,Langecker 等[66]设计了由54 条平行DNA螺旋束构成的人工离子通道,通过胆固醇修饰可以使头部的桶状结构固定在人造脂质双层膜上,中央6条螺旋束围成的茎状结构则穿过膜结构,在单通道电生理测量中该结构具有与天然离子通道类似的响应,然而该结构未在活细胞上进行测试。近 期 , Lü 等[67]构 建 了 硫 代 磷 酸(phosphorothioate,PPT)修饰的人工膜通道,该结构由6 条DNA 螺旋束围成,内径为2 nm,并证实这种结构可以将离子和小分子抗肿瘤药物分别运输至神经细胞和肿瘤细胞中,成功模拟了生物分子跨活细胞膜转运的过程。除了上述两项代表性工作,近年来大量基于DNA 纳米结构的人工跨膜孔道体系被构建出来,英国伦敦大学学院的Howorka 课 题 组[68]在2021 年 初 的 一 篇Nature Protocol文章中细致综述了各类孔道的跨膜机制和设计制备原则方法,为领域内和跨领域研究者进行相关工具的开发与应用提供了重要的参考。
网格蛋白是一种细胞内网状结构的单元模块,它具有特征性的三联体骨架结构,在细胞内吞过程中自组装形成多面体晶格,逐渐覆盖在细胞膜上,最终使脂质双层内陷并脱离细胞膜[69]。Journot等[70]模拟网格蛋白三联体(triskelion)设计了三臂的DNA 纳米结构,利用胆固醇可以将其锚定在脂质单分子或者双分子层上,加入订书钉链后可以诱导其形成网状结构[图5(b)]。利用TEM可以观察到三臂结构聚集引起的脂质单分子层的局部变形,这一过程类似网格蛋白诱导的小凹形成。
3.2.2 模拟生物过程
运用DNA 纳米技术可以构建仿生装置,对生物体内大量分子参与的复杂生理过程进行模拟,有助于将复杂的生命现象在体外进行简单的模式化研究,并且能够在体外对各种参数进行精确的控制。大部分生物膜相关的生理生化反应是由膜蛋白驱动,磷脂双分子层共同参与的复杂过程。传统生化研究方法虽然可以得到大致的分子组成信息、环境信息和初末状态信息,并提出一定的合理假设,但对于真实状态的分子时空排布与变构、磷脂膜的应变过程等信息的获取无能为力。耶鲁大学的Lin Chenxiang 课题组近年来做出了一系列重要工作,利用DNA 纳米结构为上述问题的研究提供了全新的工具。
膜融合是一种重要的生命现象,可溶性N-乙基马来酰亚胺敏感性因子附着型的蛋白受体(solubleN-ethylmaleimide-sensitive factor attachment protein receptor,SNARE)在这一过程中起到了关键作用。SNARE 蛋白复合体由三种蛋白构成:质膜蛋白(t-SNAREs)Synaxin 1、25kDa 的突触小体相关蛋白(STX1 和SNAP25A)和囊泡蛋白(v-SNARE)synaptobrevin-2(VAMP2)。Xu 等[71]构建了DNA 纳米环,通过锚定序列可以将一定数量的VAMP2 和脂质固定在纳米环上并指向环的内部,并且设计了一对DNA系链(tether)v-tether和t-tether 来模拟天然的系链蛋白,修饰DNA v-tether小型单层膜囊泡 (small unilamellar vesicles,SUV)可以通过疏水作用组装到纳米环上,这样能够和修饰了DNA t-tether 的支持脂质双层(supported lipid bilayers,SBL)组成生物装置来模拟SNARE 蛋白介导的锚定和膜融合的过程[图6(a)],该研究证明了仅仅一两对SNARE 复合物足以诱导膜融合反应的发生。
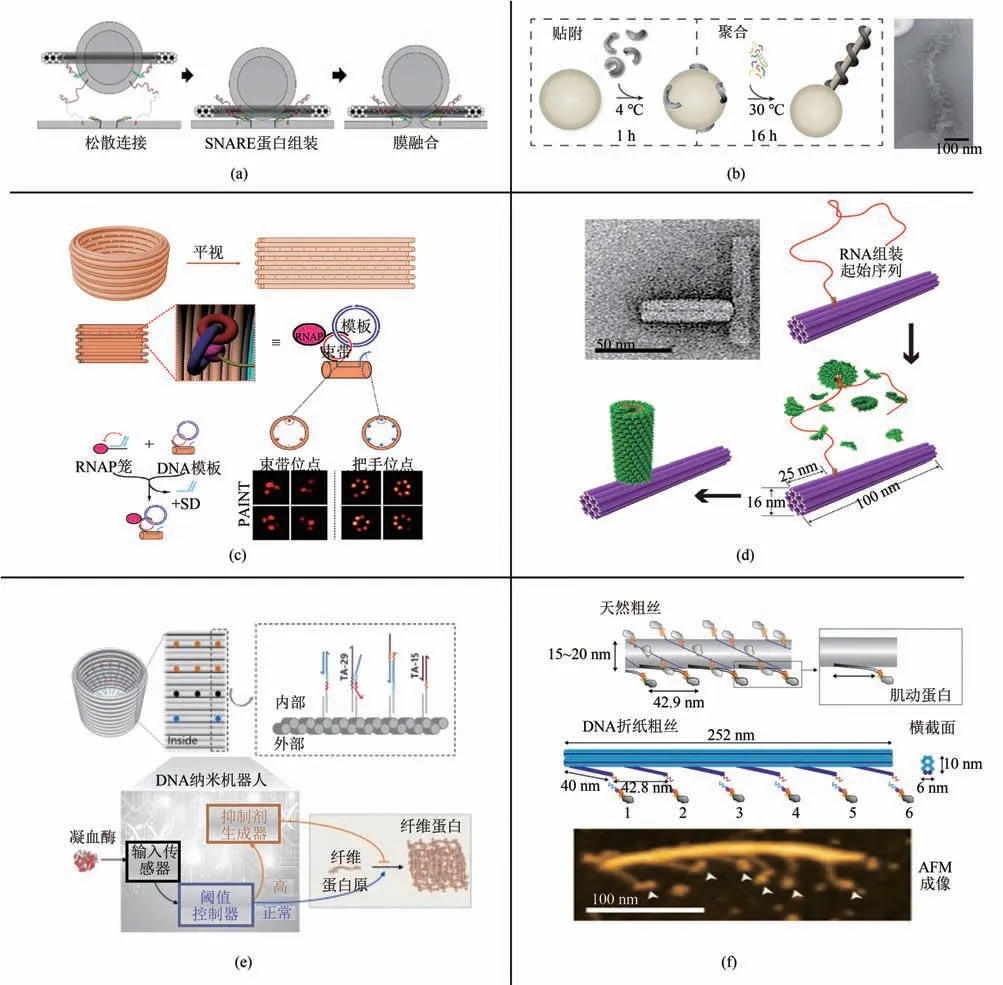
图6 模拟生物过程和生化体系(a)模拟蛋白锚定和膜融合[71];(b)囊泡成管[74];(c)RNA挤出纳米工厂[75];(d)自组装合成衣壳蛋白[52];(e)自主调控凝血系统[77];(f)肌动蛋白运动[78]Fig.6 Mimic king biological reactions and biochemical systems(a)Simulation of SNAREs protein-induced membrane fusion[71];(b)Mimicking BAR protein-induced membrane tubulation [74];(c)Producing RNA in a nanofactory[75];(d)Assembly TMV capsid protein on the DNA template [52];(e)Autonomous regulation of the thrombin dependent coagulation[77];(f)Simulation of the G-actin movement [78]
两片邻近的磷脂膜之间发生磷脂分子的交换传递现象也是一种重要而神秘的生理现象,通常发生在膜接触的部位。为了研究这些特定位点的脂质转运蛋白的作用机理,Bian等[72]构建了DNA折纸结构,可以精确控制两个脂质体之间的距离,并应用该结构研究了突触结合蛋白样线粒体脂质结合蛋白(synaptotagmin-like mitochondrial lipidbinding protein,SMP)结构域的脂质转移,发现脂质转移可以发生在超过SMP 二聚体长度的距离上,符合脂质运输的穿梭模型。
成管过程在细胞内吞、病毒出芽和胞质分裂中扮演着重要的角色。多种膜变形蛋白可以感知并且产生膜曲率,从而帮助细胞膜成管[73]。为模拟动力蛋白(dynamins)和内吞体分选转运复合体(endosomal sorting complex required for transport,
ESCRT)聚合成螺旋结构包裹脂质微管的过程,Grome 等[74]构建了DNA 折纸卷曲(curls)用来诱导大型单层膜囊泡(large unilamellar vesicles,LUV)的成管[图6(b)]。这种DNA 卷曲能够自组装成类似Snf7 的长丝状螺旋结构,并且在其内表面修饰两亲性肽来模拟Snf7的N段ANCHR螺旋用以增强其膜亲和性。
3.2.3 构建生化体系
从工程化的角度看,生物体内部有着各种复杂的生理生化体系负责物质合成、结构组装、信号调控和能量输出等具体任务。利用DNA 纳米技术,模拟生命在体外构建人工体系是非常有趣的方向,不但有助于加深对天然体系的认识,也为诸如人工细胞等复杂仿生体系的构建提供可用模块。
2020 年,Hahn 等[75]设计了一款RNA 挤出纳米工厂(nanofactory),可以对RNA 进行完整的滚环转录和加工。他们构建了外部直径为60 nm 的DNA 折纸桶装结构作为“厂房”,内部“机器”在其中按一定空间构象排列[图6(c)]。内部的“机器”包括:①RNA产生单元,由DNA模板和RNA聚合酶组成,进行滚环转录,平均每30 min 能够产生100 个拷贝的目标RNA;②RNA 加工单元,RNA 内切酶可以进一步将转录产物从聚合体切割为单体,从而使加工效率提高30%。纳米工厂提供了一种RNA 转录和加工的体外模型,用以研究RNA 分子排列对其功能的影响,并且为体外生产RNA以外的其他材料提供了新思路。
为模仿病毒衣壳蛋白的合成过程,研究人员又设计了体外蛋白合成体系,将DNA 纳米结构作为模板,可以在其上杂交RNA 链,用于合成衣壳蛋白并完成自组装。2018年,Zhou等[52]构建了棒状、三角形和三脚架DNA 纳米结构,并将烟草花叶病毒(tobacco mosaic virus,TMV)基因组来源的RNA 链通过锚定位点连接在这些结构上,这段RNA 序列上包含了装配序列的起始段,可以原位介导衣壳蛋白的合成,而衣壳蛋白会自组装为圆柱体结构[图6(d)]。该研究为精确设计并合成DNA-蛋白复合结构提供了新的路径。在此研究的基础上,Zhou 等[76]又设计了动态组装TMV 衣壳蛋白的体系,通过间隔设计锚定位点,可以将TMA-RNA 按照预先设计的方式固定在DNA 纳米结构上,而锚定位点的延长链中包含了可以进行链置换反应的toehold 区域,加入信号链则触发RNA 链的释放,进而能够进行衣壳蛋白的原位组装,若RNA 未成功释放,则组装中止,该体系探讨了实现可编程DNA-蛋白复合结构动态组装的可能性。
凝血系统是高等生物体内非常复杂和达到精致平衡的体系,其调节失衡将导致血栓或溶血两个方向的致命后果。Yang 等[77]利用一种桶状DNA 纳米结构模板(结构部)搭建了一组由凝血酶传感器、阈值控制和凝血抑制剂生成器三个模块组成的自主调控系统(计算部)[图6(e)],可以通过调节传感模块和阈值模块的比例,在模拟生物血浆的环境中实现对抗凝激活浓度的任意调节,并为该体系在不同医疗场景中对凝血酶活性自主调控开启了可能性。
肌小节是肌纤维收缩的基本功能单位,由肌球蛋白构成(myosins),可以自组装成粗肌丝,可以在高度结构化的晶格中与基于肌动蛋白(actin)的细肌丝相互作用。在模拟天然粗肌丝的形态方面,Fujita 等[78]构建了棒状DNA 纳米结构,并将肌球蛋白IIa通过linker连接在结构上,这样可以在有限的空间内直接观察力产生过程中肌动蛋白头部的运动[图6(f)]。他们发现头部扩散时,会与肌动蛋白发生弱相互作用,随后像布朗棘轮一样优先与前部区域紧密结合。在牢固结合后,两级杠杆臂摆动主要在第一步停止,偶尔会反转方向。利用该装置可以实现对多个参数进行精确控制,例如倾斜步数、杠杆角度、弱相互作用的结合和分离动力学,以及空间不对称性。
综上,DNA 纳米组装结构在指导生物大分子组装并构建仿生元件、过程、体系方面有着独特优势,因此DNA 纳米技术在合成生物学领域具有巨大的发展前景和应用潜力。
4 生物医学领域的应用
4.1 药物递送
裸露的治疗药物(包括小分子和生物分子药物),溶解性较低,对酶和化学降解的稳定性较差,具有一定副作用和毒性,且往往难以越过生物屏障,因此大多数时候无法在体内发挥其全部疗效[79]。近年来,DNA 纳米结构由于具有结构可控性和生物亲和性,在开发药物递送方面有非常大的优势,可以用于增加载药量、延长体内循环时间,从而获得更好的疗效[79-80]。
从可控性角度看,具有开关功能的DNA 纳米结构可以在一定条件下打开并释放内容物,因此在药物靶向递送方面有着很大的应用潜力。2012 年,Douglas 等[81]构建的一种逻辑门控的DNA 纳米机器人,可以将负载的分子药物递送给靶细胞。该机器人为六角套筒形的结构,分子药物通过共价修饰连接到结构内部,两对核酸适配体-互补序列分别修饰在机器人前部两侧,组成一套“与”计算的逻辑门控体系,只有当两个核酸适配体都和抗原结合才能打开结构,暴露其中的有效载荷[图7(a)]。
从载药角度,DNA 纳米结构已被成功用于小分子药物、siRNA 等分子的搭载[79]。阿霉素(doxorubicin,DOX)是一种常用的小分子药物,具有抗肿瘤的作用,然而它的脱靶效应会导致心肌损伤,因此选用合适的递送方式非常重要。而DOX 具有插层作用,能够插入到DNA 中并降低其扭转应力[82],并且搭载到DNA 纳米结构上的方式也较为简单[83]。小干扰RNA(small interfering RNA,siRNA)是一个20~25 个核苷酸的双链RNA,主要参与RNA 干扰,可以特异性地沉默靶基因用于基因治疗[84]。siRNA 引起的免疫反应较小,然而最大的问题是体内的稳定性较低,可以利用DNA 纳米结构搭载siRNA 增加其稳定性[85]。siRNA 可以通过与DNA 纳米结构伸出的锚定序列杂交[86-87]连接到结构上。此外,还可以同时在DNA 纳米结构上搭载多种药物进行联合治疗。例如,Liu 等[88]构建了三角形的DNA 纳米结构,同时搭载了肿瘤治疗基因P53 和小分子药物DOX,可用于多药耐药性肿瘤人乳腺癌MCF-7R细胞系的联合治疗,在体内体外均能有效抑制肿瘤增长,且无明显全身毒性。
近年来,研究人员利用不同形状的DNA 纳米结构进行了大量细胞递送研究,例如三角形[88-89]、矩形[87]、棒状[90-91]、纳米管[87]、纳米笼[92-93]、四面体[94-95]、立方体[96-97]、八面体[92]、二十面体[98]等。DNA 纳米结构可以通过内吞途径或非内吞途径进入细胞,内吞途径主要包括吞噬作用、网格蛋白依赖型内吞、小窝蛋白依赖型内吞和巨胞饮[79]。通过加入抑制剂阻断通路的方法可以对结构进入细胞的途径进行探索[94]。然而,细胞摄取DNA纳米结构的具体机制仍有待进一步研究。
影响DNA 纳米结构细胞递送的主要因素包括:细胞类型[99]、结构形状[100]、结构大小[90]、结构刚性[101]、结构稳定性[102]和靶向分子修饰等[103]。因此,可以通过对结构的优化设计达到增加细胞摄取的目的。此外,还可以通过修饰病毒衣壳蛋白增加DNA 纳米结构的细胞递送效率。Mikkilä 等[104]构建了大小为72 nm×92 nm 的矩形DNA 折纸结构,豇豆褪绿斑驳病毒(cowpea chlorotic mottle virus, CCMV) 的 衣 壳 蛋 白(capsid proteins,CP)可以通过静电作用自组装于结构上,并将结构包裹其中,形成DNA 折纸-CP复合体[图7(b)],应用共聚焦显微镜观察结构转染人胚肾293(human embryonic kidney,HEK)细胞,可以发现与裸露的折纸结构相比,DNA 折纸-CP复合物的细胞递送效率提高了13倍。
Perrault 等[105]模拟有包膜的球状病毒结构,构建了直径约50 nm 的DNA 八面体结构(DNAnano-octahedron,DNO),其中脂质修饰的寡核苷酸可以与结构上的48 个DNA 锚定序列杂交,并在结构外部有序排列,随后运用透析法可以诱导生成磷脂膜包裹的DNA 纳米结构[图7(c)]。与无包膜的DNO相比,有包膜的DNO展现出较低的免疫应答和更慢的体内降解速度。

图7 在生物医学领域应用(a)逻辑门控DNA纳米机器人[81];(b)病毒衣壳蛋白修饰DNA纳米结构[104];(c)仿病毒磷脂膜包裹DNA纳米结构[105]Fig.7 Applications in biomedicines(a)Logic-gate controlled DNA nanorobot[81];(b)Viral capsid protein modified DNA nanostructure[104];(c)Virus-inspired membrane-coated DNA nanostructure[105]
DNA 纳米结构可以通过修饰核酸适配体或靶向性配体增加药物的选择性,减少脱靶效应。Ma 等[106]将anti-HER2 核酸适配体加载到四面体DNA 纳米结构上,该结构可以特异性靶向HER2阳性的SK-BR-3人乳腺癌细胞,通过诱导HER2介导的结构内吞和溶酶体降解,从而降低细胞膜表面的HER2表达,最终诱导细胞凋亡,抑制肿瘤细胞生长。Ge等[93]利用靶向配体修饰棒状DNA纳米结构,用于构建抗体-药物结合体(antibody-drug conjugate,ADC),配体2-[3-(1,3-二羧基丙基)-脲基]戊 二 酸(2-[3-(1,3-dicarboxy propyl)-ureido]pentanedioic acid,DUPA)可以与前列腺特异性膜抗原(prostate-specifc membrane antigen,PSMA)结合,将搭载DOX 的ADC 特异性地递送到PSMA阳性的LNCaP人前列腺癌细胞系。
4.2 肿瘤治疗
搭载抗肿瘤药物(如Dox、siRNA 等)进行细胞递送是常用的肿瘤治疗的解决方案,在前面药物递送一节已经做过介绍。除此以外,国家纳米科学中心丁宝全教授课题组利用DNA 纳米机器进行肿瘤血管栓塞和肿瘤疫苗开发,为肿瘤治疗提供了新思路。2018 年,该课题组设计了一种DNA 纳米机器人,可以在检测到肿瘤标志物的部位精确给药[107],在这种DNA纳米管状结构的内部通过小分子交联剂sulfo-SMCC 连接了一定数量的凝血酶,“锁定序列”是靶向肿瘤标志物的核酸适配体,可以特异性识别肿瘤血管标志物核仁素(nucleolin)。在核酸适配体与肿瘤部位的核仁素结合后,结构展开为矩形,凝血酶暴露于血液中,从而诱导血管内的血栓形成和肿瘤坏死。2021年,丁教授课题组又构建了一种管状DNA 纳米结构用以开发肿瘤疫苗[108],其内部装配了相同比例的一种抗原(OVA多肽)和两种toll-样受体激动剂(dsRNA 和CpG DNA),当结构进入抗原提呈细胞(antigen presenting cells,APC)的溶酶体时,pH 的降低使“锁定序列”构象改变,结构展开为矩形,暴露的抗原和佐剂会诱导APC 成熟,诱发强烈的肿瘤特异性T 细胞免疫,疫苗产生的长期T 细胞免疫应答,可以有效地保护小鼠免受肿瘤的再次侵袭。然而,关于DNA 纳米结构应用于药物递送和肿瘤治疗方面的研究目前主要集中于细胞和动物层面,离临床应用还有一段距离,主要有几个方向需要寻求突破:①降低结构成本,实现批量制备;②获得人体产生效应所需剂量;③获得结构人体代谢相关数据;④评估在人体内产生的免疫反应。
5 挑战与展望
综上所述,DNA 纳米结构由于具有高度可设计性、精确可寻址性、生物亲和性等特性,在纳米级别的可控合成方面体现出独特优势,已经成为合成生物学重要的支持技术。本文详细介绍了如何利用DNA 纳米结构进行核酸、蛋白和磷脂的有序装配,从而实现生物大分子在一维、二维或三维的DNA 框架上数量、位置可控的排列;如何利用DNA 纳米技术构建仿生细胞元件、生物过程和生化体系,包括模拟核孔、人工膜通道、网格蛋白等细胞配件,模拟膜融合、脂质转移、细胞膜成管等生命现象,以及构建RNA 合成、病毒蛋白合成、凝血系统等复杂仿生体系;如何利用DNA 纳米结构进行药物递送和肿瘤治疗,并探讨了搭载药物种类、影响递送效率的因素、增加靶向性的方法,以及在肿瘤血管栓塞、肿瘤疫苗开发方面的应用。过去10 年中,DNA 纳米技术领域的发展已经不再满足于从工程学的角度,追求结构设计的新颖性和完善性,而是爆发式地向生命科学和医学应用的方向,提出内在变革与不断进步的要求。在探索实现这些具体需求的过程中,研究者们不断地进行着向自然学习和作用于自然的反复迭代,逐步积累了越来越多的仿生构建和功能化制备的知识与经验,相关成果也为化学生物学、合成生物学、分子医学等领域注入了全新的血液,开启了相当积极的探索。同时,我们也清楚地看到,利用DNA 纳米结构进一步合成、模拟、调控生物体系的过程中仍存在着较多改善的空间,例如:如何在已经组装完成的DNA 纳米结构上,一定程度地恢复和利用DNA 携载遗传信息能力;如何在提高结构设计修饰复杂性的同时,保持人工体系的简洁和生产的高效;如何在保证DNA 纳米结构合成效率的同时,扩大规模生产和降低材料成本;以及如何在细胞内完成结构的生产组装等。这些问题为DNA 纳米技术的发展指出未来研究方向。此外,目前DNA 纳米技术在肿瘤治疗的研究大部分停留在细胞和动物层面,在推进临床转化的道路上仍存在许多亟待解决的问题。例如:如何通过对DNA 纳米结构的合理设计,增加载药量;如何在体液环境中保持核酸结构的稳定性,延长体内循环时间;如何评估结构的免疫原性及反复给药造成的副作用;如何增加靶向性,使得结构在肿瘤部位形成有效聚集;如何通过不同的免疫佐剂修饰,诱发机体免疫应答,进行免疫治疗。事实上,大量的研究正在为上述问题的解决寻求积极途径,例如DNA 纳米结构的成本和规模化制备一直是其产业化发展的瓶颈,利用传统的固相合成法,成本将近180 元/mg,难以进行大规模合成。利用生物自身的合成体系构建生物反应器可能是解决这一问题的突破口。目前的研究已经可以利用噬菌体和DNA 核酶完成结构所需的长、短单链的生产和自组装,可以将产量提升至克级甚至千克级,选择活性更强的DNA 核酶则为效率提升指明了方向。而所有进步都将为DNA纳米技术更好地服务于合成生物学提供助益,随着DNA 纳米技术结构设计、功能优化、规模生产等方面的不断成熟,将有助于打破临床应用壁垒,形成新型产业化结构。

