合成生物学与纳米生物学的交叉融合及其在生物医药领域的应用
郑涵奇,吴晴,李洪军,2,顾臻,2,3,4
(1 浙江省先进递药系统重点实验室,浙江大学药学院,浙江 杭州 310058;2 浙江省系统与精准医学实验室,良渚实验室,浙江大学医学中心,浙江 杭州 311121;3 浙江大学医学院附属邵逸夫医院,普外科,浙江 杭州 310016;4 高分子合成与功能化教育部重点实验室,浙江大学高分子科学与工程系,浙江 杭州 310027)
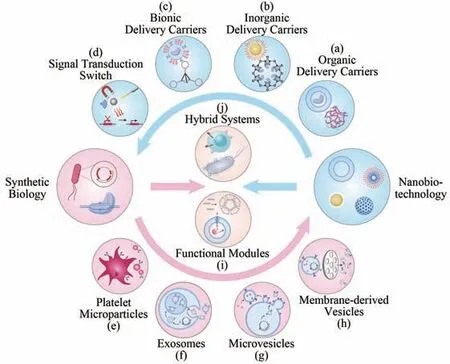
Representative examples for the integration of synthetic biology and nanobiotechnology.Nanotechnology can reinforce the development of synthetic biology by promoting the design and delivery of gene circuits.The delivery of gene circuits can be facilitated by nanocarriers, including organic (a),inorganic(b),and bionic(c)systems.Nanoparticles can convert optical,magnetic,and acoustic signals to thermal signals to regulate gene expression(d).Synthetic biology can extend the applications of nanotechnology through genetically engineering biologic nano-agents.Platelets (e), exosomes(f), microvesicles (g), and membrane-derived vesicles (h) can be programmed through synthetic biology.Synthetic biology and nanobiology can jointly generate functional modules and hybrid systems for artificial biomimetic systems.DNA, lipids, and polymers can self-assemble into functional modules(i),and nanoparticles can be combined with chimeric antigen receptor T-cells and bacteria respectively to form hybrid systems(j).
合成生物学技术通过对生命体进行工程化的设计、改造乃至重新合成,最终创建超越自然功能的人造系统[1]。合成生物学技术已在多个领域产生了重要的影响并实现了应用,包括生命健康、生物医药、农业生产、新型化工、污染治理等领域。合成生物学的研究主要有两种理念的指导:“自上而下”理念是使用代谢或基因工程技术赋予现有生物系统新的功能;“自下而上”理念是以非生命的生物分子组件来从头设计并创建新的生物系统[2]。从“自上而下”的策略出发,合成生物学将复杂的天然生命系统抽象化、解偶联,拆解为标准化的生物元件[3]。通过生物元件的功能化组装,重构为复杂的基因线路以编码细胞的功能,使得合成的生命系统达到预定的目标[4]。目前开发出的锌指蛋白(zinc-finger proteins,ZFPs)、转录激活因子样效应器(transcription activator-like effectors,TALEs)和聚集的规则间隔短回文重复(clustered regularly interspaced short palindromic repeat,CRISPR)等技术,可以用来构建和调控合成基因线路[5]。然而,合成基因线路如何安全高效地递送到特定靶部位、导入特定的细胞是合成生物学研究向临床转化的重要挑战[6]。
纳米生物学技术旨在利用物质在微纳米尺度下具有的独特的物理、化学和生物性质以解决药物递送、疾病诊断和干预等重大生物学问题[7-8]。纳米材料可以通过封装或附着等多种方式[9],帮助以基因线路为代表的合成生物学元件跨越多重生理屏障有效到达靶标位置。同时纳米材料所具有的独特的化学、机械、磁、电和生物特性[10],能够实现对信号的响应以达到体内外行为的可控。然而,传统的纳米材料生产主要基于物理、化学方法进行,且常使用的溶剂和修饰分子往往带来生物安全性方面的隐患[11]。近年来,以生物为中心的纳米材料生产展现出环保、生物活性好、毒性相对较小的优势。除了采用基因工程生物如转基因菌株、酵母、烟草花叶病毒等作为生物工厂合成纳米材料[12]之外,以细胞为来源衍生出的纳米囊泡、纳米颗粒生物相容性高,也被广泛用于新型纳米制剂的研发[13]。生物源性纳米材料在基因工程的助力下可以被自主设计和改造[14],为其生物应用带来突破。
鉴于合成生物学和纳米生物学各自的特色与需求,两者的融合是学科发展的一大趋势。自然界中许多复杂的生物功能由自组装功能单元的共价或低聚组合进化而来。相应地,基于合成生物学“自下而上”的理念,从尽可能小的组分(包括DNA、蛋白质和其他有机分子等)出发,可以构筑全新的生物功能组件模块,从而创建完全可操作的生物系统[15]。同时,自下而上的自组装方法也是纳米生物学中的重要技术手段[16],可以在纳米尺度上创造新的器件,模拟或强化生命体的特定功能。因此,在合成生物学策略指导下,通过自组装方式获得具有生物催化或触发响应功能的模块化纳米组件,实现对酶促反应隔室化和外界刺激响应性等活细胞特征的仿生,可为人造细胞的构建提供新的设计思路[17]。此外,将纳米器件和合成生物学改造后的底盘生物(如嵌合抗原受体T细胞、工程化细菌等)结合形成的纳米人工杂合系统,可以发挥双重功效,实现生物学功能的进一步优化和可调控。
综上,本文讨论了合成生物学和纳米生物学的交叉融合以及在生物医药领域中的近期实践。一方面,两者可以互相借鉴对方学科的特色,以促进自身突破性发展:①纳米技术可以助力应对合成生物学发展中的一些挑战,利用纳米载体能靶向性地递送基因线路和基因编辑体系,也可以实现用外部物理刺激来启动基因开关;②合成生物学基因编辑手段可以改进生物源性纳米制剂的性能,扩展细胞膜囊泡和工程化细胞的应用场景。另一方面,合成生物学和纳米生物学的融合可以拓展研发思路:①以“自下而上”的理念为指导,以核酸、蛋白质、无机材料、有机聚合物等为材料,构筑出模块化的纳米级功能组件,来模拟细胞功能;②将纳米功能元件整合到合成底盘生物模块中,构建纳米人工杂合生物系统,结合两个学科的优势,为肿瘤等重大疾病的治疗和诊断提出新的策略。
1 纳米技术为合成生物学的发展赋能
1.1 纳米技术助力基因线路与基因编辑体系递送
病毒载体已经被广泛应用于递送基因线路和CRISPR/Cas9等基因编辑系统,包括腺相关病毒载体(adeno-associated virus, AAV)[18-21]、腺 病 毒 载 体(adenovirus,AV)[22]和慢病毒载体(lentivirus,LV)[23]等。AAV 所 能 包 封 的 基 因 容 量 有 限(约4.5 kb);LV 虽然包封基因的容量较大,但易整合到宿主细胞基因组,可能诱导插入突变;AV 不整合入基因组,但有高免疫原性[24]。病毒载体安全性方面的不确定性制约了其在基因工程中的推广应用,鉴于此,非病毒载体近年来引起了越来越多的关注。
纳米技术的进步,为实现基因线路和基因编辑系统的多样化、靶向性递送和可控性释放提供更多的选择。CRISPR/Cas9系统的递送包括三种策略:递 送CRISPR/Cas9 的 质 粒[25],递 送Cas9 mRNA-sgRNA[26],以及直接打包递送sgRNA 和Cas9 蛋白[27-28]。非病毒的合成纳米载体不仅可以帮助带负电的质粒DNA、RNA 进入细胞,也使携带Cas9等蛋白[29]穿过细胞膜成为可能。
目前已研发出的靶向递送基因和基因编辑系统的纳米载体种类涵盖了有机载体、无机载体和生物仿生载体等新型功能化纳米载体。
1.1.1 有机纳米载体
脂质体、脂质纳米颗粒(lipid nanoparticles,LNPs)等已经被广泛用作载体来递送mRNA[30-31]和CRISPR/Cas9 系统。由于核酸携带有高密度的负电荷,阳离子脂质体是一种常见的非病毒基因递送载体[32]。虽然Cas9 蛋白是正电性的,不能直接通过静电相互作用和阳离子脂质体结合,但Cas9/sgRNA 核糖核蛋白(ribonucleoprotein,RNP)是负电性的[33],可以用阳离子脂质体装载递送Cas9-sgRNA RNP[34]。基于卵磷脂[35]等两性离子脂质[36]、可电离脂质[37-38]的载体也被用于递送CRISPR/Cas9 系统,促进细胞内涵体逃逸。然而,基因组编辑蛋白的不稳定性、较差的膜渗透性和从内涵体中释放的低效率[39],都对纳米递送载体提出新的要求。对脂质进行功能化修饰有望提供帮助。比如已经报道的含有二硫键的生物可还原脂质纳米颗粒[40-41]可响应还原性细胞内环境,增加内涵体逃逸,实现mRNA 和Cas9/sgRNA RNP的高效递送。转铁蛋白修饰的脂质体结合了肿瘤靶向潜力和优异的基因递送性能,进一步拓宽了靶向基因治疗的潜力[42]。
传统的LNPs 由可电离的阳离子脂质、两亲性磷脂、胆固醇和聚乙二醇(polyethylene glycol,PEG)-脂质组成[43],改变调节脂质成分,有望实现选择性器官靶向(selective organ targeting,SORT)策略。通过加入不同物质的量的SORT 脂质(永久阳离子、阴离子、两性离子和可电离的阳离子等),可以实现基因和编辑体系的组织特异性递送(如肺、脾和肝脏靶向)和多样性递送(包括mRNA、Cas9 mRNA/sgRNA 和Cas9 RNP 复合物等形式)[43][图1(b)]。
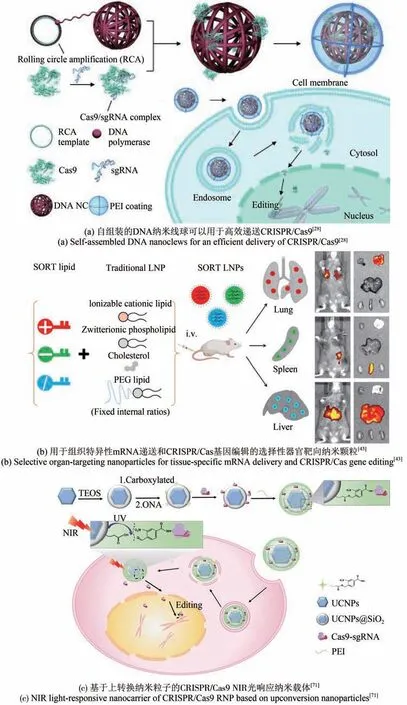
图1 纳米技术助力基因线路与基因编辑体系递送Fig.1 Nanotechnology enhances the delivery of gene circuits and gene editing agents
高分子聚合物是另一类常用的基因递送纳米载体。许多阳离子聚合物,如聚乙烯亚胺(polyethylenimine,PEI)[44]、聚赖氨酸[45-46]、聚胺树枝状聚合物[47]、聚(β-氨基酯)[48]、聚[2-(二异丙基氨基)甲基丙烯酸乙酯][49]、聚环氧丙烷[50]、氟化酸不稳定支链富羟基聚阳离子[51]、乳糖衍生的支链阳离子生物聚合物[52]等都用作CRISPR 系统的纳米递送载体。对聚合物进行修饰和组合有助于提高递送性能。基于阳离子α-螺旋多肽的聚乙二醇化纳米颗粒具有较高的膜穿透能力[53];由含有二亚乙基三胺部分的单体和含有胍基配体的单体共聚得到的聚(二硫化物)可递送不同形式的CRISPR/Cas9系统,实现递送目标的高效释放,并且能生物降解,减少细胞毒性[54];门控式的嵌段共聚物囊泡也展现出了出色的递送效率和触发响应性释放性能[55]。针对恶性肿瘤的标志物基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2),也开发出了由MMP-2 底物、细胞穿透肽和外层PEG 功能化的聚合物纳米颗粒和胶束,它们在肿瘤部位积累后,由肿瘤过表达的MMP-2 触发降解含MMP-2 底物的外壳,暴露出细胞穿透肽,提高质粒[56]、CRISPR/dCas9[57]和siRNA[58]的肿瘤转染效率。此外,Chen等[59]还开发出具有核壳纳米结构、脂质体模板化的水凝胶纳米粒子,Li 等[60]用氟化聚合物开发出多功能、核靶向的核壳结构人工病毒用于基因编辑系统递送。
相较于其他纳米载体,有机纳米载体走在了临床转化的前列,但也面临一些挑战,比如,与其他载体类似,一些载体中携带的正电荷会引起细胞毒性和“蛋白冠”的形成,使得体内清除加快[61]。其在体内的生物学命运也亟待进一步探究和优化[62]。
1.1.2 无机纳米载体
金纳米粒(gold nanoparticles, GNPs)具有制备可控、易功能化以及较好的生物安全性特征[63],是基因线路和基因编辑系统的一种潜在的递送平台。金纳米粒、金纳米团簇[64]可以将Cas9蛋白-sgRNA 共同递送到胞内[65-67],具有双链DNA支架和MMP-2可切割肽修饰的金纳米笼[68]也可以将siRNA 和化疗药联合靶向递送。Shahbazi 等[69]开发的一种基于胶体金纳米粒子的CRISPR 纳米制剂,封装了所有需要的基因编辑组件,可进行同源定向修复,有望成为不同细胞或组织中的有效递送载体。
金纳米粒子独特的光热转换性能,使其能够响应外界刺激,用于基因的可控释放。Wang 等[70]报道一种递送Cas9-sgRNA质粒的脂质-金纳米颗粒载体。在激光照射下,金纳米粒产生光热效应,触发释放细胞穿膜肽(TAT肽)及其上面静电吸附的质粒,并且TAT 肽-质粒复合物具有进入细胞核编辑目标基因的能力,从而实现激光控制的质粒靶向递送。镧系元素掺杂的上转换纳米粒子(upconversion nanoparticles, UCNPs)也被开发为光响应的Cas9 RNP 复合物触发递送平台。UCNPs作为纳米传感器,可以将近红外(near-infrared,NIR)光转换为紫外光,用于光敏分子的裂解,从而可控释放CRISPR/Cas9[71][图1(c)]。
自组装纳米级金属-有机框架(metal organic frameworks,MOFs)作为一类新型的药物递送系统,可以封装并递送基因[72]和CRISPR/Cas9系统[73]。沸石咪唑骨架(zeolitic imidazolate frameworks, ZIFs)具有多孔结构,可实现胞内递送核酸和蛋白质,其通过功能化修饰能进一步实现Cas9-sgRNA RNP的pH 响应性[74-75]和ATP 响应性[76]释放。其他无机材料,如石墨烯氧化物[77]、介孔二氧化硅颗粒[78-79]、黑磷纳米片[80]、磷酸钙[81]等也可介导Cas9 RNP的递送。
通常,这些无机材料纳米粒子化学稳定性好,但在肝脏和肾脏中易积累,在体内难以降解[82],它们的临床应用因而往往受到毒性和残留物评价方面的挑战[83]。
1.1.3 生物仿生纳米载体
生物仿生纳米材料具有较好的生物相容性,同时具有独特的生物学功能,也被开发为基因线路等合成生物学元件的递送系统。
天然膜衍生的纳米囊泡[84]、细胞外囊泡[85-86]、DNA 纳米线球[28]、病毒样颗粒[87-88]等功能化的生物仿生材料可用于基因及编辑系统的靶向递送。超声处理间充质干细胞(mesenchymal stem cells,MSCs)得到的纳米囊泡[84]保留了MSCs对多种肿瘤细胞的表面相关靶向能力,将编码治疗基因的质粒cDNA有效地靶向并且转染多种癌细胞,显著延长了荷瘤小鼠的生存期。细胞外囊泡(外泌体和微泡)及其经过嵌合抗原受体修饰、杂合处理等方法改造得到的载体也被用于siRNA[86,89]和CRISPR/Cas9 系统(质粒、sgRNA+dCas9 表达载体、RNP)[85,90-92]的递送。
自组装的DNA 纳米结构具有生物相容性高、易于设计等特性。Zhuang 等[93]设计了连接有DNA 适配体的四面体DNA 纳米结构(tetrahedral DNA nanostructures, TDNs),将TDNs 修饰到细胞外囊泡表面,实现Cas9 RNP 特异性靶向癌细胞。Han 等[82]直接用DNA 四面体 纳米笼 实 现siRNA 的递送。Ren 等[94]设计一种自组装寡核苷酸纳米载体装载siRNA 作为“钥匙”,同时引入两种与细胞表面受体结合的适配体作为“双锁”,介导siRNA 精确递送到特定靶细胞中。Sun 等[28]通过滚环扩增制得纱线状的DNA 纳米线球[图1(a)],与sgRNA 部分互补。载有Cas9/sgRNA复合物的DNA 纳米线球还包被了阳离子聚合物PEI 的涂层,帮助诱导内涵体逃逸,可以有效将Cas9/sgRNA 复合物递送到细胞核。基于病毒衣壳的仿生纳米颗粒也可以帮助CRISPR 系统的递送。Cas9/sgRNA RNP 能被包装成病毒样颗粒[87-88],实现高效的基因组编辑并有助于减少脱靶。
生物仿生纳米载体的临床转化也受到一定的挑战。比如,细胞膜衍生纳米囊泡和细胞外囊泡等携带有供体细胞的信息,每个制剂的免疫原性和生物相容性需要详尽评估[95],放大生产的稳定性和批次间均一性也是有待解决的重要问题[96]。
表1 列出了用于基因线路/编辑体系递送的典型载体。

表1 用于基因线路/编辑体系递送的典型载体Tab.1 Representative carriers used for delivering gene circuits/genome editing systems
1.2 纳米器件作为信号转导中介以调控基因表达
在合成生物学中,通过基因线路的设计实现基因的受控表达,有助于发展出更精准、智能的药物治疗和基因治疗方式。在基因线路中,合成基因开关能够接收并处理输入信号,产生特定的输出[97]。目前已经开发出多种转录基因开关和转录后基因开关,可在不同水平上进行基因表达的干预和调控[97]。通过内部环境刺激诱导基因开关的状态变化可以实现自发响应,但容易导致基因开关处于不可逆的状态[98]。光、声、热、磁等外部刺激可以根据需要而施加,易于操控,但缺乏空间控制的精确特异性[99]。引入纳米粒子作为外部信号传导的载体,可以将光、磁等信号转换为能被基因开关识别的输入信号,进而实现基因表达的时空控制。
磁信号可经纳米粒子转换为热信号。Tang等[100]报告了一种热诱导基因表达系统,在交变磁场下由Mn-Zn 铁氧体磁性纳米粒子产生热能,用于激活热诱导基因表达β-半乳糖苷酶。Ortner等[101]将磁性纳米粒子和含有诱导型热休克启动子元件的细胞封装成可植入胶囊[图2(a)],施加外界交变磁场使磁性纳米粒子在胶囊内产生局部高热,诱导表达荧光素酶报告基因,并减少热量对植入部位其他细胞的影响。Yamaguchi 等[102]也利用磁铁矿纳米颗粒作为基因开关,用于癌症治疗。
除了磁、热信号之间的转换,纳米系统还可以联系起光、热信号。基于此,Lü等[103]开发了一种吸收NIR 光的树枝状半导体聚合物(dendronized semiconducting polymer, DSP),将其作为光热纳米载体[图2(b)]。由热休克启动子调节的基因和DSP 形成纳米复合物,在被细胞内化后,基因从复合物中释放进入细胞核,留在胞质中的DSP 在NIR光照射下产生热量,刺激热休克因子单体转变为三聚体并易位到细胞核,与热休克元件结合继而启动基因表达。Wang 等[104]则使用光热响应共轭聚合物纳米粒子作为传感器,在NIR 光照射下

图2 纳米器件作为信号转导载体以调控基因表达Fig.2 Nanodevices serve as signal transduction carriers to regulate gene expression
以较高的空间和时间分辨率远程控制细胞内基因表达。金纳米粒子也可以吸收特定波长光的光能并将其高效地转化为热能[98,105]。Aratboni 等[98]设计了构象受温度诱导变化的RNA 温度计作为基因表达调控元件,以金纳米粒子作为热源,用LED光进行光热触发生产蛋白质。
2 合成生物学成为助力纳米技术应用的新引擎
在合成生物学构筑生物元件、组装基因线路的需求驱使下,众多基因工程工具被开发出来。运用这些工具对自然存在的生命体进行改造和编程,可以制造出更精妙的生物源纳米制剂。经过基因工程化的细胞膜纳米囊泡等表现出更优的靶向性和免疫治疗能力,在药物靶向递送和联合免疫治疗中具有广阔的应用前景。
天然细胞或细胞膜衍生的纳米囊泡,如细胞外囊泡(包括外泌体、小型微囊泡)和细胞膜衍生纳米囊泡[106],在生物医学领域颇具应用潜力。与体细胞具有相似膜结构的细胞膜衍生物容易被识别为“自我”而不易被清除[106]。由于膜蛋白会对纳米囊泡的功能产生决定性影响[107],用合成生物学手段将细胞膜纳米囊泡修饰上定制的膜蛋白,可以实现不同的功能。
外泌体本质上是多泡核内体(multivesicular endosomes, MVEs)成熟过程中,由核内体膜向内出芽而形成的腔内囊泡,在MVEs和细胞表面融合后分泌到细胞外[108]。相比传统的纳米颗粒,天然外泌体具有丰富的膜蛋白、高生物相容性和低免疫原性,是一种独特的纳米制剂[109]。通过基因工程方法改造细胞,可以获得携带治疗性分子[如PD-L1(programmed death-ligand 1)[110]、NF-κB抑制剂[111]等]的外泌体。利用工程化外泌体的靶向能力和尺寸效应,可以实现高效的疾病治疗。Kojima等[112]受合成生物学启发,设计了一种外泌体生产细胞,能高效地生产定制化外泌体,包装并实现mRNA的脑内靶向递送。Morishita等[113]对B16BL6 肿瘤细胞进行基因工程改造,使细胞生成的外泌体既含有肿瘤抗原,又容易修饰上免疫刺激性CpG DNA[图3(a)],作为肿瘤抗原-佐剂共递送系统用于癌症免疫治疗。此外,Shi 等[109]开发了双重靶向T 细胞CD3和乳腺癌细胞HER2受体的外泌体,相比双特异性抗体而言表现出更好的乳腺癌免疫治疗效果,合成多价抗体的重定向外泌体(synthetic multivalent antibodies retargeted exosome,
SMART-Exo)也有望成为下一代免疫纳米药物的平台技术。综上,基因工程化细胞外泌体可实现靶向药物递送、抗原佐剂呈递,也可诱导免疫效应细胞和靶细胞间的相互作用。
小型微囊泡,直接由天然细胞膜向外出芽形成[108],可以反映原始细胞所携带的抗原含量[106]。受此启发,通过基因工程改造原细胞,随后以出芽的方式仿生合成带有稳定高表达膜蛋白的微囊泡[114],在智能递送系统中展现出较大的潜力。病毒抗原、病毒特异性受体和病毒融合蛋白都可以在细胞膜上工程化过表达,出芽产生模拟病毒的纳米囊泡,用于疫苗呈递抗原[115]、抗病毒感染[116]以及递送生物活性的大分子[117]。Zhang等[117]利用水泡性口炎病毒G 蛋白(vesicular stomatitis virus G protein, VSV-G)的融合活性制备可编程的细胞外囊泡(gectosomes),通过分裂的绿色荧光蛋白(green fluorescent protein, GFP)互补系统来主动装载生物活性蛋白,减少其他胞内蛋白的非特异性封装,并实现大分子向细胞内的高效递送[图3(b)]。Lü 等[118]通过基因工程手段将靶向配体嵌入到细胞膜,从供体细胞衍生出生物工程细胞膜纳米囊泡,可用于递送溶瘤病毒并使其逃避机体的先天免疫反应,增强对肿瘤细胞的靶向递送,为肿瘤病毒疗法提供新思路。不仅如此,在细菌中,革兰氏阴性菌也从外膜产生细菌外膜囊泡(outer membrane vesicles,OMVs)[119]。类似前文所述,OMVs 也可以基因工程化后作为疫苗[120]、用于癌细胞靶向siRNA 递送[121]和肿瘤免疫治疗[122]。如Li 等[122]报告了表面插入PD-1(programmed death-1)的基因工程化OMVs,保护T 细胞免受PD1/PD-L1免疫抑制的影响,显著提高抗肿瘤功效。
细胞膜通过挤出、超声等方式获得的纳米囊泡,或将细胞膜包裹在合成核表面制成的纳米颗粒,业已成为人们关注的仿生治疗平台[123-125]。装载药物,或携带有靶向受体、抗体的细胞膜衍生纳米囊泡逐渐发展成为颇具潜力的制剂[126-129]。Zhang等[128]构建了表面展示PD-1受体的细胞膜衍生纳米囊泡,并加载了吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase, IDO)的小分子抑制剂1-甲基-色氨酸(1-methyl-tryptophan,1-MT),在阻断肿瘤细胞表面PD-L1 的同时,克服肿瘤细胞和树突状细胞(IDO+DCs)过表达的IDO 对效应T细胞的抑制作用[图3(c)]。

图3 基因工程化的生物源纳米制剂Fig.3 Genetically engineered biological nano-agents
除了从离体细胞中获得仿生纳米制剂外,也可以利用细胞原位释放亚微米级颗粒的特性开发先进的药物递送系统[130]。例如,血小板作为血管损伤的监测器,可以积聚到肿瘤手术伤口[131],并在原位被激活,释放出约200 nm 的血小板微粒(platelet microparticles, PMPs)[130,132]。表面缀连PD-L1抗体的血小板被证明能以血小板微粒的形式释放PD-L1抗体,用于癌症免疫治疗[133-134]。Zhang等[131]对 血 小 板 的 前 体 细 胞—— 巨 核 细 胞(megakaryocyte, MK)进行基因工程改造以表达PD-1,并在体外产生表达PD-1 的成熟血小板。血小板靶向手术伤口内的肿瘤细胞,激活产生带有PD-1的PMPs,阻断肿瘤细胞的PD-L1,逆转CD8+T细胞耗竭,从而抑制肿瘤术后复发[图3(d)]。MK细胞同样可以经基因编程后过表达PD-L1,产生免疫抑制性血小板,抑制自身反应性T细胞,用于逆转高血糖非肥胖糖尿病(non-obese diabetic,NOD)小鼠的新发1型糖尿病[135]。
利用合成生物学技术进一步编程仿生系统,可使其能够主动感知体内信号并自主生产纳米载体,以应对需要持续给药治疗的疾病,从而能进一步拓展纳米技术的应用潜力。
3 合成生物学和纳米生物学融合发展
3.1 模块化的纳米功能组件
合成生物学提供了一个定制化的框架来实现功能化组件的构建、组合,并将其封装成合成生物系统[15]。从工程学思路出发,合成生物学家将复杂的“系统”分解为独立的“设备”集[3],提供标准生物功能化组件的工具包,使得它们像搭积木一样易于建模和组合使用。合成生物学的模块化特性与纳米载体的构筑非常匹配适应[136]。核酸、蛋白质、有机聚合物、无机材料[137]等可以作为建筑材料,自组装搭建成纳米级合成隔室、纳米反应器等组件[138]。这些模块化的功能组件不断扩充合成生物系统的工具包,可以用作药物递送的仿生控释载体,甚至构建人工细胞。
对DNA的操纵改造,除了通过DNA重组构建起定制化基因线路、使细胞表现出定制的生物功能之外,也可以将DNA本身用作自组装构建材料。DNA 能以高度严格的碱基配对制造出特定的纳米结构[139]。传统的DNA自组装主要以小的构筑模块形成大的结构,如拼贴组装形成的四面体、DNA纳米笼等独立结构,以及基于DNA 瓦片的无限网络结构[140]。DNA 折纸的提出为DNA 自组装引入新的活力,它以一条长的单链DNA 为支架,以数百个定制的短单链DNA 为订书钉来折叠支架形成特定的形状,表现出更强大的构建复杂、不规则结 构的能力[141]。通 过DNA 折纸 和DNA 砖块[142]等技术构建出的框架核酸,具有高度可编程性和可寻址性的优势[143-144],可以作为药物智能释放[145]、疫苗精确接种[146]和生化反应[147]的平台。如Li等[145]通过DNA 折纸构建的智能DNA 纳米机器人已经被用于精准药物递送,可以将活性凝血酶保护,精确递送至肿瘤后再暴露出来。Liu 等[146]开发的管状DNA 纳米器件疫苗可以有效递送抗原和佐剂,并在抗原呈递细胞的溶酶体内响应pH而暴露,以激活强烈的免疫反应。为组装更大尺寸(微米)的DNA 结构,Yao 等[148]开发了一种六螺旋DNA 折纸束作为元DNA(Meta-DNA)进行构建,此策略有望用于定位可编程的功能组件。
蛋白质也可以自组装为蛋白质纳米笼、病毒样颗粒等结构,用于靶向递送、疫苗设计[149-150]和生物传感[151]。细菌微区室是一种自然进化的可封装蛋白质,可以用遗传技术实现在细菌体内的封装,构建纳米生物反应器,模拟细胞器[152]。脂质、聚合物等经过定向合成和修饰,也可以构筑出仿生的隔室,开发成一系列生物催化纳米反应器、触发响应型纳米囊泡等功能组件,从而进一步形成仿生细胞器或药物递送系统。Edlinger等[153]将基因工程改造的通道膜孔蛋白引入聚合物囊泡作为生物阀,构建一种pH 响应性的生物催化纳米隔室[图4(a)],根据外部环境pH 的刺激可逆地开/关阀门,允许底物分子流入加载酶的隔室而触发反应。Yu等[154]用缺氧和H2O2双敏感两嵌段共聚物自组装形成的纳米囊泡包装葡萄糖氧化酶和胰岛素,可以实现血糖响应型囊泡解离和胰岛素释放。在此基础上,多室结构“囊泡嵌囊泡”的仿生人工胰岛细胞(artificial beta cells,AβCs)被构建出[图4(b)],外部大囊泡(outer large vesicle, OLV)模拟质膜,内部小脂质体纳米囊泡(inner small liposomal vesicles,ISVs)装有胰岛素模拟成熟β细胞内的储存颗粒[155]。该系统配备了与葡萄糖相关的代谢系统,并具有pH 可控的膜融合机制,作为一种仿生胰岛素递送系统,有效地应对高血糖。
除了利用脂质、聚合物等合成多隔室囊泡来模拟生命的简化特征外,无机材料也可以组装成纳米反应器,并模拟在多个连续的隔室中发生的酶促级联反应[156-157]。酶促反应的多隔室化是生命体的一个重要特征,它允许细胞实现酶促生化反应的精密控制与时空分离[158]。在合成实体中,将酶促级联反应限制于合成“模块”中,每个模块负责单独的反应,模拟交互式级联代谢,是合成生物学构建复杂的人工细胞的一项重要挑战[159]。Jo等[159]在油包水型微乳液中,用氨丙基三甲氧基硅烷(aminopropyl trimethoxysilane,APTMS)和酶的偶联反应以及溶胶-凝胶缩聚反应,合成了共价封装三种酶(β-葡萄糖苷酶、葡萄糖氧化酶和辣根过氧化物酶)的二氧化硅纳米粒子,作为酶促纳米反应器[图4(c)],封装酶的二氧化硅纳米粒子进一步被限制于乳液的液滴中,组成了多隔室的仿生交互式级联网络。
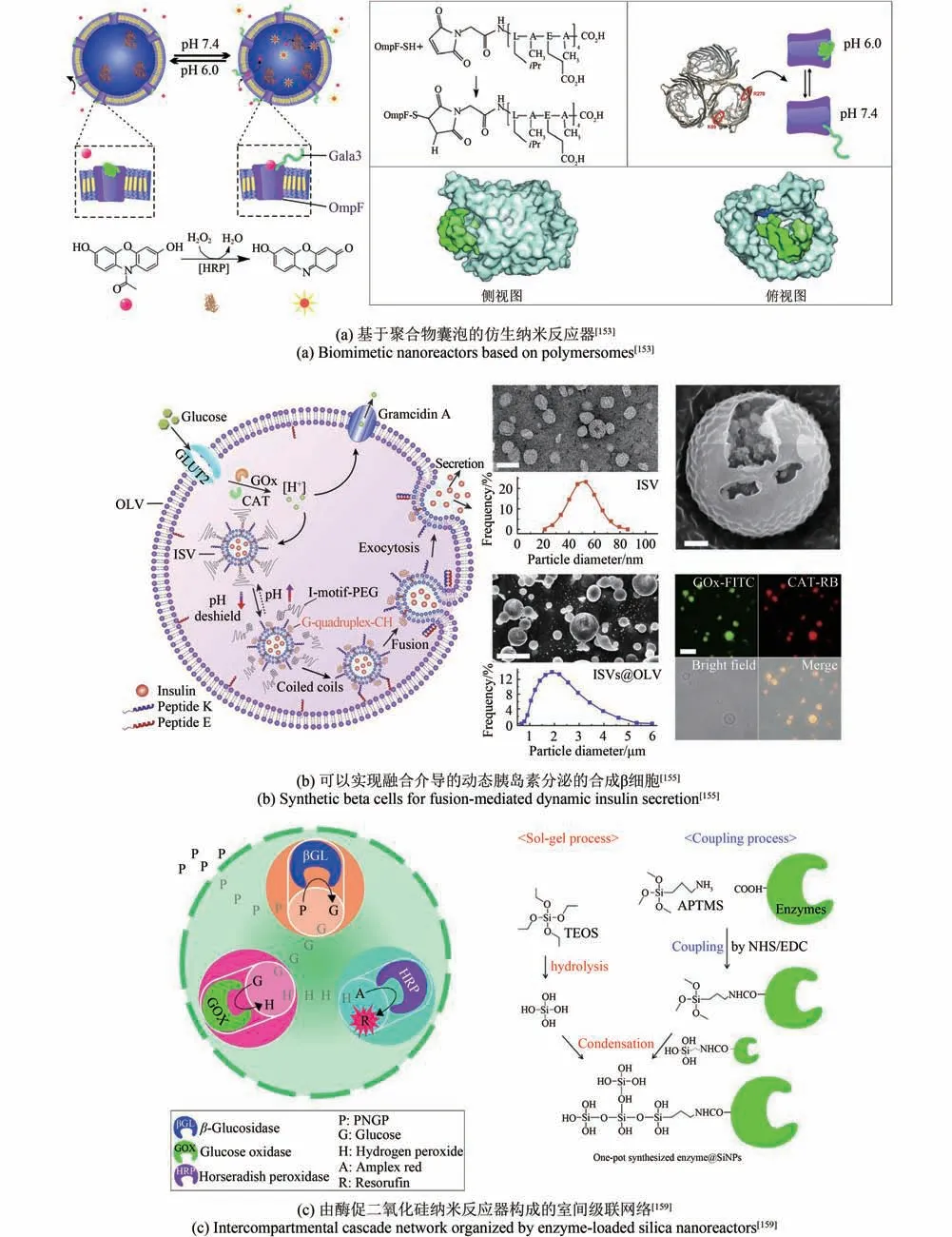
图4 模块化的纳米级功能组件Fig.4 Nanoscaled modular functional components
综上,一系列纳米功能组件的构建,为整合封装多种功能模块,从而模拟复杂的生命系统创造了众多机会[17]。
3.2 纳米人工杂合系统
通过纳米元件和底盘生物模块的定向精准组装,可构建结构和功能可控的纳米人工杂合生物系统,包括纳米杂合工程化菌株、嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)等。一方面,工程化的底盘生物具有帮助靶向递送纳米药物的能力;另一方面工程化底盘生物和纳米功能元件联合,构建出体内外运动行为高度可控的工程化杂合生物系统,能够发挥双重疗效,或用于成像和体内跟踪。
3.2.1 “工程化细菌-纳米”杂合系统
一些特定的细菌可以特异性靶向肿瘤病灶,自驱动穿透低氧的肿瘤组织[160],同时显著减少对正常组织的损伤。基于其独特的能力,可以将细菌作为一种理想的抗癌制剂。由于细菌的基因已经很容易被操纵,通过合成生物学方法改造,产生能自主推进、响应外界信号、感知局部环境并可以从外部检测到的工程化细菌,成为一种备受关注的肿瘤治疗策略[161-163]。随着纳米技术的发展,将细菌疗法、合成生物学技术和纳米技术交叉融合,构筑的功能集成的“工程化细菌-纳米”杂合系统,可以用于肿瘤精准治疗:一方面,工程化细菌可以高效、靶向、可控地运输纳米药物[164],或实现肿瘤可视化生物成像[165];另一方面,纳米颗粒改性的工程菌可以作为生化反应平台,实现不同肿瘤疗法的联合[166]。
纳米药物治疗癌症的疗效与药物在肿瘤内分散的浓度有关。纳米颗粒全身给药后向肿瘤的递送、纳米治疗药物在肿瘤内的血管外转运会受到一些物理和生物屏障的限制,肿瘤微血管网络高度不规则的结构、肿瘤内较高的间质液压力等阻碍了纳米载体的被动扩散,进而阻碍了对肿瘤的治疗[167-168]。细菌能在瘤内渗透,可以被用来将纳米治疗药物特异性靶向肿瘤,并有效地输送到难以从循环进入的部位[168];经过改造的趋磁性细菌可在外界控制下进一步实现在瘤内的定向迁移[162]。细菌的深层组织穿透性,还助力肿瘤定位和成像技术的拓展。由于人体组织对光的高度屏障作用,常用的光学成像技术在深部组织中应用的性能不佳。Bourdeau等[165]在细菌中引入编码纳米气体囊泡的工程基因簇,作为超声波的报告基因,可进行超声造影[图5(b)],提供了一种在哺乳动物体内深处可视化的方法,有望促进肿瘤诊断和治疗的发展。表2 列出了代表性的工程化细菌-纳米组件杂合系统。

表2 代表性的工程化细菌-纳米组件杂合系统Tab.2 Representative hybrid systems of engineered bacteria and nanocomponents
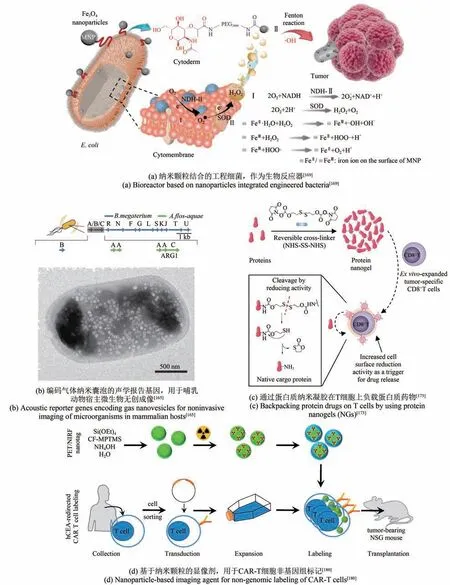
图5 纳米人工杂合系统Fig.5 Biological chassis hybrid systems engineered at nanoscale
以细菌为平台还能汇聚多种肿瘤治疗策略。工程化细菌经过纳米颗粒杂合修饰后,可以完成光、热信号转化,从而实现生化反应[169]、光控细菌代谢物疗法[161]、光热疗法[160]、光动力疗法[166]等的联合。Fan 等[169]用质粒构建了具有呼吸链酶Ⅱ(NDH-Ⅱ)过表达的大肠杆菌,并在表面修饰磁性Fe3O4纳米粒子,实现在原位催化Fenton 样反应[图5(a)],产生过氧化氢诱导肿瘤死亡。Chen等[160]开发了载有吲哚菁绿(indocyanine green,ICG)的纳米粒子作为纳米光敏剂,利用基因工程化鼠伤寒沙门氏菌YB1 的缺氧靶向能力将纳米粒子递送入肿瘤缺氧核心,在NIR 激光照射下实现高效光热治疗。Deng 等[166]改造了表达过氧化氢酶的大肠杆菌,结合聚多巴胺的光热转换能力和二氢卟酚e6(chlorin e6,Ce6)的光敏作用,实现细菌的肿瘤靶向和光热疗法、光动力疗法的联合。
3.2.2 “CAR-T细胞-纳米”杂合系统
在工程化细胞领域,T 细胞经过基因工程改造得到的CAR-T 细胞,为癌症免疫治疗带来了新的活力[171]。虽然CD19 特异性CAR-T 细胞已经被美国FDA 批 准 用 于 治 疗B 细 胞 恶 性 肿 瘤[172],但CAR-T 在对实体瘤的治疗上遇到了重重阻碍:对实体瘤较低的浸润效率、肿瘤中存在的大量免疫抑制性细胞以及细胞因子等形成的免疫抑制性微环境[171]。功能性纳米材料为增强CAR-T 细胞对实体瘤的治疗效能提供新的思路,将纳米材料与CAR-T细胞杂合构建的生物系统,可以促进CAR-T在实体瘤中的浸润,提高肿瘤杀伤的疗效;也用于成像技术,跟踪检测CAR-T的组织分布和去向。
载有治疗药物、佐剂的纳米载体杂合到CAR-T细胞表面,能将辅助药物递送和T 细胞活化相偶联,增强CAR-T 细胞的肿瘤治疗效力。Tang 等[173]将装载大量人IL-15 超激动剂(huamn interleukin-15 superagonist, IL-15Sa)的蛋白质纳米凝胶结合到CAR-T 细胞表面[图5(c)]。形成纳米凝胶所需要的交联剂为含二硫化物的双-N-羟基琥珀酰亚胺(disulphide-containing bis-N-hydroxy succinimide,
NHS-SS-NHS),当T 细胞被激活时,细胞表面的氧化还原活性增加,触发NHS-SS-NHS 交联剂响应还原条件而断裂,释放IL-15Sa。相比游离IL-15Sa 全身性给药用作佐剂而言,负载IL-15Sa 纳米凝胶的CAR-T 细胞具有更强的治疗潜力,实现人胶质母细胞瘤清除率的显著增加,同时也可提高IL-15Sa的安全给药剂量。带有响应性PD-1抗体的磁性纳米团簇[174]、含有药物阿伐麦布的脂质体[175]、载有阿霉素的聚合物纳米颗粒[176]、装载A2a 腺苷受体拮抗剂的交联多层脂质体囊泡[177]等也被开发连接到CAR-T 表面,以发挥治疗药物和过继性T细胞的双重疗效。Chen等[178]将纳米粒子介导的光热疗法和CAR-T 相联合,肿瘤的光热消融及释放的肿瘤特异性抗原可以增强CAR-T 细胞的肿瘤浸润和活化。Hu 等[179]还用微纳材料协同递送CAR-T 细胞、负载保持CAR-T 活性和增殖能力的细胞因子的纳米颗粒以及PD-L1 抗体,增强CAR-T治疗实体瘤的疗效。
在成像平台技术方面,Harmsen等[180]使用正电子发射断层扫描(positron emission tomography,PET)和近红外荧光(near infrared fluorescent,NIRF)双模式的纳米颗粒来标记CAR-T,可以高灵敏度地实现PET/NIRF成像[图5(d)],实现过继细胞转移后长达一周的全身跟踪,对评估CAR-T在体内的分布、优化CAR-T疗法具有指导作用。
4 总结与展望
近些年,合成生物学和纳米生物学的学科交叉与融合取得了显著的进展,主要体现在以下四个方面:①纳米递送载体因其易功能化、靶向性等特点极大地提高了基因线路以及基因编辑体系的体内递送效率;纳米材料作为信号控制与转导的开关,为合成基因线路的调控提供了丰富的选择。②在合成生物学编辑技术的助力下,生物源纳米制剂可被基因工程化改造,多功能的生物源纳米制剂作为联合治疗平台的潜力被发掘。③在合成生物学“自下而上”构建合成生物系统的思路指引下,以无机、有机和生物材料搭建成众多的纳米功能组件,可以模块化地应用,组装成定制化的生物系统。④将纳米元件和合成生物学改造的底盘生物模块杂化形成的纳米人工杂合系统,可以响应外在物理信号和体内生化信号,实现时空控制或自主靶向驱动,发展出联合疗法和成像诊断的新工具。
综上所述,本文重点阐述了交叉融合的合成生物学和纳米生物学的最新发展,特别是在基因编辑、药物递送以及医学成像等生物医药领域的应用。互相交叉并互相赋能的合成生物学和纳米生物学奠定并形成了一个潜力巨大的学科增长极。
对于纳米生物学和合成生物学来说,一个学科的进步将给另一个学科产生新的工具、带来新的启发。随着纳米技术的进一步发展,一系列纳米级元件可能用作催化剂、传感器和递送载体等,更精妙地实现基因线路的构建、基因线路的开关调控,以及在体基因编辑改造的完成。合成生物学可根据人类意愿构建出特定的生物分子或生态系统,自主生产纳米材料和生成纳米制剂,实现纳米制剂的增效减毒。
仿生化是纳米生物学和合成生物学趋同的一个重要标志[181],也是该领域发展的一个重要方向。向自然模拟和从自然启发,可以用合成生物可持续性地生产仿生制剂,直接用于体内疾病治疗;抑或通过纳米功能组件的模块化自组装,开发出功能集成的纳米合成生物系统,进一步构建智能化的仿生生物系统,用作疾病智能诊断和精准治疗的一体化平台。
合成生物学和纳米生物学未来的融合发展可能会特别注重如何实现标准化和模块化。标准化是纳米装置实施构建和易于操作的基础[136]。生物元件的模块化是合成生物学的一个普适性假设[182]。设计出标准化的合成通用接口和调控元件,实现功能模块的定向集成,可以规模化构建纳米合成生物系统。同时,结合多模态成像技术、荧光共振能量转移、多组学分析等多学科方法,分析技术亟待发展以用于纳米合成生物系统的在体监测与评价。合成纳米生物制剂的生物分布、对非靶向组织的影响以及代谢归宿也应当进一步研究揭示,为其临床转化和规模化生产应用奠定基础。
可以预见,在合成生物学和纳米生物学的共同驱动下,二者将持续深度融合发展,协调推进相关技术的迭代和升级。

