病毒-纳米金杂合导电网络结构在电化学分析的应用
梁晓声,郭永超,门冬,4,张先恩
(1 中南民族大学生命科学学院,湖北 武汉 430074;2 中国科学院武汉病毒研究所,生物安全大科学研究中心,病毒学国家重点实验室,湖北 武汉 430071;3 中国科学院生物物理研究所,生物大分子科教融合卓越中心,生物大分子国家重点实验室,北京 100101;4 中国科学院大学,北京 100049)
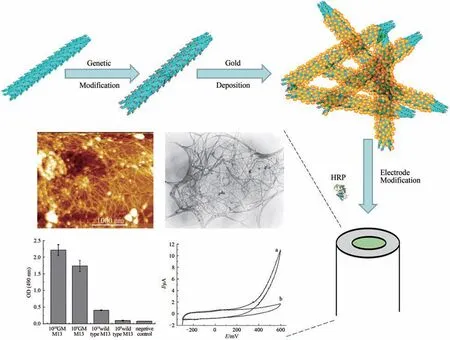
基于酶的电流型电化学传感器目前已广泛用于生物过程控制及医疗诊断等领域,近年来相关行业对生化过程小分子化合物提出了越来越高的痕量检测要求。目前,利用纳米导电材料(如碳纳米管[1])修饰电极,电子介体修饰电极[2-3]以及直接酶-电极电子传递[4-5]等方式均可构建灵敏的酶电极,从而实现多种小分子化合物的检测。
噬菌体展示是一种利用噬菌体研究蛋白/小肽与生物分子相互作用的技术[6]。噬菌体在衣壳蛋白展示功能肽/蛋白的同时,其基因组内包含展示功能肽/蛋白的编码信息[7-8]。通过这种关联,实现了基因型和表型在单个病毒颗粒内的直接联系,从而可以构建肽文库,进行体外生物分子相互作用的筛选及优选靶标的放大[9-10]。近年来,这种利用噬菌体相互作用的筛选方式扩展到了材料领域[10-12],通过噬菌体在材料表面结合,进而从肽文库中筛选出材料亲和肽,利用亲和肽控制材料沉积成核反应,从而控制材料的单分散性及形貌的方法得到了充分的发展。材料亲和肽的引入,可以在温和的仿生条件下进行材料的合成。利用噬菌体展示亲和肽的一个成功范例是基于病毒模板制备过渡金属半导体纳米线,该纳米线体现出了晶格合成的精密控制、制备条件温和、生物相容性好等优势[13]。
病毒颗粒或病毒样颗粒表面改造作为合成生物学的一个重要分支在很多方面取得了积极的进展,丝状噬菌体、烟草花叶病毒、猴空泡病毒SV40、肠道病毒EV71、口蹄疫病毒、登革热病毒、豇豆花叶病毒等病毒样颗粒均作为模板广泛用于无机功能材料的可控矿化[14-16],其中以丝状病毒的噬菌体应用最为广泛[17]。通过噬菌体展示筛选材料结合肽目前已有较多研究,迄今为止,通过M13 噬菌体gP8 蛋白展示发现了金、铂、四氧化三钴、硫化锌、聚苯乙烯、噻虫嗪等材料的结 合 肽[11-13,18-20]。噬 菌 体 展 示 结 合 肽 应 用 以Belchler 等[12]通过噬菌体展示铂、四氧化三钴结合肽作为锂离子电池电极材料显著提高了电池电容量等工作堪称经典。上述研究成功将基于噬菌体展示的蛋白-蛋白相互作用拓展到了蛋白-材料、肽-材料甚至肽-有机小分子的相互作用筛选,提供了一套全新的生物亲和材料和生物复合材料的筛选和可控制备方案。然而,基于噬菌体gP8 蛋白展示得到的多为短肽,单个短肽亲和力不足限制了其在分析检测等领域的应用。基于噬菌体展示材料新结合肽筛选的研究报道较多,然而各种材料结合肽的应用及其先进性的研究还有待进一步发展。
本文作者提出了一种通过合成生物学方法对噬菌体进行基因改造,以此构建一种高灵敏酶电极平台的通用方法。首先,通过基因工程手段在噬菌体主要衣壳蛋白上表达金结合肽。表达了金结合肽的基因改造噬菌体作为模板使得金更为均质地在噬菌体表面发生沉积,从而形成导电三维网络状结构(图1)。为了证实基因改造噬菌体导电材料有利于酶-电极间电子传递,本研究将该材料与辣根过氧化物酶共修饰于玻碳电极表面进行过氧化氢检测,相同底物浓度下显示出比纳米金等纳米材料修饰电极高数倍的信号响应。这些结果表明,纳米金-噬菌体复合物构建的三维网络结构表现出良好的酶-电极间电子传递性能,其电极增强效果可在其他酶电极推广并应用。基于贵金属及碳纳米材料修饰电极改善电极性能已有较多报道,然而沉积贵金属的基因改造噬菌体修饰电极改善了酶-电极间电子传递尚未见报道,其独特的结构特点及生物兼容性在酶电极构建方面具有较大优势和应用前景。
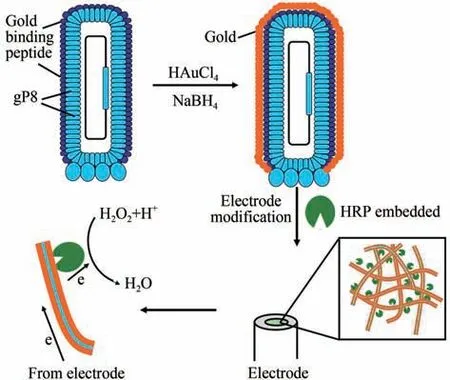
图1 HRP/纳米金-噬菌体复合物制备Fig.1 Schematic diagram for developing the enzyme-phage-gold complex
1 材料和方法
1.1 材料
噬菌体M13KE 及宿主大肠杆菌E coliER2738购自New England Biolabs 公司;PrimeSTAR Max DNA 聚 合 酶、DNA Marker、限 制 性DNA 内 切 酶购自Takara 公司;胰蛋白胨、酵母粉等购自Oxoid公司;牛血清白蛋白(BSA)及琼脂粉购自BioFroxx 公司;琼脂糖购自Gene 公司;质粒小提试剂盒,DNA纯化回收试剂盒等购自Omega公司;异丙基-β-D-硫代半乳糖苷(IPTG),5-溴-4-氯-3-吲哚-β-D 半乳糖苷(X-gal),壳聚糖及银增强试剂购自Sigma 公司;辣根过氧化物酶(HRP)购自武汉天源生物科技有限公司,纳米金溶胶(10 nm直径)购自BBI公司;硼氢化钠、四氯合金酸、30%双氧水 溶 液、K3[Fe(CN)6]、K4[Fe(CN)6]、KCl、K2HPO4及KH2PO4购自国药集团;玻碳电极、Ag/AgCl参比电极及铂电极购自辰华仪器有限公司;其余药品均为分析纯以上级别,实验用水为Milli Q纯水系统制备超纯水(电阻率18.2 MΩ·cm)。
2YT 培养基:16 g 胰蛋白胨,10 g 酵母浸粉,5 g氯化钠溶解调pH至7.0并定容至1 L(固体培养基在此基础添加2%琼脂粉,半固体培养基在此基础添加1%琼脂粉)121 ℃灭菌后使用。
实验所用引物见表1。

表1 构建基因改造噬菌体所用引物Tab.1 Primers for constructing of recombinant phage
1.2 噬菌体M13 衣壳蛋白gP8 的基因工程改造
2YT 固体培养基倾倒较薄固体平板,超净台内冷却固化。取适当稀释的噬菌体M13KE 溶液1 μL,加 入200 μL 生 长 至 早 对 数 期 的 宿 主 菌ER2738 中,孵育1 min。将上述菌液-噬菌体混合物加入5 mL 2YT 半固培养基的无菌管内混匀(半固培养基先预冷至不烫手)。含有菌液-噬菌体的半固培养基倒入预铺固体培养基的平板内,流淌均匀,超净台内冷却固化,37 ℃倒置培养12 h,观察噬菌斑。挑取噬菌斑至2YT 液体培养基中于37 ℃摇床培养12 h,取2 mL 菌液提取质粒,即为M13KE 噬菌体基因组DNA 双链状态。噬菌体改造首先通过引物6264mS和引物6264dn以M3KE为模板进行PCR 片段扩增,使用Hind Ⅲ和BglⅡ分别对PCR 扩增产物及M3KE 载体双酶切,胶回收酶切产物后连接载体和片段,连接产物转化感受态大肠杆菌ER2738,转化的感受态大肠杆菌涂布于含40 μg/mL X-gal、24 μg/mL IPTG 的2YT 固体平板上,筛选白色菌落,转接提取质粒,使用PstⅠ和BglⅡ对基因改造病毒基因组进行双酶切,出现一个条带为阳性克隆,阳性克隆送测序验证,即可得6264 处突变消除了PstⅠ酶切位点的病毒定点突变株。接着通过重叠延伸PCR 将1372 位点处T突变为A,以在该位置产生新的PstⅠ酶切位点,将1381 位点处C 突变为G 以产生BamHⅠ酶切位点。上述两个突变使用1381up、1381S、1381A 及1381dn 4 条引物进行一次重叠延伸PCR 完成。重叠延伸PCR 产物及消除了PstⅠ酶切位点的病毒定点突变株基因组分别用SnabⅠ和PacⅠ进行双酶切,酶切产物胶回收连接,连接产物转化感受态大肠杆菌ER2738,转化感受态大肠杆菌涂布于无抗性2YT 固体平板上,挑取菌落,转接提取质粒,使用PstⅠ和PacⅠ,BamHⅠ和PacⅠ分别对同一提取病毒基因组进行双酶切,两次双酶切均为两条带为酶切阳性克隆,阳性克隆送测序验证,得到定点突变后于1372及1381位点附近产生了PstⅠ和BamHⅠ双酶切位点的噬菌体。PstⅠ和BamHⅠ双酶切位点定点突变的噬菌体基因组使用PstⅠ和BamHⅠ双酶切后回收,引物GbS和GbA 直接混合退火作为片段与酶切后的基因组连接,转化2YT固体平板上,筛选菌落,转接提取质粒,使用PstⅠ和PacⅠ,BamHⅠ和PacⅠ分别对同一提取病毒基因组进行双酶切,PstⅠ和PacⅠ酶切为两条带同时BamHⅠ和PacⅠ酶切为一条带的克隆为阳性克隆,测序验证即得到金结合肽(VSGSSPDS)[20]克隆进入噬菌体衣壳蛋白gP8的N 端的基因改造噬菌体。基因改造的gP8衣壳蛋白含有金结合肽的噬菌体命名为基因改造噬菌体(GM M13),后续作为金沉积支架使用。
为了获得高达1012PFU/mL 浓度的基因改造噬菌体,适量的噬菌体GM M13 感染大肠杆菌宿主菌ER2738,加入四环素至终浓度为100 μg/mL,37 ℃,250 r/min摇床振荡过夜。培养物10 000g离心10 min,移取上清,上清加入1/6 体积的PEG/NaCl 溶液并于4 ℃静置1 h,混合物4 ℃10 000g离心15 min。沉淀用适当无菌水重悬,使用前述方法测定噬菌斑形成单位(PFU)。
1.3 基因改造噬菌体金结合能力的评估
96 孔微孔板加入100 μL 1011PFU/mL 基因改造噬菌体及野生型噬菌体M13,100 μL 5%BSA 溶液作为阴性对照加入微孔板,4 ℃孵育过夜。倾倒溶液后加入300 μL 含5%脱脂奶粉的PBS 缓冲液,37 ℃孵育2 h,每孔加入150 μL 纳米金溶胶37 ℃孵育1 h,PBS 洗涤3 次,每孔加入100 μL 银增强溶液显色至适当程度于490 nm检测吸光度值。
1.4 HRP/纳米金-噬菌体复合物/壳聚糖和HRP/纳米金颗粒/壳聚糖的制备
取1~10 μL HAuCl4分别加入200 μL 1012PFU/mL基因改造噬菌体中,加入20 μL 甘氨酸-HCl 溶液(pH 2,200 mmol/L) 孵 育30 min, 加 入1 μL 0.5 mol/L NaBH4溶液(溶解于0.1 mol/L NaOH)。产物4000g离心2 min, 沉淀用50 μL 含2%乙酸、1%壳聚糖和3~5 mg/mL HRP 溶液重悬。对照样品用纳米金颗粒制备,步骤如下:取3.2 mL 10 nm纳米金颗粒16 000g离心10 min,弃上清,沉淀用50 μL 含2%乙酸、1%壳聚糖和3 mg/mL HRP 溶液重悬。
1.5 基因改造噬菌体金沉积产物的表征
1.5.1 原子力显微
取10 μL HRP/Au-基因改造噬菌体/壳聚糖复合物滴加到新鲜解理的云母片表面并于空气中自然干燥。滴加了样品的干燥云母片用100 μL 超纯水洗涤并再次干燥,重复该步骤2 次。使用PicoScan 5 AC 模式进行原子力显微扫描(Molecular Imaging Corp.,San Diego,CA,United States of America)。使用S1-75 型低频率硅基悬臂梁于70 kHz 频率进行非接触式扫描,扫描使用AC模式。图像经SPIP软件进行平滑处理。
1.5.2 TEM
样品滴于parafilm 疏水封口膜上用镊子夹取覆碳膜铜网于液滴上飘浮10 min,夹取铜网,使用切角滤纸边缘小心吸去多余液体,铜网放置自然干燥过夜,使用日立H7000 型透射电子显微镜观察吸附样本的铜网。
1.5.3 ICP-OES
分别取5 μL HRP/纳米金-噬菌体复合物/壳聚糖及5 μL HRP/纳米金/壳聚糖溶解于200 μL 王水,超纯水洗涤至总体积为5 mL(1000倍稀释)。两样品分别使用ICP-OES Varian700 光谱仪测定波长208.207 nm 和242.794 nm 处吸收,外标为10 μmol/L HAuCl4溶液。
1.6 电极修饰及电化学测定
玻碳电极(3 mm直径)分别用1.0 μm、0.3 μm和0.05 μm α-氧化铝浆抛光,抛光完成后分别用超纯水清洗干净。抛光好的电极在超纯水、无水乙醇、丙酮及超纯水中分别超声5 min。再将电极浸泡于30%硝酸溶液中以彻底清洁电极表面,电极取出用超纯水清洗后再用高纯氮气吹干。再将电极置于0.1 mol/L H2SO4中进行循环伏安扫描,扫描范围−1~1 V,重复扫描直至获得可重复的曲线,电极用超纯水再次洗涤并用高纯氮吹干,然后滴涂5 μL HRP/Au-基因改造噬菌体/壳聚糖复合物于电极表面。修饰后的电极于4 ℃放置24 h 自然晾干。对照修饰电极修饰溶液换为5 μL HRP/纳米金/壳聚糖复合物,其余操作步骤与实验电极相同。
电化学交流阻抗谱测试用于电极的电化学表征,表征使用BAS-Zahner IM6e 型电化学工作站(Zahner-Elektrik, Kronach, Germany)于三电极系统中进行。玻碳电极及修饰的玻碳电极(3 mm直径)作为工作电极,Ag/AgCl 电极作为参比电极,铂电极作为对电极。交流阻抗测试于含0.1 mol/L KCl 及1 mmol/L K4[Fe(CN)6]/K3[Fe(CN)6](1∶1)的10 mmol/L、pH 7.0 的PBS 溶液中进行,K4[Fe(CN)6]/K3[Fe(CN)6]在溶液中做为氧化还原探针。于开路电位0.2 V 进行交流阻抗扫描,扫描频率100 kHz 到0.1 Hz,偏振电压为5 mV,数据采集设定每10 倍频率范围内测试5 个点。循环伏安法测试使用三电极系统于不搅拌的0.1 mol/L PBS(pH 7.0)溶液中进行,扫描速率20 mV/s 扫描范围为−0.3~0.6 V。电化学测定前溶液先充分通氩气以排出溶解氧。
2 结果与讨论
2.1 展示金结合肽噬菌体M13 的构建
按1.2 节的方法构建展示金结合肽噬菌体M13KE 基因组,构建过程中将病毒基因组6264 处插入碱基G 消除原有的PstⅠ酶切位点,1372 位点处T 突变为A 产生新的PstⅠ酶切位点,1381 位点处C 突变为G 产生新的BamHⅠ酶切位点,再通过PstⅠ和BamHⅠ酶切位点插入金结合肽序列,为了便于鉴定,金结合肽插入时通过插入段碱基的改变消除了BamHⅠ酶切位点。各步骤均进行了双酶切鉴定,鉴定结果如图2所示。病毒基因组6264处插入碱基G 消除原有的PstI 酶切位点后,使用PstⅠ和BglⅡ对6264 处进行移码突变的病毒基因组进行双酶切,PstⅠ通过点突变消除后的基因组双酶切仅能产生1条线性化条带。病毒基因组1372及1381位点处突变后,产生了新的PstⅠ和BamHⅠ酶切位点,使用PacⅠ和上述两个新产生的酶切位点的内切酶对突变后的基因组进行双酶切,病毒基因组被切割为两个片段,其中小片段分别为2764 bp 和2755 bp。插入金结合肽序列后消除了BamHⅠ酶切位点,此时再继续使用PstⅠ、PacⅠ和BamHⅠ、PacⅠ分别对基因组进行双酶切,PstⅠ和PacⅠ可将基因组切割为2个条带而BamHⅠ和PacⅠ仅能将基因组线性化为1个条带。插入了金结合肽序列的病毒基因组使用氯化钙转化法转化入大肠杆菌ER2738,在宿主菌中扩增后组装出gP8 展示金结合肽的重组病毒。因本实验为主要衣壳蛋白从基因组水平上的修改,如酶切及测序正确并且转化病毒基因组后能观察到病毒噬菌斑,则能证明修改后的衣壳蛋白在病毒上发生了表达并成功组装出病毒颗粒。
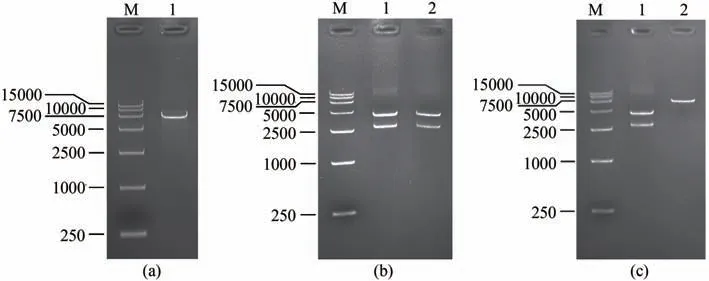
图2 展示金结合肽噬菌体的构建与鉴定M为takara DL15000 DNA ladder,(a)1泳道为使用PstⅠ和BglⅡ对6264处移码突变的病毒基因组进行双酶切;(b)1泳道为使用PstⅠ和PacⅠ,2泳道为使用BamHⅠ和PacⅠ分别对1372及1381处突变的病毒基因组进行双酶切;(c)1泳道为使用PstⅠ和PacⅠ对gp8基因插入了金结合肽序列的病毒基因组进行双酶切,2泳道为使用BamHⅠ和PacⅠ对gp8基因插入了金结合肽序列的病毒基因组进行双酶切Fig.2 Construction of gold-binding peptide displaying phage and its verificationM—Takara DL15000 DNA ladder.Lane(a)1—Site 6264 mutated phage genome digested by PstⅠand BglⅡ.Lane(b)1—Sites 1372 and 1381 mutated phage genome digested by PstⅠand PacⅠ;2—Sites 1372 and 1381 mutated phage genome digested by BamHⅠand PacⅠ.Lane(c)1—Gold-binding peptide sequence inserted phage genome digested by PstⅠand PacⅠ;2—Gold-binding peptide sequence inserted phage genome digested by BamHⅠand PacⅠ
2.2 基因改造噬菌体金结合能力的评估
通过将金结合肽序列VSGSSPDS 克隆至噬菌体M13基因组的gP8衣壳蛋白N端,获得了具有金结合能力的噬菌体。利用银增强噬菌体ELISA 确认噬菌体组装体上有金结合肽并且有金结合功能。金纳米颗粒结合到噬菌体表面经银增强反应进行信号放大后,于490 nm 波长进行定量,结果(图3)表明,基因改造噬菌体的金结合能力显著高于野生型噬菌体,并且其吸光度与噬菌体滴度呈正比关系。
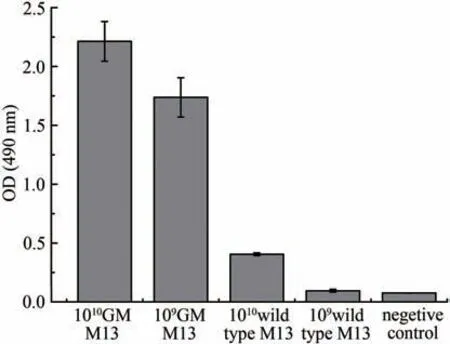
图3 银增强噬菌体ELISA实验结果(1010 GM M13 and 109 GM M13指滴度为1010 PFU/mL及109 PFU/mL基因改造的噬菌体M13;1010 Wild type M13 and 109 Wild type M13指滴度为1010 PFU/mL及109 PFU/mL野生型M13;阴性对照为未加噬菌体直接脱脂奶粉封阻后结合纳米金再进行银增强)Fig.3 Evaluation of gold-binding ability for GM M13 with silver enhancement(1010 GM M13 and 109 GM M13 refer to the genetically modified M13 with the titer of 1010 PFU and 109 PFU,respectively,and the silver enhancement GM M13 without gold nanoparticles is used as the control.)
2.3 金结合噬菌体的表征
金-噬菌体复合物通过硼氢化钠还原金离子并沉积到基因改造噬菌体表面。通过AFM 和TEM 对该复合物进行了表征。金-噬菌体复合物外观呈紫红色。尽管金结合肽已经通过基工程的手段展示在噬菌体主要衣壳蛋白的每一个拷贝上,AFM 表明,当硼氢化钠于温和条件下还原金离子时,复合物线状结构上仍然存在部分不连续区域,与此同时,病毒模板之外也有少量金纳米颗粒形成[图4(a)],这可能是因为在噬菌体处理及金沉积的过程中少量噬菌体发生了解体,其上的衣壳蛋白游离于噬菌体周围并与金离子结合继而发生还原。当金离子还原的过程中HAuCl4增加以后,还原复合物上不连续的区域消失[图4(b)],纳米线之间发生了沉积物的联结,形成了三维的网状结构。随着还原过程中金离子浓度的进一步增加,AFM表征显示,产生了更多的联结结构,并且产生了具有放射状结构的超级“结”状结构[图4(c)]。同时,TEM 结果显示,连续的噬菌体表面金沉积形成均匀的网状结构。此外,还观察到金包被噬菌体的更多细节:沉积于噬菌体表面的金呈现纳米尺度的微点状,形状不规则,表面较粗糙[图4(d)]。
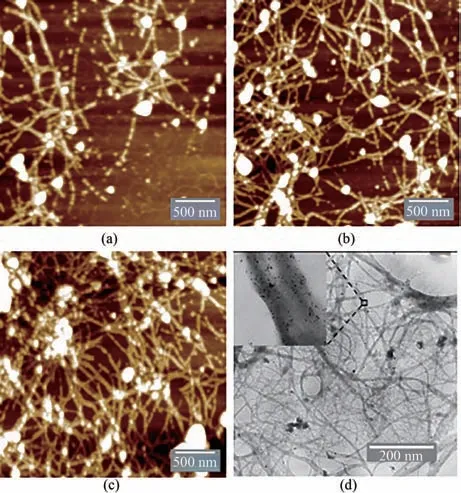
图4 不同反应条件下纳米金-噬菌体复合物的AFM及TEM图(a)0.25 mmol/L HAuCl4、1012 PFU/mL基因改造噬菌体、20 mmol/L Gly-Cl−及2.5 mmol/L NaBH4沉积条件下,AFM扫描图;(b)0.375 mmol/L HAuCl4、1012 PFU/mL基因改造噬菌体、20 mmol/L Gly-Cl−及2.5 mmol/L NaBH4沉积条件下,AFM扫描图;(c)0.5 mmol/L HAuCl4、1012 PFU/mL基因改造噬菌体、20 mmol/L Gly-Cl−及2.5 mmol/L NaBH4沉积条件下,AFM扫描图;(d)纳米金-噬菌体复合物TEM显微成像图,复合物形成条件:0.5 mmol/L HAuCl4、1012 PFU/mL基因改造噬菌体、20 mmol/L Gly-Cl−及2.5 mmol/L NaBH4 Fig.4 AFM and TEM images for the Au-GM M13 complex formed under different reaction conditions(a)AFM images for 0.25 mmol/L HAuCl4,1012 PFU/mL GM M13,20 mmol/L Gly-Cl-and 2.5 mmol/L NaBH4;(b)AFM images for 0.375 mmol/L HAuCl4,1012 PFU/mL GM M13,20 mmol/L Gly-Cl-and 2.5 mmol/L NaBH4;(c)AFM images for 0.5 mmol/L HAuCl4,1012 PFU/mL GM M13,20 mmol/L Gly-Cl-and 2.5 mmol/L NaBH4;(d)TEM image for the Au-GM M13 complex.Complex forming conditions:0.5 mmol/L HAuCl4,1012 PFU/mL GM M13,20 mmol/L Gly-Cl-and 2.5 mmol/L NaBH4
2.4 HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极的电化学活性评估
经修饰的电极于含铁氰化钾/亚铁氰化钾溶液中循环伏安扫描如图5 所示,结果显示裸玻碳电极经抛光及电极表面处理后,在铁氰化钾溶液中产生一对可逆氧化还原峰,峰电位差为70 mV。电极经HRP/纳米金-噬菌体复合物/壳聚糖修饰后,在铁氰化钾/亚铁氰化钾溶液中循环伏安扫描氧化还原峰对峰电位差显著增加至121 mV。此外,修饰后电极氧化及还原峰电流显著增大。氧化还原电位差增大说明修饰电极表面不再是玻碳电极表面均一洁净状态,氧化还原峰电流增大说明表面修饰材料导电性能良好。由于修饰材料具有较大固液接触界面,使得更多电化学探针在其表面发生氧化还原,形成电子传递,从而导致电流增大。
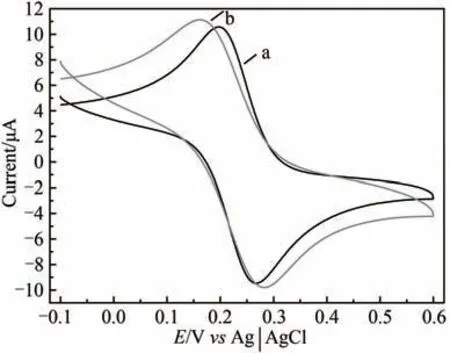
图5 HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极前后循环伏安图a—修饰前;b—修饰后[扫描速率50 mV/s;缓冲液含0.1 mol/L KCl及2 mmol/L[F(eCN)6]3−/4−的PBS(10 mmol/L,pH 7.0)溶液]Fig.5 Voltammograms of the HRP/Au-GM M13 electrode without(a)and with chitosan modifications(b)[Scan rate:50 mV/s;buffer:PBS(10 mmol/L,pH 7.0)solution containing 0.1 mol/L KCl and 2 mmol/L[Fe(CN)6]3-/4-.]
HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极的电催化活性测定显示,随着过氧化氢的添加产生了很明显的催化电流,同时无过氧化氢对照在对应电位区域无明显催化电流产生(图6、图7)。本研究通过循环伏安法[16]对HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极的电化学行为进行了测试。通过电极在含过氧化氢溶液中循环伏安扫描曲线微分解析,微分曲线呈现线性增加,直至600 mV 处有所缓解,因而,使用循环伏安600 mV处电流值对底物浓度作标准曲线来量化电极对过氧化氢的响应。HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极在连续加入过氧化氢下循环伏安响应如图6、图7 所示。每次过氧化氢添加后待信号稳定后进行测试,过氧化氢浓度2.5~640 μmol/L范围内HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极催化过氧化氢降解显示为一级反应动力学行为。该范围内响应电流对底物浓度做图获得R=0.992(n=9)标准曲线,检测限为0.32 μmol/L(S/N=3)。

图6 不同过氧化氢浓度下HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极循环伏安图[Ar-饱和PBS(0.1 mol/L,pH 7.0)中于20 mV/s速率扫描。H2O2浓度范围2.5~640 μmol/L。内插图为600 mV处峰电流(μA)对浓度(μmol/L)作图]Fig.6 Voltammograms of the HRP/Au-GM M13 electrode modified with chitosan at different concentrations of hydrogen peroxide[Scan rate:20 mV/s for N2-saturated PBS(0.1 mol/L,pH 7.0).The curve peaks were obtained in response to H2O2 concentrations from 2.5 μmol/L to 640 μmol/L.The embedded image shows the calibration curve derived from the curves.]
该检测限数值与碳纳米管-HRP 修饰电极相关研究检测限数值相近[21],比表2 中其他文献报道的低[21-26]。约640 μmol/L处单位底物的信号响应发生了显著的衰减。超过该浓度可做另一标准曲线,线性范围640 μmol/L~60 mmol/L(R=0.9829,n=9),如图7所示。
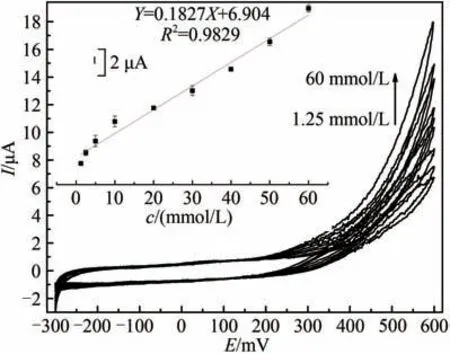
图7 不同过氧化氢浓度下HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极循环伏安图[Ar-饱和PBS (0.1 mol/L,pH 7.0)中于20 mV/s速率扫描。H2O2浓度范围640 μmol/L~60 mmol/L。内插图为600 mV处峰电流(μA)对浓度(mmol/L)作图]Fig.7 Voltammograms of the HRP/Au-GM M13 electrode modified with chitosan at different concentrations of hydrogen peroxide from 640 μmol/L to 60 mmol/L[Scan rate:20 mV/s for N2-saturated PBS(0.1 mol/L,pH 7.0).The embedded image shows the calibration curve derived from the curves.]
HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极对底物信号响应符合Michaelis-Menten 动力学方程。表观米氏常数(Kmapp)反映的是酶亲和力以及微观动力学常数,该参数可通过电化学Lineweaver-Burke方程获得[27]:
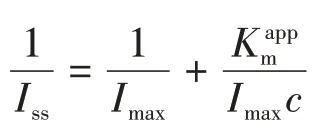
式中,Iss为过氧化氢添加后的稳态电流;c为底物宏观浓度;Imax为饱和底物条件下得到的最大电流。HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极Km
app值经计算为0.3 mmol/L,低于众多传统修饰方法的过氧化氢酶电极[28-30]。电极极低的Kmapp值证明该电极对底物具有高亲和性及高灵敏度。
2.5 不同修饰电极的比较
由于丝状噬菌体主要衣壳蛋白2700 个拷贝上均有金结合肽,金离子结合并还原形成微纳结构的成核位点在病毒模板上得到了最大化的展示。因而金离子可在病毒表面矿化形成线状纳米结构(表2)。当病毒模板滴度较高时,形成的金属-病毒复合线状结构进一步可形成三维网状结构。该结构具有如下特点:首先,网状结构有利于更多HRP 等酶分子的包埋和吸附;其次,金网状结构导电性能较好,能为酶活性中心到电极表面电子传递提供便利。上述特点可增强同等条件下酶电极的响应信号,为了验证由其结构特点得出的推论,研究中比较了4种过氧化氢酶电极(图8)。结果表明,HRP/纳米金-噬菌体复合物/壳聚糖修饰电极在高底物浓度区域和低浓度区域均展现了优越的信号响应,其响应电流约为HRP/金纳米颗粒/壳聚糖修饰电极和HRP/壳聚糖修饰电极的2~7倍。该实验中,通过ICP-OES测定了纳米金-噬菌体复合物及金纳米颗粒的金含量,修饰电极时确保了两个电极上修饰物中金含量相等。裸玻碳电极在低浓度时未测到对过氧化氢的催化电流,在过氧化氢浓度高达10 mmol/L以上时,显示了与HRP/纳米金-噬菌体复合物/壳聚糖修饰电极相同数量级的催化电流响应。这可能是由于溶液高电位高浓度条件下过氧化氢部分水解产生氧气从而产生的氧化电流。数十微摩尔浓度的过氧化氢检测在实际应用场景中其实已不具备太大的价值。图8中也显示了低浓度的响应结果,HRP/纳米金-噬菌体复合物/壳聚糖修饰电极较其他修饰电极信号响应更为灵敏。同时,没有金微纳结构参与修饰的HRP/壳聚糖修饰电极则对底物信号响应最差。上述结果表明,由于纳米金-噬菌体复合物的三维网络结构使得酶-电极的电子传递更为便利,HRP/纳米金-噬菌体复合物/壳聚糖修饰电极在较大的浓度范围内均有更好的电信号响应,此外,响应电流在很大范围内与底物浓度呈线性的正比关系。同为金纳米材料的纳米金颗粒制备HRP/纳米金颗粒/壳聚糖修饰电极则在不同浓度范围对底物催化电流均与纳米金-噬菌体复合物修饰电极的信号有数倍差异,这是因为纳米金颗粒为胶体状态,为了维持胶体状态稳定,颗粒间具有较强静电斥力,修饰电极时,纳米金颗粒间通常因为静电作用离散分布,电子通过纳米金颗粒的传递通常为Marcus模型[29]所描述的电子隧穿,传递效率较差。与之相较,纳米金-噬菌体复合物为连续金沉积的一维纳米材料,在此基础上加强沉积形成交叉三维网状结构。网状结构提供了更多的有利于电子传递的接触面。网状结构表面较为粗糙,为吸附在其表面的酶提供了更多的便于电子传递的方向,使得更多不同角度吸附的酶得以在催化条件下成功实现酶-电极间的电子传递。总之,金沉积于基因改造噬菌体而形成的复合物具有一维连续金属表面的基本结构,通过超级金属沉积结互相连接构成三维网络结构,该结构表面具有众多形貌各异的金纳米颗粒样亚结构,同时表面粗糙,为不同方向吸附的酶都能提供更为便利的电子传递条件,因而表现出优异的电响应性能。
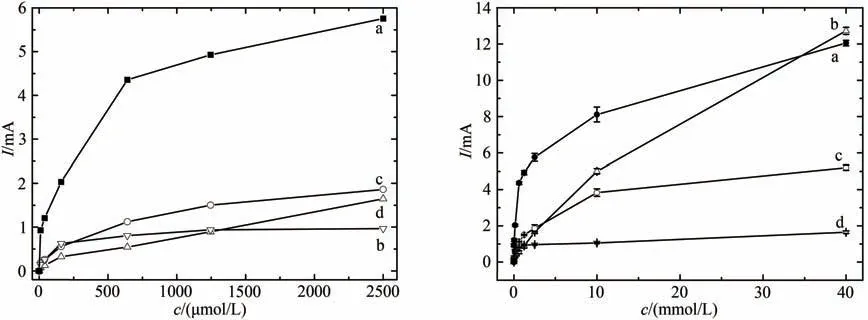
图8 随过氧化氢浓度变化不同修饰电极催化电流变化比较(a)HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极;(b)裸玻碳电极;(c)HRP/金纳米颗粒/壳聚糖修饰玻碳电极;(d)HRP壳聚糖包埋修饰玻碳电极Fig.8 Comparison of voltammograms for the electrode responses to increased H2O2 concentrations[The measurement was performed in the PBS without oxygen.HRP/Au-GM M13 electrode with(a)and without(b)chitosan modification,and HRP/Au nanoparticles electrode with(c)and without(d)chitosan modification]
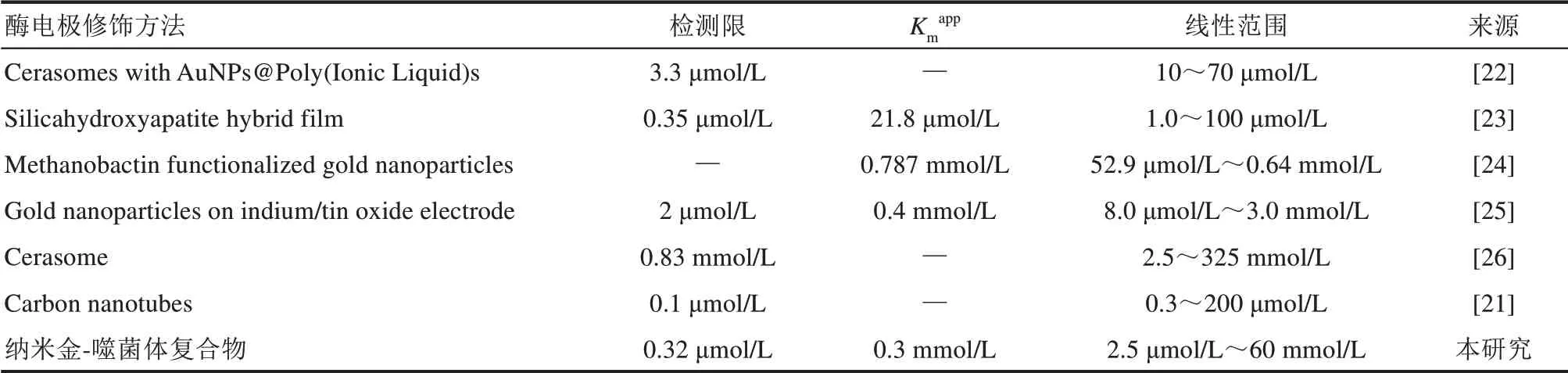
表2 HRP/纳米金-噬菌体复合物/壳聚糖修饰电极与其他修饰过氧化氢酶电极的比较Tab.2 Comparison of the analytical performance of enzyme-phage-gold modified electrode with other electrochemical biosensors
为了进一步研究这种新复合材料的电化学行为,研究中使用交流阻抗谱测试了上述不同修饰的电极(图9)。阻抗谱Nyquist 图在系列电极表征中基本由半圆弧和线性部分构成,半圆弧部分对应电子传递限制过程而线性部分则对应电化学过程中的扩散限制步骤[30-31]。半圆弧半径(Ret)可以评估电子传递的阻力大小,修饰层性能不同,氧化还原探针在电极表面电子传递动力学行为不同,因而半圆弧半径可以用来评估电极界面处的性质。图9显示玻碳电极Ret接近无穷小,其对电子探针在其表面传递和氧化还原阻力很小,探针在其表面氧化还原过程主要为扩散控制。HRP/纳米金-噬菌体复合物/壳聚糖修饰电极后Ret迅速增加,过程转为电子传递限制(图9),同时提示,在低底物浓度范围内,扩散对整个过程的影响几乎可以忽略。虽然HRP/纳米金-噬菌体复合物/壳聚糖修饰电极和HRP/纳米金颗粒/壳聚糖修饰电极具有同样的金含量,HRP/纳米金颗粒/壳聚糖修饰电极比HRP/纳米金-噬菌体复合物/壳聚糖修饰电极具有更大的Ret,表明通过纳米金颗粒电子传递阻力较大。另外,纳米金溶胶结构表面电荷分布也对[Fe(CN)6]3−/4−等电化学探针有较强静电排斥作用。纳米金-噬菌体复合物则为硼氢化钠直接还原所得,表面柠檬酸根等负电荷基团很少,也有利于带电荷探针通过其修饰层的传递。此处结果也同样解释了图8中两种修饰催化电流显著差异的原因。

图9 交流阻抗Nyquist图(Z"vs Z')测试溶液:含0.1 mol/L KCl及2 mmol/L[F(eCN)6]3−/4−的PBS(10 mmol/L,pH 7.0)溶液a—HRP/纳米金-噬菌体复合物/壳聚糖修饰玻碳电极;b—HRP/金纳米颗粒/壳聚糖修饰玻碳电极;c—HRP壳聚糖包埋修饰玻碳电极;d—裸玻碳电极Fig.9 Nyquist diagram(Z"vs Z')for Faradaic impedance spectra in the PBS(10 mmol/L,pH 7.0)containing 0.1 mol/L KCl and 2 mmol/L[Fe(CN)6]3-/4-a—HRP/Au-GM M13 electrode modified with chitosan;b—HRP/Au nanoparticles electrode modified with chitosan modified electrode;c—HRP electrode modified with chitosan;d—the glass-carbon electrode without the modification
3 结论
本研究构建了主要衣壳蛋白gP8展示金结合肽(VSGSSPDS)的M13 噬菌体,以基因改造噬菌体作为成核模板,将金还原矿化到噬菌体表面,通过矿化条件的调节,获得了三维导电网络结构。该结构为网络状,表面分布有点状纳米亚结构且有均匀的金属矿化,表面较为粗糙,具有较好的导电能力及酶吸附能力。利用该金-基因改造噬菌体复合物修饰电极制备过氧化氢酶电极,获得良好的性能。电极对过氧化氢响应线性范围2.5 μmol/L~60 mmol/L,检测限为0.32 μmol/L(S/N=3)。金-基因改造噬菌体复合物修饰电极与其他纳米材料相比具有较大优势,表现为:
①HRP/纳米金-噬菌体复合物/壳聚糖修饰电极检测限为0.32 μmol/L,检测限低于同类酶与其他纳米材料共修饰的酶电极:脂质体/纳米金/离子液体修饰、硅-羟基磷灰石修饰、铜载体功能化纳米金修饰、纳米金修饰ITO 电极及脂质体修饰等;与碳纳米管修饰过氧化氢酶电极检测限接近。
②HRP/纳米金-噬菌体复合物/壳聚糖修饰电极对底物信号响应符合Michaelis-Menten 动力学方程。表观米氏常数(Kmapp)值为0.3 mmol/L,低于众多传统方法修饰的过氧化氢酶电极。
③HRP/纳米金-噬菌体复合物/壳聚糖修饰电极在高底物浓度区域和低浓度区域均展现了优越的信号响应,其响应电流约为HRP/金纳米颗粒/壳聚糖修饰电极和HRP/壳聚糖修饰电极的2~7 倍。
④HRP/纳米金-噬菌体复合物/壳聚糖修饰电极交流阻抗测试Ret值显著小于HRP/金纳米颗粒/壳聚糖修饰电极和HRP/壳聚糖修饰电极。
上述结果说明通过噬菌体M13 主要衣壳蛋白展示金结合肽,并以之为模板进行金的矿化,由于每个噬菌体上产生了多达2700 个拷贝的成核位点,有利于形成导电一维材料,并进一步形成三维导电网络。矿化后金-基因改造噬菌体复合物表面较为粗糙有利于酶的吸附,并易于在酶的各个方向形成酶-电极的导电通路,从而提高酶电极的灵敏度及信号响应强度。本研究将为噬菌体展示材料结合肽的实际应用提供有益基础。

