“时-空耦合”活细胞合成量子点
贾剑红,杨玲玲,刘安安,庞代文
(1南开大学药物化学生物学国家重点实验室,化学学院分析科学研究中心,天津市生物传感及分子识别重点实验室,天津 300071; 2武汉大学高等研究院,化学与分子科学学院,湖北 武汉 430072)

在自然界中,活细胞通过复杂代谢系统适应外界环境,保护自身免受环境变化带来的影响[1-5]。为应对有毒重金属的损伤,细胞进化出专一的重金属代谢途径,如通过代谢将高价态金属离子还原成零价,产生金属纳米粒子[4-7];或通过胞内具有特定结构和基团的生物分子螯合金属离子,将其转运至液泡隔离或排出胞外[6,8],以达到解毒效果。从20 世 纪80 年代 末 开 始,Dameron 等[9]、Kowshik 等[10]、Sweeney 等[11]和Labrenz 等[12]通过生物矿化在裂殖酵母、球拟酵母、大肠杆菌和硫酸盐还原细菌中合成了CdS、PbS 和ZnS 等半导体纳米材料。由此可见,利用活细胞内多种高效专一的生化反应途径有望实现半导体纳米材料的可控合成。虽然利用活细胞的单一代谢途径成功合成了半导体纳米材料,但对合成机理的认识尚不明确且产物较为单一,粒径、形貌和性质均不可控,这极大限制了生物合成纳米材料的发展[5,9-13]。
量子点是一类半径小于或接近其激子玻尔半径的半导体纳米晶体[14]。量子点的带隙取决于量子点的组成和尺寸。对于同种量子点,由于量子点的量子限域效应,其尺寸越大,带隙越窄,对应的荧光发射波长越长。因此,通过改变量子点的组成和尺寸,可以实现对量子点的荧光发射波长的调控[15-17]。目前报道的量子点荧光发射波长已经实现了从紫外、可见到近红外的全波段覆盖,甚至可以延伸至中红外波段[18-21]。量子点具有高荧光强度、高量子产率及耐光漂等优异的光学性能[22-23],使其在动态示踪[24]、生物活体成像[25-27]、生物检测[28-29]等领域展现出巨大的优势和潜力。
制备量子点的传统方法主要是化学合成方法,包括有机相合成和水相合成。有机相合成的反应条件较苛刻,常涉及无水、无氧和高温等条件,以及需使用易燃易爆的有机试剂。有机相合成的量子点具有量子产率较高、粒径分布均一等优点,但是需要通过表面修饰使其水溶性化和功能化才能应用于生物医学领域,然而表面修饰往往会影响其荧光性能[30-33]。水相合成由于水的沸点限制,通常在100 ℃以下进行,需要与金属离子配位能力较强且带有氨基、羧基或巯基的有机小分子作为配体,常用配体包括巯基乙酸、巯基丙酸、半胱氨酸和谷胱甘肽等。该方法虽然能够解决量子点水溶性的问题,但合成的量子点荧光性质一般不如有机相合成的,且尺寸分布较宽,在生物医学应用中也有一定的局限[34-37]。
自2009 年,本课题组通过人为调控、调用并耦合活细胞内不同生化反应途径,仅仅通过给细胞“喂食”相关反应物,在真菌[38]、细菌[39]及哺乳动物细胞[40]内可控制备了多种具有不同发射波长的量子点。通过探究活细胞内合成量子点的机制,对活细胞合成过程中涉及的复杂胞内生化反应途径进行简化设计,进一步扩展至无细胞体系,发展出了准生物体系,即在水相溶液中加入无机盐、氨基酸、多肽、酶和辅酶等模拟细胞内的生化反应途径,在温和条件下可控制备了水相条件下较难直接合成的Ag2Se 量子点和其他多种纳米材料。与传统的合成方法相比,活细胞合成避免了高温、高压和易燃易爆有机试剂的使用,在温和条件下可控合成了生物相容性良好的量子点。
本文将总结评述“时-空耦合”活细胞合成量子点的策略以及在此基础上发展的无细胞准生物合成策略的研究进展。同时,还将总结两种策略制备的量子点在生物医学领域中的应用。
1 “时-空耦合”调控活细胞合成策略
2009 年,本课题组[38]提出“时-空耦合”调控活细胞合成新策略,即人为调控和调用活细胞中多种生化反应途径,使胞内原本不交会的生化反应途径在合适的时间和空间耦合,实现量子点的合成。使用化学合成方法通常需要提前制备活性阴阳离子前体,在高温条件下将阴阳离子前体混合,实现量子点的成核与生长。而利用活细胞合成量子点时,活性阴阳离子前体的生成和量子点的成核与生长则在人为调控下像化工厂的程序化流水线般在活细胞内特定的时间和空间依次发生。由此可见,活细胞合成量子点的关键因素包括:细胞的生长周期和阴阳离子原料的投料量、投料比、投料顺序、投料时间及孵育时间等[41-42]。以合成CdSe 量子点为例,对上述因素在量子点合成中的作用和对量子点性质的影响依次进行阐述。
首先,根据所要合成量子点的组成选择“喂养”细胞的原料。合成CdSe 量子点时,通常选取水溶性较好的氯化镉(CdCl2)为镉源,亚硒酸钠(Na2SeO3)为硒源。原料的加入会触发细胞的金属离子解毒途径以及高价Se 的代谢途径,从而产生适于合成量子点的活性前体。于酵母细胞而言,Se 的代谢途径需要谷胱甘肽(GSH)、谷胱甘肽还原酶(GR)和辅酶Ⅱ(NADPH)等参与[式(1)、式(2)][43-46],将高价态Na2SeO3还原成低价态有机硒化合物,如硒代半胱氨酸(SeCys)、硒代甲硫氨酸(SeMet)、硒甲基硒代半胱氨酸(SeMC)等,并将其储存于细胞质和线粒体内,以此作为合成CdSe 量子点所需的Se 前体。因此通常选择可以高效合成这些多肽和酶的稳定期作为Na2SeO3的添加时间点[42,47]。通过基因敲除、高效液相色谱电感耦合等离子体质谱法和硒醇特异性探针证实,硒前体的主要存在形式为SeCys[48]。其次,虽然硒是一种重要的微量元素,低剂量时可促进细胞生长[49],但高浓度Na2SeO3会刺激细胞产生活性氧自由基(ROS),破坏细胞的氧化还原环境[50],进而降低酵母细胞的酶活性并抑制细胞生长[51]。因此,一旦Na2SeO3浓度过高(≥10 mmol/L),就会触发Se 解毒途径,导致Se0成为主要产物[52][式(3)~式(5)],而Se0难以被进一步转化成活性Se 前体,从而影响量子点的产率。由此可见,为了提高活性硒前体的转化率和量子点的产率,必须优化Na2SeO3的浓度。同样地,镉作为一种有毒重金属,具有很强的生物毒性和生物累积效应[53],当高浓度Cd2+与细胞接触时,会抑制细胞壁的生长,使其机械强度下降[54];也会诱导细胞产生ROS,引起氧化应激,且Cd2+易与蛋白螯合,影响蛋白的功能。在细胞内Cd2+的解毒途径中,Cd2+被GSH 螯合后运送至特定的细胞器(如液泡)内[55],无法与细胞质中的Se 前体结合,不利于CdSe 的形成。可见,Cd的投料量和Se、Cd 投料顺序及时间点均需要优化。本课题组通过优化上述条件成功在真菌(酿酒酵母[图1(b)])[38]、细菌[金黄色葡萄球菌(图2)][39]和哺乳动物细胞[人乳腺癌细胞MCF-7(图3)和MDA-MB-231;犬肾细胞MDCK][40]中合成了荧光量子点。通过优化孵育时间,在酵母细胞中实现了CdSe 量子点发射波长由520 nm 到670 nm的调控[38]。
活细胞内Na2SeO3的反应途径如下:

为科学地实现胞内量子点的可控合成,科研工作者们探究了酿酒酵母细胞合成荧光CdSe 量子点的机理,发现GSH 代谢途径与酿酒酵母细胞合成CdSe 量子点有密切联系。敲除酵母细胞中调控GSH 合成的基因GSH1(速控基因)、GSH2以及编码GR 的基因GLR1后,该细胞合成CdSe 的能力大大减弱[图1(c)]。相较于野生型的酵母细胞,过表达GSH1基因的酵母细胞合成CdSe 量子点后具有更强的荧光,可见量子点的产率大幅提升[图1(d)][56]。通过敲除酵母细胞中SeMet 代谢的相关基因证明了SeCys 为主要硒前体, 且SeMet-SeCys 转化通路介导量子点的合成,过表达甲硫氨酸合成酶MET6基因可以实现硒化酵母细胞中SeMet 的积累,进而促进CdSe 量子点的合成[48]。通过研究酵母细胞内能量代谢对量子点合成的影响发现,活细胞合成量子点的能量供给主要是ATP。ATP 有助于胞内硒前体的产生和富集、Cd 的吸收以及量子点的形成。通过基因改造上调细胞内ATP 的表达量,可以使细胞合成量子点的产率明显提高[57]。在一些异化金属还原菌(如希瓦氏菌)中,将活细胞“时-空耦合”策略合成CdSe 量子点和跨膜电子的传递过程相结合,敲除cymA基因能显著降低胞外零价硒的生成,使活性硒前体的含量大大增加,进而在胞内合成了大量荧光CdSe 量子点,这说明调节细胞跨膜电子传递过程可以有效调控材料的含量、种类和分布位置[58]。这些工作从遗传学和代谢的角度深化了对活细胞合成CdSe 量子点所涉及代谢途径的认识,为活细胞合成量子点提供了理论依据。
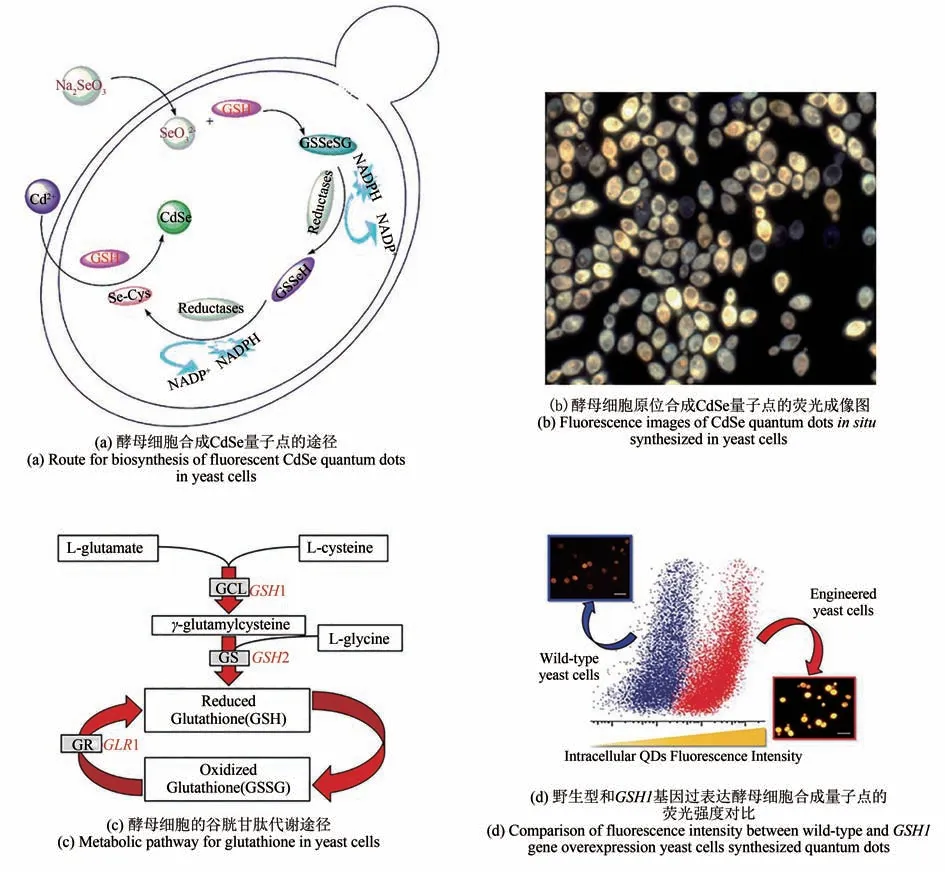
图1 酵母细胞内CdSe量子点的活细胞合成途径及相关机理研究[38,56]Fig.1 Biosynthesis pathway for CdSe quantum dots in yeast cells and related mechanisms[38,56]
2 活细胞内合成量子点的应用
2.1 生物检测
除了酵母细胞,本课题组还将这一策略推广至金黄色葡萄球菌(简称金葡菌),原位合成了CdS0.5Se0.5量子点,将金葡菌转变成粒径均一、荧光性质稳定的细胞信标(图2)[39]。与此同时,借助金葡菌表面天然表达的蛋白A 能够与抗体Fc 端特异性结合的性质,结合免疫磁捕获技术,成功实现了细胞信标对禽流感H9N2 病毒的高灵敏检测。通过改变与蛋白A 结合的特异性抗体,实现伪狂犬病毒、杆状病毒、鼠伤寒沙门氏菌、人乳腺癌细胞(SK-BR-3)等多种病原微生物和肿瘤细胞的高灵敏、高特异性检测[39]。由于水体中的Hg2+可以取代量子点中的Cd,从而使量子点的荧光减弱,因此合成了CdSxSe1−x量子点的大肠杆菌可以作为高灵敏、低成本的荧光探针用于无标记的Hg2+检测,其检测灵敏度与化学合成探针相当,因检测限较低,可以直接用于饮用水中Hg2+的检测[59]。
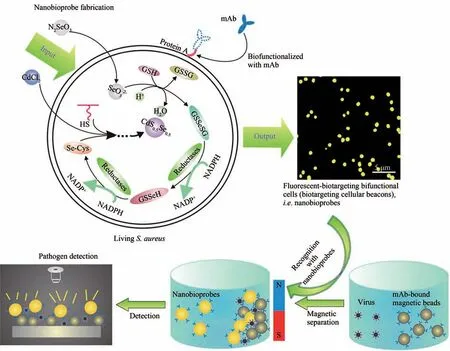
图2 细胞信标构建生物检测探针的原理及其应用[39]Fig.2 Principle and application of constructing biological detection probes by cell beacons[39]
2.2 生物标记与成像
利用“时-空耦合”策略在哺乳动物细胞(MCF-7、MDA-MB231、MDCK)中合成CdSe量子点时,由于重金属离子的刺激,细胞会不断分泌微囊泡(MVs),因此胞内合成的量子点可自发地被细胞质膜出芽形成的MVs 包裹,产生结构和功能完整的荧光标记MVs(图3),标记效率均高于83%;在MDCK 细胞中,标记效率高达95%[40]。通过提高质子浓度,促进细胞内还原性巯基化合物的生成,加速细胞对硒源和镉源的摄取和转化,从而将原本数十小时的合成过程缩短至3.5 h。将大肠杆菌合成的CdSxSe1−x量子点用于斑马鱼的非侵入性荧光成像,观察到荧光信号在肝部富集,9 h 后量子点逐渐从斑马鱼体内代谢至排除。与浓度为25 μg/mL 的量子点共培养10 h 后,斑马鱼仍能保持90%的活性,表明活细胞合成的量子点具有低毒性和良好的生物相容性[60]。

图3 通过MCF-7胞内合成荧光量子点一步标记微囊泡的示意图[40]Fig.3 Schematic illustration for one-step labeling of microvesicles by coupling the intracellular synthesis of fluorescent quantum dots in live MCF-7 cells[40]
2.3 人工光合作用
加州大学伯克利分校杨培东课题组通过热醋穆尔氏菌与Cd2+和半胱氨酸共培养合成CdS 量子点,得到了生物-无机复合杂化体系。利用活细胞合成的量子点的优异光吸收性能,将不具备光合作用能力的热醋穆尔氏菌转化为可进行光合作用的细胞,高效制备醋酸(图4)[61]。其电子传递过程为:在太阳光照射下,CdS 量子点首先高效捕获光能并将电子传递给细菌;然后,细菌高选择性地(>90%)催化CO2转化成醋酸盐;同时,在黑暗条件下,醋酸类产物又可以作为养分供给细菌[61]。热醋穆尔氏菌利用发光的CdS 量子点产生的电子进行光合作用,量子点在该系统中起到电子和能量中继体的作用,为人工光合作用领域提供了新思路[62-63],也为“时-空耦合”策略的发展带来了更多可能。利用量子点的半导体特性,光照条件下,量子点吸收光能后电子从价带跃迁至导带,导带的光生电子具有较强的还原能力,能够促进胞内SeO2−3还原产生更多的活性硒前体,从而促进大肠杆菌和梨形四膜虫内CdSxSe1−x量子点的合成[64]。人工光合作用中利用活细胞合成的量子点作为电子和能量中继体,不仅是“时-空耦合”策略合成量子点的成功应用,也是更进一层次的“时-空耦合”,赋予了生物合成更多的潜能。
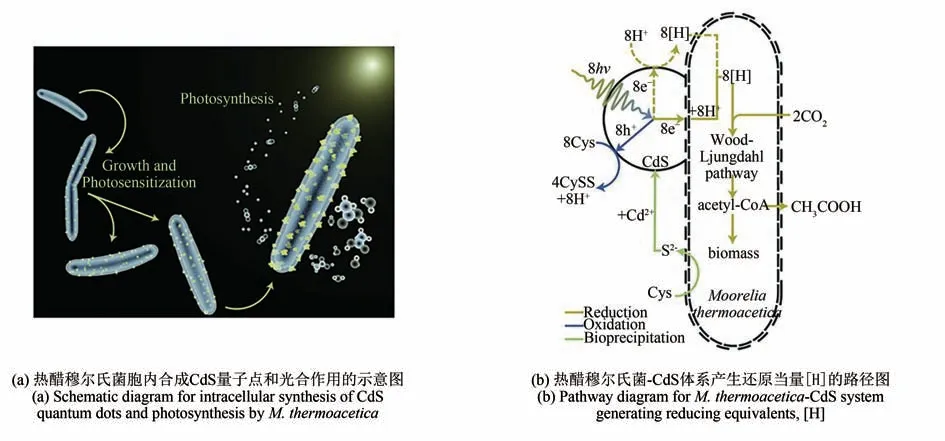
图4 热醋穆尔氏菌-CdS的反应示意图[61]Fig.4 Reaction schematics for the M.thermoacetica-CdS system[61]
3 准生物体系可控合成纳米材料及应用
3.1 可控合成纳米材料
通过“时-空耦合”策略,人为调控细胞的代谢和金属离子的解毒途径合成量子点的工作,在材料合成的角度给细胞中各种物质和能量的循环提供了新的启示和认知。这些物质和能量的代谢循环不仅可以维持细胞的生长和增殖,同时也为材料合成提供原料和能量。在“时-空耦合”策略的基础上,把其中核心的机理和主要的反应途径加以简化和设计,在无细胞的水相反应条件下,构建由酶、多肽、电解质、辅酶等组成的准生物体系。该体系已成功实现Au纳 米 颗 粒[65]、Au 团 簇[66]、Au-Ag 合 金 纳 米 颗粒[67]、Te 纳米棒[68]、PbSe 纳米立方晶体[69]以及近红外Ag2Se 量子点[70]在无细胞水相中的可控合成。
通过合理调控准生物体系中NADPH 和GR 的浓度,在室温条件下即可得到粒径均一且尺寸可调的表面包覆GSH 的水溶性Au纳米颗粒。当溶液中Au3+和GSH 处于一定比例时,体系中生成一种特殊的GSH 和Cl–同时配位的Au(Ⅰ)离子。在室温条件下,还原性较弱的NADPH 通过静电作用与该配合物结合,将其还原成Au 纳米颗粒。该法制备的Au 纳米颗粒表面通过Au-S 键被GSH 紧密包裹,在室温和高盐浓度下均具有很好的稳定性[65]。通过对该反应过程的动力学进行调控,即可控制反应终止在初级阶段,合成平均粒径只有1.3 nm的Au 团簇[66]。由于Au 团簇在细胞中产生的活性氧会导致线粒体的氧化降解,因此Au 团簇具有剂量依赖的细胞毒性[71]。在用准生物体系合成Au-Ag合金纳米颗粒时,仅通过改变Au和Ag的投料比例就可以调控合金纳米颗粒的粒径[67]。模拟胞内高价碲(Na2TeO3)的代谢还原途径,利用准生物体系合成Te 纳米棒,且通过改变NaOH 浓度和酶的量就可以调控Te 纳米棒的长度[68]。此外,模拟胞内的硒代谢途径和GSH 与Pb2+的络合,在水相中合成了尺寸均一的PbSe 纳米立方晶体,其成核生长的过程属于动力学控制的非经典结晶过程[69]。在准生物体系中耦合Na2SeO3的还原过程和L-丙氨酸与Ag+络合两个反应,合成了粒径超小(1.5 nm)、生物相容性好的近红外Ag2Se 量子点,通过简单改变银和硒的投料比就可以调控产物的发射波长[图5(a)][70]。
3.2 应用
准生物体系在水相中进行,反应条件温和,合成的纳米材料仅通过超滤或透析纯化便可直接应用,且其表面配体多是氨基酸、多肽或蛋白,具有较好的生物相容性,因而可用于生物医学领域。其中Ag2Se 量子点因其近红外发射的优异荧光性质,被广泛应用在检测和活体成像等领域。如利用Ag2Se 量子点的阴极电致化学发光性质,构建适于实际样品中多巴胺检测的电致化学发光生物传感器,具有精密度好、准确度高的特性[72]。此外,合成得到的Ag2Se 量子点粒径仅1.8 nm,且以分子量较小的GSH 为表面配体,其水合粒径仅为4 nm,因此可以通过电穿孔的方法快速高效地标记病毒轻粒子,制备具有优异的肿瘤靶向性、体内肿瘤成像能力(Ag2Se 量子点的近红外荧光)和抗肿瘤疗效(负载抗肿瘤药物)的肿瘤靶向纳米载体[73]。由于Ag2Se 量子点表面富银,通过NaOH 溶液处理使其表面含氧,再利用Mn2+和O2–较强的配位能力,即可使Ag2Se 量子点的表面成功键合上Mn2+。该方法不仅不会破坏量子点内部的晶体结构,同时还可以使水分子直接和量子点表面的Mn2+接触,从而使其纵向弛豫率可以达到临床造影剂Gd DTPA 的4 倍[73]。采用电穿孔技术,可以实现该超小Ag2Se@Mn 量子点对微囊泡的快速高效标记,使其具有良好的近红外荧光和磁共振双模态成像性能[图5(b)][74],并首次揭示了被标记的循环微囊泡具有较强的肿瘤靶向性[75]。
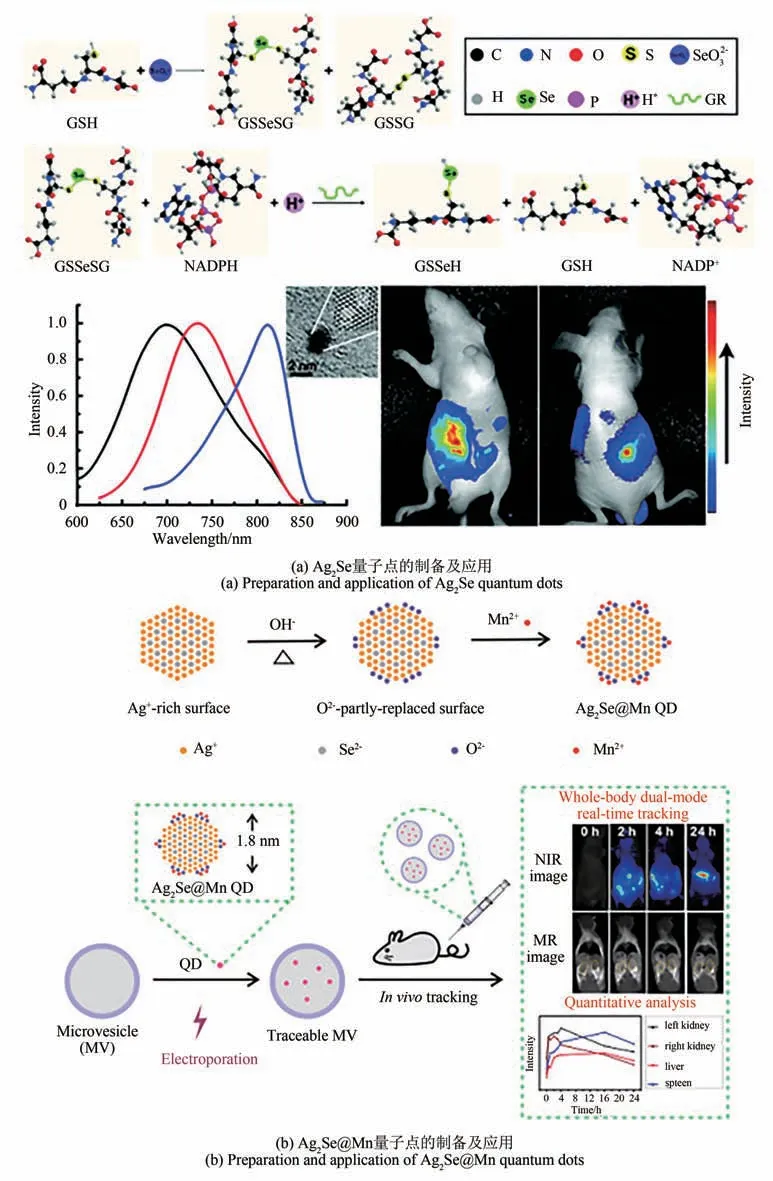
图5 准生物体系可控合成纳米材料及应用[70,74]Fig.5 Controllable synthesis and application of nanomaterials in quasi-biological systems[70,74]
4 挑战与展望
通过人为调控活细胞内一系列生化反应途径,使其在时间和空间上耦合,在真菌、细菌和哺乳动物细胞中成功合成了多种量子点。同时,通过活细胞合成量子点的机制研究,奠定了活细胞合成的科学基础,并可将“时-空耦合”活细胞合成反应中所涉及的复杂生化反应简化,进一步拓展至无细胞的准生物体系,实现通常难以制备的无机纳米材料合成。“时-空耦合”活细胞合成的相关工作不仅以复杂的活细胞结构、细胞代谢与无机盐的相互作用为基础,同时融入了人为设计的理念。然而,目前“时-空耦合”活细胞合成策略处在发展的关键时期,还面临着很多难题亟待解决和突破,如可利用代谢途径有限、原位表征技术匮乏等。
众所周知,活细胞内有着复杂的代谢网络,而目前可用于活细胞合成的代谢途径屈指可数,主要包括氧族元素(硫、硒、碲)的还原途径以及金属离子[镉(Ⅱ)、银(Ⅰ)等]的解毒途径。活细胞合成的量子点还是荧光发射集中在可见光区的二元或三元Ⅱ-Ⅵ族量子点(CdS、CdSe 和CdS0.5Se0.5等)。但是,随着活体成像技术在临床医学领域的广泛应用[76-81],利用活细胞制备发射波长在近红外波段(尤其是近红外二区,1000~1700 nm)的量子点有着更深远的意义。理论上,Ⅰ~Ⅵ族量子点(Ag2S、Ag2Se 和Ag2Te)的发射波长可以达到近红外二区,但是Ag2S、Ag2Se 和Ag2Te 的溶度积常数通常很小,以致难以调控量子点的粒径和荧光发射波长等[82-87]。目前根据已经报道的活细胞内其他离子的代谢途径,通过加
入合适的反应原料,利用活细胞内温和的代谢途径,调控量子点的成核生长,量子点发射波长有望从可见拓展至近红外波段。同时,合成多功能、多层级的纳米材料,如核壳结构或异质结构等还具有一定的挑战性。随着对代谢调控网络研究的深入,利用细胞内多条代谢通路、使用不同原料有望实现量子点结构和功能的多样化。
在活细胞合成量子点时,以活细胞或其衍生物(如微囊泡)为整体进行应用,可以避免提取、纯化带来的不良影响,同时还能够达到意想不到的效果。因此,在活细胞合成过程中,原位监测和表征量子点的形貌、尺寸、元素组成、荧光性质至关重要。目前适用于原位表征的方法主要有电子显微镜[88-90]、拉曼光谱[91-96]、荧光光谱[97-101]等,但是由于细胞环境和结构的复杂性,进行原位表征的难度依然很大。相信,随着原位表征技术的不断发展,原位实时监测纳米材料在细胞内的合成过程和分布情况也将成为可能。
在后续研究中,如何以具体的生物医学应用为导向设计活细胞合成,以及如何进一步深入认识合成机理、实现合成材料的多样化及合成调控的精细化,仍是日后需要思考和努力的方向。这些挑战意味着活细胞合成还有很多值得研究者挖掘的潜力,随着对活细胞合成机制认识的不断加深,还会发展出更加多样化的策略来操控活细胞内的生化反应途径,制备更丰富的高性能、多层级、多功能的纳米材料,同时衍生出基于发光活细胞直接制备发光外泌体、活体生物传感器和智能诊疗载体等的新方法。相信在不远的未来,活细胞合成量子点等无机纳米材料能够给合成生物学的发展带来更多的惊喜。

