双特异性抗体及纳米技术在肿瘤免疫治疗中的应用进展
许仕琳,许海燕
(中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005)
合成生物学是一种设计驱动的科学,主要通过对天然或合成成分的分解、重建及再利用来实现对人工生物系统的精确控制[1]。近年来,基于合成生物学的生物技术在疫苗研发、分子诊断和细胞治疗等领域中得到了广泛应用。肿瘤免疫治疗包括单克隆抗体类免疫检查点抑制剂、治疗性抗体、癌症疫苗和细胞治疗等[2],其中治疗性抗体已经成为肿瘤治疗的重要研究方向[3]。目前,被批准用于临床及处于临床试验研究阶段的治疗性抗体大多数是单特异性的,只能与单个靶点相互作用[4-5]。然而,复杂的疾病往往由多因素诱发,涉及多种配体、受体以及信号传导通路之间的串扰。例如,肿瘤细胞通常会上调多种促进细胞生长的受体的表达,这些受体能够通过单独或联合影响细胞内信号传导通路的活化干扰细胞功能[6-7]。因此,仅针对单一抗原的单特异性抗体治疗难以完全摧毁肿瘤细胞。
双特异性抗体是一种合成分子,将来自两个抗体的抗原识别位点结合成一个单一的结构,可以同时与不同的抗原或表位结合[8-9]。双特异性抗体的生产主要通过化学异源结合、杂交瘤技术和DNA重组技术等实现,这些生物合成方法提高了双特异性抗体的稳定性并降低了免疫原性,具有诱人的临床应用前景[10]。双特异性抗体在抗肿瘤治疗中的主要作用机制包括以下方面(图1)[11]:①招募T细胞或自然杀伤细胞,并将它们重定向至肿瘤细胞,增强其对肿瘤细胞的杀伤力;②同时阻断发病进程中两个不同的信号传导通路而发挥独特或重叠的功能,影响肿瘤细胞的生长增殖及存活;③同时靶向细胞表面不同的抗原或表位,增强其与肿瘤细胞的特异性结合并直接杀伤肿瘤细胞。需要强调的是,双特异性抗体要实现有效治疗必须有合适的药代动力学参数,这些参数可通过对双特异性抗体进行有针对性的修饰和改造来获得[12]。
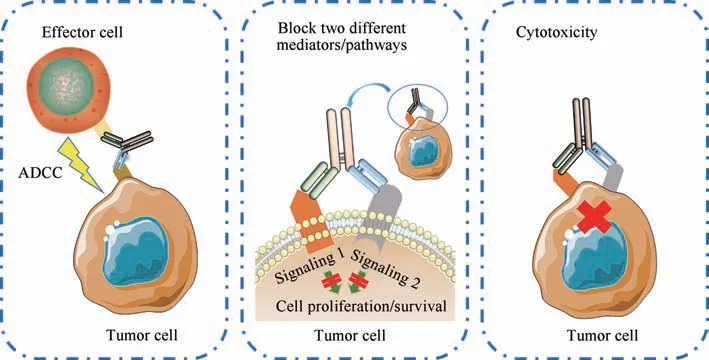
图1 双特异性抗体在肿瘤免疫治疗中的作用机制Fig.1 Mechanisms underlying tumor immunotherapy with bispecific antibodies
纳米医学在克服和跨越生物障碍、有效递送疏水药物和生物制剂以及优先靶向抗原位点等方面展现出诸多优势,纳米材料的高效负载能力和丰富的表面修饰方法为改善药物的生物相容性和药代动力学以及药物的靶向性提供了多种可能性。此外,纳米药物递送平台可同时装载多种药物,将其用于联合用药方案的优化可提高药物疗效,减少耐药的发生[13-14]。因此,纳米技术有望为双靶点抗体药物的研发提供有力的新工具。本文对近年来双特异性抗体及其与纳米技术相结合形成的递送系统在肿瘤免疫治疗中的应用进展做分类介绍和综合评述。
1 双特异抗体的制备及分类
天然抗体都是单特异性的,尽管单特异性抗体在肿瘤免疫治疗中的应用较为广泛,但是它们并未在临床应用中获得预期的疗效。这是由于单特异性抗体的治疗策略还存在诸多弊端,比如大部分患者会产生较为严重的不良反应以及患者对该疗法产生耐药进而导致疾病复发等[15]。鉴于上述原因,人工设计的双特异性抗体近年来受到越来越多的关注和开发,以期克服单特异性抗体治疗中出现的问题。制备重组抗体方法的发展可以使双特异性抗体具有明确的结构、组成成分、生化、功能和药理特性,在疾病诊断、成像、预防和治疗等方面有广阔的应用潜力,近年来有大量应用研究集中在肿瘤免疫治疗方面,如将包括T细胞在内的效应细胞重定向至肿瘤细胞[16]。
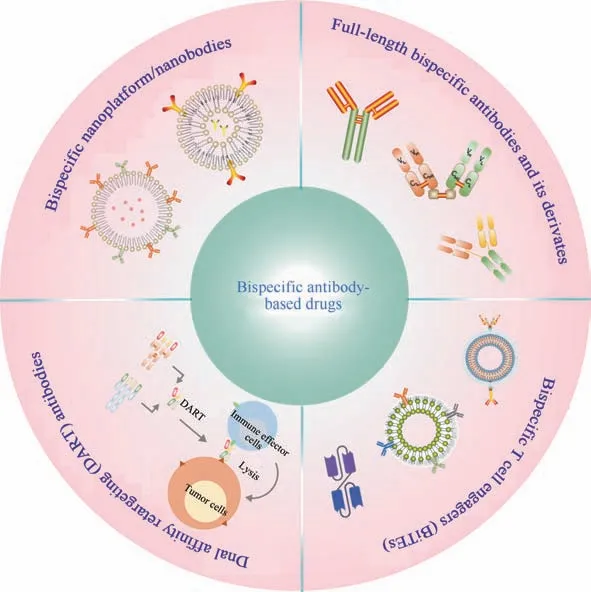
双特异性抗体分子在自然界中并不存在,因此,需采用生物化学、合成生物学和基因工程等技术手段设计制备。常用的双特异性抗体制备方法包括:①将两个不同的抗体或抗体片段利用化学偶联剂进行连接;②将两个产生不同抗体的杂交瘤细胞融合成双杂交瘤细胞株,在同一个细胞内产生两个不同的重链和两个不同的轻链,组成双特异性抗体分子;③利用基因工程技术对传统抗体进行多种形式的改造[16]。双特异性抗体存在多种形式,按其结构可划分为IgG 样双特异性抗体和非IgG 样双特异性抗体两大类[17],前者包含两个可结合不同抗原位点的Fab 片段和一个Fc 片段,保留了Fc 片段介导的效应功能,如抗体依赖细胞介导的细胞毒作用 (antibody-dependent cellular cytotoxicity,ADCC)、补体依赖的细胞毒作用(complementdependent cytotoxicity,CDC)和抗体依赖性细胞吞噬作用(antibody-dependent cellular phagocytosis,ADCP)[18];后者由于分子量较大且能够通过结合新生儿Fc 受体(neonatal Fc receptor,FcRn)循环利用,在血清中具有较长的半衰期。IgG 样双特异性抗体的生产工艺较为成熟,其中的Fc 片段也有助于增加抗体纯化的溶解度和稳定性[19]。IgG样双特异性抗体主要有三功能抗体(triomab)、“Knobsinto-holes”杵臼结构、双可变结构域Ig(dualvariable domains Ig, DVD-Ig)、 IgG 单 链 抗 体(IgG-single-chain Fv,scFv)等形式。非IgG 样双特异性抗体专门由Fab 片段组成,不包含Fc 片段。相比于IgG 样双特异性抗体,它们的分子量较小,在体内展现出更快的清除和更好的组织穿透能力。虽然这些非IgG 样双特异性抗体分子在结构上大致相似,都是两个或多个抗体Fab片段通过柔性肽连接,但每个分子都有独特的分子构型,这导致了双特异性抗体在物理化学性质、生物活性以及生产方法等方面的差异[17]。非IgG样双特异性抗体主要有双亲和重定向蛋白(dual-affinity re-targeting,DART)、纳米抗体(nanobodies)、双价和双特异性抗体(diabody)和双特异性T 细胞衔接器(bispecific T cell engager,BiTE)等形式。
2 双特异性抗体在恶性血液肿瘤免疫治疗中的应用
2.1 急性髓细胞白血病
急性髓细胞白血病(acute myeloid leukaemia,AML)是一种恶性血液肿瘤,其特征是细胞的分化成熟过程受到阻滞,在骨髓和外周血中聚集了大量未分化的原始细胞[20]。现行的AML 化疗方案可使60%~80%的患者获得完全缓解,但在完全缓解后5 年内有超过50%的患者会复发且预后较差,因此迫切需要开发新的治疗方法[21]。由于大多数白血病细胞与CD123、CD33、CD96、CLL-1 等特异性抗原的阳性表达有关,而双特异性抗体可以同时靶向不同抗原,因此,基于抗体的靶向治疗方法有望增强AML 的治疗效果并降低化疗所产生的毒副作用[22-23]。
Leong 等[24]设 计 了 一 种 靶 向CLL-1 的CD3 T 细胞依赖的双特异性全长人源化IgG1 抗体(Tcell-dependent bispecific,TDB)。该研究表明,CLL-1/CD3 TDB 具有良好的耐受性和清除靶细胞的能力。AMG330 是一种靶向CD3 和CD33 的双特异性抗体,能够招募CD3+T 淋巴细胞,引导其定向并裂解CD33+AML 原始细胞[23-24]。临床前研究结果表明,AMG330通过T细胞介导的细胞毒作用不仅可以有效杀伤AML 原始细胞,而且对CD33+骨髓来源的抑制性细胞具有明显的杀伤作用[25]。一项针对复发/难治性AML 患者的临床Ⅰ期研究(NCT02520427)结果表明,AMG330 具有明显的抗白血病活性,药物剂量达到720 μg/d时,患者对AMG330 的 耐 受 性 良 好[26]。 MGD006, 又 名Flotetuzumab,是一种靶向CD123×CD3 DART®蛋白。MGD006 介导T 细胞重定向至CD123+AML 细胞并将其杀伤,在食蟹猴模型中的耐受性良好,在临床前研究展现出抗白血病活性和可接受的安全性。临床Ⅰ/Ⅱ期试验(NCT02152956)结果表明,MGD006 在约31%的难治性AML 患者中展现出较好的耐受性和有效性,但在复发性AML 患者中 的 疗 效 并 未 显 现[27-28]。XmAb14045 是 一 种CD123×CD3 双特异性IgG 抗体,临床前研究结果表明,XmAb14045 能够招募并激活T 细胞,有效杀伤循环血液及骨髓中的CD123+细胞[29]。临床Ⅰ期研究(NCT02730312)的初步结果显示,XmAb14045 对复发/难治性AML 患者具有抗白血病作用,但仍需对药物最优剂量和毒副作用做进一 步 评 估[30]。JNJ-63709178 是Genmab 公 司 利 用DuoBody®技 术 设 计 的 一 种CD123×CD3 人 源 化IgG4 双特异性抗体,在体内、体外水平上均能特异性杀伤CD123+AML 细胞[31]。但是,在用于治疗复发/难治性AML 患者的临床Ⅰ期试验中,由于患者出现3级以上的细胞因子释放综合征而被搁置(NCT02715011)[32]。
近期有文献报道了一类新的抗体融合蛋白,称为“三体”(Triplebodies)。这些“三体”中的双抗体可以结合同一靶细胞上两种不同的肿瘤抗原,通过这种“双靶向”模式增强对肿瘤细胞的选择性,与此同时,“三体”中还包含一个激活效应细胞的触发分子,能够使双抗体定向到某种效应细胞[33-35]。例如,“三体”[123×ds16×33]是一种单链多肽,由抗AML 细胞上CD123 和CD33 的特异性单链抗体片段与抗NKs 和巨噬细胞上CD16的特异性单链抗体片段连接而成。与单靶向制剂[123×ds16×123]相比,双靶向“三体”[123×ds16×33]对CD33 和CD123 双 阳 性AML 细胞 的ADCC 作用显著增强;对从来自7 名AML 患者的外周血或骨髓中的原代白血病细胞的ADCC 作用也较强[34]。以此为基础对双靶向“三体”[123×ds16×33]进行优化,将鼠源的单链抗体片段替换为人源化且含有稳定二硫键的单链可变区抗体片段作为抗原结合位点,并加入了利于其临床应用的突变片段。结果显示,优化后的三体(SPM-2)在纳摩尔浓度下即可介导NKs 对来源于29 例不同AML 亚型患者的原代白血病细胞进行有效杀伤,而且表现出根除白血病干细胞的潜力[36]。
脱靶效应造成的细胞毒性是导致AML 免疫治疗药物研发缓慢的重要因素之一[32]。目前,许多针对AML 治疗的新型双特异性抗体在实验室阶段研究中展现出了良好的抗白血病效果,但在临床试验阶段的治疗效果尚未达到预期。若将双特异性抗体与其他形式的免疫治疗方法相结合,如靶向共刺激信号通路和免疫逃逸机制,或可进一步提高AML的疗效和临床效益。
2.2 B细胞恶性血液肿瘤
B 细胞恶性血液肿瘤通常起源于生发中心中的B细胞,这些细胞具有较高的增殖速率,易发生染色体易位或染色体畸变(形成超二倍体或亚二倍体),可诱发白血病的形成[37]。为改善患者经化疗后产生的明显毒性并降低疾病复发,激酶抑制剂和治疗性抗体已逐渐成为治疗B细胞恶性血液肿瘤的重点研究方向[38-39]。
CD19 是一种在B 细胞恶性血液肿瘤中广泛表达的表面标记物。研究人员设计了一种靶向CD47和CD19 的全人源化的双特异性抗体NI-1701,在体内、体外实验中均可显著杀伤B细胞恶性血液肿瘤细胞,同时抑制小鼠异种移植模型中肿瘤的生长。该研究表明,NI-1701 通过与淋巴瘤细胞上CD47/CD19 的结合,诱导抗体依赖性细胞吞噬作用(antibody-dependent cellular phagocytosis,ADCP),有效清除靶细胞[40]。HD37×T5.16 是一种由四源杂交瘤细胞分泌得到的双特异性抗体,可同时靶向CD19 和CD5。研究结果显示,HD37×T5.16 能够增强细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)对CD19+B 细胞淋巴瘤细胞系的杀伤[41]。
MGD011,又名Blinatumomab,是一种CD19×CD3 DART,旨在重定向T 淋巴细胞,以消除CD19+B 细胞淋巴瘤细胞。临床前研究结果表明,MGD011 可介导人或食蟹猴的外周血单个核细胞(peripheral blood mononuclear cell,PBMCs)对人的B细胞淋巴瘤细胞有效杀伤;MGD011对小鼠移植性淋巴瘤模型具有良好的抗肿瘤作用;食蟹猴对MGD011 有良好的耐受性,没有出现化合物毒性作用及病理改变[42]。2014年12月,美国FDA批准将MGD011 用于治疗复发/难治性急性B 淋巴细胞白血病患者[43]。在评估MGD011 对NHL 患者治疗效果的初步报告中,4 例患者获得完全缓解,7例患者获得部分缓解[44]。临床Ⅰ期剂量递增试验(NCT02454270)结果表明,逐步增加给药剂量至患者的最大耐受剂量可让NHL 患者获得更为持久的缓解[45];MGD011 对复发/难治性弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)患者疗效及安全性评估的临床Ⅰ/Ⅱ期研究结果也得到了相似的结果[46],即MGD011 单独治疗复发/难治性NHL或DLBCL患者均表现出良好的抗淋巴瘤作用。由于MGD011 在患者体内的半衰期(约2 h)较短,对MGD011 进行优化,如AFM11、AMG562 和HLE-BiTEs 等[47-49],尽 管未 影 响其 疗效,但这些双特异性抗体会引起较强的神经毒性或细胞因子释放综合征,因此临床试验一再搁置。
靶向CD20 的治疗策略对CD20+前体B 细胞淋巴细胞白血病(precursor B-cell lymphoblastic leukemia,BCP-ALL)患者以及CD19 抗原阴性复发患者的治疗较有前景[50-51]。几种靶向CD20 和CD3 的双特异性抗体(如FBTA05、REGN1979、Mosunetuzumab 和XmAb13676)正处于临床Ⅰ/Ⅱ期研究阶段[52-54]。初步结果表明,这些CD20×CD3双特异性抗体单独或与免疫检查点抑制剂、化疗联合治疗CD20+B细胞恶性血液肿瘤患者具有令人满意的安全性和有效性[55-56]。
信号调节蛋白α(signal regulatory protein alpha,SIRPα)是一种在吞噬细胞(包括巨噬细胞和树突状 细 胞) 上 表 达 的 蛋 白[57]。 SIRPα 的 配体为CD47,在B 细胞非霍奇金淋巴瘤(B cell non-Hodgkin lymphoma,NHL)、AML 和多种实体瘤细胞上均过度表达[58]。SIRPα 与CD47 结合后可启动信号级联通路传递“不要吃我”的信号,使肿瘤细胞逃避吞噬细胞的吞噬[59]。由于CD47在正常组织细胞上也普遍表达,抗CD47 的单特异性抗体很难在体内精准靶向肿瘤细胞。解决这一问题的一种治疗策略是设计双特异性抗体,降低对CD47 的亲和力并保留阻断CD47-SIRPα 相互作用的能力,加入抗肿瘤其他抗原的抗体片段以实现对肿瘤细胞的高亲和力。Piccione 等[60]研发了一种同时靶向CD47 和CD20 的双特异性抗体CD20-CD47SL,这是具有双重可变结构域的免疫球蛋白(dual-variable-domain immunoglobulin,DVD-Ig)。体外实验结果表明,当淋巴瘤细胞与红细胞(CD47 高表达)共培养时,CD20-CD47SL 能选择性地结合CD47+CD20+淋巴瘤细胞;动物实验结果表明,CD20-CD47SL 能减轻小鼠的淋巴瘤负担,显著延长生存期。
综上,在实验室研究及临床试验阶段的初步结果表明,双特异性抗体或可成为治疗B细胞恶性血液肿瘤的一个较有前景的治疗策略。虽然观察到双特异性抗体具有一定的抗肿瘤作用,但其临床转化仍受到毒副作用的限制,如脱靶效应、药理局限性等[61]。因此,需要结合免疫学、药理学和合成生物学等专业知识来提高双特异性抗体在B细胞恶性血液肿瘤中的治疗效果。
3 双特异性抗体在实体瘤免疫治疗中的应用
3.1 乳腺癌
乳腺癌是全球女性中最常见的肿瘤之一,在中国,乳腺癌的发病率和死亡率分别位列女性恶性肿瘤的第1 位和第4 位[62]。人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)是一种跨膜蛋白,属于表皮生长因子受体酪氨酸激酶家族,在15%~20%的乳腺癌中过表达,是一个重要的治疗靶点[63]。曲妥珠单抗(Trastuzumab)、帕妥珠单抗(Pertuzumab)和拉帕替尼(Lapatinib)等已被广泛用于HER-2阳性乳腺癌患者的治疗[64-66],但并不是所有患者均能从中获益,部分患者会复发和转移,最终导致死亡。因此,开发新的靶向治疗策略十分必要。
厄妥索单抗(Ertumaxomab)是一种靶向HER-2和CD3的三功能双特异性抗体,可优先结合并激活Fcγ Ⅰ/Ⅲ型受体,在肿瘤细胞、T 细胞和辅助细胞之间形成三细胞复合体[66-67],在曲妥珠单抗耐药和HER2/neu 抗原密度低的细胞上表现出了抗肿瘤作用,其临床Ⅰ期研究结果表明,厄妥索单抗对转移性乳腺癌患者具有长期抗肿瘤免疫效应[67]。M802 是通过盐桥和同二聚体“杵臼结构”(knobsinto-holes)技术设计的一种HER-2/CD3 双特异性抗体,能重定向CD3+免疫细胞,对HER-2 阳性、HER-2 阴性和曲妥珠单抗耐药的细胞具有比曲妥珠单抗更强的杀伤作用[68]。MM-111 由抗HER-2和抗HER-3 单链抗体与经修饰的人血清白蛋白相连接而成[69],可同时与HER-2 和HER-3 结合形成三聚体复合物,阻断HER-2 过表达的肿瘤细胞内HER-3 和PI3K 信号通路的传导[70]。MM-111 与曲妥珠单抗和拉帕替尼联合应用可有效抑制HER-2阳性乳腺癌小鼠肿瘤的生长,比AKT和MEK 抑制剂的联合治疗效果更为显著[71]。
肝配蛋白受体A10(ephrin receptorA10,EphA10)是一种跨膜受体,被鉴定为新的人乳腺癌生物标志物[72]。靶 向EphA10 和CD3 的 双 特 异 性 抗 体(EphA10/CD3 BsAb)能重定向T 细胞,有效裂解过表达EphA10 的乳腺癌细胞。二聚体形式的BsAb比单体形式的BsAb对细胞的毒性更强,在小鼠异种移植模型中也表现出显著的抗肿瘤效应[73]。基于抗PD-L1 抗体阿替唑单抗(Atezolizumab)和共有变异体1(CV1)的可变区可构建针对CD47和PD-L1 的双靶向融合蛋白IAB[74],在体外诱导吞噬细胞吞噬肿瘤细胞、激活T 细胞介导的ADCC作用。在免疫功能正常的MC38 小鼠模型中,IAB表现出较强的抗肿瘤活性。但抗CD8 抗体或氯膦酸盐脂质体均可削弱IAB 的抗肿瘤作用,说明该作用需要CD8+T 细胞和巨噬细胞的参与。此项研究提示IAB 对CD47 和PD-L1 的双重阻断可能成为一种同时激活天然免疫应答和获得性免疫应答的协同治疗方法。B7-H4(VTCN1)是一种负调控免疫应答的免疫检查点分子,在多种人类肿瘤中过表达。靶向B7-H4 和CD3 的双特异性抗体能够介导人PBMCs 对乳腺癌细胞及其他B7-H4+细胞株的有效杀伤,在小鼠异种移植模型中展现出较强的 抗 肿 瘤 作 用[75]。 催 乳 素 受 体(prolactin receptor,PRLR)是一种Ⅰ型细胞因子受体,在正常乳腺组织中仅轻度表达,在肿瘤乳腺组织中高表达[76]。通过分裂内含蛋白介导的蛋白质转导(split intein mediated protein transsplicing,BAPTS)系统技术研发的靶向PRLR 和CD3 的双特异性抗体PRLR-DbsAb 能在体外招募并激活T 细胞,促进T 细胞分泌IFN-γ 和TNF-α 细胞因子对PRLR+乳腺癌细胞有效杀伤;相比于PRLR 单抗治疗组,PRLR-DbsAb 能显著抑制肿瘤的生长,延长小鼠生存期[77]。
3.2 卵巢癌
卵巢癌是一种常见的妇科恶性肿瘤,死亡率在妇科肿瘤中居首位[78]。外科手术治疗与含铂类化疗药物辅助治疗相结合仍然是现阶段卵巢癌治疗的主要手段,大约有80%的患者会获得完全缓解,但其中有超过60%的患者最终会复发,只有不到40%的患者能长期存活5年以上,因此,迫切需要开发新的卵巢癌治疗方法[79-80]。
人上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)是一种Ⅰ型跨膜糖蛋白,在多种肿瘤细胞(如卵巢癌、胃癌、前列腺癌和乳腺 癌 等) 上 高 表 达[80-82]。 卡 妥 索 单 抗(Catumaxomab)是一种由抗EpCAM 抗体片段和抗CD3 抗体片段组成的双特异性抗体,能招募并重定向T细胞介导ADCC 作用,或激活T细胞分泌穿孔素和颗粒酶B对肿瘤细胞有效杀伤。卡妥索单抗也可以通过其完整的Fc 段与辅助细胞(如巨噬细胞、树突状细胞和自然杀伤细胞)上的Fcγ受体结合,激活过表达Fcγ 受体的辅助细胞吞噬肿瘤细胞[83]。临床Ⅰ/Ⅱ期研究结果显示,卡妥索单抗明显降低卵巢癌患者体内腹水的积累,有效杀伤EpCAM+肿瘤细胞,并具有可接受的安全性[84]。一项多中心、单臂临床Ⅱ期研究结果表明,原发性上皮卵巢癌患者在术后标准化疗前接受卡妥索单抗治疗,获得了预期疗效,但约有39%的患者出现伤口并发症、胸腔积液和感染等毒副作用[85]。AMG110 是由抗EpCAM 单链抗体和抗CD3 单链抗体组成的双特异性抗体[86],能介导免疫效应细胞有效杀伤EpCAM+原发性子宫癌和卵巢癌肉瘤细胞[87],也能显著抑制原发性耐药上皮性卵巢癌细胞系及来源于卵巢癌患者体内腹水肿瘤细胞的活性[88]。一项临床Ⅰ期研究结果显示,AMG110 在约95%的EpCAM+难治性实体瘤患者中出现了剂量限制性毒性(如严重腹泻、肝酶升高),难以达到有效发挥抗肿瘤作用的治疗剂量[89]。
通过化学编程技术可将人源化单克隆抗体h38C2 与人源化抗CD3 单克隆抗体v9 制备成h38C2×v9 DART 蛋白,同时靶向叶酸受体1(folate receptor 1,FOLR1)和CD3。研究结果表明,h38C2×v9 DART 蛋白能选择性地与过表达FOLR1 的卵巢癌细胞结合,招募并激活T 细胞有效抑制肿瘤细胞的增殖[90]。进一步设计的不对称双特异性抗体(CD3×FOLR1 biAbs)可介导T 细胞对过表达FOLR1 的卵巢癌细胞的杀伤,在小鼠异种移植模型中展现出良好的抗肿瘤效果[91]。靶向FOLR1 和死亡受体5(death receptor,DR5)的双特异性细胞毒性激活剂抗体BaCa 能选择性地与FOLR+卵巢癌细胞结合并锚定在细胞上,维持高水平的肿瘤特异性细胞凋亡并在小鼠异种移植模型中展现出良好的抗肿瘤作用,比此前报道的DR5激动剂的抗肿瘤效果更为突出[92]。由人/鼠嵌合的抗Ⅰ型胰岛素样生长因子受体(type Ⅰinsulin-like growth factor receptor,IGF-1R)的单克隆抗体m590 和抗HER-2 的曲妥珠单抗组成的双特异性抗体Bi-Ab可通过阻断PI3K/AKT和促分裂原活化蛋白激酶信号通路的磷酸化而显著抑制HER-2+IGF-1R+卵巢癌细胞SKOV-3 的增殖。相比于m590、曲妥珠单抗单独或两种抗体联合的治疗,Bi-Ab 在小鼠异种移植模型中展现出更好的抗肿瘤效果[93]。
3.3 肺癌和头颈癌
表皮生长因子受体(epidermal growth factor receptor,EGFR)的过度表达与头颈癌、肺癌、乳腺癌、结肠癌和前列腺癌患者的预后不良相关[94]。血管内皮生长因子(vascular endothelial growth factor,VEGF)和EGFR 通路相互作用,促进肿瘤生长及血管生成,因此,同时靶向EGFR 和VEGF的治疗性抗体可能比单特异性抗体的抗肿瘤效果更好[95]。例如,抗EGFR和VEGF的双特异性抗体DT-IgG[96]可显著抑制非小细胞肺癌(non-small-cell lung cancer,NSCLC)细胞A549 和头颈部鳞状细胞 癌(head and neck squamous cell carcinoma,HNSCC)细胞Tu212 的生长,诱导细胞凋亡的能力与西妥昔单抗(抗EGFR单克隆抗体)相似;尽管DT-IgGs在血清中的半衰期较短,但在肺癌和头颈癌的小鼠异种移植模型中表现出与贝伐单抗相当的疗效[97]。MEHD7945A(Duligotuzumab)是一种人源化EGFR/HER-3 双特异性IgG1 抗体,其中两个抗原结合片段均能与EGFR和HER-3具有较高的亲和力[98-99],在抑制EGFR/HER-3信号传导通路、肿瘤生长和细胞周期方面比西妥昔单抗和抗HER-3 抗体联合治疗的效果更显著;还能通过调节细胞周期进程和控制凋亡细胞死亡的修复过程,限制EGFR抑制剂耐药细胞对辐射的交叉耐药[100]。MEHD7945A 联合放疗对肺癌和头颈癌细胞系及小鼠异种移植模型均具有良好的抗肿瘤作用[98]。与抗HER 单特异性抗体相比,MEHD7945A 在多种肿瘤模型中均表现出抗肿瘤效应,体现了双靶向抑制EGFR 和HER-3的重要性。目前,MEHD7945 A正在一项用于上皮性实体肿瘤的临床研究中,临床Ⅰ期研究结果表明,MEHD7945A与顺铂/5-氟胞嘧啶或卡铂/紫杉醇联合治疗复发/转移性HNSCC患者展现出良好的抗肿瘤作用,但同时也增加了对患者的毒副作用[101];另一项多中心、随机、开放性临床Ⅱ期研究表明,在针对复发/转移性HNSCC 患者的治疗中,MEHD7945A 与西妥昔单抗的疗效并无明显差异[102]。Croasdale 等[103]报道了同时靶向IGF-1R 和EGFR 的双特异性抗体。结果显示,IGF-1R-EGFR 双特异性抗体能够阻断IGF-1R 和EGFR 信号通路介导的ADCC 作用,有效抑制H322M 和H460M2 肿瘤细胞的增殖;在BxPC3 和H322M 小鼠皮下移植模型中,IGF-1REGFR双特异性抗体比抗IGF-1R和EGFR单特异性抗体联合应用的抗肿瘤效果更强。
神经毡蛋白1(neuropilin-1,NRP1)是一种非酪氨酸激酶受体,作为其他细胞表面受体(如整合素)的辅助受体,在多种实体瘤中过表达,并在肿瘤的发生发展、转移和血管生成中起关键作用。此外,NRP1 的过表达与NSCLC 的不良预后相关[104-106]。Ctx-TPP11 是一种由NRP1 靶向肽TRR11 与西妥昔单抗重链的C 末端融合而成的双特异性抗体,通过与NRP1 结合而被细胞内化,抑制与NSCLC 耐药相关信号通路PI3K-Akt 和RalBTBK1 的传导,有效逆转了西妥昔单抗在NSCLC KRAS 突 变 型 肿 瘤 细 胞 中 的 耐 药[107]。RANK(TNFRSF11a)和RANKL(TNFSF11)分别是肿瘤坏死因子受体和配体超家族的成员,与CD40 和CD40L 同源性最高[108]。研究表明,在不同的小鼠肿瘤模型(如肺癌、黑色素瘤、前列腺癌、结肠癌等)中,抗RANKL 单克隆抗体与免疫检查点抑制剂(如抗PD-1、CTLA-4 或PD-L1 的单克隆抗体)联合治疗可有效抑制肿瘤的生长和转移[109-111]。在肿瘤耐药微环境中,靶向RANKL 和PD-1 的双特异性抗体比单特异性抗体联合治疗的抗肿瘤效果更为显著[112]。
3.4 双特异性抗体在其他肿瘤免疫治疗中的应用
常规化疗对晚期直肠癌(colorectal cancer,CRC)患者的生存率没有明显改善。由嵌合的抗CD133 单克隆抗体AC133 和人源化OKT3 单链组成的非对称双特异性抗体MS133 对CD133 和CD3具有双重抗原结合特异性。MS133 对高表达CD133 的CRC 细胞具有明显的细胞毒作用,对低表达CD133 的CRC 细胞无明显杀伤作用;在非肥胖型糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠模型中,MS133 能有效抑制肿瘤的生长,延缓发病进程,且无明显的毒副作用[113]。靶向EGFR和IGF-1R 的双特异性IgG 样抗体EI-04 能够有效抑制肿瘤细胞EGFR 和IGF-1R 的磷酸化,阻断AKT和ERK 下游通路的激活,进而抑制肿瘤细胞的生长增殖、阻滞细胞周期进程。在人胰腺癌BxPC3细胞株的小鼠异种移植模型中,EI-04 表现出比抗EGFR 或抗IGF-1R 单克隆抗体以及两种单克隆抗体联合治疗更强的抗肿瘤作用[114]。MM-141(Istiratumab)是一种靶向IGF-1R 和HER-3 的双特异性抗体,通过抑制AKT 的磷酸化而促进IGF-1R和HER-3 蛋白的降解,增强胰腺癌细胞对化疗药的敏感性[115]。一项多中心、随机双盲、安慰剂对照Ⅱ期临床试验研究表明,相比于白蛋白结合型紫杉醇和吉西他滨的标准治疗方案,MM-141与标准化疗方案联合对转移性胰腺癌患者的治疗效果并未有明显改善[116]。
目前,大多数针对于实体瘤治疗的双特异性抗体在临床前研究阶段已取得良好的抗肿瘤效果,但在临床试验阶段的治疗效果尚未达到预期。简化双特异性抗体的结构和制备流程,利用合成生物学等方法对双特异性抗体的结构进行调整和改进,建立一个强大的双特异性抗体设计及生产制作平台,或可成为增强双特异性抗体在肿瘤免疫治疗中的疗效,以及改善药物对患者的毒副作用的关键。
4 基于纳米技术设计的双特异性抗体在肿瘤免疫治疗中的应用
近年来,纳米技术在肿瘤免疫治疗中的应用受到越来越多的关注。纳米治疗技术可将特异性单克隆抗体、治疗性药物或显影剂物理包埋或化学偶联到纳米载体上,形成功能化的纳米颗粒,其优势在于:①纳米颗粒具有较长的循环能力,将蛋白质的小分子片段连接到纳米颗粒表面可以延长其在体内的循环时间,减少给药频率;②纳米颗粒具有柔性的表面修饰能力,为表面偶联多价抗体或多型抗体提供了平台;③载有治疗性药物的纳米颗粒可以增强杀伤细胞的能力,展现出较强的抗肿瘤作用[117]。因此,在肿瘤免疫治疗中应用纳米技术具有重要的意义。
目前,甲氧基聚乙二醇化纳米颗粒(methoxy PEGylated nanoparticles,mPEG-NPs)越来越多地应用于肿瘤成像和治疗。有研究报道一种同时靶向mPEG 分子和EGFR 或HER2 分子的人源化双特异性抗体(BsAbs)[118],BsAbs 由人源化抗mPEG抗体的Fab 段与抗EGFR 或HER2 单链抗体融合而成。研究表明,BsAbs 与mPEG-NPs 简单混合后,在生理环境下,可有效介导多种mPEG-NPs 与EGFR+或HER+肿瘤细胞优先结合;当mPEG-NPs负载阿霉素后,能显著增强阿霉素对EGFR+或HER+肿瘤细胞的杀伤。动物实验结果显示,BsAbs 修饰的mPEG-NPs 在小鼠肿瘤中的积累量明显增加,也显著提高了载药NPs对EGFR+的小鼠异种移植模型的抗肿瘤活性。在此基础上研发的一种人源化双特异性抗体(mPEG×HER2)可用于修饰脂质体阿霉素(PEGylated liposomal doxorubicin,PLD),组成HER2 靶向脂质体αHER2/PLD,增强PLD 对过表达HER2的乳腺癌细胞的特异性、细胞内化和抗肿瘤活性[119]。结果显示,αHER2/PLD 对乳腺癌耐药细胞株有显著的细胞毒作用;在荷瘤小鼠中,与无靶向PLD 相比,αHER2/PLD 在小鼠体内的肿瘤细胞核中有效积累阿霉素,展现出良好的抗肿瘤作用。该团队也利用mPEG×HER2 双特异性抗体修饰多种纳米探针(如超顺磁性氧化铁纳米颗粒、量子点和胶体金纳米粒子等),用于增强HER2+肿瘤多模成像的灵敏度和对比度强度[120]。对HER2+乳腺癌小鼠模型的成像结果表明,相比于无靶向的纳米探针,经双特异性抗体修饰后的脂质体纳米探针(αHER2/Lipo-DiR)和超顺磁性氧化铁纳米颗粒(αHER2/SPIO)能有效靶向HER+肿瘤,并增加纳米探针在肿瘤中的积累。
众所周知,所有IgG 抗体中Fc 段的结构高度一致,且抗IgG(Fc 段特异性)抗体[anti-IgG(Fc specific) antibody,αFc]能够通过非共价相互作用特异性识别并结合任何包含Fc 段的单克隆抗体[121-122]。据此,有研究组将αFc 偶联到纳米载体的表面,构筑了一种通用的“抗体固定平台”(αFc-NP)。研究证实,αFc-NP 可以方便有效地固定两种类型的单克隆抗体,经简单物理混合制备出新型双特异性纳米抗体,但不会损害原来的单克隆抗体的抗原结合能力,命名为“免疫调节纳米 适 配 子”(immunomodulating nano-adaptors,imNAs)[123]。研究人员以免疫检查点抑制剂抗PD1抗体αPD1 和抗PDL1 抗体αPDL1 为模型制备了一种纳米适配子imNAsαPD1&αPDL1。研究结果表明,与αPD1 和αPDL1 单克隆抗体相比,imNAsαPD1&αPDL1能有效促进T细胞与肿瘤细胞的相互作用,显著增强T细胞介导的抗肿瘤免疫效应。不同于复杂的分子设计和基因工程,该研究为双/多特异性抗体的设计提供了一种新的更为简便的方法。
将生物素标记的抗CD20和抗CD3单克隆抗体偶联到链霉亲和素修饰的超小Fe3O4纳米颗粒表面,可构建一种水合动力学尺寸为30 nm 的双特异性纳米平台(bi-specific nanoplatform,BSNP)[124]。研究表明,相比于临床应用的钆(Gd)对比剂,所合成的BSNP 具有更好的磁共振成像能力。在细胞水平上,BSNP 可以靶向CD20+的人Burkitt 淋巴瘤细胞Raji,同时招募并重定向T 细胞,增强T 细胞介导的体外细胞杀伤作用;在动物水平上,BSNP能明显抑制肿瘤的生长,延长NHL小鼠异种移植瘤模型的生存期。模块化设计的BSNP提供了一种潜在、有效的肿瘤免疫治疗策略,后续可通过结合不同的单克隆抗体构建多种双/多特异性纳米平台,以期增强肿瘤治疗效果。Ding等[125]设计了一种靶向EGFR1 和HER2 的双功能抗体MaAbNA。研究结果显示,MaAbNA 可显著抑制过表达EGFR1 和HER2 的乳腺癌细胞增殖,且对低表达EGFR1 和HER2 的细胞具有较弱的毒性。为了增强MaAbNA 的抗肿瘤作用,该团队利用聚乙二醇接枝共聚物(PEG2000)将MaAbNA 和阿霉素(Adriamycin,ADM)偶联形成复合抗癌药物MaAbNA-PEG2000-ADM,该复合药物具有比单独ADM 或MaAbNA以及西妥昔单抗或曲妥珠单抗更强的抗肿瘤效果。MaAbNA 及其衍生物MaAbNA-PEG2000-ADM 的抗肿瘤效果在动物实验中也得到了验证。Xu 等[126]研发了一种以PEG 化的中空介孔钌纳米颗粒(hollow mesoporous ruthenium nanoparticles,HMRu NPs)为载体,负载抗肿瘤荧光复合物([Ru(bpy)2(tip)]2+,RBT)和抗CD16 和抗癌胚抗原(carcinoembryonic antigen,CEA) 的双特异性抗体SS-Fc 形成偶联物HMRu@RBT-SS-Fc。结果表明,HMRu@RBT-SSFc 能有效靶向并杀伤过表达的癌胚抗原的结直肠癌细胞;在CT26-CEA结直肠癌小鼠皮下移植瘤模型中,HMRu@RBT-SS-Fc 通过在肿瘤部位的大量积累和重定向免疫效应细胞对肿瘤细胞有效杀伤。
Alhallak 等[127]设计了一类基于纳米颗粒的双特异性T 细胞衔接器(nanoparticle-based bispecific T-cell engagers,nanoBiTEs),即在脂质体上偶联靶向T 细胞的抗CD3 单克隆抗体和靶向肿瘤抗原(如CD20、BSMA、CS1 和CD38)的单克隆抗体。研究人员也开发了一种基于纳米颗粒的多特异性T细胞衔接器(CD3/BCMA/CS1/CD38 nanoMuTEs),即在脂质体上同时偶联靶向T细胞的抗CD3单克隆抗体和靶向不同肿瘤抗原的多种单克隆抗体。研究结果表明,nanoBiTEs和nanoMuTEs的半衰期均在60 h 左右,因此不需要连续注射,1 周注射1 次即可在体内外维持较好的治疗效果;而且相比于nanoBiTEs,靶向多种肿瘤抗原的nanoMuTEs 在细胞和动物水平中对骨髓瘤细胞的杀伤效果更为显著,其优势在于nanoMuTEs 不会导致单个肿瘤抗原的下调(或丢失),能有效防止因抗原丢失的肿瘤逃逸过程。细胞核蛋白Ki-67 在快速增殖的细胞中过表达,它也是在肿瘤患者的活组织检查中一种确定的可评估细胞增殖活性的预后指标[128]。利用纳米技术对细胞内的分子过程进行光学控制,具有较高的空间和时间精度,也能同时结合靶向和有效杀伤细胞的机制,有望为肿瘤靶向治疗提供新的思路和方法。Wang 等[129]设计了一种针对细胞表面蛋白EGFR 和细胞核蛋白Ki-67 的双重靶向策略,该策略能选择性地靶向过表达EGFR 和Ki-67 的肿瘤细胞并利用光控有效杀伤细胞。抗EGFR 抗体西妥昔单抗与经聚乙二醇修饰后的脂质体通过共价键结合形成靶向EGFR 的免疫脂质体,在690 nm 光照下,与细胞共孵育的光敏剂卟啉衍生物(benzoporphyrin derivative,BPD)能触发免疫脂质体和细胞核内体膜的破坏,即免疫脂质体能被EGFR+细胞有效摄取,释放异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗Ki-67抗体TuBB-9;之后在490 nm 光照下,激活FITC标记的TuBB-9,导致Ki-67 蛋白失活,诱导细胞凋亡。结果显示,该双重靶向策略对过表达EGFR和Ki-67 的肿瘤细胞(人宫颈癌细胞HeLa 和人卵巢癌细胞OVCAR-5)具有高度选择性,能有效杀伤肿瘤细胞,且对正常人成纤维细胞没有选择特异性。间皮素(mesothelin,MSLN)是一种糖基磷脂酰肌醇锚定蛋白,在正常细胞上弱表达,在三阴性乳腺癌中高表达,因此成为一个有吸引力的靶点[130]。研究人员设计了一种抗MSLN 的纳米抗体(nanobody)和抗CD16 的纳米抗体组成的与Fab段结构相似的双特异性抗体MesobsFab[131]。体外实验结果表明,MesobsFab 能有效招募NK 细胞定向到MSLN+三阴性乳腺癌细胞系中,介导ADCC作用有效杀伤细胞并降低细胞的侵袭性。在三阴性乳腺癌小鼠异种移植模型中,MesobsFab 能显著抑制肿瘤的生长。
综上,基于纳米颗粒的双特异性抗体制剂可以更灵活地构建多价或多臂结构,在维持良好的抗肿瘤作用的同时有效延长循环时间。因此,纳米技术在提高疗效、增加转化潜能甚至在现有肿瘤免疫治疗的基础上开发新的治疗策略等方面均发挥着独特的作用。
5 总结和展望
临床中虽然可以根据疾病的发病部位将患者统一归类,但在患有同一类型肿瘤患者的体内所检测到的肿瘤特异性标志物的表达可能存在较大差异,因此,设计个性化/精准医学治疗方案是解决肿瘤异质性的有效方法。近年来,肿瘤免疫治疗已经成为一个快速发展的领域,成为许多实体肿瘤和恶性血液肿瘤的标准治疗手段。双特异性抗体作为新一代的肿瘤治疗策略,因其独特的作用机制而备受关注。一般来说,双特异性抗体比单特异性抗体联合的治疗效果更好,主要是因为双特异性抗体在与肿瘤细胞高度结合的同时能够招募并重定向免疫效应细胞,选择性攻击并裂解肿瘤细胞。经人工设计的双特异性抗体对肿瘤细胞的靶向更为精准,有望降低与治疗相关的不良反应。
虽然目前仅有少数双特异性抗体获得了上市批准,但有若干新的双特异性抗体已进入临床试验阶段,并取得了令人鼓舞的初步结果,它们不仅应用于肿瘤免疫治疗,而且还可用于治疗其他疾病[11,132]。双特异性抗体的设计具有多种形式,如BiTEs、DART、同二聚体“杵臼结构”抗体和三功能性双特异性抗体等。未来对双特异性抗体的设计和形式可能会整合多种功能,以靶向两个或更多的肿瘤抗原,同时连接T细胞和辅助细胞形成人工免疫突触。然而,在双特异性抗体设计及构建中仍存在诸多挑战,比如提高特异性、敏感性和稳定性、增加其半衰期以及选择合适的靶抗原以限制肿瘤外毒性等[133-134]。尽管利用杂交瘤细胞技术在制备重组的双特异性抗体方面已进行了较大优化,但在双特异性抗体制备的过程中想要同时实现高产和低成本的目标仍需更多努力。为了解决上述问题,研究人员可综合多种方法(如药物化学、蛋白质组学、合成生物学、生物化学和计算化学等)来探索复杂的、相互关联的分子信号通路,这将有助于设计双特异性抗体,从而有效阻断致癌途径。同时,将系统生物学和在全基因组范围内研究药物作用的系统药理学结合使用,能够促进更多新型双特异性抗体的研发。
此外,纳米技术介导的靶向治疗策略在肿瘤治疗中的应用也已经成为一大研究热点,将多种形式的双特异性抗体与纳米载体通过简单的混合即可形成功能化的纳米颗粒,可以在一定程度上克服传统的全长单克隆抗体与纳米药物偶联物的不稳定性及非特异性结合,改善疗效并延长循环时间等[135]。
综上所述,双/多特异性抗体可能在不久的将来成为一类有效且广泛应用于多种疾病的治疗性药物,也可以进一步地与免疫检查点抑制剂、IDO通路抑制剂(indoleamine 2,3-dioxygenase,吲哚胺2,3-双加氧酶)或疫苗等其他疗法联合应用。

