HBsAg水平对ALT正常的HBeAg阳性慢性HBV感染者肝脏炎症发生的预测价值
曾 湛, 高媛娇, 毕潇月, 陈凤欣, 邓 雯, 蒋婷婷, 林妍洁, 杨 柳,李明慧,, 谢 尧,
1 北京大学地坛医院教学医院 肝病二科, 北京 100015; 2 首都医科大学附属北京地坛医院 肝病二科, 北京 100015
据2016年世卫组织公布的研究[1]显示,目前全世界范围内约有2.57亿人患有慢性乙型病毒性肝炎(CHB),目前认为慢性HBV感染的自然史分为5个阶段:HBeAg阳性的慢性感染、HBeAg阳性的慢性肝炎、HBeAg阴性的慢性感染、HBeAg阴性的慢性肝炎、HBsAg阴性阶段[2]。免疫耐受期指的是HBeAg阳性的慢性感染阶段,这个阶段的临床特点是高病毒载量、转氨酶正常、无明显肝脏炎症坏死和纤维化[3],其中无明显肝脏炎症坏死和纤维化是判断免疫耐受的最重要依据,然而在实际临床中,部分转氨酶正常且高病毒载量的患者却已经存在着肝脏炎症坏死或纤维化的情况[4],如果仅以转氨酶、病毒量作为诊断依据,很有可能会漏判一部分肝炎患者,从而延误了治疗时机。本研究的目的是探索ALT正常且高病毒载量的HBeAg阳性慢性HBV感染者人群的肝炎发生情况及预测因素,以期为临床诊断提供参考依据。
1 资料与方法
1.1 研究对象 本研究临床注册号为NCT04032275。回顾性选取2008年10月—2015年5月在北京地坛医院进行肝穿刺活检的HBeAg阳性慢性HBV感染者,按照标准筛选分组完成后对收集资料进行对比分析,同时研究肝炎发生的预测因素。高病毒载量定义为HBV DNA≥2×107IU/mL[3],根据肝穿刺活检病理结果来判断是否存在炎症[3],即G≥1或者S≥1则定义为肝炎。
1.2 患者筛选 入组标准:(1)HBsAg持续阳性6个月以上;(2)HBeAg阳性;(3)既往从未接受过HBV抗病毒治疗;(4)患者同意入组。排除标准:(1)患者ALT>40 U/L或HBV DNA<2×107IU/mL;(2)合并其他病毒性肝炎(如甲型肝炎、丙型肝炎、丁型肝炎、戊型肝炎)或慢性肝病(如酒精性肝病、脂肪性肝病、自身免疫性肝病)。分组标准:肝穿刺提示≤G1且≤S1的患者归为无肝炎组,将>G1或>S1的归为肝炎组(即有肝组织损伤或纤维化)。
1.3 收集资料 收集患者性别、年龄、肝穿刺活检结果(G表示肝脏炎症程度,S表示纤维化程度)以及做肝穿刺活检前后2周内的检验结果,包括ALT、AST、TBil、Alb、WBC、PLT、PTA、HBsAg定量log值、HBeAg、HBV DNA定量log值。
1.4 血清学检测 采用化学发光微粒子免疫检测法(检测试剂来自美国雅培公司)对HBsAg和HBeAg进行检测,HBsAg动态范围为0.05~250 U/mL。HBsAg浓度为>250 U/mL的样品稀释至1∶500后进行计算获得具体浓度。HBeAg阳性定义为>1样品/截止值(S/CO)。

2 结果
2.1 一般资料 收集HBeAg阳性慢性HBV感染者共1037例,排除ALT>40 U/L者674例,排除HBV DNA<2×107IU/mL者180例,最后剩余183例符合入组标准。根据病理结果得知无肝炎组占79.8%(146/183),肝炎组占20.2%(37/183)。在有肝炎的37例中,肝穿刺提示G1S2者5.4%(2/37)、G2S1者70.3%(26/37)、G2S2者18.9%(7/37)、G3S1者2.7%(1/37)、G3S2者2.7%(1/37)。
2.2 肝炎组与无肝炎组基线情况对比 对比无肝炎组和肝炎组患者的基线数据情况,两组患者间ALT水平并无显著性差异(P>0.05),对ALT按照<20、20~29.9、30~40 U/L进行分层后再进一步组间比较,结果仍无显著性差异(P值均>0.05)。肝炎组患者的AST水平显著高于无肝炎组患者(P=0.001) ,男性比例显著低于无肝炎组患者(P=0.011),HBsAg水平显著低于无肝炎组患者(P=0.029)。余指标未见显著性差异(表1)。

表1 肝炎组与无肝炎组基线情况对比
2.3 肝炎发生危险因素 将肝炎发生与否作为因变量,年龄、性别、ALT、AST、TBil、Alb、WBC、PLT、PTA、HBV DNA、HBsAg、HBeAg做为自变量进行二元logistics回归,单因素分析显示,年龄、性别、AST、HBsAg、HBeAg有显著性差异(P值均<0.05)(表2),将5个因素以后退法进行多因素分析,结果显示HBsAg是肝脏炎症的危险因素(OR=0.077,95%CI:0.009~0.630,P=0.017)。
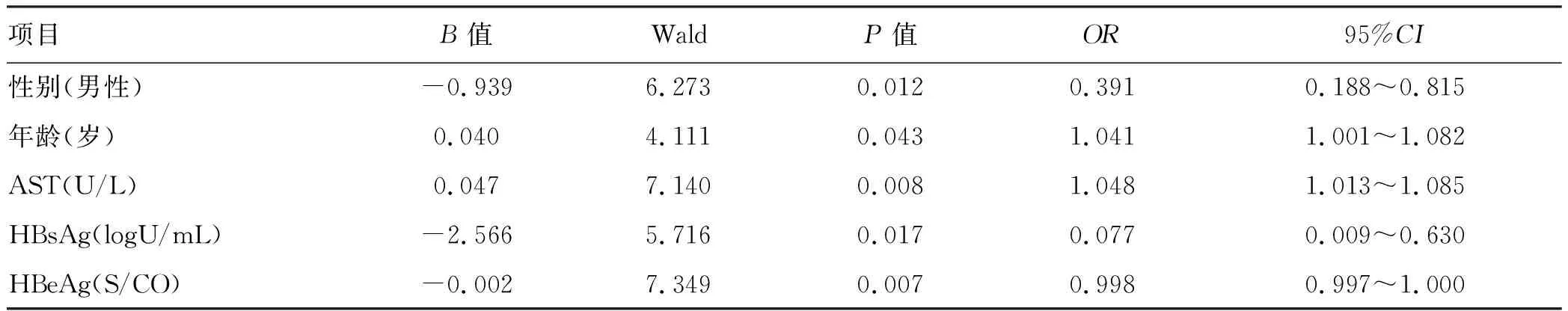
表2 单因素logistic回归分析肝炎危险因素
2.4 ROC曲线分析 HBsAg定量log值ROC下面积为0.667,P=0.032,计算约登指数为0.276,此数值下的敏感度为0.824,特异度为0.452,截断值为4.53,即HBsAg=33 884.4 IU/mL(图1)。

图1 HBsAg定量log值的ROC曲线
鉴于AST在两组基线对比中的差异和单因素logistics回归的统计学差异,单独对AST行ROC曲线分析并计算截断值,结果显示曲线下面积为0.678,P=0.032,计算约登指数为0.309,此数值下的敏感度为0.405,特异度为0.904,截断值为28.45(图2)。

图2 AST的ROC曲线图
2.5 美国肝病学会(AASLD)乙型肝炎指南诊断标准下肝炎发生情况 2018版AASLD乙型肝炎指南里对ALT正常范围的定义为男性≤35U/L,女性≤25U/L,在本研究的183例患者中,有122例符合标准。这122例患者中有102例(83.6%)肝穿刺提示不存在肝炎,余61例中有17例(27.9%)提示存在肝炎。比较国内指南标准下和AASLD指南标准下判断两组患者免疫耐受准确率的差异,结果提示两者比较不存在显著性差异(79.8%% vs 83.6%,χ2=0.705,P=0.401)。
3 讨论
HBV本身不会造成肝细胞的损伤,肝细胞的损伤是由HBV引起的免疫应答造成的,随着感染者免疫状态的改变,慢性感染者的耐受状态打破随即进入清除期,这也是转氨酶升高的原因,但是由于树突状细胞和HBV特异性T淋巴细胞的功能障碍,HBV无法从人体中彻底清除,HBsAg的大量存在也会抑制免疫功能导致感染持续,这也是肝炎持续存在和反复发生的原因[3,5]。
HBeAg阳性的慢性感染在HBV感染的自然病程中等同于以往分期中的免疫耐受期[6]。我国2019年更新的乙型肝炎指南提示,免疫耐受期具有以下特点,HBsAg阳性且>10 000 IU/mL,HBeAg阳性、抗-HBc阳性、HBV DNA>2×107IU/mL、ALT≤40 U/L[3],但是满足以上条件并不意味着一定处于免疫耐受状态,诊断的金标准是肝穿刺活检,免疫耐受期患者的肝组织病理学检查无明显炎症坏死或纤维化。然而肝穿刺活检是有创性检查,临床上难以广泛实施,因此希望能够通过无创性的检验来提高病程诊断的准确度。对于打破了免疫耐受状态的患者,要及时予以治疗[7],ALT升高可能是改善预后的治疗时机[8],而是否应该积极治疗仍处在免疫耐受期的患者,则众说纷纭,有研究[9-10]表明ALT正常的高病毒载量患者发展成为肝癌的风险也相对较高,因此应该进行抗病毒治疗降低病毒载量;但是也有学者认为免疫耐受期进行治疗难以取得可观的疗效,所以定期复查即可[11-13]。基于此,本研究探索ALT正常且高病毒载量的HBeAg阳性慢性HBV感染者人群的肝炎发生情况及预测因素,以期为临床诊断提供参考依据。
本研究中满足大三阳、HBV DNA>2×107IU/mL、ALT≤40 U/L的患者有183例,但是分析了这部分患者的肝脏病理结果后,只有79.8%的患者满足无明显炎症坏死或纤维化,也就是说诊断免疫耐受的准确率只有79.8%。在其他学者的研究中,也发现了类似的情况,比如Chi等[14]关于免疫耐受期的双中心前瞻性队列研究发现,在ALT≤40 U/L、HBeAg阳性、HBV DNA≥5 logIU/mL患者中,只有31%的患者肝穿活检提示无明显炎症坏死或纤维化;Kumar等[4]以同样的标准分组的患者中,有60.3%的患者活检提示无明显纤维化。由此可见,即便满足ALT正常、高病毒载量、HBeAg阳性等条件,仍然有部分患者存在着肝脏炎症,如果不及时干预,肝炎的持续就可能会导致肝硬化的发生[15]。
ALT是反映肝脏炎症的敏感指标,但是在本研究中,没有发现肝炎组和无肝炎组患者之间ALT的差异,即使在分层比较之后,也未见到显著性差异。虽然如此,AST却在比较中发现了显著性差异的存在,这提示,在ALT无法判断肝脏炎症的时候,AST或许是一个值得关注的指标。在Chi等[14]研究中就发现AST可以作为预测肝脏炎症的预测因素。因此尽管在多因素logistic回归中没有发现AST可以作为预测因素,本研究仍对AST单独行单因素logistic回归和绘制ROC曲线,并求得截断值为28.45 U/L,AST位于肝细胞线粒体内,ALT位于肝细胞质中,AST的升高或许表明肝脏存在慢性炎症[16]。HBV DNA能直接反映病毒在人体的活跃程度,人体对病毒的免疫激活会在一定程度上清除HBV DNA,使其载量下降,但是在本研究中,肝炎组和无肝炎组的患者之间HBV DNA载量无显著差异,这可能与在制订入组标准时,只纳入了HBV DNA>2×107IU/mL的患者有关。本研究发现HBsAg是肝脏炎症发生的独立危险因素,HBsAg是由HBV的Dane颗粒和病毒亚颗粒组成,具有抑制人体免疫的作用,能够同时抑制人体的固有免疫和特异性免疫[17], 肝炎的发生意味着免疫耐受的打破,其中涉及到多种免疫细胞和细胞因子,Li等[18]发现,HBsAg与IL-10、IL-6、IFNα等细胞因子明显的相关关系,因此HBsAg的变化趋势可以用于预测抗病毒治疗的效果和预后[19-20],此外HBsAg的消失能够最大程度降低肝癌的发生风险[21-22]。 此前Chan等[23]的一项长时间队列观察研究发现,较低水平的HBsAg可以在一定程度上反映免疫清除,但是他们的研究中没有发现一个HBsAg截断值可以用来判断是否存在免疫清除。在本研究中发现HBsAg的截断值为33 884.4 IU/mL,尽管特异度只有0.452,但是在临床工作中也可以作为医者诊断的一个提示。
目前我国指南与AASLD指南对于转氨酶正常的定义有所不同[3,15],因此笔者也根据AASLD的标准对数据进行了分析,结果提示,尽管在AASLD的标准下诊断免疫耐受的准确率稍高于我国标准,但是其差异不存在统计学意义,因此我国对ALT的上限值制订符合我国人群,诊断效果与AASLD无显著性差异。
在无法进行肝组织病理检查的情况下,寻找其他无创性指标来判断肝脏炎症存在与否就显得尤为重要,本研究中发现,发生肝炎与未发生肝炎患者的基线性别比例、AST和HBsAg都存在着显著差异,进一步进行回归分析后发现HBsAg是预测肝炎发生与否的可靠指标,临床上应着重关注血清HBsAg低于33 884.4 IU/mL的患者后续检查结果的变化,及时发现转氨酶的异常,必要时可以进行肝穿刺活检以明确病程指导治疗。
当然,本研究尚存在着一定的不足,183例的样本量可能存在一定的偏差,但这是本研究横断面数据的真实展现,在今后的研究中笔者可以增加中心和扩充样本量来纠正偏差,有待以后进行前瞻性研究进行深入探讨。更大样本的数据分析或许能够发现更多预测指标,其他学者的研究中发现抗-HBc、HBV DNA载量、ALT等可能也是肝炎发生的危险因素[13,24];此外对患者的检查没有进行多时间点的分析,无法确定入组患者中是否存在有转氨酶间断异常波动的情况,后续有待纳入更多患者扩充样本量,同时收集多个时间节点的检查结果,以进行更全面的分析研究。
伦理学声明:本研究方案于2018年1月25日经由首都医科大学北京地坛医院伦理委员会批准,批号:201800201。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:谢尧、李明慧对研究思路和研究设计有关键贡献;陈凤欣、邓雯、蒋婷婷、林妍洁、杨柳收集和分析数据;高媛娇、毕潇月参与研究统计学方法的选择和文章的修改;曾湛负责撰写成文。

