胡桃醌对宫颈癌细胞增殖的抑制作用及其机制
赵行宇, 杨 欣, 朱志华, 何 涵, 宋梓桐, 张 巍
(1. 吉林医药学院生化教研室,吉林 吉林 132013;2. 延边大学基础医学院生化教研室,吉林 延吉 133000)
宫颈癌在女性恶性肿瘤发病率中排名第2位[1],感染人乳头瘤病毒(human papilloma virus,HPV) 为宫颈癌发病的主要原因,其中人乳头瘤病 毒 16 型 (human papilloma virus type 16,HPV 16)和人乳头瘤病毒18 型(human papilloma virus type 18,HPV 18)为高危型HPV,通过编码E6 和E7 病毒性癌蛋白,干扰肿瘤抑制蛋白P53 和视网膜母细胞瘤pRB 引起细胞异常增殖[2-3]。胡桃醌是一种广泛存在于胡桃科植物胡桃的未成熟外果皮中的α 萘醌类衍生物[4],又称为5-羟基-1,4-萘醌,目前已有研究[5-7]表明胡桃醌具有体外抗肿瘤的作用,如胃癌、卵巢癌、乳腺癌和结肠癌等。脯氨酰顺反异构酶 1 (peptidyl-prolyl cis-trans isomerase NIMA-interacting 1,Pin1) 是 一 种 在 细胞内信号转导过程中起一定作用的小分子蛋白质[8],其在肿瘤细胞微循环血管搭建[9]、增殖及转移过程中起主要作用,并在肿瘤细胞中高水平表达[10-11]。已有研究[12]表明:胡桃醌是Pin1 基因表达的特异性抑制剂,本课题组前期预研究发现胡桃醌对Caski 和C33A 细胞的作用效果不同,推测其可能与影响Pin1 基因的表达有关。为了探讨Pin1基因与该作用有关的可能机制,本研究通过将胡桃醌对Caski、shCaski 和C33A 细胞的作用效果进行对比,阐明胡桃醌对HPV 阳性和阴性细胞促凋亡作用差异的机制,为胡桃醌未来临床应用提供证据。
1 材料与方法
1.1 细胞、主要试剂和仪器Caski 细胞系和C33A细胞系购自中国科学院上海细胞生物学研究所,保存于吉林医药学院实验室;培养液所用Penicillin-Streptomycin Solution、 胎 牛 血 清 和Dulbecco’s Modified Eagle Medium 培养基均购自杭州四季青公司,并按1∶10∶100 配制;周期与凋亡试剂盒购自碧云天生物有限公司;胡桃醌和溴化四氮唑蓝[3-(4,5-dimethyl-2-thia-zolyl) -2,5-diphenyl-2Htetrazolium bromide,MTT]购自美国Sigma 公司;各类单克隆抗体及二抗购自美国Santa Cruz 公司。MOTIC AE31 显微镜购自北京汗盟紫星仪器仪表有限公司,伯乐-550 型全自动酶标仪购自上海领成生物科技有限公司。
1.2 RNA 干扰实验建立Pin1 基因敲低细胞株构建Pin1 shRNA (5′-CCACCGTCACACAGTATTTAT-3′) 慢 病 毒 载 体,感 染Caski 细 胞,用0.5 g·L-1的嘌呤霉素筛选稳定敲低的细胞,即shCaki 细胞。
1.3 MTT 法检测各组细胞增殖活性将瓶内培养的Caski、shCaski 和C33A 细胞用胰蛋白酶消化,在显微镜下观察到细胞表面无明显的糖蛋白黏连时,加一定量含有血清的培养液终止消化,转移至离心管在1000 g 离心4 min,离心后用细胞计数板计算细胞数量,在培养皿中加入细胞悬液及一定量培养液,以每孔1×103个细胞接种于96 孔细胞培养板,放入细胞培养箱中培养24 h。将配制好的胡桃 醌 以10、20、50 和100 μmol·L-1的 浓 度(10、20、50 和100 μ mol·L-1胡 桃 醌 组) 干 预24 h,0 μmol·L-1胡桃醌组作为对照组,5 g·L-1MTT 以每孔20 μL 孵育4 h,DMSO 溶解蓝紫色结晶在波长490 nm 处测定各组吸光度(A)值,以A 值表示细胞增殖活性。
1.4 Hoechst 染色检测各组细胞形态盖玻片上接种Caski 细胞和C33A 细胞于6 孔细胞培养板内培养,细胞汇合度达70%时,胡桃醌组以20 μmol·L-1浓度的胡桃醌处理24 h,弃上清液,用多聚甲醛固定15 min。吸去液体,用清洗液洗3 min,重复2 次,加入0.5 mL Hoechst33258 染色5 min。清洗液清洗2 次,荧光显微镜下观察并拍照。
1.5 Western blotting 法检测2 组细胞中Pin1 蛋白表达量收集培养的细胞,采用PBS 缓冲液洗涤后加入裂解缓冲液裂解细胞,裂解10 min,1.2×104g 离心10 min,检测上清浓度,取5 μg 蛋白进行SDS-PAGE 电泳,之后转膜。室温下,PVDF 在5% 非脂肪牛乳中封闭膜2 h,加入Pin1 (1∶2000)和β-actin(1∶1000)一抗,在4 ℃环境中过夜。第2 天用TBST 洗涤,以1∶10000 稀释度将膜与二抗在室温避光条件下孵育2 h,加底物发光并拍照。
1.6 流式细胞术检测各组细胞周期和细胞凋亡率瓶内培养的Caski 和C33A 细胞用胰蛋白酶消化后离心,用1 mL 冰浴的PBS 缓冲液重悬离心后加入70%乙醇固定30 min。固定好的细胞用PBS缓冲液再次离心去上清,将事先配制好保存于4 ℃条件下的碘化丙啶(PI)染色液以每管0.5 mL 加入细胞样品染色30 min,此过程需要温浴,并避光,染色完成后进行检测。观察不同细胞周期细胞百分率,并计算细胞凋亡率。
1.7 Western blotting 法检测各组细胞周期相关蛋白和凋亡相关蛋白表达情况收集培养的细胞,采用冷PBS 缓冲液洗涤后加入裂解缓冲液裂解细胞,裂解10 min,在1.2×104g 离心10 min,检测上清浓度,取50 μg 蛋白进行SDS-PAGE 电泳,之后转膜。室温下,PVDF 在5%非脂肪牛乳中封闭膜2 h, 加 入B 细 胞 淋 巴 瘤(B-cell lymphoma-2,Bcl-2)、 Bcl-2 相 关X 蛋 白(Bcl-2-associated X protein,Bax)、裂解的半胱氨酸蛋白酶3(Cleaved Caspase-3) 和 PARP (poly ADP-ribose polymerase)(1∶5000),β-actin(1∶1000)一 抗,在4 ℃环境下过夜。 第2 天用TBST 洗涤,以1∶10000 稀释度将膜与二抗在室温避光条件下孵育2 h,加底物发光并拍照。
1.8 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组细胞增殖活性、不同细胞周期细胞百分率和细胞凋亡率以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞增殖活性胡桃醌干预24 h 后,与正常对照组比较,不同浓度胡桃醌组Caski细胞增殖活性降低(P<0.05或P<0.01);50和100 μmol·L-1胡桃醌组C33A 细胞增殖活性降低(P<0.05);且相同胡桃醌浓度条件下,Caski 细胞增殖活性低于C33A 细胞(图1A 和B)。采用不同浓度胡桃醌处理shCaski 细胞,结果显示:与Caski 细胞比较,shCaski 细胞增殖活性升高(P<0.05)(图1C)。

图1 不同浓度胡桃醌干预后Caski、shCaski 和C33A 细胞增殖活性Fig.1 Proliferation activities of Caski, shCaski and C33A cells after treatment of different concentrations of juglone
2.2 2 组Caski 和C33A 细胞核形态表现用20 μmol·L-1胡 桃 醌 干 预Caski 和C33A 细 胞24 h,与正常对照组比较,胡桃醌组Caski 细胞和C33A细胞中观察到核皱缩和裂解(箭头所示),且Caski细胞核皱缩和裂解多于C33A 细胞(图2)。

图2 胡桃醌干预后细胞核形态(×400)Fig.2 Nucleus morphology after juglone treatment(×400)
2.3 2 组细胞中Pin1 蛋白表达量Western blotting 法检测结果显示:Caski 细胞中Pin1 蛋白表达量高于C33A 细胞(图3A),胡桃醌干预后Caski细胞中Pin1 蛋白表达量降低(图3B);与Caski 细胞比较,shCaski 细胞中Pin1 蛋白表达量降低(图3C)。

图3 各组Caski、C33A 和shCaski 细胞中Pin1 蛋白表达电泳图Fig.3 Electrophoregram of Pin1 protein expression in Caski, C33A and shCaski cells in various groups
2.4 各组不同细胞周期Caski 和C33A 百分率采用20 μmol·L-1胡桃醌干预Caski 和C33A 细胞,流式细胞术检测结果(图4)显示:胡桃醌干预后,Caski 细胞G2期峰值高于对照组,C33A 细胞G2期峰值(图4D)与对照组相当;与对照组比较,胡桃醌干预后,G2期的Caski 细胞百分率由(17.38±2.17)%增 加 至(38.97±3.22)% (P<0.01),G2期C33A 细胞百分率差异无统计学意义(P>0.05)。见图4E。
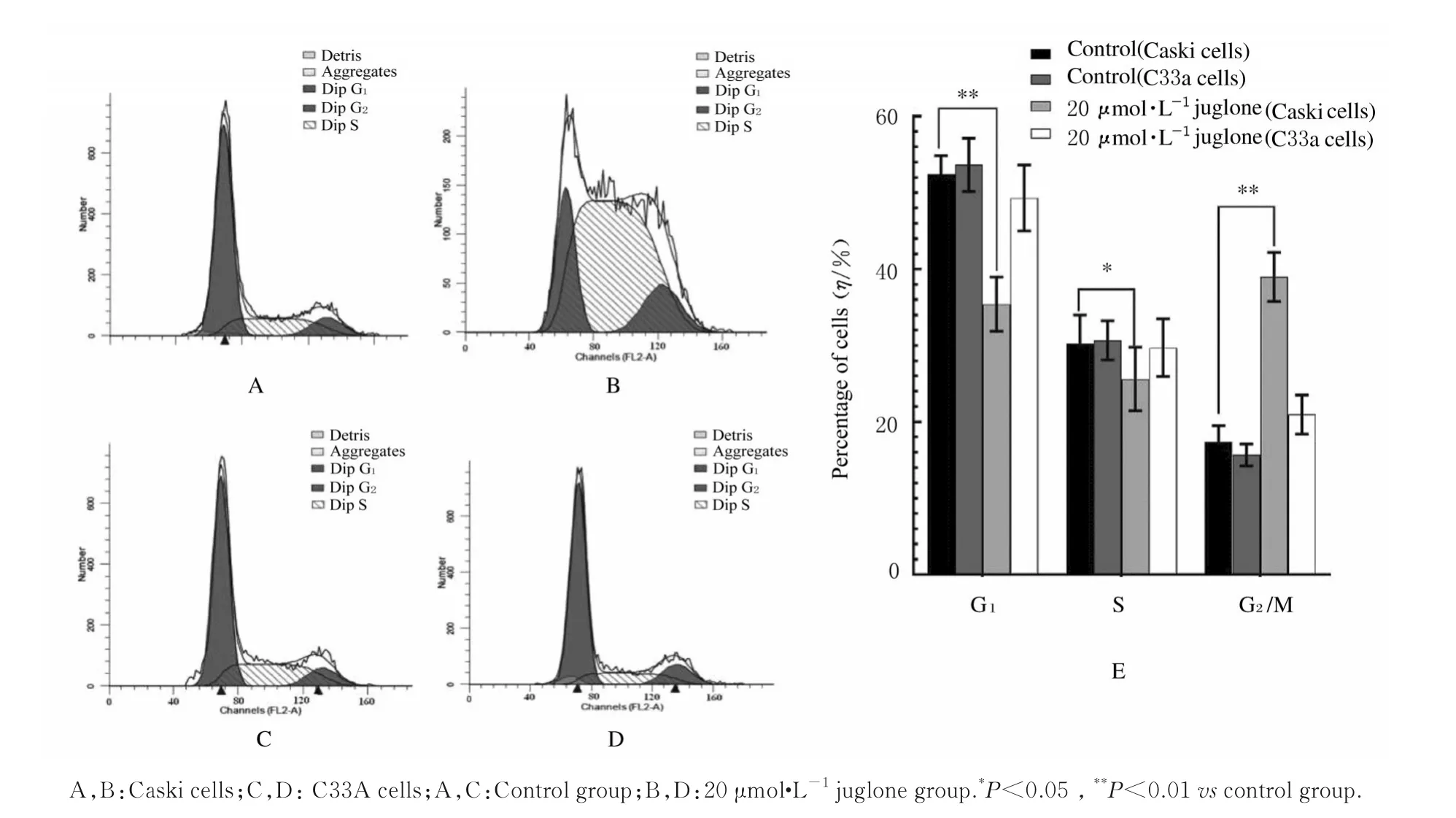
图4 胡桃醌干预后不同细胞周期细胞百分率Fig.4 Percentages of cells in cell cycles after juglone treatment
2.5 各组Caski 和C33A 细胞凋亡率流式细胞术检测结果显示:与对照组比较,20 μmol·L-1胡桃醌组早期凋亡细胞量明显升高;Caski 和C33A 细胞早期凋亡率均升高(P<0.05或P<0.01)。见图5。
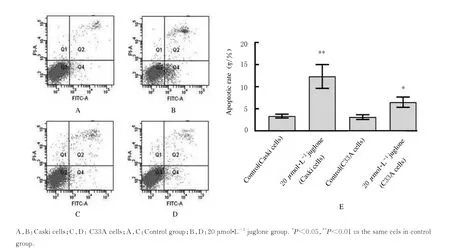
图5 胡桃醌干预后各组细胞早期凋亡率Fig.5 Early cell apoptotic rates after juglone treatment in various groups
2.6 各组Caski 和C33A 细胞中细胞周期相关蛋白表达量与对照组比较,胡桃醌组C33A 细胞中的共济失调- 毛细血管扩张突变蛋白(ataxiatelangiectasia mutated proteins, ATM)、 磷 酸 化ATM(phosphorylated ATM,pATM)、磷酸化细胞周期检查点激酶2 (phosphorylated checkpoint kinase 2,pChk2)、磷酸化细胞分裂周期蛋白25C(phosphorylated Cdc25c,pCdc25c)、216 位丝氨酸磷 酸 化Cdc25c (Ser216 phosphorylated Cdc25c,pCdc25c-Ser216) 和15 位 酪 氨 酸 磷 酸 化Cdc25c(Tyr15 phosphorylated Cdc25c, pCdc25c Tyr15)蛋白表达量未见明显改变;Caski 细胞中pATM、pChk2、pCdc25c Ser216 和pCdc25c Tyr15 蛋 白 表达量升高,Cdc25c 蛋白表达量降低,Cdk1 蛋白表达量变化不明显。见图6。

图6 胡桃醌干预后2 组细胞中细胞周期相关蛋白表达电泳图Fig. 6 Electrophoregram of expressions of cell cycle-related proteins in cells after juglone treatment in two groups
2.7 各组Caski 和C33A 细胞中凋亡相关蛋白表达量与 正 常 对 照 组 比 较,20 μmol·L-1胡 桃 醌 组Caski 细胞中的Bax 蛋白表达量升高,Bcl-2 蛋白表达量降低(图7A);Caski 细胞中细胞质CytC 表达量升高,线粒体CytC 表达量降低(图7B);Caski细胞中的Cleaved Caspase-3、Cleaved PARP 蛋白表达量升高(图7C);与对照组比较,胡桃醌干预后,C33A 细胞上述蛋白的表达量无明显变化。
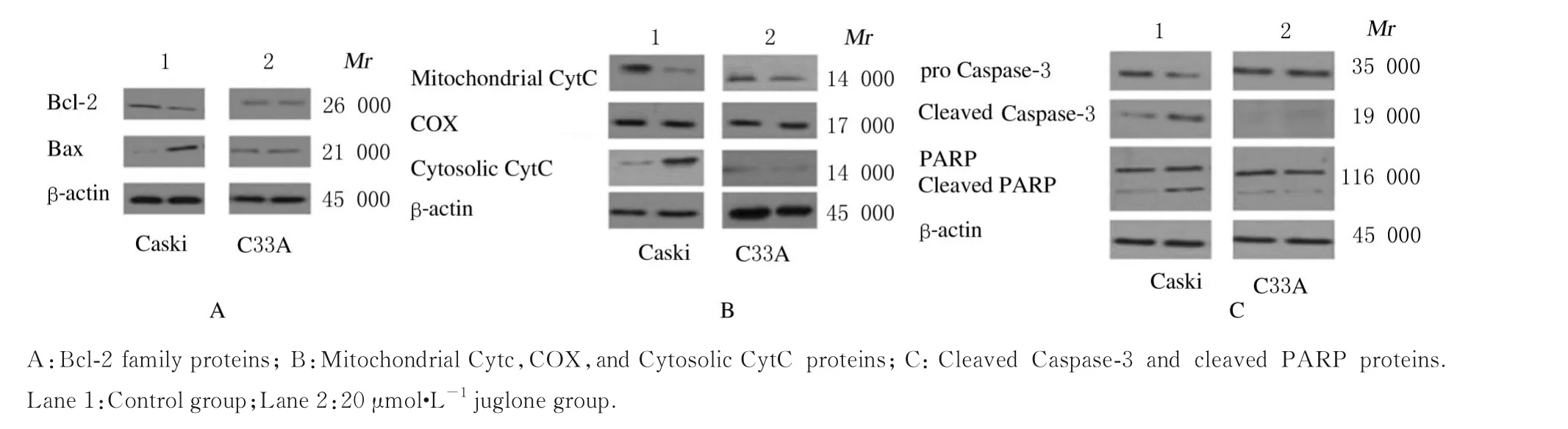
图7 胡桃醌干预后2 组细胞中细胞凋亡相关蛋白表达电泳图Fig.7 Electrophoregram of expressions of apoptosis-related proteins in cells after juglone treatment in two groups
3 讨论
胡桃醌的体外抗肿瘤作用已被许多研究[13-21]证实,同时也揭示胡桃醌对不同类型的肿瘤细胞的细胞作用机制会有所差别。本研究中,胡桃醌对Caski 细胞和C33A 细胞均产生了明显的生长抑制作用,并随着胡桃醌浓度的升高作用不断增强,与本研究结果一致,同时本研究也观察到相同浓度的胡桃醌对HPV 阳性的Caski 细胞的抑制作用要高于HPV 阴性的C33A 细胞。为探索该作用机制,本研究观察了胡桃醌对2 种宫颈癌细胞的细胞周期的影响,结果显示:胡桃醌导致HPV 阳性细胞明显阻滞于G2期,而对HPV 阴性的细胞无明显作用;胡桃醌对细胞周期相关蛋白表达量实验进一步发现HPV 阳性细胞的影响亦明显高于HPV 阴性的细胞,表明胡桃醌对宫颈癌细胞的生长抑制与细胞周期阻滞导致分裂受阻及诱导细胞凋亡有关。
本研究结果显示:胡桃醌在HPV 阳性的Caski细胞导致的核碎裂更多,细胞早期凋亡率也明显高于HPV 阴性的C33A 细胞;针对胡桃醌对凋亡相关蛋白表达影响进行观察,发现HPV 阳性细胞胡桃醌减少Bcl-2 蛋白表达而增加Bax 蛋白表达,线粒体CytC 进入胞浆,Caspase-3 激活增加,Cleaved PARP 片段的增加,表明线粒体途径的凋亡途径启动;而HPV 阴性的细胞该变化不明显,表明胡桃醌对宫颈癌细胞的生长抑制作用还与胡桃醌诱导细胞凋亡有关。
本研究结果表明:胡桃醌对宫颈癌细胞的生长抑制作用与细胞周期阻滞和促进细胞凋亡有关,且对于HPV 阳性的细胞生长抑制作用明显高于HPV阴性的细胞。Pin1 是细胞有丝分裂过程中重要的调节因子,对于肿瘤细胞的生长起重要作用,如肿瘤细胞的血管生成及微循环搭建均需Pin1 的调节[22-24]。本 研 究 进 一 步 观 察 了Pin1 在Caski 和C33A 细胞中的表达,发现Caski 细胞中Pin1 表达水平明显高于C33A 细胞;以胡桃醌干预敲减Pin1基因的shCaski 细胞,结果显示:敲减Pin1 基因后,胡桃醌对细胞的生长抑制作用减弱,与C33A 细胞相似。本研究结果提示Pin1 蛋白在HPV 阳性的细胞和HPV 阴性的细胞差异是导致胡桃醌对2 类细胞作用差异的可能机制,而深层次的机制还需进一步探索。

