HILIC-MS/MS 法测定早产儿血浆中咖啡因的浓度
俞 平,文诗雨,赵 杨,房秋晨,陈相龙,曾女金,李 悦,陆 超,孙鲁宁*,王永庆*
1 南京市溧水人民医院,南京 211200;2南京医科大学第一附属医院 临床药理研究室,南京 210029;3南京医科大学 药学院,南京 211166;4 江苏省妇幼保健院 儿科,南京 210036
早产儿呼吸暂停(apnea of prematurity,AOP)是新生儿重症监护中最常见且较为严重的临床问题之一,持续的呼吸暂停会对早产儿及新生儿脑部及器官发育产生长期危害[1]。咖啡因是甲基黄嘌呤类药物,主要通过拮抗腺苷受体、抑制磷酸二酯酶和动员细胞内钙离子产生效应[2],用药后可迅速进入中枢神经系统,使中枢浓度接近血浆水平,外周化学感受器对CO2的敏感性提高,呼吸中枢输出量增加,松弛平滑肌,增强横膈肌活动幅度等[3]。咖啡因在2006 年已被中华医学会儿科分会新生儿学组作为国内AOP 防治的推荐药物。
在欧洲药品局出台的新生儿临床药物研究指南中,规定临床研究相关的血液丢失量,每个新生儿在4 周内不超过其血容量的3%,每次不超过其血容量的1%[4]。故基于早产儿患者临床试验存在的伦理、频繁抽血困难等问题,应使血浆需求量尽可能少的方法来测定新生儿血浆中的咖啡因浓度。
司徒冰等[5]采用LC-MS/MS 法测定早产儿咖啡因的血药浓度,血样量超过50 μL,且分析时间较长;另外,文献[5,6]开发的方法前处理均需要萃取或旋干,较为繁琐。本研究采用HILIC-串联质谱联用法(HILIC-MS/MS),建立了一种简便、快捷的分析方法,血浆量仅需10 μL,用于测定早产儿静脉泵注枸橼酸咖啡因后血浆中咖啡因的浓度。
1 材 料
1.1 仪器和设备
液质联用仪使用安捷伦1290 Infinity 超高效液相色谱仪;API 4000 三级四极杆串联质谱、色谱工作站使用Analyst®软件,均为美国应用生物公司产品;BP211D 型电子分析天平(德国赛多利斯集团)。
1.2 药品和试剂
咖啡因(纯度98%)、内标13C3-咖啡因(纯度98%)均由Toronto Research Chemicals 公司提供;乙腈、甲醇、甲酸、甲酸铵为分析纯;水为纯化水。
2 方 法
2.1 色谱条件
色谱柱:Atlantis®HILIC Silica(2.1mm×150mm,3 μm);柱温:38 ℃;自动进样器10 ℃;5 mmol·L-1甲酸铵溶液(含0.1%甲酸)为A 相,乙腈为B 相,以0.3 mL·min-1的流速梯度洗脱(条件为:0~2.8 min,A为10%;2.8~3.0 min,A 从10%→45%;3.0~4.5 min,A为45%;4.5~4.7 min,A 从45%→10%;4.7~7.0 min,A为10%);进样量:1.0 μL;每针分析时间7.0 min。
2.2 质谱条件
离子检测方式:多重反应监测(MRM);定量分析离子对:咖啡因m/z 195.1→138.1、内标(13C3-咖啡因)m/z 198.1→140.1;离子化方式:电喷雾离子化(ESI);离子极性:正离子(Positive);离子化电压(IS):5500 V;温度:700 ℃;雾化气(Gas 1):345 kPa;涡轮气(Gas 2):345 kPa;气帘气(Curtain Gas):241 kPa;碰撞气(Collision Gas):69 kPa。
2.3 溶液的制备
2.3.1 咖啡因储备液及工作液精密称取10.19 mg咖啡因对照品(相当于咖啡因9.99mg·mL-1)加于10mL量瓶中,再加入50%甲醇溶解后定容,混匀即可配制成浓度为0.999mg·mL-1的咖啡因储备液。用50%甲醇稀释咖啡因储备液,配制成浓度分别为0.200、0.400、1.20、4.00、12.0、40.0、120、180、200μg·mL-1标准曲线用咖啡因工作液,以及浓度分别为0.500、6.00、10.0、160μg·mL-1的质控用咖啡因工作液。
2.3.2 含内标的沉淀剂精确称量13C3-咖啡因对照品5.12 mg(相当于13C3-咖啡因5.00 mg·mL-1),于5 mL 量瓶中,加入50%甲醇溶解并定容,混合均匀,配制成1.00 mg·mL-1的13C3-咖啡因储备液。用移液器将100 μL 浓度为1.00 mg·mL-1的13C3-咖啡因储备液移取至1.5 mL EP 管中,加入50%甲醇900 μL,混合均匀,得到浓度为100 μg·mL-1的13C3-咖啡因内标工作液。然后在100 mL 量瓶中加入100 μL 上述配制好的内标工作液,用乙腈定容,混合均匀,得到含13C3-咖啡因(100 ng·mL-1)的含内标的沉淀剂。
2.4 血浆样本预处理
将10 μL 血浆样本加入至1.5 mL EP 管中,加入100 μL 含内标的沉淀剂,室温下涡旋10 min(强度2000r·min-1),再于4℃下、16000r·min-1离心15min,吸取上清液10 μL 加至装有90 μL 乙腈的进样瓶中,涡旋,混合均匀后进行HILIC-MS/MS 分析。
2.5 标准曲线及质控样本的配制和处理
将2.5 μL 相应浓度的标准曲线用或质控用工作液加入到1.5 mL EP 管中,室温自然挥干,加入10 μL空白血浆溶液,涡旋15 s,混匀,配制成含咖啡因浓度分别为0.0500、0.300、1.00、10.0、30.0、45.0、50.0 μg·mL-1的标准曲线用含药血浆样本和浓度分别为0.125、1.50、2.50、40.0 μg·mL-1的质控用含药血浆样本。后续处理同“2.4”项。
3 结果
3.1 特异性考察
取6 份不同来源的空白血浆样本,除不添加内标外,按照“2.4”项方法配制和处理后进行HILICMS/MS 分析,以考察是否有内源性干扰成分影响测定。咖啡因的保留时间在2.37 min 左右;咖啡因的同位素内标的保留时间在2.37 min 左右,见图1。实验表明,咖啡因、咖啡因的同位素内标峰形良好,在保留时间处没有干扰,本方法具有较高的选择性。
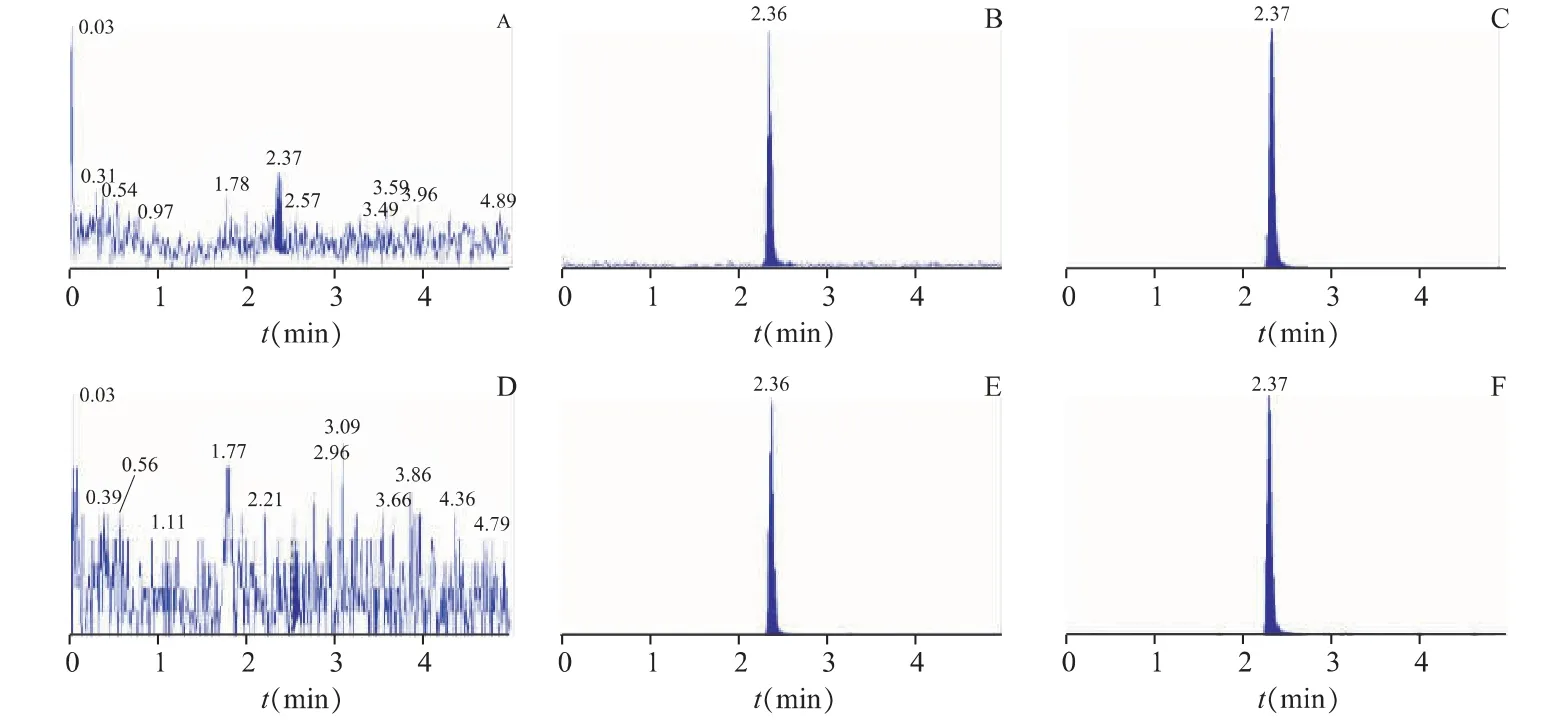
图1 人血浆中咖啡因的代表色谱图
3.2 基质效应及提取回收率
将6 种不同来源的10 μL 空白血浆,分别置于1.5 mL EP 管中,按“2.5”方法配制含咖啡因浓度为0.125、1.50、40.0 μg·mL-1的标准含药血浆样品,每个浓度配制3 份,按“2.4”项下方法处理,即为提取样本。取6 种不同来源空白血浆20 μL,加入200 μL乙腈,涡旋10min,于4℃、16000r·min-1离心15min,将空白血浆提取液110 μL 收集在另一1.5 mL EP管中。加入2.5 μL 的0.500、6.00、160 μg·mL-1工作液,制备咖啡因浓度分别为0.125、1.50、40.0 μg·mL-1的含药血浆样本,每种浓度制备3 份,再加入4.00μg·mL-1内标溶液2.5 μL,涡旋离心,即为“未提取样本”。进样分析,以峰面积比计算提取回收率,公式:
提取回收率(%)=提取样本的平均响应值(峰面积)/未提取样品的平均响应值(峰面积)×100%。
取6 种不同来源空白血浆20 μL,操作同“未提取样本”,制备含咖啡因浓度为0.125、40.0 μg·mL-1的基质效应样本,每个浓度配制3 份。取20 μL 初始流动相替代空白血浆,其余操作同基质效应样本,即为基质效应对照样本,每个浓度配制3 份。进样分析,以峰面积比计算基质效应。公式:
基质效应(%)=基质效应样本的平均响应值(峰面积)/基质效应对照样本的平均响应值(峰面积)×100%。
考察咖啡因在血浆中的基质效应和提取回收率,结果见表1。这表明提取回收率符合生物样本分析要求,无明显基质效应。
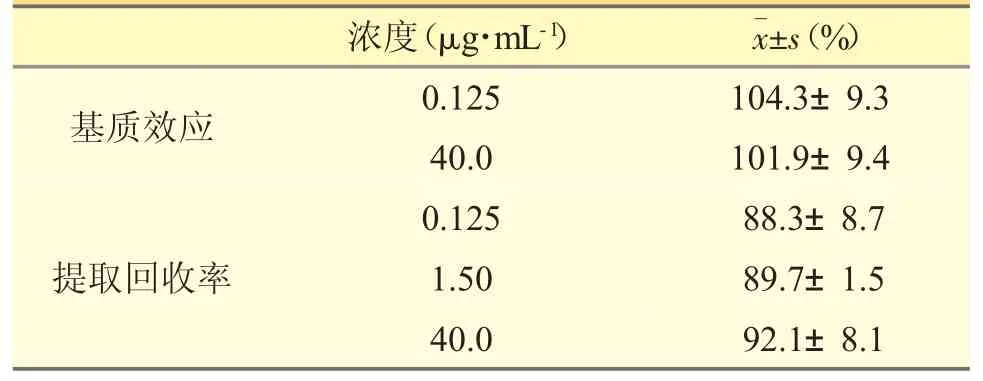
表1 基质效应及提取回收率测定结果
3.3 标准曲线及定量下限
按“2.5”项下方法配制并处理含咖啡因浓度分别为0.0500、0.300、1.00、3.00、10.0、30.0、45.0、50.0 μg·mL-1的标准含药血浆,同时制备空白血浆样本(DB)和仅含内标的血浆样本(BK),进行HILIC-MS/MS分析,并记录色谱图。计算咖啡因的峰面积As和内标峰面积Ai之比f(f=As/Ai),用峰面积之比f 对血药浓度C 进行加权回归计算,得到标准曲线f=0.001 06C+0.018 9(r=0.999 3)。结果表明,血浆中咖啡因在浓度0.050 0~50.0 μg·mL-1线性关系良好,最低定量下限为0.050 0 μg·mL-1,且信噪比>10。
3.4 精密度和准确度试验
按 “2.5” 项下方法配制并处理咖啡因浓度为0.0500、0.125、1.50、40.0 μg·mL-1的标准含药血浆样本,每个浓度制备5 份,同时制备两条随行标准曲线,进行3 批批内、批间精密度和准确度考察,结果见表2。这表明咖啡因在这4 种浓度的批内、批间精密度、准确度均符合相关生物样本分析要求。
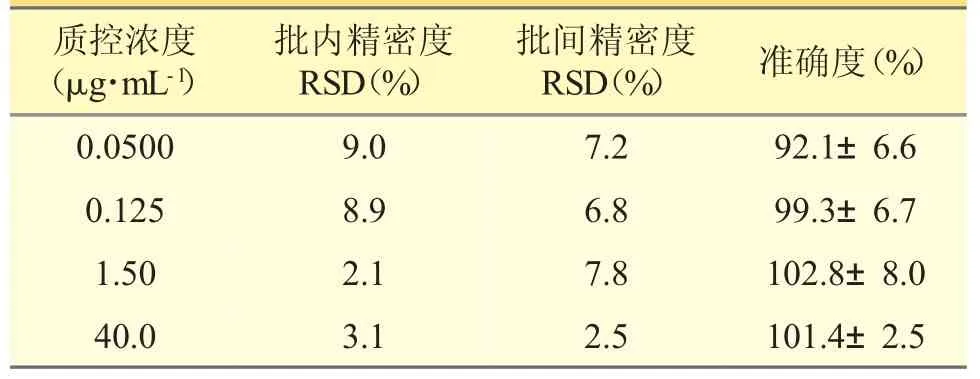
表2 血浆中咖啡因方法精密度与准确度测定结果
3.5 稳定性试验
分别新鲜配制咖啡因储备液和咖啡因浓度分别为0.0500、50.0 μg·mL-1标准工作液,平行制备2 份,考察在室温及10 ℃进样器中放置12 h 的稳定性,稀释至100 ng·mL-1进样,咖啡因相对偏差(RE)均不超过5.3%。这表明咖啡因储备液和标准工作液在室温及10 ℃进样器中放置12 h 的稳定性均良好。
按 “2.5” 项方法配制含咖啡因浓度分别为0.125、40.0 μg·mL-1的标准含药血浆样本,每种浓度配制9 份。3 份在进样器中放置24 h,RE 为-4.3%~-3.8%;3 份在室温下放置5 h,RE 为-6.7%~6.7%;3 份反复冻融3 次,RE 为-11.4%~7.7%。这表明咖啡因血浆样本在各种环境条件下稳定性均良好。
3.6 残留效应
按照“2.5”项下方法配制并处理5 份含咖啡因浓度为50.0 μg·mL-1的标准含药血浆样本和5 份空白血浆样本,交替进样,考察高浓度样本进样后,再分析空白样本时,观察色谱图中是否有残留。若空白样品中分析物色谱峰面积在定量下限的20%以下,且不超过内标的5%,则认为其合格。结果表明,该方法无残留效应,不会影响后续样本浓度的测定。
3.7 方法应用
临床上使用枸橼酸咖啡因注射液(1 ml∶20 mg)负荷剂量20mg·kg-1,静脉输液泵输注30min,24h 后给予维持剂量10mg·kg-1,输注时间15min。给予枸橼酸咖啡因治疗的早产儿(胎龄<31 周,体重<1500 g),于7 天后采集维持剂量输注完成后30 min 的血样,取离心后上清液于-80 ℃冰箱保存待测,使用本方法行咖啡因的血药浓度检测。4 例早产儿胎龄在29~31周,体重范围为1000~1200 g,连续服用枸橼酸咖啡因7 天后,测得咖啡因血药浓度分别为31.1、53.5、51.1、28.5 μg·mL-1,为(41.1±13.1)μg·mL-1。
4 讨论
本研究主要考察了苯基柱、T3 柱以及HILIC柱,初期尝试使用C18柱对咖啡因进行分离,发现需要98%、甚至100%的水相,虽然最终有所保留,但响应较低。鉴于早产儿的特殊性,样本采集点数及量均与成人有较大区别,从伦理角度考虑建立一种高灵敏度、血浆用量少的分析方法是十分必要的。HILIC 柱采用两性离子修饰的固定相,具有高度极性的表面,适用于极性和亲水性化合物的分析。研究发现,咖啡因在HILIC 柱中,即使在高有机相的条件下,也具有合适的保留时间,且呈现高灵敏度,有效减少所需的血浆样本体积。此外,进样量只需1 μL,能有效降低基质效应。在流动相的选择上,发现在5 mmol·L-1甲酸铵水溶液中加入0.1%的甲酸能改善峰形,减轻残留效应。同时采用梯度洗脱,减少基质效应,更加适用于生物样本的分析。
在文献[6,7]报道中,咖啡因的提取方法有液相萃取法、固相萃取法等,操作繁琐、昂贵费时;赵婷等[6]使用甲醇直接沉淀蛋白,周玉[8]使用高氯酸直接沉淀蛋白,两者处理杂质较多,干扰测定;本研究以乙腈作为沉淀剂,除去血浆中的蛋白质和杂质,该操作方法简单易行。另外,在目前检测成人或早产儿咖啡因的方法中,所需的血样体积较多,如司徒冰等[5]的研究中需要200μL 血清,而本法只需要10μL 的血浆样本进行前处理,更符合伦理要求,更适用于早产儿研究。
说明书中早产儿咖啡因的有效血药浓度为8~30 μg·mL-1,本研究中4 例早产儿咖啡因平均血药浓度为41.4 μg·mL-1,超过有效血药浓度,可适当降低用药剂量,以减少不良反应的发生。另外,枸橼酸咖啡因血药浓度在早产儿人群的不同个体及胎龄中存在较大差异,故监测早产儿咖啡因血药浓度对于评估疗效、个体化调整用药有重要临床意义。
本研究建立的方法灵敏、高效、分析时间较短、血样用量少且前处理简单便捷,可用于早产儿静脉泵注枸橼酸咖啡因后的咖啡因血药浓度监测。

