离子色谱法同时测定复方电解质注射液中果糖、乳酸钠和抗氧剂的含量
石 洁,朱 飞,周 静,霍立茹*
1 徐州医科大学,徐州 221000;2 南京济群医药科技股份有限公司,南京 211112
复方电解质注射液是一种含有果糖、乳酸钠、氯化钾、氯化钠等组分的灭菌水溶液,可以有效调节体液容量、渗透压,提供能量。一方面,果糖和乳酸钠作为上述注射液的主要组分,可有效维持体内的酸碱平衡,并为人体提供能量,另外,果糖与葡萄糖相比,更具有快速代谢和迅速转化为能量的作用,且代谢不依赖胰岛素,对血糖影响小,尤其适合糖尿病患者和肝病患者使用,而当这两种组分的含量不足时,药效将会显著下降,且国内研究表明,过量使用果糖有可能引起危及生命的乳酸性酸中毒[1]。另一方面,为有效克服果糖易在高温灭菌过程中发生氧化分解的缺陷,常在该注射液制备过程中加入抗氧化剂亚硫酸氢钠,以提升其药物稳定性;但该品自身易氧化分解,在样品贮藏过程中会逐渐消耗。当亚硫酸氢钠摄入过量时,也可诱发消化系统疾病、神经细胞死亡和抑制尿激酶纤溶蛋白活性等不良反应[2-5]。因此,应对复方电解质注射液中果糖、乳酸钠、亚硫酸氢钠等的含量进行合理测定和有效控制,以确保该药物有效性和安全性。
据2020 版《中国药典》收载,果糖的含量测定方法主要是采用旋光法;乳酸钠含量测定方法主要是阳离子交换树脂法;而亚硫酸氢钠作为药用辅料,《中国药典》中多采用滴定法测定。上述方法专属性较差,费时,实际检测中不易控制。目前,研究多采用HPLC 法单独测定果糖[6,7]、乳酸钠[8,9]和亚硫酸氢钠[10,11]的含量,也有文献报道[12],采用离子色谱柱结合紫外检测器同时测定果糖和乳酸钠的含量;但这些方法仍有可改进之处,如单次分析成分数量较少,方法灵敏度低等。这些方法都可能影响含量的检测效率和准确性,且尚未见采用离子色谱法同时测定果糖、乳酸钠和亚硫酸氢钠含量的报道。为此,本研究通过优化色谱条件,建立了用离子排斥色谱柱结合紫外检测器同时测定果糖、乳酸钠和抗氧剂亚硫酸氢钠含量的离子色谱法。该方法不仅可以大大降低工作量,缩短分析周期,也为后期复方电解质注射液的质量控制提供有力支撑。
1 仪器与药品、试剂
1.1 仪器
液相色谱仪(U3000 型,美国赛默飞公司);万分之一天平(BSA124S,德国赛多利斯公司);十万分之一天平(MSE125P-1CE-DU,德国赛多利斯公司)。
1.2 药品与试剂
复方电解质注射液:(自制,批号:210801、210802、210803,南京济群医药科技股份有限公司)。氯化钠对照品(纯度100%,批号:100376-201703)、氯化钾对照品(纯度100%,批号:100708-20112)、果糖(纯度99.9%,批号:100231-202008)、乳酸钠(纯度99.7%,批号:100911-202003),均购自中国食品药品检定研究院;亚硫酸氢钠对照品(纯度99.9%,批号:S818007,上海麦克林生化科技有限公司);硫酸、乙腈为分析纯;水为纯净水。
2 方法与结果
2.1 色谱条件与系统适用性试验
取对照品果糖、乳酸钠与亚硫酸氢钠适量,精密称定,加水溶解并稀释制成每1 mL 约含果糖2 mg、乳酸钠0.3 mg、亚硫酸氢钠0.05 mg 的溶液作为系统适用性溶液。
采用磺酸型聚苯乙烯苯乙烯二乙烯基苯共聚体阳离子交换树脂H 型(Aminex HPX-87H,300 mm×7.8 mm,9 μm)为色谱柱;柱温为40 ℃;流动相为0.005 mol·L-1硫酸-乙腈(85∶15);流速为0.6 mL·min-1;检测波长为200 nm;进样量为20 μL。在上述条件下,各峰之间分离度良好(Rs>1.5),出峰顺序依次为果糖、乳酸钠、亚硫酸氢钠。见表1、见图1。
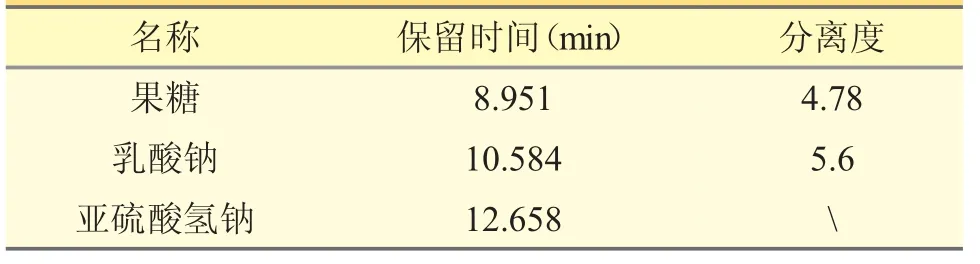
表1 系统适用性结果
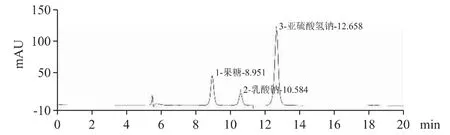
图1 复方电解质注射液系统适用性色谱图
2.2 溶液制备
2.2.1 对照品溶液取对照品果糖、乳酸钠与亚硫酸氢钠适量,精密称定,加水溶解并稀释制成每1 mL约含果糖2 mg、乳酸钠0.3 mg、亚硫酸氢钠0.05 mg的溶液。
2.2.2 供试品溶液精密量取供试品5 mL,置25 mL量瓶中,用水稀释至刻度,混匀。
2.3 专属性考察
取处方中不含3 种成分的其他成分,稀释成与供试品、对照品相同倍数的空白溶液,与供试品溶液和对照品溶液一并分析。结果表明,对照品溶液与供试品溶液中各成分色谱峰之间分离度均大于1.5,而空白溶液对测定无干扰。见图2。

图2 复方电解质注射液HPLC 色谱图
2.4 定量限和检测限确定
取“2.2.1”项下对照品溶液进行逐级稀释,并按照“2.1”项下色谱条件进样分析,以信噪比(S/N)约为10 作为定量限浓度,信噪比(S/N)约为3 作为检测限浓度。亚硫酸氢钠定量限为0.25 μg·mL-1,检测限为0.10 μg·mL-1。
2.5 进样精密度试验
取“2.2.1”项下对照品溶液20 μL,按“2.1”项下色谱条件连续进样6 针,记录峰面积,果糖、乳酸钠和亚硫酸氢钠的峰面积RSD 分别为0.33%、0.46%和0.62%,表明该方法精密度良好。
2.6 溶液稳定性试验
取对照品溶液及供试溶液各1 份,按照“2.1”项下色谱条件分别于0、1、2、3、5、7、9、12、18 h 进样测定。结果表明,果糖与乳酸钠的供试溶液与对照品溶液在室温条件下18 h 内稳定,而亚硫酸氢钠的供试溶液与对照品溶液在室温下放置5 h 内含量均下降约5%,溶液稳定性略差,故应临用新配。
2.7 线性范围
2.7.1 果糖与乳酸钠取果糖对照品约200 mg,乳酸钠对照品约30 mg,精密称定,置于同一20 mL 量瓶中,加水溶解并定容,摇匀,作为储备液。精密量取储备液1.6、1.8、2.0、2.2、2.4 mL,分别置于10 mL量瓶中,加水稀释定容,制成一系列质量浓度的供试溶液,分别进样。以质量浓度(X,mg·mL-1)为横坐轴,峰面积(Y)为纵坐轴进行线性回归,得回归方程。结果表明,果糖和乳酸钠在相应范围内与峰面积线性关系良好。见表2。

表2 3 种成分的线性关系
2.7.2 亚硫酸氢钠取亚硫酸氢钠对照品约25 mg,精密称定,置50 mL 量瓶中,加水溶解并定容,摇匀,作为储备液。精密量取储备液0.5、0.8、1.0、1.2、1.5mL,分别置于10 mL 量瓶中,用水稀释制成一系列质量浓度的溶液,同时,将亚硫酸氢钠储备液逐级稀释配得定量限溶液,按照“2.1”项下色谱条件进样测定。以质量浓度(X,mg·mL-1)为横坐轴,峰面积(Y)为纵坐轴,得其线性回归方程。结果表明,亚硫酸氢钠在其浓度范围内线性关系良好。见表2。
2.8 重复性试验
取同一批号样品,照“2.2.2”项下方法平行配制6份供试品溶液,按“2.1”项下色谱条件进样测定,结果果糖、乳酸钠和亚硫酸氢钠含量的RSD 分别为0.43%、0.21%和1.27%(n=6),表明三者的重复性均良好。
2.9 回收率试验
2.9.1 果糖和乳酸钠①按复方电解质注射液处方比例,除果糖和乳酸钠外,称取其他各组分及亚硫酸氢钠,置100 mL 量瓶中,用水溶解并稀释至刻度,混匀后作为阴性空白溶液。
②取乳酸钠对照品约60 mg,精密称定,置于20 mL 量瓶中,用水溶解并定容至刻度,摇匀,作为乳酸钠储备液。精密称定果糖对照品16、20、24 mg,分别置10 mL 量瓶中,先用适量水将其溶解,再依次加入0.8、1、1.2 mL 的乳酸钠储备液和1 mL 的阴性空白溶液,并用溶剂稀释定容至刻度,摇匀,制成果糖和乳酸钠浓度分别相当于供试品溶液浓度80%、100%、120%的溶液,每个浓度平行3 份,共9份,按“2.1”项下的色谱条件进样测定,记录峰面积,以外标法计算各成分的测得量,并用测得量除以对照品加入量,计算其回收率。结果表明,果糖和乳酸钠的平均回收率分别为99.28%(n=9)和99.75%(n=9),RSD 分别为0.66%和0.69%。
2.9.2 亚硫酸氢钠①按复方电解质注射液处方比例,除亚硫酸氢钠外,称取该注射液中各组分,置100 mL 量瓶中,用水溶解并稀释至刻度,混匀后作为阴性空白溶液。
②精密量取“2.7.2”项下亚硫酸氢钠储备液0.4、1、2、3 mL,分别置于预先加入阴性空白溶液2 mL 的20 mL 量瓶中,加水制成亚硫酸氢钠浓度相当于理论浓度20%、50%、100%和150%的供试溶液,每个浓度平行制备3 份。按“2.1”项下色谱条件进样测定,记录峰面积,以外标法计算亚硫酸氢钠的测得量,并用测得量除以对照品加入量,计算其回收率。结果表明,亚硫酸氢钠的平均回收率为99.63%,RSD 为1.20%(n=12)。
2.10 含量测定
按照“2.2.2”项下方法制备3 个批号供试品溶液,平行制备3 份,按“2.1”项下色谱条件进样测定,记录峰面积并用外标法计算各成分的含量,结果见表3。

表3 供试品含量测定结果(n=3)
3 讨论
3.1 色谱条件优化
3.1.1 色谱柱的选择果糖、乳酸钠、亚硫酸氢钠均为极性较大的化合物,一般色谱系统难以较好分离。本研究选择了磺酸型聚苯乙烯苯乙烯二乙烯基苯共聚体H+阳离子交换树脂为固定相的离子排斥色谱,该色谱保留机理[13]主要有Donnan 排斥、空间位阻排斥和疏水性吸附作用等。基于其保留机理对果糖、乳酸钠、亚硫酸氢钠分离进行考察,结果三者在该色谱系统中得到较好分离。同时比较两支不同厂家色谱柱,月旭科技(Xtimate®sugar-H)和伯乐生命医学(Aminex HPX-87H),以三者的峰的分离度和峰形等因素作为判断依据,结果两厂家色谱柱在分离度和峰形上无明显差异,说明该方法耐用性较好。
3.1.2 流动相的选择比较了不同浓度硫酸水溶液和不同比例乙腈-硫酸水溶液两个流动相系统,当选择0.005~0.02 mol·L-1硫酸水溶液作为流动相时,各峰保留时间稳定,无明显变化,表明该浓度范围内乳酸及亚硫酸氢钠的电离均被有效抑制,从对色谱柱保护的考虑,优选0.005 mol·L-1硫酸水溶液。
为使乳酸与焦亚硫酸的峰可完全分离,通过向流动相中加入一定量的有机相(乙腈),一定程度地阻塞固定相的吸附位点,减少乳酸与固定相的相互作用,从而缩短乳酸保留时间。本研究比较了5%、10%、15%和20% 4 种不同的有机相比例,结果发现随着乙腈比例增加,果糖和亚硫酸氢钠的峰保留时间基本不变,乳酸钠的保留时间逐渐缩短。当乙腈比例为15%时,果糖、乳酸钠和亚硫酸氢钠之间分离度最优。因此,综合考虑峰型、分离度、基线平稳及色谱柱常规冲洗和保存等因素,最终选择0.005 mol·L-1硫酸水溶液-乙腈(85∶15)为流动相体系。
3.1.3 检测波长选择在3 个组分结构中均无长共轭结构或较强的发色团,根据高效液相色谱二极管阵列检测器扫描的紫外吸收图谱,3 个组分均在紫外光末端吸收位置200 nm 附近有吸收,且均有较大响应值,表明溶剂对其测定无干扰,故选定200 nm作为测定波长。
3.2 其他
因亚硫酸氢钠本身易氧化分解,需临用新配,且亚硫酸氢钠作为抗氧剂,在样品贮藏过程中会逐渐消耗,故对复方电解质注射液中亚硫酸氢钠的定量限及范围等进行了单独验证。
4 小 结
本研究首次建立了离子色谱法同时测定复方电解质注射液中果糖、乳酸钠、亚硫酸氢钠的含量,该方法专属性强,准确度高,可用于复方电解质注射液及其相关制剂的质量控制与评价。
——运动抗肿瘤的作用及其特异性研究

