凤香型酒醅中理化指标、功能酶活及微生物变化的研究
杨美媛,孟勤燕,张 艳,白莉圆,徐 晨,张永利,闫宗科
(陕西西凤酒股份有限公司,陕西凤翔 721406)
白酒酿造是我国古代科技水平的体现,已有近千年的历史,中国白酒独特的酿造工艺在世界蒸馏酒舞台上也始终占据着重要位置。近年来,随着白酒行业的发展以及人们对白酒认识的逐渐加深,各大名酒企业也在酿酒基础科研这一环节增加投入,增强技术研发能力,其中对酿酒微生物的研究已成为各酒厂科研领域中的热点。
西凤酒是以中高温制曲、热拥法生产、土窖短期发酵、酒海储藏等工艺而生产出的一类白酒,作为凤香型白酒的典型代表,其生产工艺有别于其他香型白酒。以高粱为原料,加以储存期满的大曲进行泥窖固态发酵,经曲种混合发酵后即形成西凤酒的酒醅。酒醅作为微生物发酵的主要载体和白酒呈香物质的直接来源,其原料利用程度、发酵条件控制、微生物体系消长变化等直接影响出酒率和最终的风味与口感。在酒醅发酵过程中,理化指标会影响其中微生物的生长代谢、酶的活性,进而造成微生物群落的改变。在凤香型白酒酿造过程中,液化酶、糖化酶主要由霉菌所产生,可将高分子淀粉分解为葡萄糖;酵母菌则是发酵动力,将葡萄糖转化成乙醇,直接关系着白酒的出酒率;细菌作为生香动力,将淀粉、蛋白质、脂类等物质经过多步复杂反应生成白酒中香气成分,赋予凤香型白酒独有的风格特征。本实验对酒醅在发酵过程中各项理化指标、功能酶活性及微生物群落的变化进行追踪检测,寻找各因子动态变化规律,从更加微观的角度来认识凤型白酒生产工艺,从而为指导实际生产工作提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器
样品:酒醅样品取自制酒车间编号为5#和6#两个窖池,跟踪酒醅发酵全过程。
试剂:三羟甲基氨基甲烷、酒石酸钾钠、三氯乙酸、乳酸、干酪素、己酸、丙酸辛酯等均为分析纯。
仪器设备:气相色谱质谱联用仪GC 6890-MS 597,美国Agilent 公司;固相微萃取头50/30 μm DVB/CAR/PDMS,美国Supelco 公司;固相微萃取自动进样器(MPS 2),德国Gerstel 公司;冷冻高速离心机DH-2000R,上海德洋意邦仪器有限公司;紫外可见分光光度计TU-1810S,北京普析通用仪器有限责任公司;生化培养箱SPX-250-Ⅱ,上海龙跃仪器设备有限公司;立式压力蒸汽灭菌器,上海博讯实业有限公司;恒温水浴锅SYG-2S,常州朗越仪器制造有限公司。
1.2 实验方法
1.2.1 取样
每个窖池选择上中下三层取样,每层选中间及两角为取样点,共9 个点进行取样。分别取入池0 d、2 d、5 d、8 d、14 d、18 d、22 d、26 d 的酒醅样,-20 ℃冷藏备用。
1.2.2 理化指标检测
还原糖测定方法:直接滴定法,参照GB 5009.7—2016。
水分、酸度、淀粉、酒精度测定:参照QB/T 4257—2011《酿酒大曲通用分析方法》。
温度:用温度计直接插入酒醅中进行测量。
1.2.3 功能性酶活力测定
脂肪酶测定方法:参照文献;酯化酶测定方法:参照文献;糖化酶、α-淀粉酶测定方法:参照文献。
1.2.4 微生物群落多样性检测
酒醅样品送上海派森诺生物科技有限公司,利用Illumina平台进行高通量测序分析。提取酒醅微生物总基因组后,对细菌16S V3—V4 区和真菌的ITS1区扩增子测序分析。
1.2.5 数据处理
采用Origin进行数据分析。
2 结果与分析
2.1 酒醅发酵过程中理化指标分析
如图1 所示,在发酵过程中温度先升高再缓慢降低,最后趋于稳定。在发酵0~2 d,酒醅温度较低在20~21 ℃,2~18 d 温度逐渐升高且在18 d 时达到最高为31.5 ℃,后期又有所回落。这可能由于前期微生物还未完全适应环境,生长代谢缓慢,温度处于较低水平;中期随着微生物对环境逐渐适应,开始大量增殖,代谢产热使得酒醅温度逐渐升高;发酵后期酒醅酸度达到较高水平,加之温度较高,部分不耐酸、不耐热的微生物生长受到限制或逐渐消失,温度有所降低。酒醅中水分含量先增长后趋于稳定。酒醅发酵过程中水分来源有两方面,一是生产时人为加入的水,二是发酵过程中生理生化反应、微生物代谢所产生的水。发酵前期酒醅中淀粉被利用转化成乙醇产生水分,发酵至14 d 后,随着酒醅环境变化,淀粉转化速率减小,水分含量变化不大。
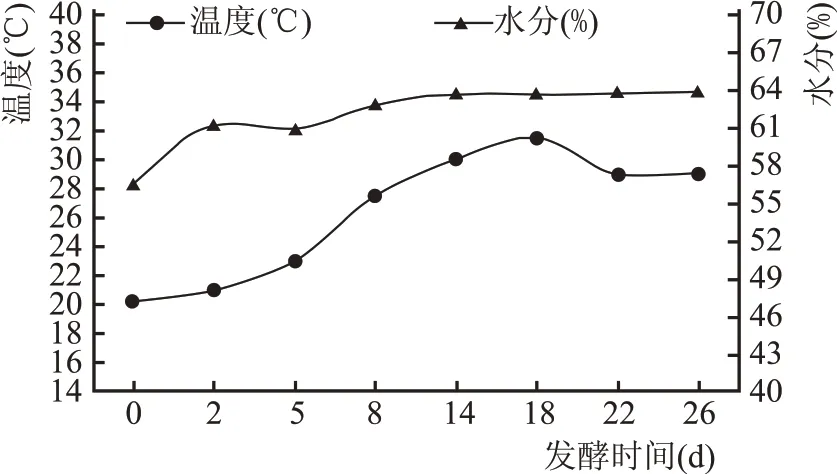
图1 酒醅发酵过程中温度、水分变化情况
如图2 所示,酸度在酒醅发酵过程中呈现先降低后升高趋势。酒醅中酸度主要来源于部分微生物产酸代谢和脂肪、淀粉、蛋白质的降解。发酵前期霉菌、酵母菌大量增殖在酒醅中占据主导地位,中后期随着营养物质及氧的消耗,酵母菌逐渐衰亡,此时部分厌氧及兼性厌氧细菌大量增殖产生多种有机酸,使得酒醅酸度迅速升高。
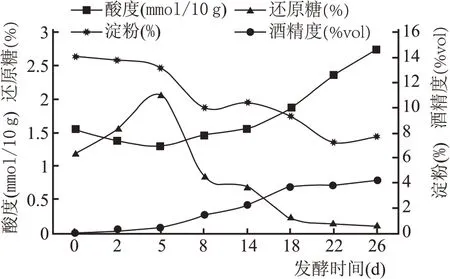
图2 酒醅发酵过程中理化指标变化情况
淀粉含量在发酵过程中整体呈现下降趋势。发酵开始时原料中淀粉含量较高,营养丰富,微生物代谢旺盛,淀粉转化速率高;后期由于体系酸度升高影响酶活性以及酵母菌逐渐衰亡,淀粉含量逐渐降低至趋于平稳。
还原糖含量在发酵过程呈现先升高后降低的趋势。在发酵前期微生物繁殖,糖化速度加快,故而还原糖逐渐积累含量升高。随后产生的还原糖不断被利用,且随着酒醅中酸度的升高,抑制糖化酶的活力使还原糖含量降低。
酒精含量在发酵过程中整体呈现上升趋势。酒精度反映了酒醅发酵过程中乙醇产生情况,发酵0~5 d 酵母菌主要进行有氧增殖,5~18 d 进行无氧酒精发酵,后期随着环境体系的变化,酵母菌的生长代谢受到抑制,酒精含量基本趋于稳定。
2.2 酒醅发酵过程中功能性酶活变化规律
2.2.1 酒醅发酵过程中酯化酶活力变化规律
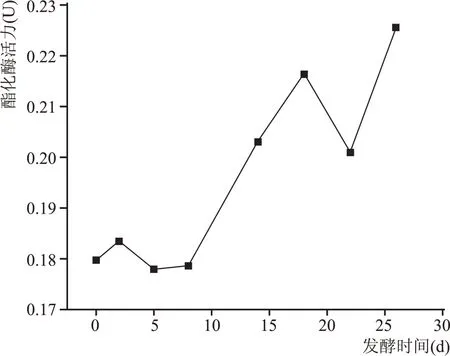
图3 酒醅中酯化酶活力变化
2.2.2 酒醅发酵过程中脂肪酶活力变化规律
如图4 所示,酒醅中脂肪酶活性随发酵时间总体处于动态的变化过程。在发酵前期,脂肪酶活性处于上升趋势且在第8 天达到最高值,随后急剧下降;发酵后期,脂肪酶活性呈现缓慢上升趋势。脂肪酶是一种特殊的酯键水解酶,它可作用于甘油三酯的酯键,使甘油三酯降解为甘油单酯、单甘油酯、甘油和脂肪酸。凤香型白酒生产过程中脂肪酶可作用于代谢产物,经过一系列生化反应进而转化为呈香物质。
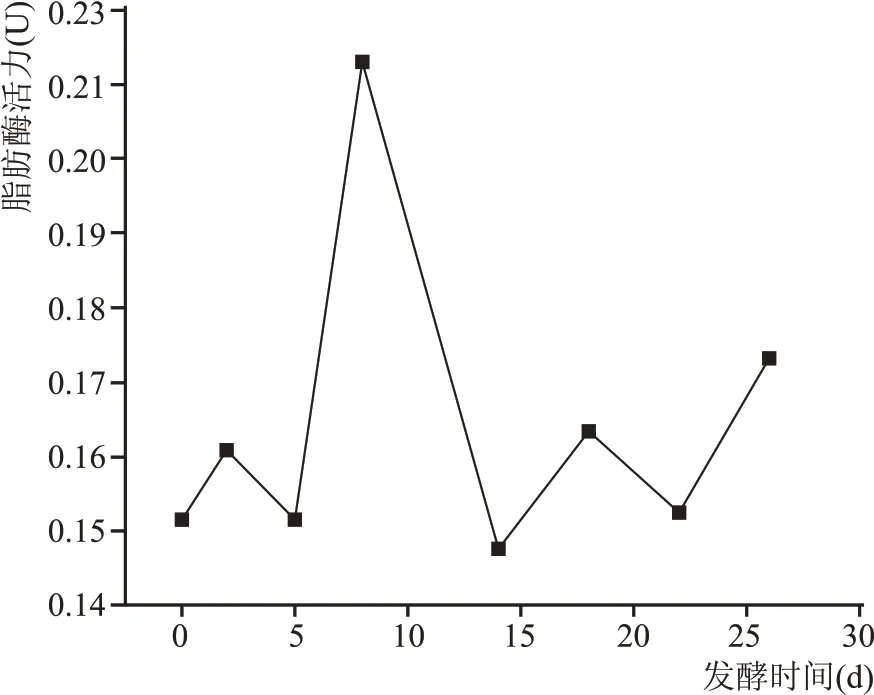
图4 酒醅中脂肪酶活力变化
2.2.3 酒醅发酵过程中α-淀粉酶活力变化规律
如图5 所示,在酒醅整个发酵周期中,α-淀粉酶活力呈现逐渐降低趋势。在刚入池时最高,发酵初期α-淀粉酶活力先急速降低,第5 天出现短暂升高,之后逐渐降低。α-淀粉酶即液化酶,能够将淀粉水解为长短不一的短链糊精和少量的低分子量糖类。在发酵前期霉菌大量繁殖,酸度、温度均较低,α-淀粉酶的活性较高,随着发酵时间的延长,酒醅中酸度迅速增加,α-淀粉酶的活力呈现下降趋势。
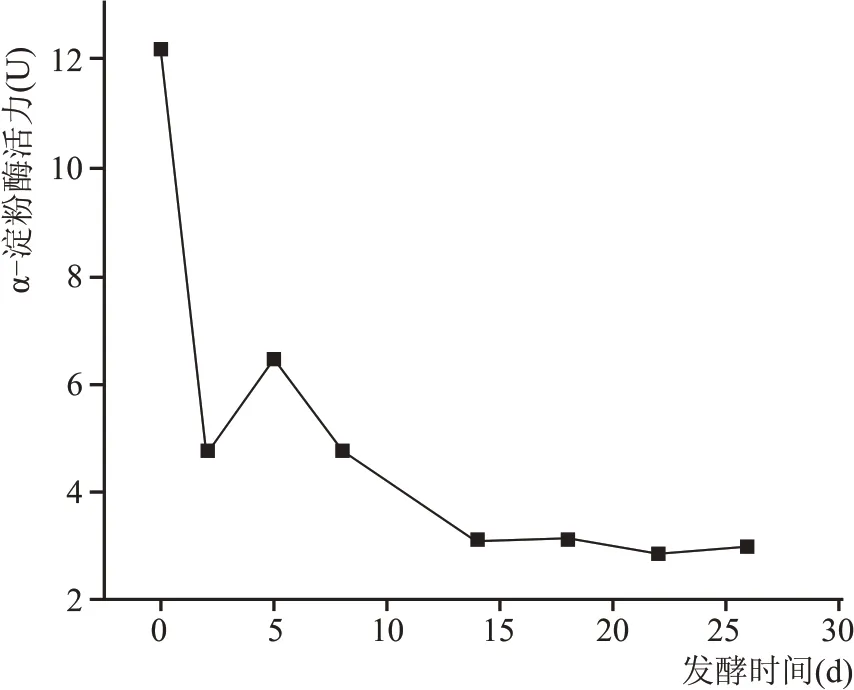
图5 酒醅中α-淀粉酶活力变化
2.2.4 酒醅发酵过程中糖化酶活力变化规律
如图6 所示,在酒醅整个发酵周期中,糖化酶活力呈现先上升后下降趋势。从入池至发酵第2天快速升高且达到最大值,随着发酵时间的延长,在第5~14 天酶活急剧下降,随后糖化酶活力缓慢降低。糖化酶即α-1,4-葡萄糖水解淀粉酶,是一种从淀粉的非还原性末端开始依次水解α-1,4-葡萄糖苷键生成葡萄糖的酶。糖化酶主要是由曲霉菌所产生的,在发酵初期,霉菌快速生长繁殖,淀粉原料被快速分解,在发酵中后期霉菌逐渐消亡,糖化酶的活力逐渐降低。
由上可知,“农业为主”论在教育界乃至政界均有一定的共识,他们认为中国“以农立国”,而且现实国情也要求中国应当重点发展农业,因此发展生产教育应当以农业为主。其中又有“农业为主,工业为辅”与单纯强调“农业为主”两种观点的区别。
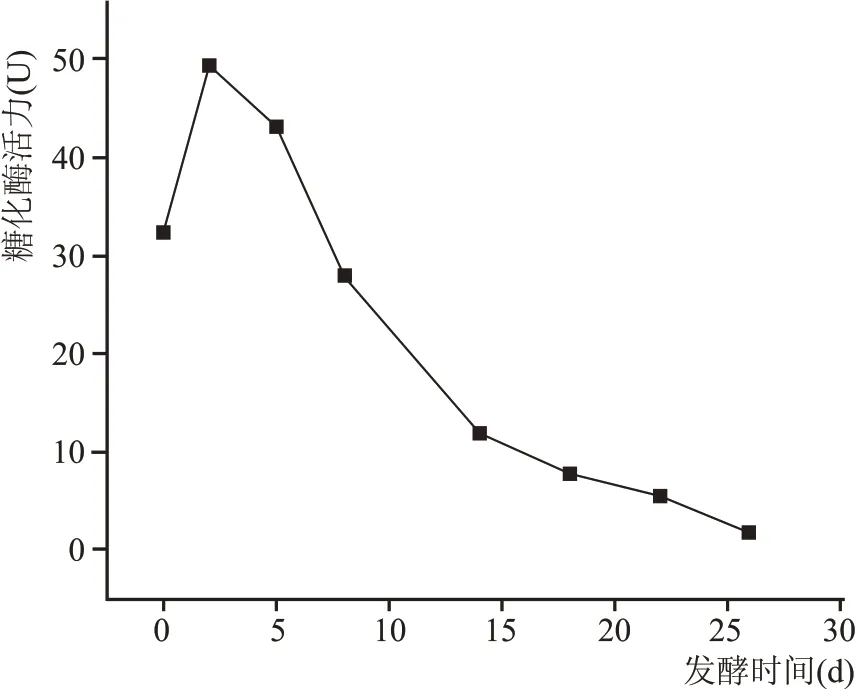
图6 酒醅中糖化酶活力变化
2.3 酒醅发酵过程中微生物群落多样性变化规律分析
2.3.1 真菌物种分类学分析
由图7 可看出,酒醅中真菌群落归属于4 个真菌门,分别为子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota)、担子菌门(Basidiomycota)、被孢霉菌门(Mortierellomycota),其中子囊菌门在酒醅发酵过程中占绝对优势,相对丰度在94 %以上。研究显示清香型白酒酒醅中子囊菌门也是优势菌门。

图7 酒醅门水平真菌群落组成分布
图8 为酒醅发酵过程中真菌属水平下丰度组成top10 的真菌,按照物种丰度大小依次为、、、、、、、、。其中相对丰度占比为25.08 %~39.78 %,这可能是入池(0 d)时大曲、高粱、酿酒环境中带入部分,相对丰度较高,发酵前期需要适应环境,丰度占比稍有降低,中期大量增殖后相对丰度再次增大,后期受温度、氧气、营养物质等条件的限制相对丰度又逐渐降低。相对丰度为14.28 %~37.18 %,前期相对丰度占比较大,发酵2~5 d 后随着乙醇大量积累,温湿度增大,其他细菌开始增殖,生长受到限制,相对丰度有所降低,后期部分继续增殖,相对丰度稍有增大。在发酵前期占比较大,中后期丰度降低动态稳定在6.47 %~8.72 %,这可能是因为前期大曲带入部分,使得丰度较大,中后期受发酵条件限制,相对丰度降低后没有继续增殖。存在于酒醅发酵的中后期,发酵5 d时相对丰度达到峰值为16.05%,后期降低至1.43%~5.35%之间。相对丰度为0.57%~3.27%,发酵14~18 d时丰度较大,前后期均处于较低水平。存在于酒醅发酵的中后期,第5 天和第26 天相对丰度较大为3.66 %和3.91 %,中间受温度、酸度等影响丰度较低在0.44 %~0.85 %之间。、、、在酒醅发酵过程中占比很小,相对丰度都在1 %以下,且只存在于某一时期。综上所述,和在酒醅发酵过程中占据优势地位,受乙醇浓度,酸度,营养物质消耗以及微生物代谢产物的积累等条件影响,相对丰度呈现动态变化。
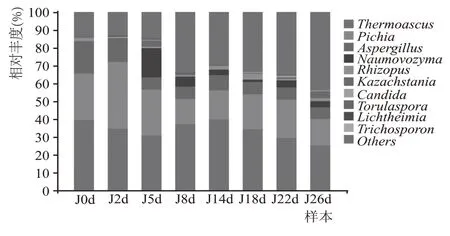
图8 酒醅中真菌属水平top10物种组成分布
2.3.2 真菌Alpha多样性分析
通过Illumina高通量测序对酒醅发酵过程中的8 个样本进行真菌多样性分析,在97%相似度水平下对序列聚类并进行OTU划分,结果见表1。
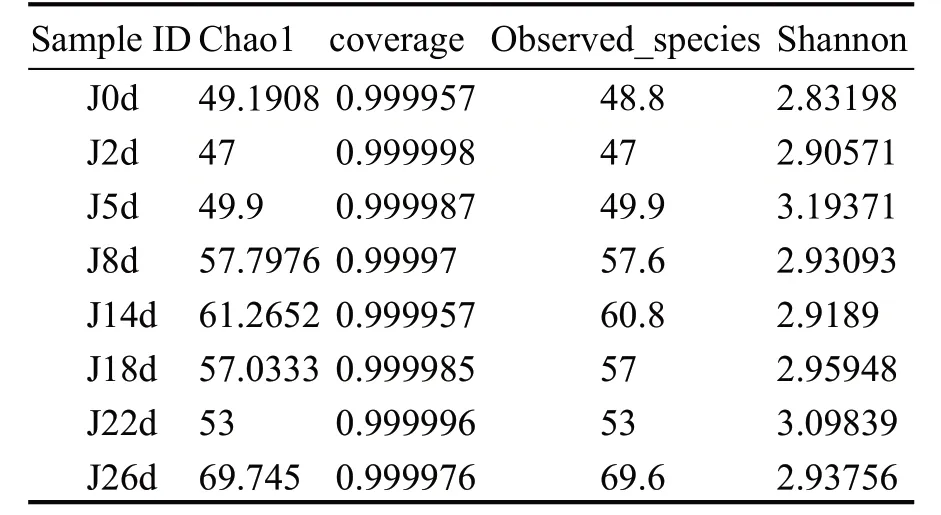
表1 酒醅真菌Alpha 多样性指数
表1 中coverage 是所有样本序列的覆盖率,其数值在0.985606~0.999998 之间,表明本次测序结果能完整反映酒醅中真菌菌群组成的真实情况。Chao1 和Observed_species 指数主要表征样本中物种丰富度,其数值越大,表明样本中包含物种的数目越多。Shannon 指数主要表征样本中物种多样性,数值越大表明样本的多样性越高。
由表1 可知,发酵的不同时期,酒醅中真菌的群落多样性差异较小,而丰富度差异较大。入池至发酵5 d 期间,酒醅中真菌的Chao1、Observed_species 指数较低,表明发酵初期酒醅中真菌群落的丰富度较低;8~14 d 时Chao1 和Observed_species 指数增大,即此时酒醅中真菌群落丰富度增大;14~22 d 时,低氧、高温等条件导致某些好氧、不耐高温微生物数量下降,丰富度也随之降低;26 d 样品的Chao1 指数最高,表明出池酒醅中真菌群落丰富度最大,可能是因为出池酒醅接触大量空气,混入了一些空气微生物。
2.3.3 真菌β-多样性分析(层次聚类分析)
图9 中左侧为8 个样本的层次聚类树,右侧为聚类结果对应的样本属水平top10 物种丰度。图中所有样本被分为两大类,发酵前期(0~5 d)被分为一类,中后期(8~26 d)被分为一类,两大类下又分为多个小类。整体而言,酒醅发酵的中后期样本中真菌群落结构与前期差异较大。
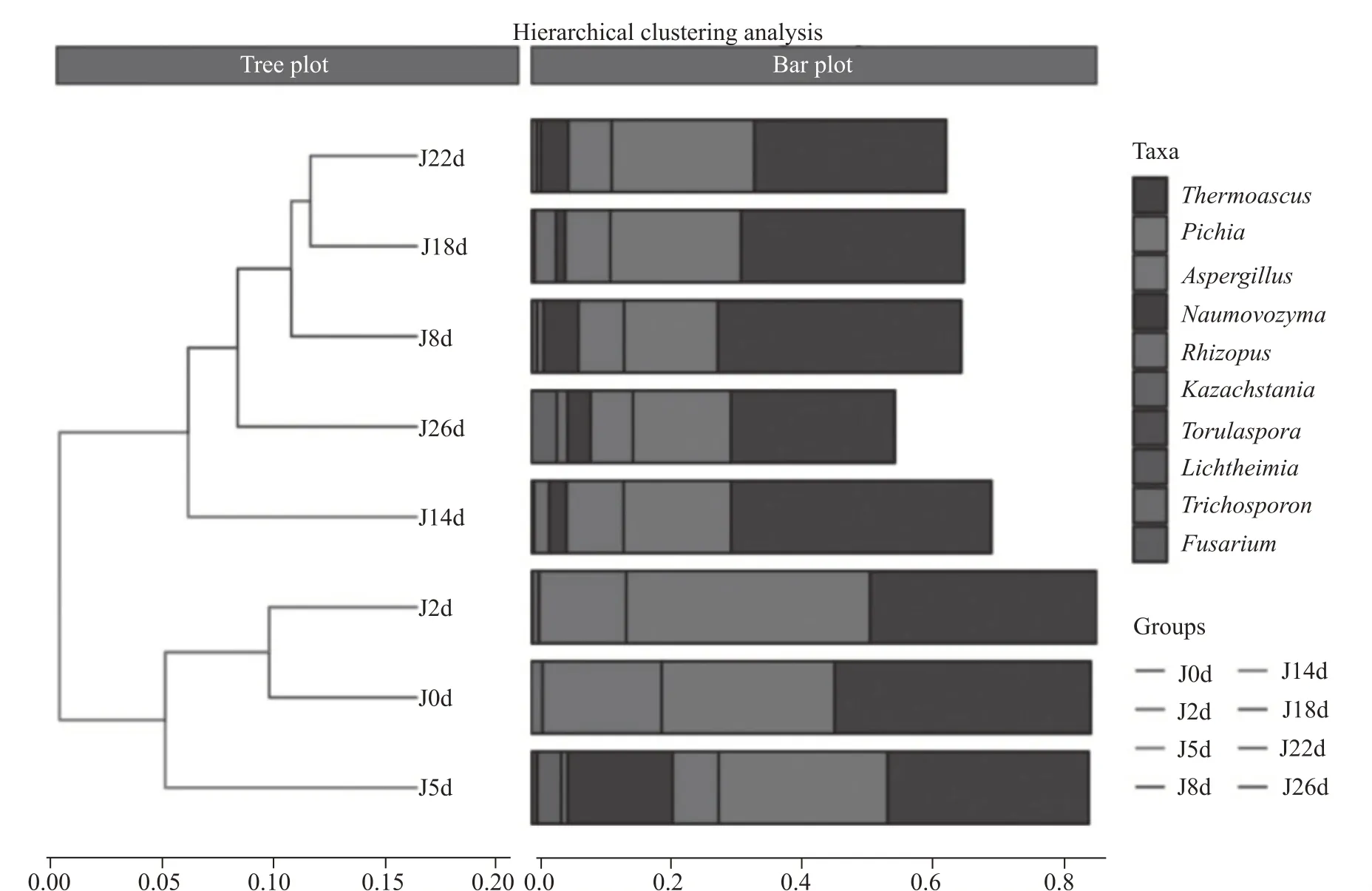
图9 酒醅样本中真菌聚类树
2.3.4 细菌物种分类学分析
由图10 可知,酒醅发酵过程中门水平下共检测出23 种细菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)等。发酵前期酒醅中Firmicutes 和Proteobacteria 占主导地位,中后期Firmicutes 迅速增长成为优势菌群,在发酵过程中占绝对主导地位,相对丰度达95 %以上。这与酱香型白酒、浓香型白酒、清香型白酒发酵过程中细菌菌群变化规律相似,表明白酒发酵过程中细菌菌群多样性会随着发酵时间延长而降低,发酵微生物体系由多菌群共同作用逐渐演变为Firmicutes 主导的单一体系。
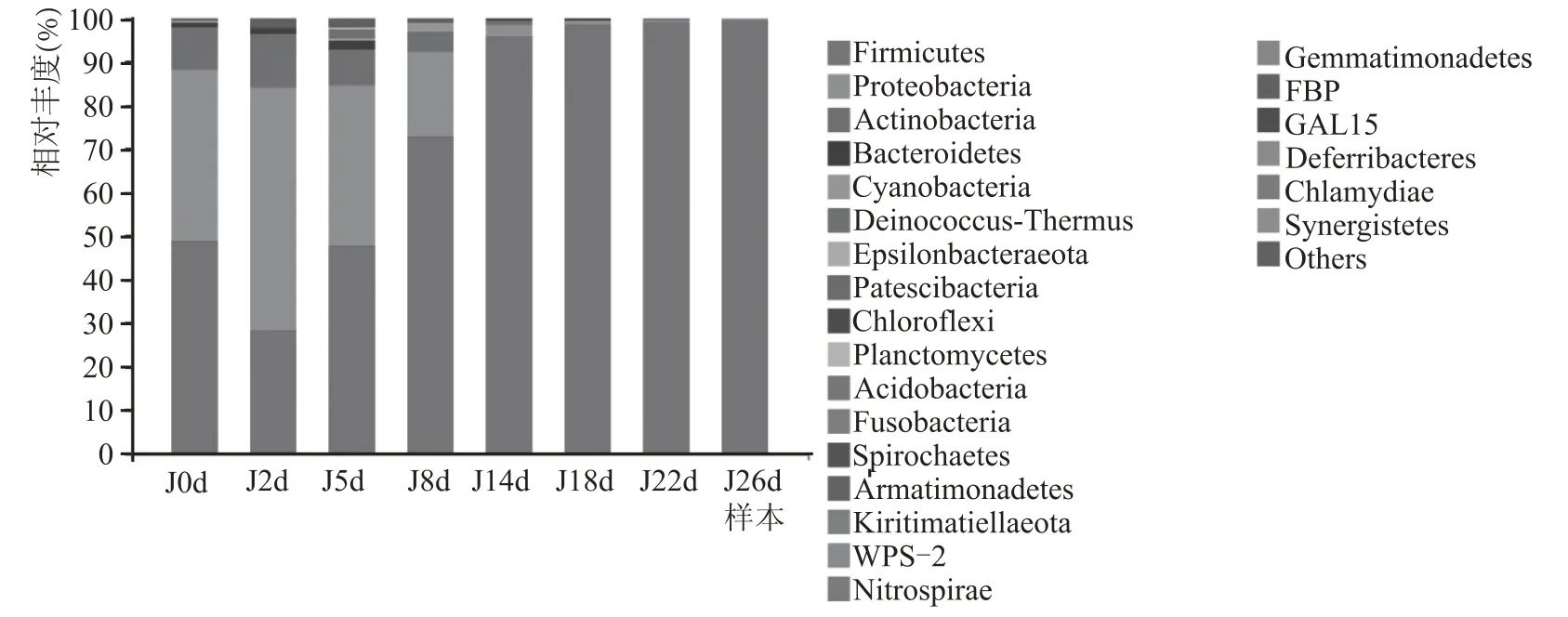
图10 酒醅门水平细菌群落结构组成
图11 为酒醅发酵过程中细菌属水平top10 的细菌,依据相对丰度大小依次为、、、、、、、、、。由图11 可知,入池酒醅中细菌多样性丰富,、、相对丰度分别为31.53 %、16.37 %、14.80%,在细菌菌群中占比较大。在发酵前期相对丰度较低,随着发酵期的延长,相对丰度从16.27%迅速升至90%以上,从发酵的第14天开始,相对丰度增长速率减缓,直至26 d 发酵结束时相对丰度达到99.12 %。在酒醅发酵过程中主要代谢碳水化合物产生乳酸、乙酸等有机酸,是一类兼性厌氧菌,耐酸性较好,酒醅发酵时温度、酸度逐渐升高及后期氧含量逐渐减少,此时环境条件不利于大部分细菌生长,但为创造了良好的生长环境,因而后期占绝对优势。在发酵前期占比较大,相对丰度为5.95%~19.51%,后期相对丰度降低,占比不足1 %。在发酵的第2 天相对丰度达到峰值为40.57 %,在0 d 时相对丰度为16.37 %,后期随着发酵时间延长相对丰度逐渐降低,22 d 后不被检出,表明酒醅发酵环境不利于的繁殖,后期逐渐衰亡。(相对丰度0.47 %~6.22 %)、(相对丰度0.06 %~5.78 %)、(相对丰度0.47 %~4.26 %)、(相对丰度0.17 %~1.94 %)、(相对丰度0.26 %~2.07 %)、(相对丰度0.29%~1.86%)均存在于酒醅发酵的前期和中期(0~14 d),前期相对丰度较高,中期相对丰度逐渐减小,发酵至14 d 后基本不被检出。综上所述,酒醅发酵前期微生物种类丰富,随着发酵过程的推进,部分细菌因不能适应较高的乙醇浓度和高酸环境,生长受到抑制或死亡;细菌菌群的多样性和丰富度逐渐降低,后期耐酸性强的迅速增殖成为优势菌,占比达到90%以上。

图11 酒醅属水平top10细菌组成柱状图
2.3.5 细菌Alpha 多样性分析
通过Illumina高通量测序对酒醅发酵过程中的8 个样本进行细菌多样性分析。在97 %相似度水平下对序列聚类并进行OTU划分,结果见表2。

表2 酒醅中细菌的Alpha多样性指数
由表2 可知,酒醅中细菌群落多样性及丰富度在发酵的前期和后期差异较大。发酵前期细菌菌群Chao1 指数和Observed_species 指数都比较高,表明这一时期酒醅中细菌大量繁殖,菌落丰富度逐渐增大,即细菌种类增多;发酵5~26 d,Chao1 指数和Observed_species 指数逐渐减小,细菌群落丰富度逐渐降低,这与酒醅发酵期间窖池中氧含量、温度、酒醅水分含量、酸度等有关,发酵中后期窖池中高温、低酸、低氧等环境导致大部分细菌死亡,只有乳杆菌、鞘脂单胞菌、醋杆菌等对不利环境耐受性好的菌存活。菌群多样性表征指数Shannon 指数在发酵的0~8 d 较高,后期较低,这也是因为发酵前期微生物大量繁殖种类较多,多样性丰富,后期随着部分微生物的死亡,菌群多样性降低。
2.3.6 细菌β-多样性分析(层次聚类分析)
图12 为酒醅中细菌样本层次聚类树,图中所有样本被分为两大类,发酵前期(0~8 d)为第一类,后期(14~26 d)为第二类,两大类下又分为多个小类。从右侧细菌属水平top10 分布来看,第一类中细菌多样性和丰富度高,第二类中细菌结构单一,表明酒醅发酵前后期样本中细菌群落结构差异较大。
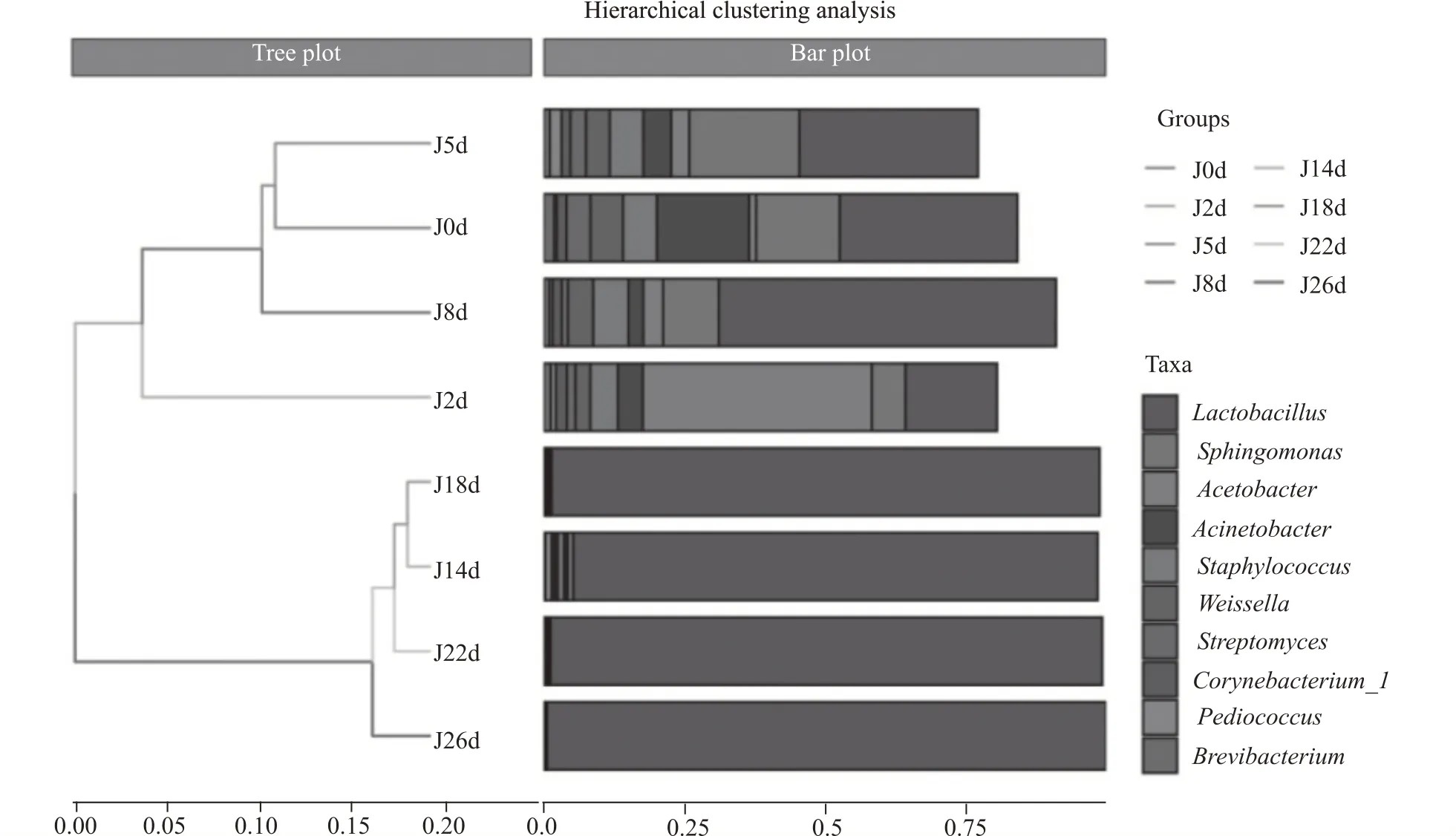
图12 酒醅样本中细菌聚类树
3 结论
酒醅发酵过程是白酒酿造的关键环节,直接关系着白酒产质量的高低。研究结果表明,在发酵过程中酒醅温度变化符合“前缓、中挺、后缓落”的变化规律,随着温度的升高,酒醅中水分含量、酸度、酒精度随发酵时间的推进有所上升,淀粉在淀粉酶系作用下逐渐分解,还原糖在发酵前期部分积累后也随着微生物的增殖以及发酵的进行被大量消耗,含量逐渐减少。酒醅的酸度是非常重要的工艺参数,在一定程度上反映了微生物的生长代谢情况,淀粉和还原糖则可以反映发酵的进行程度,酒精度也是生产工艺上一个重要参考指标。这些理化指标控制在合理范围之内,是保证产酒质量的基本条件。
微生物区系是白酒酿造的动力来源,主要包括霉菌、酵母菌、细菌以及放线菌等。在凤香型酒醅发酵过程中真菌和占据优势地位,细菌以、、为主。糖化酶和液化酶主要由霉菌产生,部分根霉菌也有产生脂肪酶和乙醇的能力,可以催化有机酸与醇生成酯类物质;酯化酶主要来源于酵母菌和霉菌。在酒醅发酵前、中期,水分、温度、营养物质等条件适宜,酵母菌和霉菌快速繁殖,各种酶活性较高,随着发酵时间的延长,酸度、酒精度等理化指标含量增加,酶活随之降低;在发酵后期,酵母菌、霉菌大量衰亡,细菌逐渐成为优势种属,尤其部分耐酸耐酒精细菌占据优势地位。在整个酒醅发酵过程中理化指标与功能酶活性变化与微生物群落变化相一致,呈现一定的作用规律。
综上所述,酒醅中各种功能酶的产生主要来源于微生物代谢,酒醅理化指标的变化则会影响各种功能酶的活性变化和微生物的生长情况,这三者之间相互作用,联系紧密。掌握了酒醅在发酵过程中的物质变化规律与微生物群落变化,可以更加清楚认识到两者之间的相互作用,为后续指导生产工作提供理论支撑。

