正常和腹泻水貂肠道微生物16S rRNA测序差异性分析
任建炜 , 徐 航 , 庄桂玉 , 温建新
(1.青岛农业大学动物医学院 , 山东 青岛 266109 ; 2.青岛西海岸新区农村农业局 , 山东 青岛 266400)
引起水貂腹泻的因素有很多,常存在混合感染致病的情况,主要分为病原性腹泻和非病原性腹泻,其中病原性腹泻包括病毒性腹泻、细菌性腹泻和寄生虫性腹泻等[1]。腹泻的发生没有明显的季节性,温度、饮食、用药及免疫等很多方面都能引起水貂腹泻,养殖户在确诊前的用药对疾病的控制有重要影响[2],如不清楚病因时盲目用药,可能会加重病情,因此需要对腹泻的原因进行准确的鉴定和诊断[3],如采用肠杆菌基因间重复共有序列PCR(Enterobacterial repetitive intergenic consensus-PCR,ERIC-PCR)技术可以分析出毛皮动物肠道内的益生菌和有害菌菌种[4]。在各种因素的作用下,不同个体肠道内正常菌群的种类、数量和分布是不固定的、变化的[5]。因抗药、耐药性的细菌不断产生,以及超级细菌的出现,使毛皮动物肠道疾病多发,且多出现混合感染的情况[6]。本试验将对青岛西海岸某水貂养殖场中的腹泻水貂和正常水貂的粪便进行16S rRNA测序,并通过分类操作单元(Operational taxonomic units,OTU)分析对正常水貂和腹泻水貂粪便中菌群的物种分布和物种丰度聚类进行分析,从而得出腹泻水貂与正常水貂肠道微生物的物种分布、结构以及物种丰度聚类的差异,可以准确得出腹泻水貂肠道内菌群的分布、种类和丰度,对腹泻进行进一步诊断,并采取措施使机体体内微生态环境恢复正常状态,达到治疗腹泻的目的。
1 材料与方法
1.1 材料 于青岛西海岸新区某水貂养殖场随机采集同一养殖场、同一时间正常水貂和腹泻水貂粪便。
1.2 方法 将随机采集的粪便进行样本合并后稀释并进行分组,每组3个重复,分别为正常组(NM-1、NM-3、NM-5)和腹泻组(DM-1、DM-3、DM-4)。所有样品送至安诺优达基因科技(北京)有限公司进行测序,对测序结果进行分析。
2 结果
2.1 物种分布
2.1.1 门水平分布 6个样品共得到2个门,分别为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),见表1。腹泻组中厚壁菌门分别占比83.00%、58.00%和88.00%,高于正常组,差异显著(P<0.05);腹泻组中变形菌门分别占比17.00%、42.00%和12.00%,低于正常组,差异显著(P<0.05)。与正常组肠道菌群相比,腹泻组的优势菌群是厚壁菌门,正常组中的优势菌群是变形菌门。
2.1.2 纲水平分布 6个样品共得到3个纲,分别为芽孢杆菌纲(Bacilli)、梭菌纲 (Clostridia)和丙型变形菌纲(Gamma proteobacteria),见表1。腹泻组中芽孢杆菌纲分别占比12.00%、1.50%和13.20%,与正常组相比差异不显著(P>0.05);梭菌纲仅在腹泻组中检测出,分别占比 60.00%、58.50%和74.80%,明显高于正常组,差异极显著(P<0.01);腹泻组中丙型变形菌纲分别占比28.00%、40.00%和12.00%,低于正常组,差异显著(P<0.05)。与正常组肠道菌群相比,腹泻组优势菌群是梭菌纲,正常组优势菌群是丙型变形菌纲。
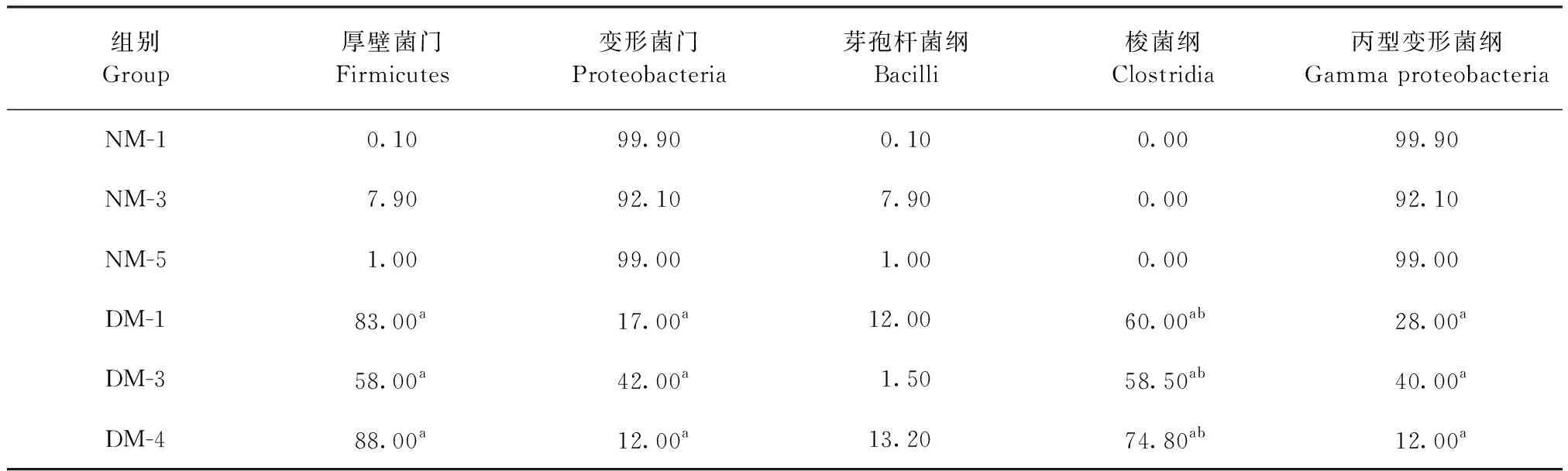
表1 细菌门水平和纲水平分布分析Table 1 Analysis of the distribution of bacterial phylum and class level (%)
2.1.3 目水平分布 6个样品共得到5个目,其中比例较高的4个目分别为乳杆菌目(Lactobacillales)、梭菌目(Clostridiales)、巴氏杆菌目(Pasteurellales)和肠杆菌目(Enterobacteriales),见表2。梭菌目和巴氏杆菌目仅在腹泻组中检测出,梭菌目占比60.00%、58.50%和74.80%,巴氏杆菌目占比3.55%、35.50%和4.87%,2个菌目均明显高于正常组,差异极显著(P<0.01);腹泻组中乳杆菌目分别占比12.50%、2.00%和10.18%,与正常组相比差异不显著(P>0.05);腹泻组中肠杆菌目分别占比23.95%、4.00%和10.15%,明显低于正常组,差异极显著(P<0.01)。与正常组肠道菌群相比,腹泻组优势菌群是梭菌目和巴氏杆菌目,正常组优势菌群是肠杆菌目。
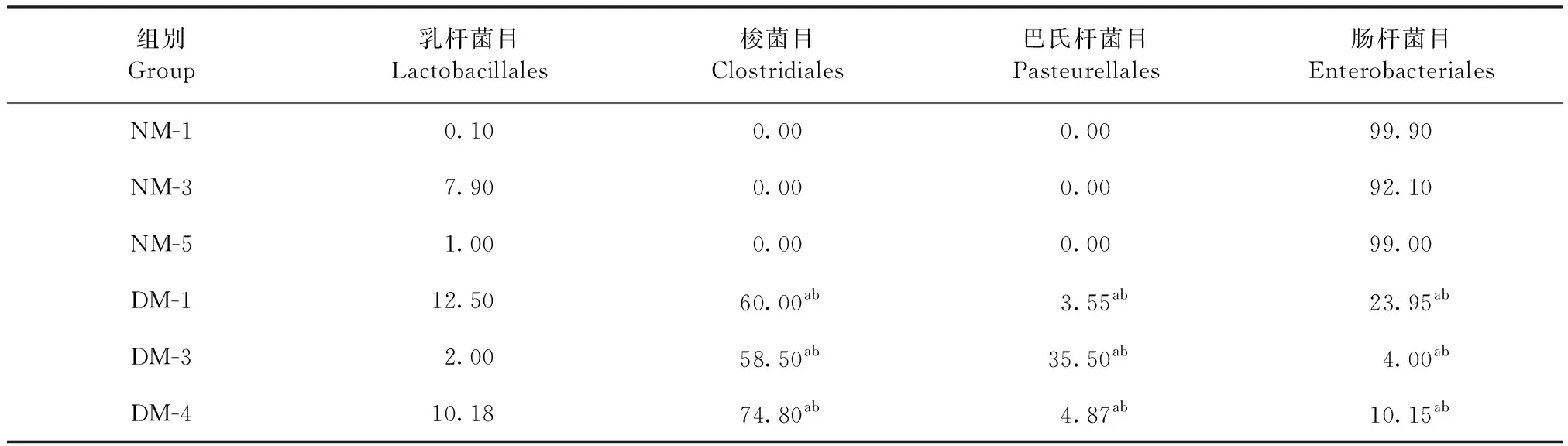
表2 细菌目水平分布分析Table 2 Analysis of the distribution of bacterial order level (%)
2.1.4 科水平分布 6个样品共得到6个科,其中比例较高的5个科分别为肠球菌科(Enterococcaceae)、巴氏杆菌科(Pasteurllaceae)、链球菌科(Stretococcaceae)、梭菌科(Clostridlaceae)和肠杆菌科(Enterobacteriaceae),见表3。巴氏杆菌科、链球菌科和梭菌科仅在腹泻组中检测出,巴氏杆菌科占比 3.55%、35.50%和4.87%,链球菌科占比12.50%、2.00%和10.18%,梭菌科占比60.00%、58.50%和74.80%,3个菌科均明显高于正常组,差异极显著(P<0.01);腹泻组中肠球菌科占比为0,肠杆菌科分别占比23.95%、4.00%和10.15%,2个菌科均明显低于正常组,差异极显著(P<0.01)。与正常组肠道菌群相比,腹泻组优势菌群是梭菌科、链球菌科、巴氏杆菌科,正常组优势菌群是肠球菌科、肠杆菌科。
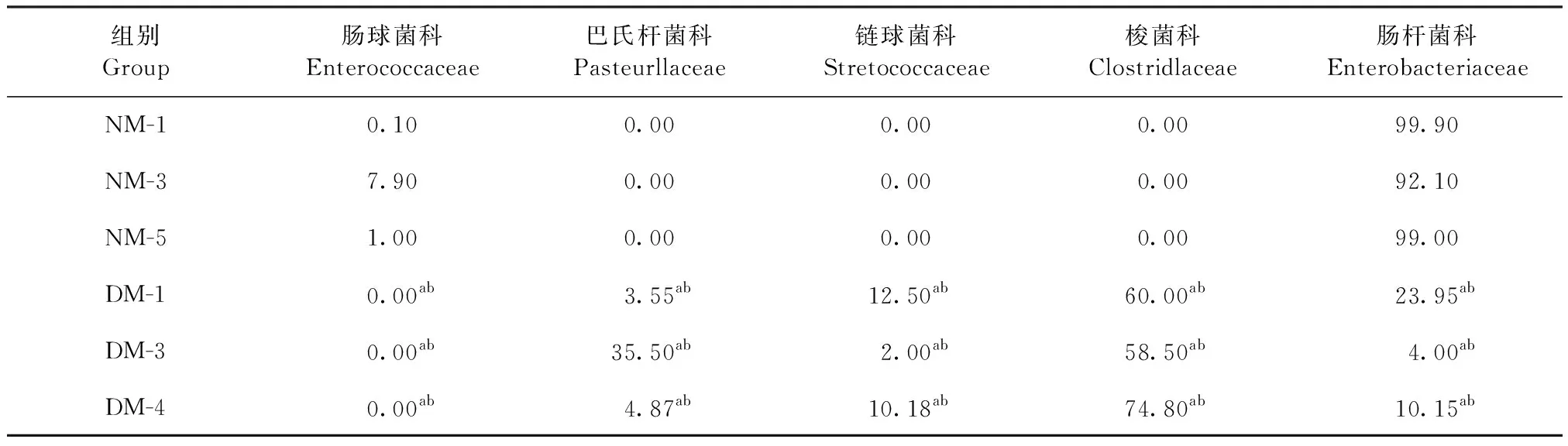
表3 细菌科水平分布分析Table 3 Analysis of the distribution of bacterial family level (%)
2.1.5 属水平分布 6个样品共得到7个属,其中比例较高的6个属分别为巴氏杆菌属(Pasteurella)、肠球菌属(Enterococcus)、放线杆菌属(Actinobacllus)、沙雷菌属(Serratia)、链球菌属(StrePtococcus)和梭菌属(Clostridllus),见表4。巴氏杆菌属、放线杆菌属、链球菌属和梭菌属仅在腹泻组中检测出,巴氏杆菌属分别占比3.00%、0和0,放线杆菌属分别占比0、32.00%和0,链球菌属分别占比12.28%、2.00%和12.00%,梭菌属分别占比60.00%、58.50%和74.80%,4个菌属均明显高于正常组,差异极显著(P<0.01);腹泻组中肠球菌属占比为0,明显低于正常组,差异极显著(P<0.01);腹泻组中沙雷菌属占比为0,明显低于正常组,差异极显著(P<0.01)。与正常组肠道菌群相比,腹泻组优势菌群是巴氏杆菌属、放线杆菌属、链球菌属、梭菌属,正常组优势菌群是肠球菌属、沙雷菌属。

表4 细菌属水平分布分析Table 4 Analysis of the distribution of bacterial genus level (%)
2.2 物种丰度聚类
2.2.1 目水平物种丰度聚类 经过测序,选取主要丰度的菌目和其在每个样品中的丰度信息,并进行聚类,见表5。腹泻组DM-3巴氏杆菌目丰度Z值为2,远高于正常组,差异极显著(P<0.01);腹泻组梭菌目丰度Z值分别为0.5、0.5和1.5,远高于正常组,差异极显著(P<0.01);腹泻组中肠杆菌目的丰度Z值均低于腹泻组,差异极显著(P<0.01);乳杆菌目丰度在2个组之间差异不显著(P>0.05)。与正常组相比,腹泻组中梭菌目和巴氏杆菌目丰度相对增加,肠杆菌目在腹泻组丰度相对减少,乳杆菌目丰度并未产生明显差异变化。
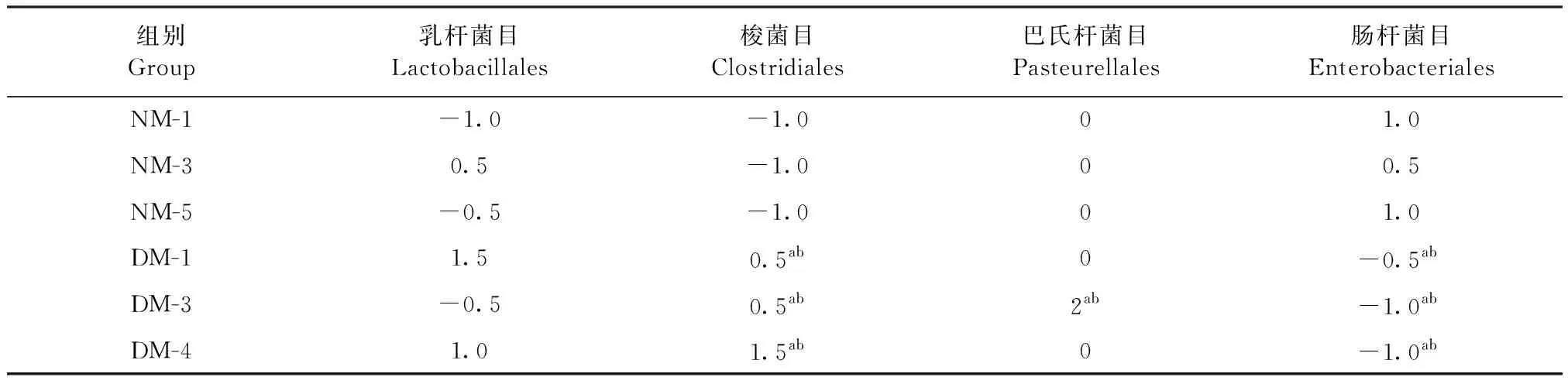
表5 细菌目水平丰度分析Table 5 Abundance analysis of bacterial order level (Z)
2.2.2 科水平物种丰度聚类 经过对6个样本进行测序,科水平丰度见表6。腹泻组中巴氏杆菌科丰度Z值分别为0.0、2.0和-0.5,梭菌科丰度Z值分别为0.5、0.5和1.0,链球菌科丰度Z值分别为1.5、-0.5和1.0,3个菌科丰度均远高于正常组,差异极显著(P<0.01);腹泻组中肠杆菌科丰度Z值分别为-0.5、-1.0和-1.0,肠球菌科丰度Z值为-0.5、2.0和0.0,2个菌科丰度均低于正常组,且差异极显著(P<0.01)。与正常组相比,腹泻组中梭菌科、巴氏杆菌科、链球菌科丰度相对增加,肠杆菌科、肠球菌科丰度相对减少。

表6 细菌科水平丰度分析Table 6 Abundance analysis of bacterial family level (Z)
2.2.3 属水平物种丰度聚类分析 属水平丰度分析见表7。腹泻组中巴氏杆菌属丰度Z值分别为2.0、-0.5和-0.5,梭菌属丰度Z值分别为2.0、0.0和-0.5,链球菌属丰度Z值分别为1.5、-0.5和1.0,放线杆菌属丰度Z值分别为-0.5、-0.5和2.0,4个菌属丰度均远高于正常组,差异极显著(P<0.01);腹泻组中肠球菌属丰度Z值均为-0.5,沙雷氏菌属丰度Z值均为-0.5,2个菌属丰度均低于正常组,差异极显著(P<0.01)。与正常组相比,腹泻组中梭菌属、巴氏杆菌属、链球菌属和放线杆菌属丰度相对增加,肠球菌属、沙雷菌属丰度相对减少。
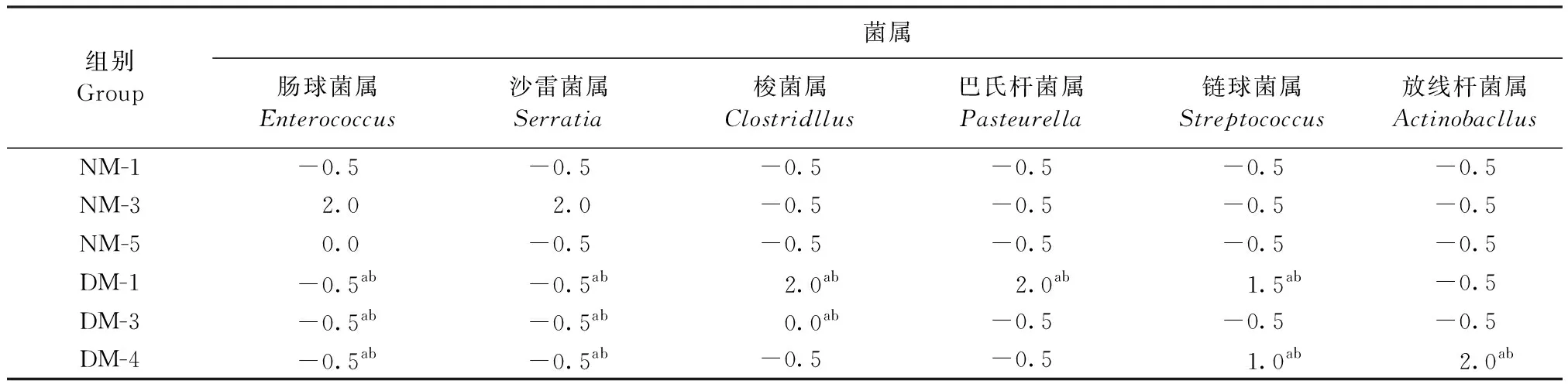
表7 细菌属水平丰度分析Table 7 Abundance analysis of bacterial genus level (Z)
3 讨论
肠道内的致病菌增多是导致水貂腹泻的主要原因之一。目前,大多数研究表明,肠道内的单一致病菌感染或多种致病菌混合感染均可导致水貂腹泻,于杰等[7]从死亡水貂中分离鉴定出绿色气球菌(Greenballoonfungus)、大肠埃希菌、副伤寒沙门菌(Salmonellaparatyphi)和小肠结肠炎耶尔森菌(Yersiniaenterocolitica)等细菌均可导致水貂细菌性疾病。葛俊伟等[8]首次报道了对水貂源致病性粪肠球菌的分离和鉴定。肠球菌是人和动物体内正常菌群之一,也是机会致病菌,可引起尿路感染、化脓性腹部感染、败血症、心内膜炎和腹泻、发烧等多种疾病[9]。邹积振等[10]从腹泻水貂的临床病例中分离出的魏氏梭菌、志贺氏菌(Shigella)[11]、沙门菌[12]、巴氏杆菌[13]也是引起水貂腹泻的病原。王贵升[14]在对水貂腹泻病的流行病学调查中发现,导致水貂腹泻病的细菌病中大肠埃希菌感染的发病率最高。
根据已报道的研究并结合本试验的结果分析,腹泻水貂肠道微生物在纲水平上梭菌纲占比显著增加;在目水平上梭菌目、巴氏杆菌目占比及相对丰度均显著增加,并且乳杆菌目和肠杆菌目占比及相对丰度相对减少;在科水平上梭菌科、巴氏杆菌科、链球菌科占比及相对丰度显著增加,肠球菌科、肠杆菌科占比及相对丰度相对减少;在属水平上梭菌属、巴氏杆菌属、链球菌属、放线杆菌属占比及相对丰度显著增加,肠球菌属、沙雷菌属占比及相对丰度相对减少。因此,可以对本试验的水貂腹泻做出初步诊断,根据在属水平所检测出的菌群及其占比和相对丰度情况,可以得出导致水貂腹泻的原因之一为梭菌属、巴氏杆菌属、链球菌属、放线杆菌属等多种致病菌群增多而引起混合的感染。
目前已知的水貂肠道细菌性疾病原因比较复杂,在预防和治疗的过程中困难重重[15]。因此,在了解腹泻水貂肠道内菌种的分布和结构后,对肠道疾病的诊断有很大帮助。微生态制剂在养殖业的应用可以有效调节动物机体肠道微生态和微生物的分布、数量及种类,以维持肠道内菌群的动态平衡,达到预防和治疗疾病的效果。

