河南地区猪源肠外致病性大肠杆菌的分离鉴定与耐药性试验
蒋增海 , 邓同炜 , 唐光武 , 夏艳勋 , 何启盖
(1.河南牧业经济学院动物医药学院 , 河南 郑州 450046 ; 2. 华中农业大学动物医学院 , 湖北 武汉 430070)
肠外致病性大肠杆菌(Extraintestinal pathogenicEscherichiacoli)是分离于肠道外感染的大肠杆菌,例如致肾盂肾炎大肠杆菌、新生儿脑膜炎大肠杆菌、败血型大肠杆菌,它们属于一小部分健康群体肠道中的正常菌群,可无症状的定居于肠道,一旦进入肠道外的组织,能够高效定植,导致人类或者许多种类的动物发病[1]。
在我国,肠外致病性大肠杆菌在病猪中普遍流行,造成严重危害。Tan等[2]报道,从我国19个省份送检的3 127份猪肺脏、心脏、脾脏等样品中分离到肠外致病性大肠杆菌 315株,检出率为10.1%(315/3 127),其中检出率从2004年的 3.1%上升到2007年的14.6%。马增军等[3]报道,2013年12月—2014年7月从秦皇岛地区送检的30份高热症状濒死的猪病料中分离鉴定出8株肠外致病性大肠杆菌,检出率为26.67%(8/30)。
本试验调查了河南地区猪肠外致病性大肠杆菌的流行、耐药谱和整合子携带情况,分析其整合子可变区携带耐药基因,旨在为本地区该病菌感染的预防和控制提供参考依据。
1 材料与方法
1.1 病料来源 2016年9月—2018年12月,从鹤壁、郑州、商丘、平顶山、许昌、新乡、周口、洛阳、开封、驻马店和漯河等地61家猪场送检的病猪中,采集肺脏、肝脏、脾脏、肾脏、心血、淋巴结等病料,进行大肠杆菌的分离鉴定。
1.2 主要试剂 MH(Mueller-hinto)肉汤,购自英国Oxoid公司;胰蛋白酶大豆琼脂(Tryptic soy agar,TSA)、胰蛋白酶大豆肉汤(Tryptic soy broth,TSB),均购自美国BD公司;麦康凯琼脂和营养肉汤,均购自北京奥博星生物有限公司;肠杆菌科细菌生化编码鉴定管 CYZ-15e及配套试剂,购自杭州滨和微生物试剂有限公司;ExTaqDNA Polymerase、dNTP Mixture、10×ExTaqBuffer(Mg2+plus),均购自TaKaRa公司;BM2 000 DNA Marker,购自北京博迈德基因技术有限公司;各种药物,均购自Solarbio公司。
1.3 方法
1.3.1 细菌的分离培养 采集病猪的肺脏等病料,划线接种于TSA平板(加有5%犊牛血清和0.01%NAD),37 ℃恒温培养12~24 h,挑取圆形、湿润、半透明、1~2 mm大小的优势菌落,接种于麦康凯平板进一步纯化2~3代;再挑取纯化后的单菌落,接种于TSB肉汤,37 ℃摇床培养8~12 h,使用灭菌的甘油溶液,保存于-80 ℃备用。
1.3.2 革兰染色镜检 采用革兰染色液对分离纯化菌株进行革兰染色,在油镜下观察分离细菌形态特征。
1.3.3 生化试验 按照杭州滨和微生物试剂有限公司生产的肠杆菌科细菌生化编码鉴定管 CYZ-15e及配套试剂说明书操作,进行分离菌株的生化试验,根据生化试验结果,利用肠杆菌科细菌生化鉴定编码手册,检索细菌鉴定结果。
1.3.4 PCR检测 利用水煮沸法提取细菌DNA模板。参照文献[4]合成1对大肠杆菌PCR检测的特异性引物(EColi-1:5′-ATGAAAGCTGGCTACAGGAAGGCC-3′,EColi-2:5′-GGTTTATGCAGCAACGAGACGTCA-3′),扩增特异性片段大小约为264 bp。按照TaqDNA聚合酶试剂的说明书进行PCR体系加样。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸10 min。PCR产物经1%琼脂糖电泳后,DNA凝胶成像系统分析。
1.3.5 药敏试验 选取头氨苄西林(Ampicillin,AMP)、阿莫西林/克拉维素(Amoxicillin/clavulanate,AMC)、头孢噻呋(Ceftiofur,EFT)、头孢曲松(Ceftriaxone,CRO)、庆大霉素(Gentamicin,GEN)、卡那霉素(Kanamycin,K)、链霉素(Streptomycin,STR)、四环素(Tetracycline,TE)、强力霉素(Doxycycline,DOX)、环丙沙星(Ciprofloxacin,CIP)、恩诺沙星(Enrofloxacin,ENR)、磺胺甲噁唑/甲氧苄啶(Sulfamethoxazole/trimethoprim,SXT)、磺胺甲噁唑(Sulfamethoxazole,SF)、黏杆菌素(Colistin,CT)、氯霉素(Chloramphenicol,CHL)、氟苯尼考(Florfenicol,FloR)16种药物,以大肠杆菌 (ATCC25922)为质控菌株,依据参考文献[5-6],采取微量稀释法药敏试验进行猪肠外大肠杆菌分离菌株的耐药性检测。
1.3.6 氟苯尼考耐药基因(floR)的检测 参考 GenBank上公布的鼠伤寒沙门菌DT104 H3380 菌株floR基因序列(登录号:NG_047860.1),利用Primer 5设计1对扩增floR的特异性引物(FloR-1:5′-CTCCCTGTCGTTCCAGCGAT-3′,FloR-2:5′-AGACGACTGGCGACTTCTCG-3′),扩增大小为1 114 bp,反应条件:94 ℃预变性 3 min;94 ℃变性30 s,58 ℃ 退火30 s,72 ℃ 延伸1 min,共30个循环;72 ℃ 延伸10 min,最后凝胶电泳分析扩增结果。PCR产物送测序,其测序结果通过BLAST分析,进一步确认floR的检测结果。
1.3.7 Ⅰ类整合子及其基因盒的检测 参考文献[7]分别合成Ⅰ类整合酶基因(intⅠ)及基因盒可变区PCR扩增引物(intI1-F:5′-GCCTTGCTGTTCTTCTACGG-3′,intI1-R:5′-GATGCCTGCTTGTTCTAC GG-3′,扩增片段大小为558 bp;CS-F:5′-GGCATCCAAGCAGCAAGC-3′,CS-R:5′-AAGCAGACTTGACCTGAT-3′,扩增片段大小可变)。PCR 反应条件:94 ℃预变性 5 min;94 ℃变性30 s,55~58 ℃ 退火30 s,72 ℃ 延伸1 min 30 s,共35个循环;最后72 ℃ 延伸10 min。PCR扩增产物经过2%琼脂糖凝胶电泳分析。基因盒可变区PCR扩增产物纯化回收后,送生工生物工程(上海)股份有限公司测序,测序结果提交NCBI数据库进行BLAST同源性比对分析。
2 结果
2.1 细菌分离培养 从河南省61家猪场送检的病猪中采集肺脏、肝脏、心血等样品,共分离到大肠杆菌可疑菌株17株,检出率为27.8%(17/61),分别命名为KFW、WG1、KF、ZMD1、Sq2Hy、YanlinF2、Z1MF、ZMFD、ZhM1F、LKPS、ZhkouX1、ZHM2X、ZhM3X、WSX、ZMD、WSG和WG。肺脏是分离菌株的主要来源,其次是心血和肝脏。其中16株分离菌从保育仔猪中分离到,保育仔猪是最主要的感染年龄阶段猪。
2.2 革兰染色 将分离到的大肠杆菌可疑菌株进行革兰染色,在油镜下观察,均呈革兰阴性、中等大小的杆菌(图1)。

图1 分离菌株的染色镜检结果(1 000×)Fig.1 Microscopic examination of the stained isolates(1 000×)
2.3 生化试验 根据分离菌株的生化试验结果,利用生产厂家提供的肠杆菌科细菌生化鉴定编码手册检索细菌鉴定结果,显示所分离的17株细菌均为大肠杆菌。
2.4 PCR检测 采用PCR扩增法对分离菌株进一步检测,结果表明分离菌株均能够扩增264 bp的特异性条带(图2),进一步验证分离菌株均为大肠杆菌。

图2 分离菌株的PCR扩增Fig.2 PCR amplification of the isolates M:BM2 000 Marker; 1~17:分离菌株; 18:阴性对照M:BM2 000 Marker; 1-17:The isolates; 18:Negative control
2.5 药敏试验 结果如图3所示,分离菌株对各种药物耐药率普遍较高,其中氨苄西林、阿莫西林/克拉维酸、四环素、磺胺甲噁唑/甲氧苄啶、磺胺甲噁唑、氯霉素、氟苯尼考耐药率为100%,多黏菌素耐药率最低为41.18%,头孢噻呋钠和头孢曲松耐药率均为47.06%,其他药物耐药率为58.82%~94.11%不等。由表1可知,分离菌株均为多重耐药菌株,四重耐药模式(如ACSuT)的菌株占100%,五重耐药模式(如ACSSuT)的菌株占58.82%,而七重耐药模式(如ACSSuT with amoxicillin/clavulanic acid and ceftriaxone)的菌株占35.29%。所有分离菌株都对10种以上药物耐药,其中3株分离菌株对16种药物均耐药。

表1 17株分离菌的多重耐药谱Table 1 Multidrug resistance spectrum of 17 isolates
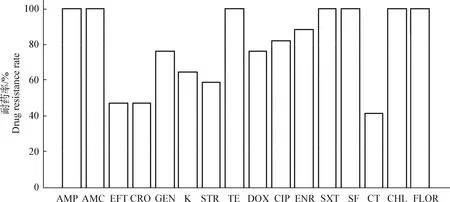
图3 17株分离菌对各种药物耐药率Fig.3 Resistance rates of 17 isolates to various drugs
2.6 氟苯尼考耐药基因(floR)检测 分离菌株floR的检测结果显示,分离菌株floR的PCR扩增结果均为阳性(图4),同时,PCR产物测序结果分析进一步确认分离菌株携带floR,由此可以判定17株分离菌株对氟苯尼考的耐药表型,与其携带floR相符合。

图4 分离菌株floR的PCR扩增Fig.4 PCR amplification of florfenicol resistance gene floR in the isolatesM:BM2 000 Marker; 1~17:分离菌株; 18:阴性对照M:BM2 000 Marker; 1-17:The isolates; 18:Negative control
2.7 Ⅰ类整合子及其基因盒的检测 分离菌株Ⅰ类整合子及其基因盒检测结果显示,分离菌株均携带Ⅰ类整合子(图5),其中Sq2Hy、ZMD、ZMD1、ZhM1F和WG菌株未扩增出基因盒可变区,其他12株菌扩增出大小为1 000~2 000 bp的片段,通过 BLAST比对分析,发现YanlinF2、ZhM3X、ZMFD、WSX、Z1MF菌株基因盒携带dfrA17-aadA5耐药基因类型,编码产物对甲氧苄啶和氨基糖甙类药物耐药;ZhM2X、LKPS、WG1菌株基因盒携带aadA22-aadA23-aadA25耐药基因类型,编码产物对氨基甙类药物耐药;WSG、ZhKouX1、KFW菌株分别携带floR、dfrA12、dfrA12-aadA2耐药基因,分别对于氟苯尼考、甲氧苄啶、甲氧苄啶-氨基糖甙类耐药;KW菌株基因盒不携带耐药基因。

图5 分离菌株Ⅰ类整合子的整合酶基因的PCR扩增Fig.5 PCR amplification of integrase genes in Class I integron of the isolatesM:BM2 000 Marker; 1~17:分离菌株; 18:阴性对照M:BM2 000 Marker; 1-17:The isolates; 18:Negative control
3 讨论
肠外致病性大肠杆菌不仅可以正常定植于肠道,而且能侵入体内引起菌血症,并诱发败血症或局部肠道外感染,如脑膜炎、关节炎、肺炎、心内膜炎等[8]。本试验从河南61家猪场送检的发病猪中共分离到17株肠外致病性大肠杆菌,检出率为27.86%(17/61),相比国内其他地区检出率稍高,如曾博等[9]报道西南地区猪肠外致病性大肠杆菌检出率为18.5%,周磊[8]报道在安徽等五省猪场中肠外致病性大肠杆菌检出率为19.2%。
多重耐药指至少对3类抗菌药物具有耐药性[10]。本试验结果显示,全部分离菌株均为多重耐药菌株,如四重耐药模式(如ACSuT)的菌株占100%,其中3株分离菌株对16种检测药物均耐药,表明该地区猪源肠外大肠杆菌耐药性十分严重。近年来,全国各地[11-14]报道猪源大肠杆菌对各种药物耐药率普遍比较高,如氨苄西林、四环素、氯霉素和磺胺甲噁唑等,但是对头孢类药物耐药率相对低一些,与本试验结果一致。但是与文献[11-14]相比,本试验分离菌株对某些药物如头孢类药物、氨苄西林、氯霉素等耐药率更高。
整合子作为一个可移动的基因元件,可定位于细菌染色体上,使细菌耐药性发生垂直传播,也可借助于质粒、转座子在不同细菌之间发生水平转移[15]。本试验结果显示,分离菌株均携带floR耐药基因和Ⅰ类整合子,但是有的菌株Ⅰ类整合子基因盒不携带耐药基因,多数菌株携带dfrA17-aadA5、aadA22-aadA23-aadA25、dfrA12-aadA2等耐药基因谱。与其他文献[16-17]报道相比,本试验分离菌株中Ⅰ类整合子阳性率更高,表明其自身携带的耐药基因更可能发生传播的风险。氟苯尼考是目前猪场应用最为广泛的药物之一,本试验分离菌株对氟苯尼考均耐药,同时均携带floR,提示在临床应用时应注意检测其药物敏感性,以免造成治疗失败。

