猕猴源毛滴虫的鉴定
李鹤龄 , 王 宏 , 陈智岗 , 宗发梁
(1. 昆明理工大学灵长类转化医学研究院 , 云南 昆明 650500 ; 2. 云南中科灵长类生物医学重点实验室 , 云南 昆明 650217)
猕猴(Macacamulatta)是一种重要的非人灵长类动物,也是研究人类健康和疾病的理想动物模型,在普通级环境中饲养的猕猴,都会受到寄生虫的侵袭,寄生虫感染不仅影响自身健康,也会干扰实验结果[1]。三毛滴虫是一种寄生于动物肠道,引起动物反复腹泻,营养物质吸收不良,严重影响猕猴质量,甚至危及其生命,给猕猴养殖业带来极大的危害。截止目前,三毛滴虫的形态学和分子生物学等方面的研究已在猪[2]、猫[3]等物种中开展,但对猕猴源毛滴虫的形态和分子鉴定等方面的研究鲜有报道。本试验主要对猕猴肠道内三毛滴虫形态结构进行观察并基于18S rRNA基因序列进行分析,准确鉴定出猕猴源三毛滴虫(Tritrichomonas),对猕猴三毛滴虫的诊断具有重要意义。
1 材料与方法
1.1 样本 随机采集30个饲养于开放环境设施内具有全身消瘦、脱水、粪便呈黄褐色水样症状的猕猴新鲜粪便。试验猕猴来源于云南中科灵长类生物医学重点实验室[SCXK(滇)K2017—0001]。
1.2 仪器及试剂 普通光学显微镜(Olympus,日本),PCR仪(Biometra,美国),DNA电泳成套设备(Bio-Rad,美国),凝胶成像仪(AlphaImager 2200,美国)。2×TaqPCR Master Mix和粪便基因组DNA提取试剂盒,均购自天根生化科技有限公司;胶回收试剂盒,购自北京擎科新业生物技术有限公司;卢戈碘液染色剂,购自北京索莱宝科技有限公司。
1.3 显微镜观察 于载玻片中央滴1滴生理盐水,用竹签挑取少许粪便在生理盐水中涂抹均匀,涂制成薄而均匀的粪膜,置于光学显微镜下观察虫体大致形态及滋养体形态结构。
1.4 毛滴虫浓集 选取低倍镜下每个视野平均5个以上毛滴虫滋养体的粪便样本。用注射器轻轻吸取5 mL粪便样本于15 mL离心管内,加入5 mL生理盐水,混匀,用一层灭菌纱布过滤2次,弃沉渣;再加5 mL生理盐水与滤液混匀,分别用两层、三层纱布各过滤2次,每次过滤后弃沉渣,3 500 r/min离心5 min。轻微摇晃,弃除上层液及中间杂质层,取最下层管底沉积约1 mL于2 mL离心管,加1 mL生理盐水后3 500 r/min离心5 min,弃上清液。取管底浓集的毛滴虫样本用作碘液染色和DNA提取试验。
1.5 碘液染色 取浓集后的管底样本10 μL于1.5 mL离心管,再加入10 μL卢戈碘液轻轻混匀,静置30 s待虫体着色后吸取10 μL于载玻片上,盖上盖玻片,置于普通光学显微镜下观察。
1.6 猕猴毛滴虫基因组DNA提取及PCR鉴定 取浓集后的管底样本,按照粪便基因组DNA提取试剂盒说明书提取粪便基因组DNA,分光光度计测得DNA浓度>40 ng/μL,OD260/OD280值为1.7~2.0的DNA样本用于后续试验。
1.6.1 18S rRNA基因序列扩增 参照文献[4]中的三毛滴虫18S rRNA基因引物序列:上游引物 P1(5′-GCTCGTAGTCAGAACTGC-3′);下游引物P2(5′-CCCAATTAGAACTCTATCTC-3′),扩增虫体18S rRNA基因序列。PCR反应体系:1 μL 模板,12.5 μL 2×TaqPCR MasterMix,上、下游引物各1 μL,ddH2O补足25 μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。取10 μL PCR产物用1%琼脂糖凝胶电泳检测后,用胶回收试剂盒纯化回收目的DNA,再将回收产物送至北京擎科新业生物技术有限公司进行测序。
1.6.2 5.8S rRNA基因序列扩增 参照文献[5]中的五毛滴虫5.8S rRNA 基因引物序列:上游引物 P3(5′-TGCTTCAGTTCAGCGGGTCTTCC-3′);下游引物P4(5′-CGGTAGGTGAACCTGCCGTTGG-3′),扩增虫体5.8S rRNA序列。PCR反应体系参照1.6.1。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。取10 μL PCR产物用1%琼脂糖凝胶电泳对其进行检测。
1.7 序列比对分析与进化树构建 获得的基因序列应用MegAlign软件与GenBank上已发表的相关序列经BLAST进行同源性比对,并利用MEGA 7.0构建系统发育进化树,分析比较不同种来源的毛滴虫的亲缘关系。
2 结果
2.1 形态观察 在高倍镜下可看到大量梨形、月牙形或近似卵圆形且有力、快速地不停游动的虫体,运动方向不固定,虫体末端有1根较粗大的轴杆突出于滋养体末端(图1A),经碘液染色后,在油镜下可见虫体呈卵圆形或梨形、虫体末段有1根鞭毛伸出体外,即为后鞭毛(图1B),未见波动膜;在油镜下可见虫体前鞭毛,但鞭毛数目很难在普通光学显微镜下判断准确(图1C)。基于形态观察,来源于猕猴肠道的毛滴虫可初步鉴定为猴源毛滴虫。
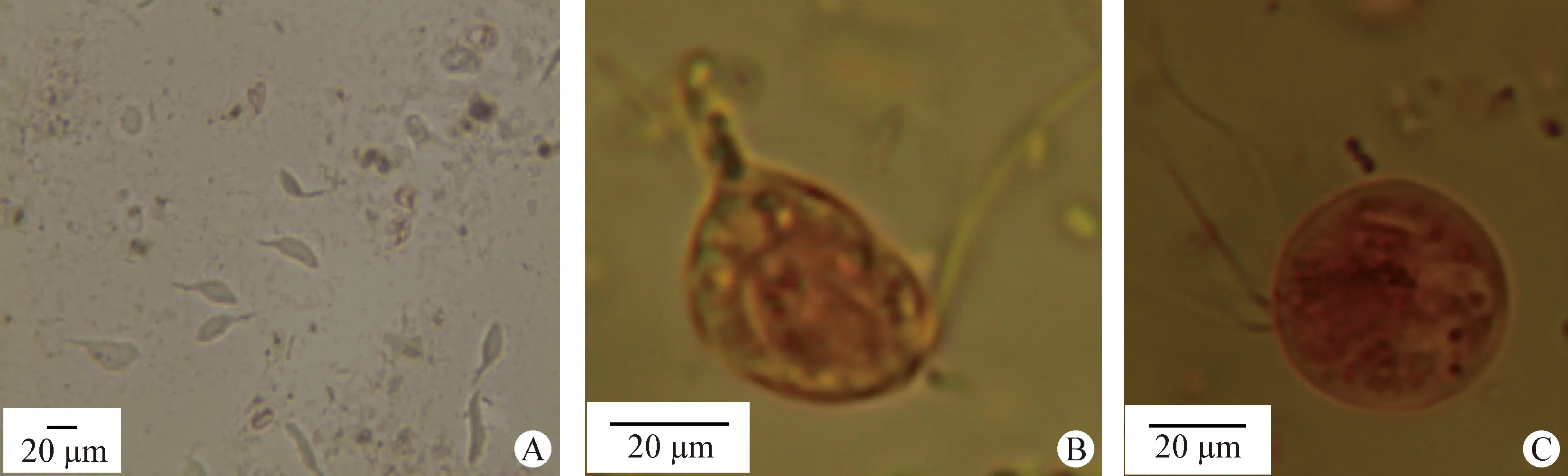
图1 猕猴源三毛滴虫的镜下观察结果Fig.1 Microscope observation of Tritrichomonas from rhesus monkeyA:直接涂片观察的猕猴源毛滴虫(40×); B、C:碘液染色后的猕猴源毛滴虫(100×)A:Trichomonas from rhesus monkey by direct smear (40×); B,C:Trichomonas from rhesus monkey stained by iodine solution(100×)
2.2 猕猴源三毛滴虫18S rRNA基因及五毛滴虫5.8S rRNA基因的克隆与序列分析 对扩增后的PCR产物用1%琼脂糖凝胶电泳检测,9个样品均获得500~750 bp的目的基因条带(图2),符合预期。将目的基因条带纯化回收后测序,获得的猴源三毛滴虫18S rRNA基因序列大小为656 bp。
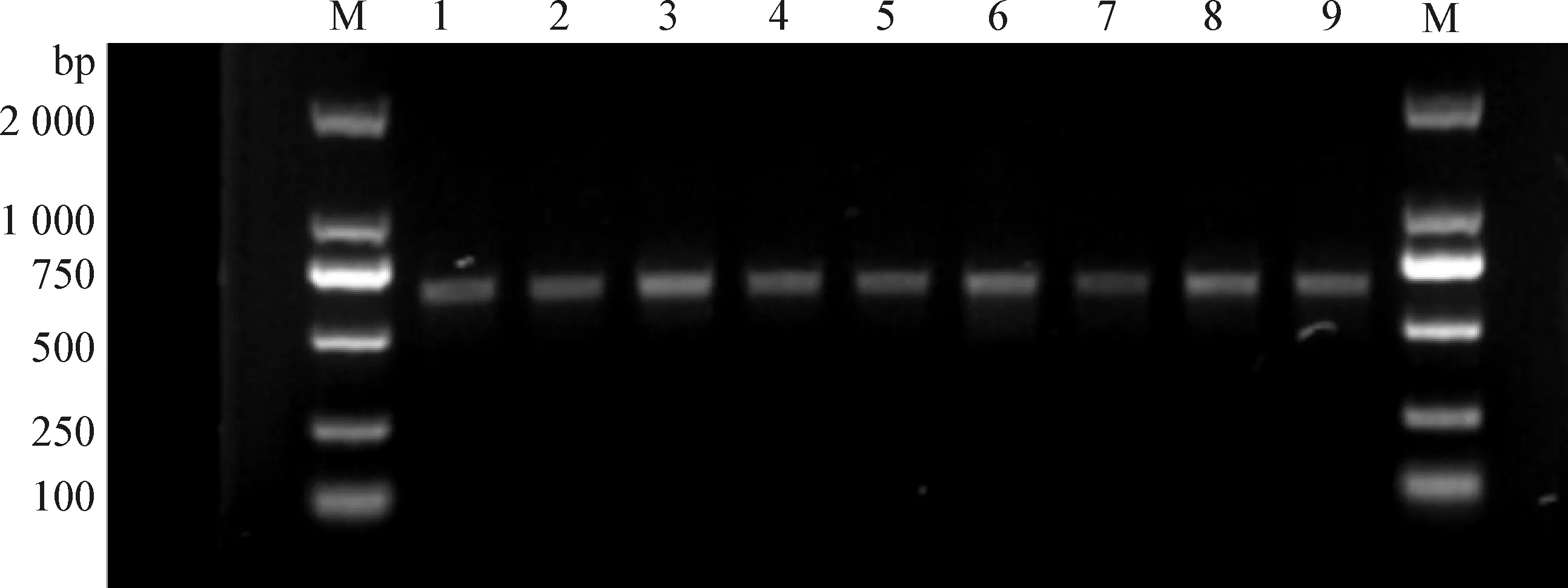
图2 猕猴源三毛滴虫18S rRNA基因的PCR扩增Fig.2 Amplification of Tritrichomonas 18S rRNA gene from rhesus monkey by PCRM:DL-2 000 marker; 1~9:样品M:DL-2 000 marker; 1-9:Samples
对五毛滴虫5.8S rRNA基因进行PCR扩增后的产物用1%琼脂糖凝胶电泳检测,未获得300~400 bp目的基因条带。
用DNASTAR的Clustalw法将获得的18S rRNA序列与发表在GenBank上的代表性序列进行比对,发现获得的猕猴源三毛滴虫(编号:RM060734)18S rRNA序列与分离自腹泻犬粪便中的胎儿三毛滴虫(登录号:AY754332)相似度最高,达到了97.2%(图3)。

图3 猕猴源三毛滴虫(RM060734)与其他种源毛滴虫同源性比对Fig.3 Similarity comparison of Tritrichomonas between rhesus monkey(RM060734) with others
2.3 基于18S rRNA基因序列构建的系统发育进化树 结果如图4所示,从猕猴粪便中分离的虫体与已报道的犬胎儿三毛滴虫18S rRNA(登录号:AY754332)以及污水中分离的人畜共患的三毛滴虫18S rRNA(登录号:KU939249)形成一个分支,而与其他的毛滴虫亲缘关系较远。因此,基于18S rRNA基因序列的分析可以鉴定来源于猕猴肠道的毛滴虫为猴源三毛滴虫。

图4 猕猴源三毛滴虫(RM060734)与已报道不同种源毛滴虫18S rRNA的系统发育进化树Fig.4 Phylogenetic tree based on 18S rRNA of Tritrichomonas between isolated from rhesus monkey(RM060734) with others▲:本试验所得▲:Obtained in this study
3 讨论
毛滴虫是一种微小的单细胞原生动物。据报道,寄生于人、犬、猫、非人灵长类和啮齿类动物的粪便中的毛滴虫有胚胎三毛滴虫[2-3](Tritrichomonasfoetus)和人五毛滴虫(Pentatrichomonashominis)[6-9]。
人五毛滴虫主要通过污染饮用水或者食物而被动物或者人误食而感染,苍蝇等也有传播作用,感染后主要症状表现为腹泻,还会导致肺部感染、风湿性关节炎等疾病[10-11]。三毛滴虫是通过粪—口途径感染发病,导致肠道感染和慢性腹泻[3,12-13],在繁殖群的牛群里面被认为是一种重要的性传播疾病,可导致母牛不孕和流产等[12],三毛滴虫还可能是免疫缺陷病毒感染的恒河猴发生坏死性化脓性胃炎的重要辅助因子[14]。目前,有关毛滴虫对猕猴的致病性及采用形态学结合分子生物学方法对毛滴虫进行鉴定的报道较少,所以本次对猕猴毛滴虫的研究为猕猴毛滴虫的检测提供了参考依据。
毛滴虫的生命周期简单,只有滋养体一种形式,其典型特征是滋养体呈1个梨形体或近似圆形,前鞭毛2~4根或3~5根,后鞭毛1根。在不利的环境条件下,如温度的突然变化[15]或药物[16]存在的情况,滋养体有时候会发生形态改变,滋养体表面发生内陷,而使鞭毛凹入滋养体内部。本试验采集猕猴的30份粪便直接涂片观察发现,有9份感染毛滴虫,6份感染小袋纤毛虫,1份感染阿米巴原虫,1份感染鞭虫,其余寄生虫未检出,毛滴虫感染率最高。本次从猕猴体内看到的毛滴虫呈蝌蚪状,运动方向不固定,2~5根前鞭毛和1根后鞭毛,但鞭毛数目很难在普通光学显微镜下判断准确,且未发现三毛滴虫鞭毛内陷现象。基于形态观察,来源于猕猴肠道的毛滴虫可初步鉴定为猴源毛滴虫。
在虫种或虫株水平上开展毛滴虫的分类研究,对毛滴虫的诊断和治疗等方面都具有十分重要的意义[6],因此传统的形态观察与分子生物学研究相结合的方法对种属的分类鉴定更为科学[17]。本试验利用形态观察及三毛滴虫18S rRNA基因和五毛滴虫5.8S rRNA基因分析对猕猴的毛滴虫进行了初步研究,结果显示从猕猴粪便中分离的毛滴虫与犬胎儿三毛滴虫18S rRNA基因的相似度为97.2%,并形成一个分支,而与其他的毛滴虫亲缘关系较远。由此推断,从猕猴粪便中分离的毛滴虫为三毛滴虫,所采样本未发生三毛滴虫和五毛滴虫混合感染的情况。该研究方法为猕猴肠道寄生虫的临床诊断提供了依据。

