布鲁氏菌DnaJ蛋白的表达及功能分析
印双红 , 张俊波 , 李寅翠 , 张孟琴 , 毛 宏 , 易 萌 , 蔡春连 , 张 红 , 李志强 , 陈创夫
(1.铜仁学院大健康学院 , 贵州 铜仁 554300 ; 2.铜仁学院农林工程与规划学院 , 贵州 铜仁 554300 ;3.铜仁学院贵州省梵净山地区生物多样性保护与利用重点实验室 , 贵州 铜仁 554300 ; 4.铜仁学院材料与化学工程学院 , 贵州 铜仁 554300 ; 5.商丘师范学院生物与食品学院 , 河南 商丘 476000 ; 6.石河子大学动物科技学院 , 新疆 石河子 832000)
布鲁氏菌病是一种人兽共患传染病,布鲁氏菌疫苗仍存在安全性差、免疫期短、重复免疫等一些缺陷[1],现有的亚单位疫苗还未达到减毒活疫苗的保护水平[2],与减毒活疫苗相比,亚单位疫苗具有避免发生免疫副反应并有助于血清学监测的优点[3],用于布鲁氏菌病亚单位疫苗研制的蛋白主要包括分子伴侣DnaK、外膜蛋白和AsnC等[4-5],但这些融合蛋白疫苗不能持续诱导有效的细胞免疫反应。
DnaJ是一种具有分子伴侣特性的蛋白质,DnaJ蛋白在生命体细胞中具有活性,功能为纠正或清除细胞内错误折叠、损伤失去活性的蛋白质和指导生成正确且具有生物活性的蛋白质,从而保护细胞免受应激破坏[6]。本试验通过对DnaJ蛋白进行表达与纯化,并研究其在细胞和小鼠体内产生的细胞和体液免疫反应,旨在为该蛋白的功能和疫苗开发研究奠定基础。
1 材料与方法
1.1 主要试剂及实验动物TaqDNA聚合酶、T4 DNA连接酶、蛋白Marker和DNA Marker,均购自宝生物工程(大连)有限公司;质粒pET-30a,购自Novagen公司;小鼠IFN-γ、IL-4、IgG1和IgG2a ELISA试剂盒,均购自美国GBD公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒,均购自天根生化科技(北京)有限公司。
1.2 菌株和细胞 布鲁氏菌M5-90、DE3感受态细胞、DH5α感受态细胞和RAW264.7细胞为贵州省梵净山地区生物多样性保护与利用重点实验室保存。
1.3 实验动物 6周龄体重约17 g的BALB/c小鼠,购自新疆医科大学动物实验中心。
1.4 试验方法
1.4.1 DnaJ蛋白的生物信息学分析 利用Predicting Antigenic Peptides在线预测DnaJ蛋白的抗原决定簇。使用SOPMA在线软件分析预测DnaJ蛋白的二级结构。
1.4.2DnaJ基因的合成及重组表达质粒pET-30a-DnaJ的构建 在布鲁氏菌M5-90株的DnaJ基因序列(BMEI1513)上接上NdeI/Hind III酶切位点,然后送通用生物系统(安徽)有限公司合成基因序列。对pET-30a表达载体进行NdeI/Hind III双酶切,然后将DnaJ(NdeI/Hind III)目的片段连接至pET-30a载体,连接体系为20 μL:pET-30a 4.0 μL,10×Ligation Buffer 4.0 μL,T4 DNA Ligase 0.3 μL,ddH2O 9.7 μL。22 ℃连接16 h。用试剂盒提取pET-30a-DnaJ质粒,然后对该质粒进行酶切验证,酶切体系为30 μL:NdeI内切酶1.0 μL,Hind III内切酶1.0 μL,质粒pET-30a-DnaJ 4.0 μL,10×Ligation Buffer 3.0 μL,ddH2O 21.0 μL,然后将质粒送深圳华大基因科技有限公司测序,然后进行DnaJ蛋白表达。
1.4.3 DnaJ蛋白的表达及纯化 将PET-30a-DnaJ质粒转化至DE3感受态细胞中,37 ℃、220 r/min振摇至菌体OD600值为0.6~0.8,向细菌培养物中加入诱导剂IPTG(1 mmol/L),在37 ℃、220 r/min条件下培养2、4 h和6 h以诱导DnaJ蛋白的表达,用20 μL的PBS重悬菌体并加入20 μL的5×Loading Buffer,利用12%的SDS-PAGE凝胶电泳检测,凝胶经染色和脱色后检测DnaJ蛋白的表达情况。将培养好的菌液12 000 r/min离心6 min,加入裂解液Liysis 4 ℃裂解10 h,在液氮和37 ℃水浴锅中反复冻融3次后,对菌体进行超声破碎,12 000 r/min离心25 min后收集沉淀,加入8 mol/L尿素,用0.45 μm滤膜过滤,用AKTAxpress智能多维纯化系统对DnaJ蛋白纯化,收集洗脱液,SDS-PAGE电泳检测DnaJ蛋白的纯化效果。
1.4.4 小鼠巨噬细胞RAW 264.7中的IFN-γ和IL-4检测 用含10%胎牛血清的培养基在37 ℃、5%CO2条件下培养RAW264.7细胞至对数生长期,试验组每孔加入25 mg的DnaJ蛋白,对照组添加PBS,在4、12 h和24 h收集细胞上清液,用ELISA试剂盒测定IFN-γ和IL-4的水平,操作方法见试剂盒说明书。
1.4.5 小鼠脾细胞中的IFN-γ和IL-4检测 选取6周龄的BALB/c小鼠,将正常小鼠断颈椎处死(每组5只),无菌取出脾脏,通过匀浆法获得单细胞悬液,利用ACK红细胞裂解液除去红细胞。脾细胞在96孔微量滴定板中以4×105个细胞/孔进行培养;试验组每孔加入25 mg的DnaJ蛋白,对照组添加PBS。在37 ℃、5%CO2条件下与细胞共同孵育12 h和24 h,收集细胞上清液,用ELISA试剂盒检测脾细胞分泌的IFN-γ和IL-4水平,操作步骤见试剂盒使用说明书。
1.4.6 小鼠免疫及体液免疫水平检测 将6周龄的BALB/c小鼠随机分为试验组和对照组,20只/组。试验组小鼠腹腔注射DnaJ蛋白(50 μg/只),对照组小鼠注射PBS(200 μL/只),共免疫2次,免疫间隔21 d,首次免疫后的第7、21天和第35天对小鼠断尾采血分离血清,用ELISA试剂盒测定血清中IgG1和IgG2a水平,操作步骤见试剂盒使用说明书。
1.4.7 DnaJ蛋白免疫小鼠后诱导IFN-γ和IL-4水平分析 取1.4.6中免疫35 d的小鼠,将小鼠断颈椎处死(每组5只),无菌取出脾脏,通过匀浆法获得单细胞悬液,利用ACK红细胞裂解液除去红细胞。脾细胞在96孔微量滴定板中以4×105个/孔进行培养;每孔加入25 mg的DnaJ蛋白或热灭活的布鲁氏菌16M裂解液,阳性对照组添加0.5 mg的ConA,阴性对照组添加RPMI 1640细胞培养基,在37 ℃、5%CO2条件下与细胞共同孵育72 h,收集细胞上清液,用ELISA试剂盒测定细胞中IFN-γ和IL-4的水平,操作方法见试剂盒说明书。

2 结果
2.1 DnaJ重组蛋白的生物信息学分析 Predicting Antigenic Peptides预测DnaJ蛋白有11个抗原决定簇,分别在第4~12、21~30、46~53、71~78、149~172、178~188、209~217、227~245、254~262、265~271、285~293位氨基酸处(表1)。SOPMA预测DnaJ蛋白中有68个氨基酸参与形成α-螺旋,占总氨基酸的比例为21.73%;54个氨基酸参与延伸链的形成,占总氨基酸的比例为17.25%;21个氨基酸参与β-折叠的形成,占总氨基酸的比例为6.71%;170个氨基酸参与无规卷曲结构的形成,占总氨基酸的比例为54.31%(图1)。
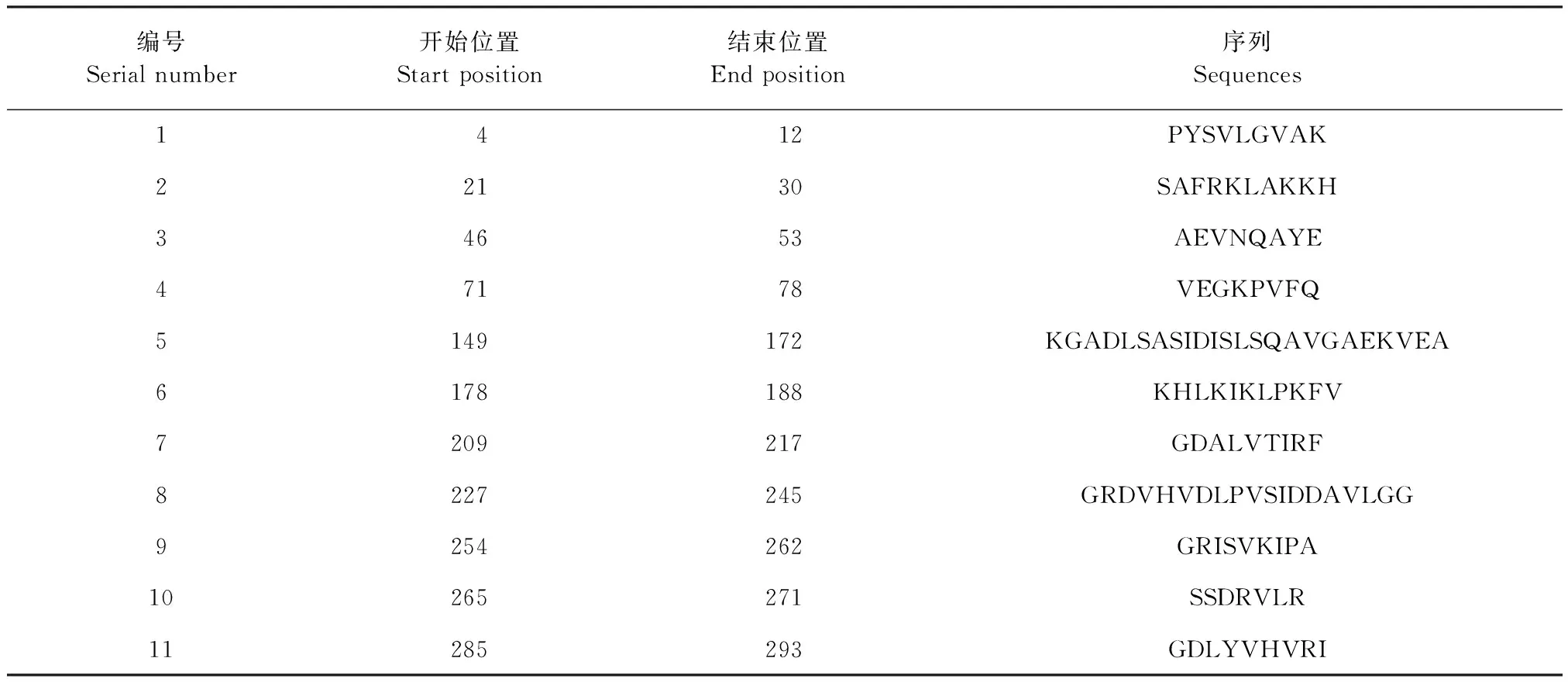
表1 DnaJ蛋白抗原决定簇的预测Table 1 Prediction of antigen clusters in DnaJ protein

图1 DnaJ蛋白二级结构的预测Fig.1 Prediction of secondary structure in DnaJ protein
2.2 重组表达质粒pET-30a-DnaJ的构建及鉴定 对重组载体pET-30a-DnaJ进行NdeI/Hind III双酶切,得到942 bp的条带,与理论值相符(图2),同时测序结果与GenBank中一致,表明重组质粒pET-30a-DnaJ构建成功。
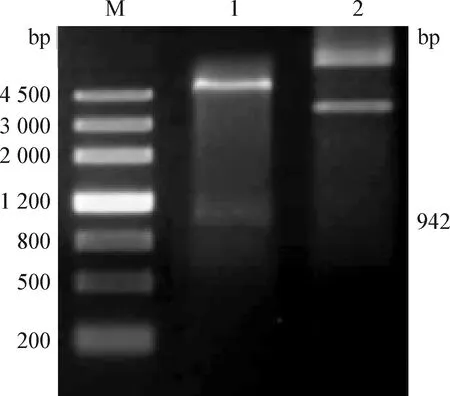
图2 重组质粒pET-30a-DnaJ的构建及鉴定Fig. 2 Construction and verification of recombinant plasmid pET-30a-DnaJM:DNA marker 4 500; 1:pET-30a-DnaJ的酶切产物; 2:pET-30a-DnaJ质粒M:DNA marker 4 500; 1:pET-30a-DnaJ digestion product;2:pET-30a-DnaJ plasmid
2.3 DnaJ蛋白的表达及纯化 表达结果显示,得到与预期蛋白质分子质量大小一致的37.7 kDa DnaJ蛋白(图3A)。纯化结果显示,DnaJ蛋白的纯化效果较好(图3B)。

图3 融合蛋白DnaJ的表达鉴定(A)及纯化(B)Fig. 3 Expression,identification (A) and purification (B) of fusion protein DnaJM:蛋白分子marker; 1:IPTG诱导2 h的pET-30a-DnaJ; 2:IPTG诱导4 h的pET-30a-DnaJ; 3:IPTG诱导6 h的pET-30a-DnaJ; 4:DE3; 5:未纯化蛋白; 6:纯化蛋白M:Protein molecule marker; 1:Induced pET-30a-DnaJ for 2 h by IPTG; 2:Induced pET-30a-DnaJ for 4 h by IPTG; 3:Induced pET-30a-DnaJ for 6 h by IPTG; 4:DE3; 5:Unpurified protein; 6:Purified protein
2.4 DnaJ蛋白诱导RAW 264.7细胞产生IFN-γ和IL-4 结果如图4所示,在4 h时,DnaJ蛋白刺激RAW 264.7细胞中的IFN-γ水平显著高于PBS对照组(P<0.05),而IL-4水平无明显变化(P>0.05);在12 h和24 h时,DnaJ蛋白刺激RAW 264.7细胞中的IFN-γ和IL-4水平均极显著高于PBS对照组(P<0.01)。结果表明,DnaJ蛋白可诱导RAW 264.7细胞产生IFN-γ和IL-4。
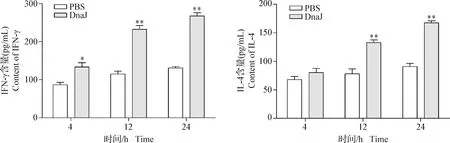
图4 DnaJ融合蛋白诱导RAW 264.7细胞产生的IFN-γ和IL-4水平变化Fig.4 The levels of IFN-γ and IL-4 cytokine production in RAW 264.7 cells after induction with DnaJ fusion protein与PBS对照组相比,*:P<0.05,**:P<0.01; 下图同Compare to group PBS, *:P<0.05,**:P<0.01. The same as below
2.5 DnaJ蛋白诱导小鼠脾细胞产生IFN-γ和IL-4 结果如图5所示,在12 h和24 h时,DnaJ蛋白刺激小鼠脾细胞产生的IFN-γ和IL-4水平均极显著高于对照组(P<0.01)。结果表明,DnaJ蛋白可诱导小鼠脾细胞产生Th1和Th2型免疫反应。

图5 DnaJ融合蛋白诱导小鼠脾细胞产生的IFN-γ和IL-4水平变化Fig.5 The levels of IFN-γ and IL-4 production in mouse splenocytes after induction with DnaJ fusion protein
2.6 DnaJ蛋白可诱导细胞免疫反应 结果如图6所示,免疫DnaJ蛋白的小鼠脾细胞产生的IFN-γ和IL-4水平均极显著高于免疫PBS的小鼠(P<0.01);ConA可诱导小鼠脾细胞产生高水平的IFN-γ和IL-4;而RPMI 1640和免疫PBS不能诱导小鼠脾细胞产生IFN-γ和IL-4。结果表明,DnaJ蛋白可诱导小鼠产生Th1和Th2型免疫反应。

图6 DnaJ融合蛋白诱导的细胞免疫反应变化Fig. 6 Changes in cellular immune response induction with DnaJ fusion protein
2.7 DnaJ蛋白可诱导体液免疫反应 结果如图7所示,在7 d时,免疫DnaJ蛋白的小鼠产生的IgG1和IgG2a与PBS对照组相比无明显变化(P>0.05);在21 d和35 d时,免疫DnaJ蛋白的小鼠产生的IgG1和IgG2a水平极显著高于PBS对照组(P<0.01)。结果表明,DnaJ蛋白免疫小鼠可诱导机体产生IgG1和IgG2a的体液免疫反应。
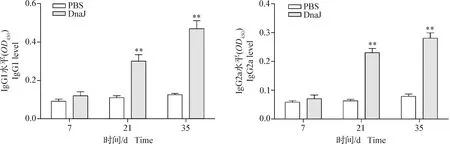
图7 DnaJ融合蛋白诱导的体液免疫反应变化Fig. 7 Changes in humoral immune response induction with DnaJ fusion protein
3 讨论
Th1型免疫反应的主要特性是产生IFN-γ,以抵抗布鲁氏菌的感染[7]。巨噬细胞在布鲁氏菌感染过程中可分泌大量IFN-γ以杀死胞内的细菌[8]。IL-4由Th2型细胞产生,可介导细胞免疫应答,诱导Th2细胞的生长和分化[9]。IgG1抗体的产生依赖于Th2型细胞因子IL-4的分泌,而IgG2a抗体的产生依赖于Th1型细胞因子IFN-γ的分泌[10]。本试验发现,DnaJ融合蛋白可刺激小鼠巨噬细胞、脾细胞及小鼠体内均产生高水平的IFN-γ和IL-4,且在小鼠体内诱导高水平的IgG1和IgG2a抗体,表明DnaJ蛋白可诱导小鼠体外细胞和体内产生Th1和Th2型免疫反应,且Th1和Th2型免疫反应进一步促进了IgG1和IgG2a抗体产生,增加了小鼠的体液免疫。
DnaJ是刺激DnaK的ATP酶和蛋白折叠活性的辅助分子伴侣[11]。DnaJ作为毒力因子参与一些细菌的致病过程,影响细菌感染宿主细胞[12-13]。黏膜免疫的DnaJ蛋白可诱导细胞产生抗体、IL-10、IFN-γ和IL-17A,通过腹膜内接种DnaJ后诱导小鼠IgG滴度和淋巴细胞增殖;黏膜免疫接种DnaJ蛋白能够降低鼻或肺定植的肺炎球菌,并抵御不同种血清型肺炎球菌的感染,腹腔内接种DnaJ蛋白也能够抵御不同种血清型肺炎球菌的感染,DnaJ是肺炎球菌具潜力的候选蛋白疫苗[14]。本试验发现,布鲁氏菌DnaJ蛋白可诱导较好的细胞和体液免疫,因此,该蛋白可作为候选的亚单位疫苗。
热休克蛋白的诱导合成对于致病菌在宿主体内存活至关重要[15]。肺炎链球菌DnaJ蛋白具有良好的免疫原性,且与其感染致病力相关[16]。研究表明,DnaJ在迟缓爱德华氏菌的致病中发挥重要作用,且具有免疫保护作用,因此DnaJ可用于控制水产养殖中的迟缓爱德华氏菌感染[17]。布鲁氏菌的应激反应蛋白毒力因子包括Hfq、DnaK、DnaJ、HtrA和Lon。研究表明,Hfq在布鲁氏菌致病中可调控大量靶标基因的表达水平,影响布鲁氏菌在宿主体内的慢性持续性感染[18-19]。然而,目前只初步证明Lon、htrA、DnaJ和DnaK影响布鲁氏菌的毒力[20-23],它们在布鲁氏菌致病中的作用机制尚不清楚。本课题组前期已经获得了可作为候选疫苗株的布鲁氏菌Hfq和DnaK基因缺失株,因此后期也将进一步构建DnaJ基因缺失株,获得DnaJ基因调控布鲁氏菌的毒力机制。
——一道江苏高考题的奥秘解读和拓展

