皮蛋模拟胃肠道消化物对HepG2细胞的影响
潘佳静, 梁焱惠, 张 敏, 刘小洁, 赵世林, 黄双佳, 靳国锋,*
(1.北京工商大学 食品与健康学院/北京食品营养与人类健康高精尖创新中心, 北京 100048;2.华中农业大学 食品科学技术学院, 湖北 武汉 430070)
细胞周期是细胞从一次分裂结束开始生长到下一次分裂结束的过程,它分为DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)以及分裂期(M期)[1]。细胞的增殖、生长和衰老离不开细胞周期的调控,当细胞周期相关的调控因子异常表达时,细胞周期会发生紊乱,细胞增殖失控,从而引起癌症的发生[2]。肝细胞癌是全球第六大最常见的癌症,也是癌症导致死亡的第三大主要原因[3]。肝癌的发生和发展过程是复杂的,肝脏持续的炎症损伤,会导致肝细胞坏死、再生和纤维化沉积[4]。有研究表明,阻滞癌症细胞周期,可以诱导细胞凋亡,抑制癌细胞的生长[5],故把细胞周期阻滞作为抗癌药物的主要作用方式是目前的研究热点之一。有研究者发现植物中的多糖、生物碱、黄酮和多肽以及动物中一些活性蛋白质和多肽等天然产物具有抗肿瘤的活性。如Li等[6]研究发现花椒提取物可以诱导人肝癌细胞在G2/M期和S期阻滞,使肝癌细胞增殖受到抑制。阮之平等[7]研究发现蟾蜍活性多肽能够影响周期调控因子的表达使结肠癌细胞阻滞于G2/M期来抑制癌细胞的增殖。
皮蛋又称变蛋、松花蛋、卞蛋,是中国特色传统食品之一。它是以鲜蛋为原料,经用氢氧化钠(烧碱)、食盐、茶叶(添加或不添加)、水等辅料和食品添加剂(含食品加工助剂硫酸铜等)配成的料液或料泥腌制、包装等工艺制成的蛋制品。传统的皮蛋制作工艺原料中含有氧化铅,对人体有一定的毒性作用,但是早在2015年,国家就规定皮蛋一律采用无铅工艺,在皮蛋生产过程中不可添加含铅的物质。
古时已有医书记载,皮蛋具有一定的食疗功效,《医林篆要》记载皮蛋可“泻肺热、醒酒、去肠火、治泻痢,能散、能敛。”,坊间也有用其治疗咽喉痛、声音嘶哑和便秘的传闻。目前对皮蛋功能性的研究大多集中在其清热和抗炎方面,对其作用机制已有整体上的了解。王淑珍[8]用碱性蛋白酶和中性蛋白酶复合酶酶解皮蛋制备多肽,利用皮蛋多肽处理诱发炎症的Caco- 2细胞,发现皮蛋多肽能降低细胞中的炎症因子,达到抗炎的目的。Zhao等[9]通过动物实验研究发现皮蛋清模拟胃肠道消化物可以抑制IL- 8的分泌,降低TNF- α、IL- 6、IL- 1β、IFN- γ和IL- 17的表达,上调IL- 10等抗炎细胞因子的表达来治疗肠道炎症。有研究进一步探究了皮蛋蛋白源性多肽抗肠炎的作用途径,发现皮蛋蛋白源性多肽通过MAPK信号途径发挥其抗炎的作用,研究认为,皮蛋清模拟胃肠道消化物中提取的DR- 10、DF- 9、ML- 7和MF- 7可以作为具有抗炎特性的化合物添加到保健食品中[10-11]。皮蛋胃肠道消化物已被证实可促进人结直肠腺癌细胞Caco- 2细胞的凋亡[12]。
考虑到持续的炎症反应是肝癌的重要危险因素之一,由此推测,皮蛋的胃肠道消化物可能通过调控细胞周期来抑制细胞增殖,从而对人肝癌HepG2细胞有一定的抑制作用。但目前对于皮蛋的研究主要集中在加工方式、质量安全及抗炎方面,而皮蛋发挥抗癌抗肿瘤功效的途径与作用机制尚不清晰。本研究拟使用PESD处理人肝癌HepG2细胞,采用CCK- 8法研究HepG2细胞增殖情况,分析细胞存活率的变化,通过流式细胞术研究PI染色后的HepG2细胞周期进程,同时用western blot法检测HepG2细胞周期调控蛋白的表达,探究皮蛋模拟胃肠道消化物抑制人肝癌HepG2细胞活性的途径及作用机制,旨在为皮蛋等传统食品在抗癌抗肿瘤方面的合理应用提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
皮蛋(来源于鸭蛋),湖北神丹健康食品有限公司;人肝癌细胞(HepG2),中国科学院上海细胞库。
胃蛋白酶(3 000 U/mg)和胰蛋白酶(250 U/mg),上海源叶生物有限公司;氯化氢、碳酸氢钠、聚乙二醇辛基苯基醚(triton X- 100)、碘化丙啶(propidium iodide, PI)、无水乙醇(分析纯),国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒、细胞裂解液(RIPA)、核糖核酸酶A(RNase A)、TBST缓冲液(pH=7.6),上海碧云天生物技术有限公司;CCK- 8试剂盒,北京庄盟国际生物基因科技有限公司;α-MEM培养基、磷酸盐缓冲液(phosphate buffered saline,PBS),美国HYCLONE公司;胎牛血清(fetal bovine serum,FBS)、二甲基亚砜(dimethyl sulfoxide,DMSO)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、双抗(10 000 U/mL青霉素和10 mg/mL链霉素),北京赛默飞世尔生物化学制品有限公司;兔源细胞周期蛋白A(cyclin A)、兔源细胞周期蛋白E(cyclin E)、兔源细胞周期依赖性激酶2(cyclin-dependent kinases 2, CDK2)、兔源毛细血管扩张性共济失调突变因子重组蛋白(ATM)、兔源细胞周期检查点激酶2(checkpoint kinase 2, chk2)、兔源细胞分裂周期蛋白25A(cell division cyclin 25A, CDC25A)、鼠源β-actin抗体,美国Abcam公司;辣根过氧化物酶(horseradish peroxidase, HPR)标记山羊抗兔二抗、HRP标记山羊抗鼠二抗,美国Cell Signaling Technology公司。
胰蛋白酶- EDTA溶液:将胰蛋白酶与EDTA溶于PBS溶液中,使胰蛋白酶和EDTA最终质量浓度分别为2.5 g/L及0.2 g/L,4 ℃过夜后调节pH值至7.4,过滤除菌并于-20 ℃下保存;PI染液:将PI溶于含trition X- 100的PBS溶液(其中trition与PBS溶液的体积比为1∶1 000)中,使其终质量浓度为50 μg/mL,再加入RNase使其质量浓度达到100 μg/mL,避光保存。
1.2 仪器与设备
Alpha1- 4LSC型真空冷冻干燥机,德国Christ公司;85- 2型磁力搅拌器,常州国华电器有限公司;R301型恒温水浴锅,巩义市英峪高科仪器厂;DYY- 12型电泳仪,北京六一仪器厂;DYCZ- 24DN型垂直电泳槽,北京六一仪器厂;IX71型荧光倒置显微镜,日本Olympus公司;DL- CJ- 2ND型超净工作台,哈尔滨东联电子技术有限公司;HERAcell 1501型二氧化碳培养箱,美国Thermo Scientific公司;FACSCalibur型流式细胞仪,美国BD公司;DYCA- 40型电转仪,北京六一仪器厂;TS- 1型水平摇床,江苏海门其林贝尔仪器制造有限公司;MμLtiskan MK3型酶标仪,美国Thermo公司;Sigma3- 30N型冷冻离心机,美国Sigma公司;XHF- DY型高速分散器,中国宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1皮蛋模拟胃肠道消化物的制备
皮蛋模拟胃肠道消化物(preserved eggs simulated gastrointestinal digests,PESD)的制备方法如下。将皮蛋剥壳,用高速分散器将其打碎并置于真空冷冻干燥机中冻干(-40 ℃,50 h,1.0 Pa)。取10 g冻干粉与100 mL蒸馏水于烧杯中混合均匀,常温下将烧杯置于磁力搅拌器上(200 r/min,30 min)搅拌。用0.1 mol/L的盐酸调节pH值至2.0后加入0.125 g的胃蛋白酶,于37 ℃下水浴振荡2 h完成模拟胃消化过程。将盛有溶液的烧杯置于磁力搅拌器上搅拌,用1 mol/L的碳酸氢钠溶液调节pH值至7.0后加入0.2 g的胰蛋白酶,37 ℃水浴振荡2 h,模拟肠道消化的过程。将溶液放到沸水中灭酶15 min,冷却后在4 ℃、5 000 r/min下离心10 min,取上清液冻干,于-80 ℃冰箱储存。
1.3.2HepG2细胞的培养
将80 mL的α-MEM培养基,1 mL的双抗和10 mL的FBS混合均匀,经1 mol/L的碳酸氢钠溶液调节pH值至7.4后,加入α-MEM培养基定容至100 mL,用0.45 μm膜过滤。将HepG2细胞接种于配置好的α-MEM细胞培养液中,然后将其置于培养箱(温度37 ℃、相对湿度95% 、CO2体积分数5%)中进行培养。
在荧光倒置显微镜下观察HepG2细胞分布达到80%时,将细胞进行传代。除去旧培养液,用PBS(pH=7.4)洗涤细胞两次,加入1 mL配置好的胰蛋白酶- EDTA溶液(预先于37 ℃下水浴30 min),混合均匀后放入培养箱(37 ℃)内消化3 min。在荧光倒置显微镜下观察细胞飘起后加入2 mL的α-MEM细胞培养液终止消化,将细胞转移至离心管内,1 000 r/min离心3 min,弃上清液,加入3 mL的α-MEM细胞培养液使细胞重悬。分装细胞并添加3 mL左右α-MEM细胞培养液,放入培养箱内。
1.3.3HepG2细胞存活率的测定
用CCK- 8法进行HepG2细胞增殖分析,测定HepG2细胞存活率。取生长状态良好的HepG2细胞,胰蛋白酶- EDTA溶液消化细胞并用α-MEM细胞培养液终止消化,收集细胞,在1 000 r/min下离心3 min,弃上清液,使细胞重悬。用α-MEM细胞培养液将细胞悬液浓度调至1×104个/mL后,接种于96孔板中,每孔100 μL,培养24 h。用移液枪吸去旧α-MEM细胞培养液,设置空白组(α-MEM细胞培养液)和PESD实验组(含0、1、2、3、4、5 mg/mL PESD的α-MEM细胞培养液),其中含0 mg/mL PESD的组别为对照组(经体外模拟胃肠道消化,含α-MEM细胞培养液和细胞,不含PESD),每组设置3个平行,每孔加入100 μL溶液,培养24 h。将细胞从培养箱中取出,用PBS(pH=7.4)洗涤两次后加入含有CCK- 8的α-MEM细胞培养液[V(α-MEM培养液)∶V(CCK- 8试剂)=9∶1],每孔100 μL,培养2 h后用酶标仪在450 nm处测定吸光值。根据下列公式计算HepG2细胞的存活率。
细胞存活率=(AS-Ab)/(Ac-Ab)×100%
(1)
式(1)中:As为试验孔吸光度(含细胞、培养基、CCK- 8溶液和PESD溶液);Ac为对照孔吸光度(含细胞、培养基、CCK- 8溶液,不含PESD);Ab为空白吸光度(含培养基、CCK- 8溶液,不含细胞、PESD)。
1.3.4HepG2细胞周期进程的测定
采用PI染色标记并通过流式细胞术测定HepG2细胞周期进程。取生长状态良好的HepG2细胞,胰蛋白酶- EDTA溶液消化细胞并用α-MEM细胞培养液终止消化,收集细胞,在1 000 r/min下离心3 min,弃上清液,使细胞重悬。用α-MEM细胞培养液将细胞悬液浓度调至5×105个/mL后,接种于6孔板中,每孔加入2 mL细胞悬液,培养24 h。用PBS(pH=7.4)洗涤细胞两次,每孔加2 mL不同浓度(0、1、2、4 mg/mL)的PESD培养基,培养24 h后用移液枪吸去旧培养基,每孔加入1 mL胰蛋白酶- EDTA溶液消化细胞,移至离心管中于1 000 r/min下离心5 min,用预冷的PBS(pH=7.4)洗涤沉淀两次,加入同体积预冷的70%乙醇于-20 ℃固定。在1 500 r/min下离心5 min收集底部细胞,用1 mL的PBS(pH=7.4)洗涤细胞,加入500 μL的PI染液,于4 ℃避光30 min。用流式细胞仪检测,使用FL2- w和FL2- A通道显示,结果用细胞周期拟和软件ModFit分析。
1.3.5HepG2细胞周期调控蛋白表达量的测定
采用western bolt法检测HepG2细胞周期调控蛋白的表达量。在荧光倒置显微镜下观察HepG2细胞生长到80%时,用胰蛋白酶- EDTA溶液消化细胞后加入α-MEM细胞培养液终止消化,收集细胞,在1 000 r/min下离心3 min,弃上清,使细胞重悬。用α-MEM细胞培养液将细胞悬液浓度调至5×105个/mL后,接种于6孔板中,每孔加入2 mL细胞悬液,培养24 h。按照设置的组别加入PESD(4 mg/mL),对照组(0 mg/mL的PESD)加入等体积的培养液,培养24 h后,加入含蛋白酶抑制剂以及磷酸酶抑制剂的细胞裂解液提取细胞蛋白,利用BCA试剂盒测定蛋白浓度。
吸取40 μg的蛋白进行电泳分离,将蛋白转移到PVDF膜上,于含质量分数为5%脱脂奶粉的封闭液(TBST)中封闭2 h,稀释后的一抗4 ℃封闭过夜,HPR标记的二抗(以1∶5 000的体积比稀释于pH=7.4的PBS中)37 ℃下孵育2 h,TBST洗涤PVDF膜5次。以1∶1的比例混合ECL试剂中增强液与稳定的过氧化物酶溶液,滴加至PVDF膜上,待荧光带明显后用滤纸吸去多余的液体,覆上保鲜膜,X光胶片压片后依次显影、定影,冲洗胶片。晾干胶片,扫描胶片,用Image-pro plus软件分析胶片灰度值。
一抗为相应的蛋白抗体:cyclin A(以1∶2 000的体积比稀释于pH=7.4的PBS中,下同)、cyclin E(1∶2 000)、CDK2(1∶2 000)、ATM(1∶2 000)、chk2(1∶2 000)、CDC25A(1∶2 000)和β-actin(1∶5 000)抗体;二抗为HPR标记的山羊抗兔二抗和HPR标记山羊抗鼠二抗;以β-actin为内参,用样品与β-actin的灰度值之比来表示蛋白相对表达量。
1.4 数据分析
每组实验重复3次,所有实验数据都用“平均值±标准偏差”来表示。使用邓肯多重范围检验来比较平均值之间的差异;通过SPSS软件进行统计学分析;采用Image-pro plus对相应蛋白表达水平进行定量分析;采用Origin8.5软件绘制实验柱状图。
2 结果与分析
2.1 PESD对HepG2细胞存活率的抑制作用
不同浓度的PESD处理HepG2细胞24 h后,用CCK- 8法进行癌细胞增殖分析,其对HepG2细胞增殖的抑制作用见图1。在相同的处理时间下,相比于未加入PESD的对照组而言,PESD处理对细胞增殖有明显的抑制作用。且不同浓度的PESD对HepG2细胞存活率的影响明显不同,随着PESD浓度增加,HepG2细胞的存活率显著降低(P<0.05),呈剂量依赖关系。1 mg/mL的PESD处理后的癌细胞存活率相比于0 mg/mL的对照实验组降低了8.91%(P<0.05)。当PESD浓度增加至2 mg/mL时,HepG2细胞存活率显著降低(P<0.05),即癌细胞的生长增殖被明显抑制。当PESD浓度为4 mg/mL时,细胞的存活率接近50%。通过回归拟合分析得到PESD处理HepG2细胞24 h后IC50值为4.17 mg/mL。实验结果表明,PESD对HepG2细胞的生长增殖有显著抑制作用,且呈剂量依赖性的方式。
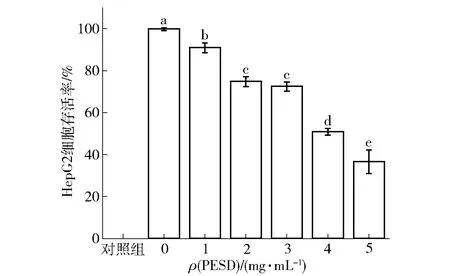
不同字母表示实验组与对照组研究结果之间的差异在P<0.05的检验水平上具有统计学意义。图1 PESD对HepG2细胞存活率的影响Fig.1 Effect of PESD on survival rate of HepG2 cells
2.2 PESD对HepG2细胞周期进程的抑制作用
细胞增殖的过程中通常有细胞周期的调控参与。当细胞周期运行受到影响或干扰时,就会在相关因子的调控下暂停或终止,进行细胞修复或诱导细胞凋亡,以保证细胞周期的顺利运行[13]。为了研究PESD对细胞毒性作用机制是否与细胞周期调控有关,实验采用不同浓度的PESD处理了HepG2细胞后,用PI进行染色标记,通过流式细胞术测定细胞周期。
不同浓度的PESD处理HepG2细胞后,细胞周期占比的变化情况见图2和图3。随着PESD浓度的增加,G0/G1期和G2/M期的HepG2细胞占比随之减少,S期的细胞占比则显著增加(P<0.05)。4 mg/mL的PESD处理细胞后,与对照组相比,G0/G1期和G2/M期细胞百分比分别降低了19.43%和96.43%(P<0.05),相反,S期细胞占比则从30.4%增加至52.33%(P<0.05)。由此可知,PESD诱导HepG2细胞阻滞于S期。S期是细胞完成DNA复制以及染色质结构组装的时期,可以影响细胞的增殖[14]。Ahmed等[15]的研究中,芥末籽的乙醇提取物诱导肺腺癌细胞周期阻滞于S期和G2/M期。Li等[16]研究发现虫草素可以使胰腺癌细胞阻滞于S期。因此推测,PESD可通过诱导HepG2细胞于S期阻滞从而抑制肝癌细胞的增殖。
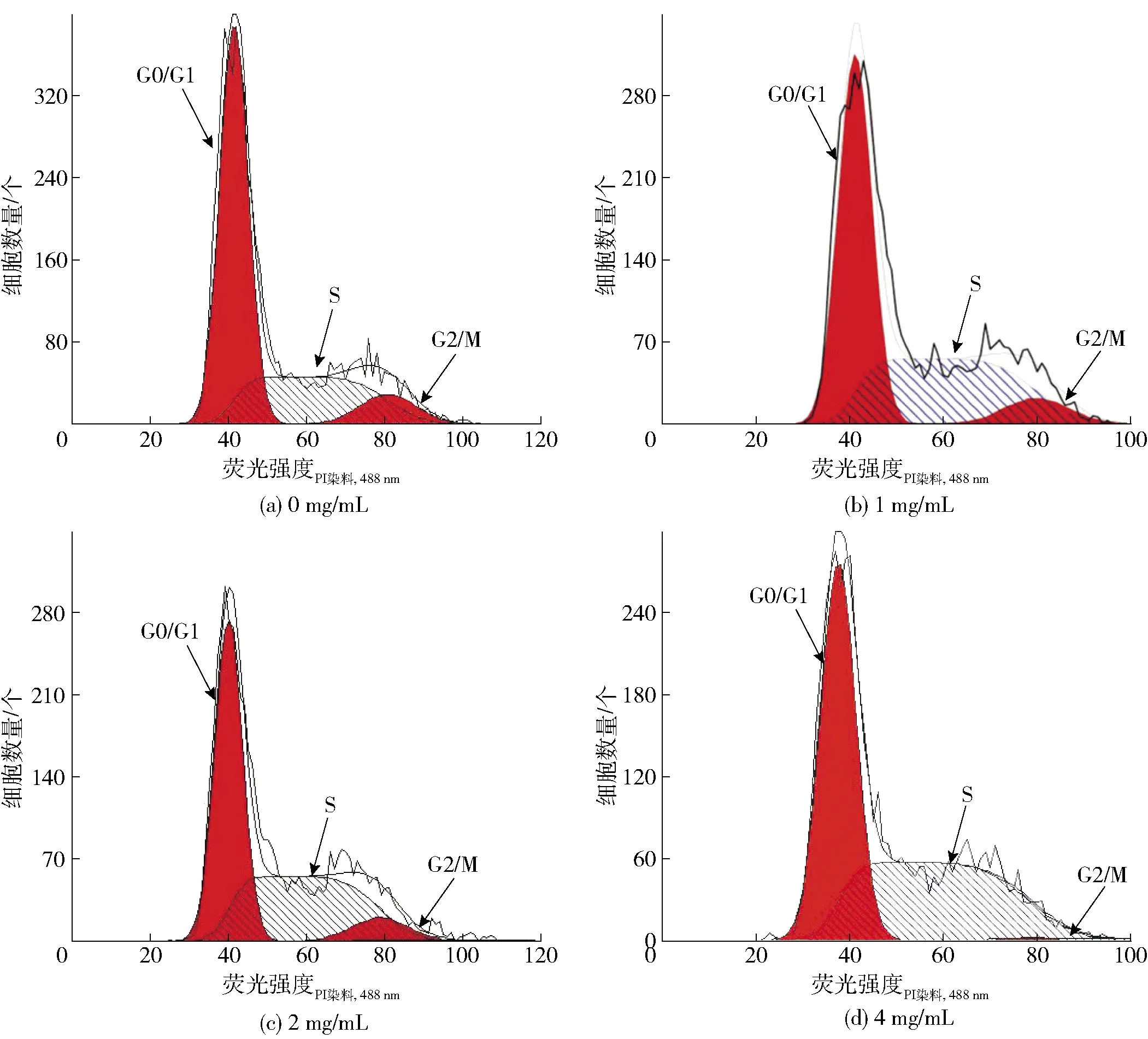
图2 PESD处理后HepG2细胞的流式细胞周期变化Fig.2 Changes of HepG2 cells cycle of flow cytometry assay after PESD treatment
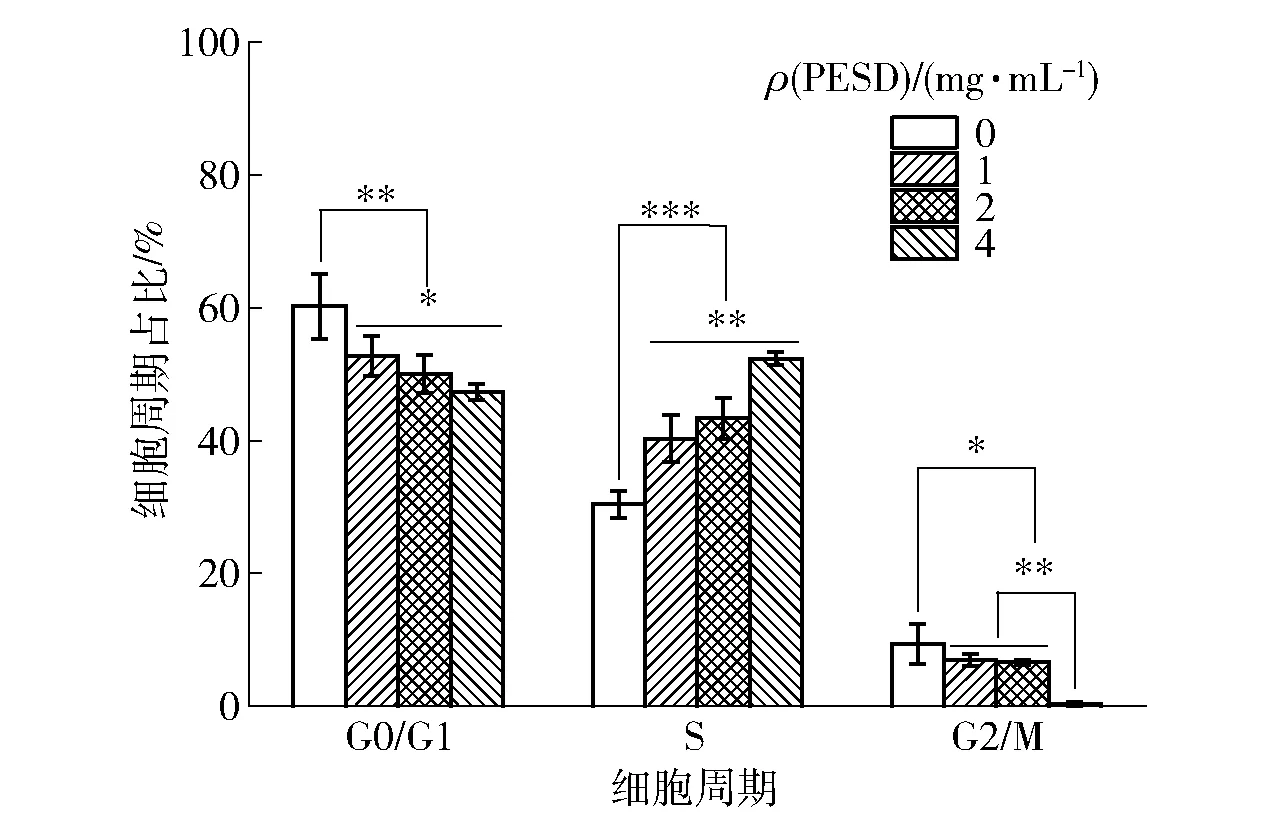
*、**和***分别表示实验组与对照组研究结果之间的差异在P<0.05、P<0.01和P<0.001的检验水平上具有统计学意义。图3 PESD对HepG2细胞周期占比的影响Fig.3 Effect of PESD on cycle percentage of HepG2 cells
2.3 PESD对HepG2细胞周期调控蛋白表达量的影响
2.3.1对cyclin A、cyclin E和CDK2的影响
细胞周期受周期调控蛋白的影响,哺乳动物的细胞周期蛋白有九大类,分别是cyclin A~H以及T。细胞周期蛋白会随着细胞周期进程合成和降解,在相应的时间达到活性峰值,特异性地与相应的细胞周期依赖性激酶(cyclin-dependent kinases, CDK)结合,形成复合物,介导CDK激活参与细胞周期调控[17]。cyclin A是启动DNA复制所必需的,cyclin A- CDK2是细胞周期S期的最主要的复合物,主要参与S期DNA的复制,阻止已复制的DNA再次被复制,即保证S期的DNA只复制一次[18]。Cyclin E- CDK2复合物是调节细胞从G0/G1期转变到S期的关键激酶复合物,能促使细胞跨过G1/S期限制点,调节DNA相关复制基因的表达,从而合成与DNA复制相关的酶和蛋白质[17,19]。为探究PESD诱导的S期阻滞的机制,本实验研究了与S期阻滞相关的调控因子cyclin A、cyclin E和CDK2的表达。前期实验已得出PESD处理HepG2细胞24 h后的IC50值为4.17 mg/mL,故将实验分成两组,用0和4 mg/mL的PESD处理HepG2细胞,用western blot法测定了细胞中控制细胞周期的相关因子cyclin A、cyclin E和CDK2的蛋白表达,实验结果见图4。与对照组相比,实验组细胞中cyclin A与cyclin E蛋白表达显著上升(P<0.05),而CDK2蛋白表达显著下降(P<0.05)。Xie等[20]实验中发现,冬虫夏草乙醇提取物通过上调cyclin A 与cyclin E蛋白表达,下调CDK2蛋白表达来诱导肿瘤细胞在S期阻滞。Nani等[21]研究中也是通过cyclin E的上调和CDK2的下调来达到细胞周期于S期阻滞的目的。由此可推测,PESD通过上调cyclin A 与cyclin E蛋白的表达,下调CDK2蛋白的表达来诱导HepG2细胞的S期阻滞。
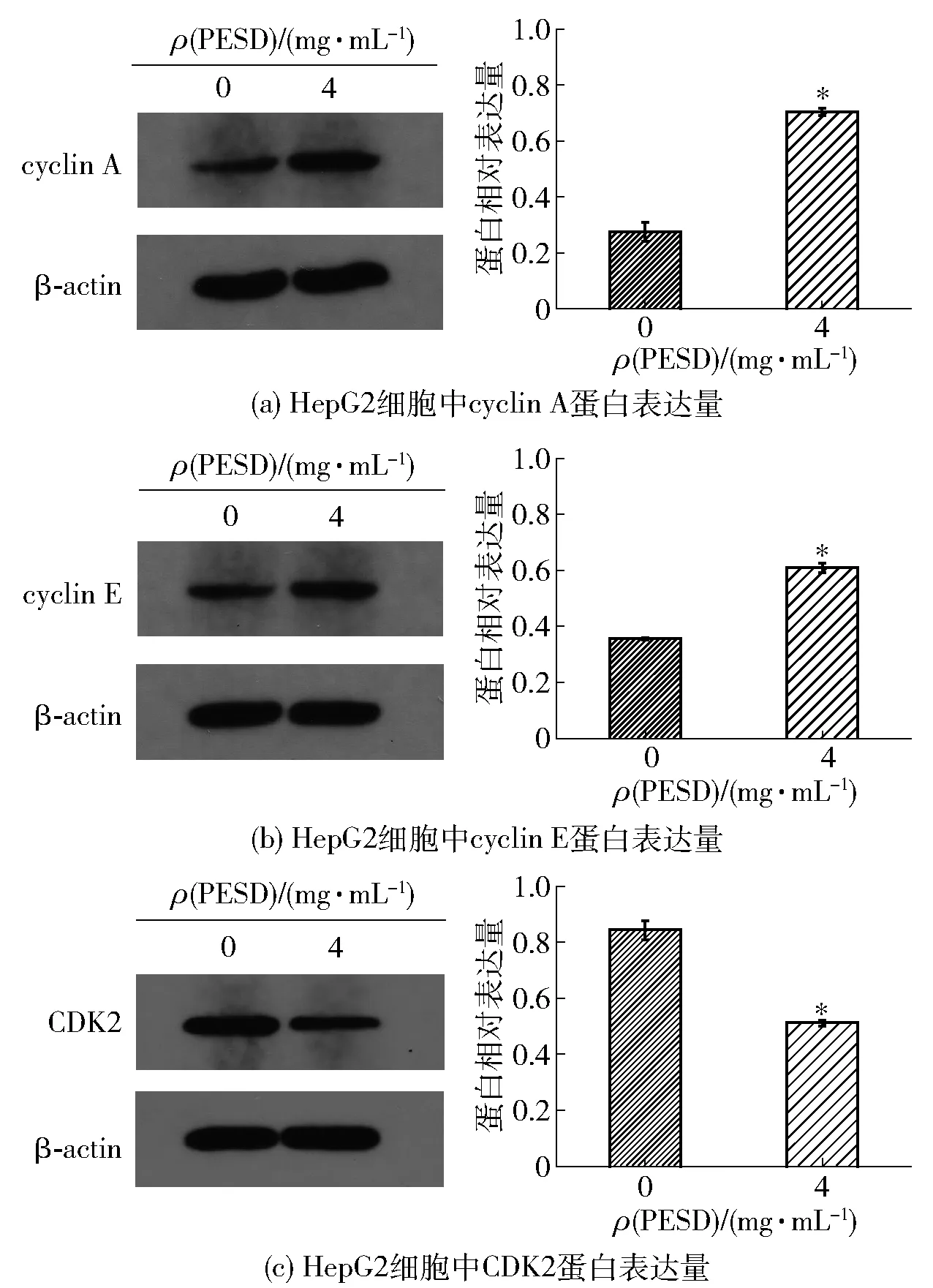
*表示实验组与对照组研究结果之间的差异在P<0.05的检验水平上具有统计学意义。图4 PESD对HepG2细胞中cyclin A、cyclin E和CDK2 蛋白表达的影响Fig.4 Effect of PESD on expression of cyclin A, cyclin E and CDK2 proteins in HepG2 cells
2.3.2对ATM、chk2和CDC25A的影响
细胞周期阻滞还与细胞周期检查点的调控有关,G1/S检查点是重要的细胞周期检查点,确保DNA正常复制以及损伤修复。毛细血管扩张共济失调突变基因(ataxia telangiectasia mutated gene,ATM基因)编码产物- ATM蛋白激酶作为磷酸肌醇3激酶相关激酶家族的成员,涉及多个信号通路的传导,可以调控DNA损伤修复和凋亡,是细胞周期检查点的关键激酶[22]。细胞周期检查点激酶2(checkpoint kinase 2, chk2)是ATM蛋白激酶的下游关键检查点底物,可以通过调控相关蛋白表达使分裂中的细胞阻滞在G2/M或S期[23],而活化的ATM蛋白激酶又能使其磷酸化从而影响其激活与表达。细胞分裂周期蛋白25(cell division cyclin 25, CDC25)家族包含CDC25A、CDC25B及CDC25C这3种亚型,其中CDC25A是chk2的下游底物,可以激活CDK并与cyclin结合,形成复合物,从而促进细胞由G0/G1期向S期转化[24],故ATM、chk2和CDC25A之间的联系可以调控S期关卡。为进一步探究PESD使HepG2细胞在S期阻滞的机制,本研究采用western blot法来测定HepG2细胞经4 mg/mL 的PESD处理后,ATM、chk2和CDC25A在细胞中的表达,实验结果见图5。
由图5可知,与对照组相比,经过4 mg/mL的PESD处理后,ATM、chk2和CDC25A蛋白表达均显著上升(P<0.05)。Li等[25]的报道中补骨脂酚(bakuchiol)可以上调ATM、chk2等蛋白的表达,诱导癌细胞在S期阻滞。先前也有报道,低浓度的3-羟基三苯基林(3-hydroxyterphenyllin)可以通过增加人卵巢癌细胞中ATM、chk2和CDC25A的表达,来诱导人卵巢癌细胞S期周期阻滞[26]。Saiko等[27]研究发现一种白藜芦醇的类似物同样通过上调ATM、chk2和CDC25A蛋白的表达,激活ATM- chk2- CDC25A信号通路诱导癌细胞S期阻滞,抑制癌细胞的增殖。由此可推测,PESD可能通过ATM- chk2- CDC25A的途径影响细胞周期蛋白的表达,从而导致HepG2细胞在S期阻滞。
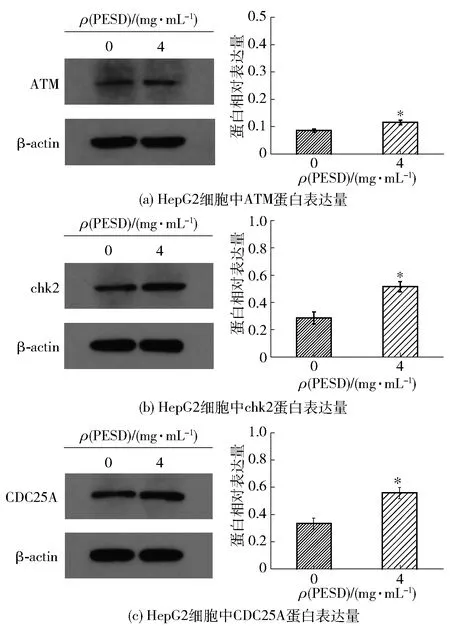
*表示实验组与对照组研究结果之间的差异在P<0.05的检验水平上具有统计学意义。图5 PESD对HepG2细胞中ATM、chk2和CDC25A蛋白 表达量的影响Fig.5 Effect of PESD on expression of ATM, chk2 and CDC25A proteins in HepG2 cells
3 结 论
本研究通过CCK- 8法测定PESD对人肝癌HepG2细胞增殖的抑制作用,在对细胞进行PI染色标记后,通过流式细胞术分析PESD对HepG2细胞周期的影响,又进一步采用western blot法测定了细胞周期的调控蛋白表达,从而探究了PESD通过影响细胞周期来抑制HepG2细胞生长的机制。
结果表明,PESD可以激活细胞周期G1/S检查点相关激酶,通过ATM- chk2- CDC25A信号通路作用,上调cyclin A和cyclin E的表达,下调CDK2的表达使得HepG2细胞阻滞于S期,影响细胞周期进程,且以剂量依赖性的方式来抑制人肝癌HepG2细胞的增殖,希望研究结果可为皮蛋作为抗癌功能性食品的开发提供理论基础。但皮蛋模拟胃肠道消化物发挥其抗癌功效是否与其他信号通路存在协同或拮抗作用,对其他癌症细胞活性是否有类似效果以及消化物中主要抗癌活性物质的种类仍需进一步研究。

