低温无水保活对虾夷扇贝肌肉质构和肝脏生化特性的影响
米红波, 张 婷,2, 姜 琦,2, 陈敬鑫,*, 仪淑敏, 李学鹏, 励建荣
(1.渤海大学 食品科学与工程学院/国家鱼糜及鱼糜制品加工技术研发分中心/生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
虾夷扇贝(Patinopectenyessoensis)主要分布于中国北部沿海,2019年全国贝类海洋捕捞产量41.2万t,其中辽宁作为捕捞产量第二大地区,贝类产量约占总产量的11.96%[1]。虾夷扇贝营养丰富,味道鲜美,是中国主要的海产经济贝类之一。随着生活水平的快速提高,人们更加注重食品的品质,为满足各地消费者对鲜活贝类的需求,同时达到运输成本低、无污染等要求,虾夷扇贝的低温无水保活运输技术迅速引起了广大科研工作者的关注。
低温无水保活技术是通过生态冰温使水产动物进入休眠状态,从而降低其新陈代谢速率。在低温无水条件下进行保活运输需考虑环境因素对贝类存活率、氧化应激、新陈代谢及品质产生的影响。0 ℃条件下充氧包装海湾扇贝可显著延长其保活时间,有效保持海湾扇贝保活后的品质[2]。田元勇等[3]研究表明,捕后暂养可延迟虾夷扇贝死后硬化发生时间。低温(0 ℃± 2 ℃)环境下,以碎冰为介质无水保活虾夷扇贝7 d,存活率仍可达73.20%;与以空气为介质相比,扇贝乳酸积累量较少,糖原消耗低,且主要呈味氨基酸保留度高,感官品质稳定[4]。目前,虽然有关贝类无水保活运输的研究较多,但主要集中在保活参数的优化方面,系统分析虾夷扇贝无水保活过程中和复水后生理生化指标和品质变化的研究较少。肌肉是扇贝的主要食用部分,通过肌肉质构特性的变化可判断不同保活时间下虾夷扇贝的品质状态。与鳃部组织相比,肝脏更容易采集,且肝脏中有许多与生命体征相关的活性较高的酶,通过分析这些酶的活性以揭示扇贝氧化应激、新陈代谢的变化情况,可为虾夷扇贝的无水保活运输提供理论基础。本研究以虾夷扇贝为对象,分析暂养时间、湿度、氧气和温度4个主要环境因素对其存活率的影响,确定优化无水保活条件,探究虾夷扇贝在无水保活和复水过程中肌肉的质构特性和肝脏的生化特性。
1 材料与方法
1.1 材料与试剂
虾夷扇贝,个体鲜活、大小均匀,壳长(45.0±5.2)mm,2020年9月分批购自辽宁省锦州市凌西大街农贸市场,将其放入加冰的泡沫箱内运输至实验室。海水晶购自辽宁省锦州市凌西大街农贸市场,海水晶与去离子水按料液比(kg/L)1∶31配制成人工海水。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、溶菌酶(LZM)、乳酸脱氢酶(LDH)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)和糖原(Glc)试剂盒均购自南京建成生物工程研究所。
1.2 仪器与设备
5804R型高速冷冻离心机,德国Eppendorf公司;GI54DS型高压灭菌锅,厦门至微仪器有限公司;GDN型光照培养箱,上海标卓科学仪器有限公司;TA.XT Express型质构仪,英国Stable Micro System公司;UV- 2100型紫外可见光分光光度计,日本Shimadzu公司;Forma70型-80 ℃超低温冰箱,美国TA公司;MS105DU型分析天平,深圳市力达信仪器有限公司;HH- 4型数显恒温水浴锅,常州智博瑞电器有限公司。
1.3 实验方法
1.3.1优化无水保活条件的测定
根据存活率确定优化暂养时间、保活温度,并确定保湿、充氧条件对存活率的影响。将虾夷扇贝以贝水质量比1∶2放入20 ℃人工海水中分别暂养不同时间(0、15、30、60 min),暂养后放入铺有或未铺有人工海水浸湿纱布的塑料筐中,并置于不同温度的恒温箱中(-1、0、2、4、6 ℃),每隔12 h测定存活率。为探究氧气对存活率的影响,将虾夷扇贝放入铺有人工海水浸湿纱布的聚乙烯材质自封袋(长32 cm,宽22 cm,12丝)底,并向袋中充入体积分数99.9%的氧气后密封;未充氧组处理方法同保湿组。
在优化实验条件下进行无水保活实验,分别测定保活前(0 h)、保活过程中(24、48、72、96 h)和复水后(4、8 h)虾夷扇贝肌肉的质构特性和肝脏的各项生理生化指标,每个时间点各取10枚扇贝。
复水过程:不同保活时间后,每组随机取出10枚虾夷扇贝,放入20 ℃的人工海水里进行复水。
1.3.2存活率的测定
将无水保活后的虾夷扇贝转移至20 ℃人工海水中,参照Zamora等[5]的方法对张壳的虾夷扇贝进行10次快速敲击,若闭合即为存活,若没有闭合即为死亡。存活率(S)计算见式(1)。
(1)
1.3.3样品的采集
虾夷扇贝在优化保活条件下进行无水保活后,用消毒后的手术刀迅速去壳取扇贝横纹肌和肝脏,肝脏和一部分扇贝肌肉放于-80 ℃冰箱分别保存,另一部分扇贝肌肉用于质构的测定。
1.3.4质构的测定
将扇贝肌肉切成1 cm×1 cm×1 cm的立方体,采用质构仪的TPA模式测定肌肉的硬度、弹性、黏聚性和咀嚼性。测定条件:选用P/50型号探头,形变量30%,触发力0.074 N,测试速度1 mm/s,每个时间点设定6个平行。
1.3.5酶活性及糖原质量比的测定
肌肉中LDH活性、Glc质量比及肝脏中SOD、CAT、LZM、GOT、GPT活性均按照试剂盒的方法进行测定,每个时间点设定3个平行实验。
1)LDH活性测定。LDH能催化乳酸生成丙酮酸,丙酮酸与2,4-二硝基苯反应生成丙酮酸二硝基苯腙,在碱性溶液中呈棕红色,通过比色可求出酶活性。
2)Glc质量比测定。Glc在浓硫酸的作用下可脱水生成糖醛衍生物,后者再与蒽酮作用形成蓝色化合物,与同法处理的葡萄糖标准溶液比色定量。
3)SOD活性测定。采用黄嘌呤氧化酶法(羟胺法)测定。
4)CAT活性测定。CAT分解过氧化氢的反应可通过加入钼酸铵迅速终止,剩余的过氧化氢与钼酸铵作用产生一种淡黄色的络合物,在405 nm处测定其生成量,可计算出CAT活性。
5)LZM活性测定。LZM能水解细菌细胞壁肽聚糖,使细菌裂解而浓度降低,透光度增强,故可以根据透光度变化来推测LZM的活性。
6)GOT活性测定。GOT能使α-酮戊二酸的酮基与天门冬氨酸的氨基相互转换,生成草酰乙酸和谷氨酸,草酰乙酸在反应过程中可自行脱羧成丙酮酸,丙酮酸与2,4-二硝基苯肼反应生成2,4-二硝基苯腙,在碱性溶液中显红棕色,比色后,查标准曲线可得酶活性。
7)GPT活性测定。在37 ℃及pH值7.4条件下,GPT作用于丙氨酸及α-酮戊二酸组成的底物,生成丙酮酸。反应30 min后加入2,4-二硝基苯肼盐酸溶液终止反应,同时2,4-二硝基苯肼与丙酮酸中羰基加成,生成丙酮酸苯腙。苯腙在碱性条件下呈红棕色,于505 nm处测吸光度并计算酶活性。
1.4 数据处理
利用SPSS 22.0软件进行实验数据分析,采用单因素方差分析和Duncann多重比较分析,P<0.05为差异显著。结果用平均值±标准差表示,采用Origin 8对数据进行统计和绘图。
2 结果与分析
2.1 暂养时间对无水保活过程中虾夷扇贝存活率的影响
暂养净化能够有效去除双壳贝类体内的微生物和致病菌,延长保活时间[6]。暂养时间对无水保活过程中虾夷扇贝存活率的影响如图1。随着保活时间的延长,各组虾夷扇贝的存活率均逐渐降低。然而,在同一保活时间下,暂养15 min的虾夷扇贝存活率明显高于其他组(P<0.05),在无水保活72 h时,存活率仍可达72.5%。对于未暂养的虾夷扇贝,由于泥沙和微生物未去除,导致无水保活后期细菌大量繁殖,60 h后存活率显著低于暂养15 min组(P<0.05)。短暂的暂养不仅可以缓解运输压力,减弱氧化应激反应,起到净化作用,而且还能减缓Glc的消耗[6]。暂养60 min的虾夷扇贝在无水保活过程中存活率迅速降低(图1),这是因为随着暂养时间的延长,虾夷扇贝在未进食的状态下为了维持基本的新陈代谢,Glc、脂质等营养物质直接被作为能源物质消耗。其次,受环境因素影响,虾夷扇贝在运输至实验室的过程中会受到一定的损伤,暂养越久,能量损耗越多,生命体征越弱。同时,暂养过程中一些对虾夷扇贝后期存活不利的微生物繁殖,暂养时间越长,微生物繁殖速度也加快,导致存活率降低[6-7]。张玉晗[8]研究发现:与暂养6 h相比,暂养12 h会加快花鲈鱼在无水保活过程中的细胞凋亡,对肝脏代谢水平和生命活力产生负面影响,导致存活率降低。本研究结果表明,与暂养30、60 min组相比,15 min的短暂暂养可以避免虾夷扇贝本身能量物质的消耗,有利于其后期的低温无水保活。因此,本研究确定优化暂养时间为15 min。
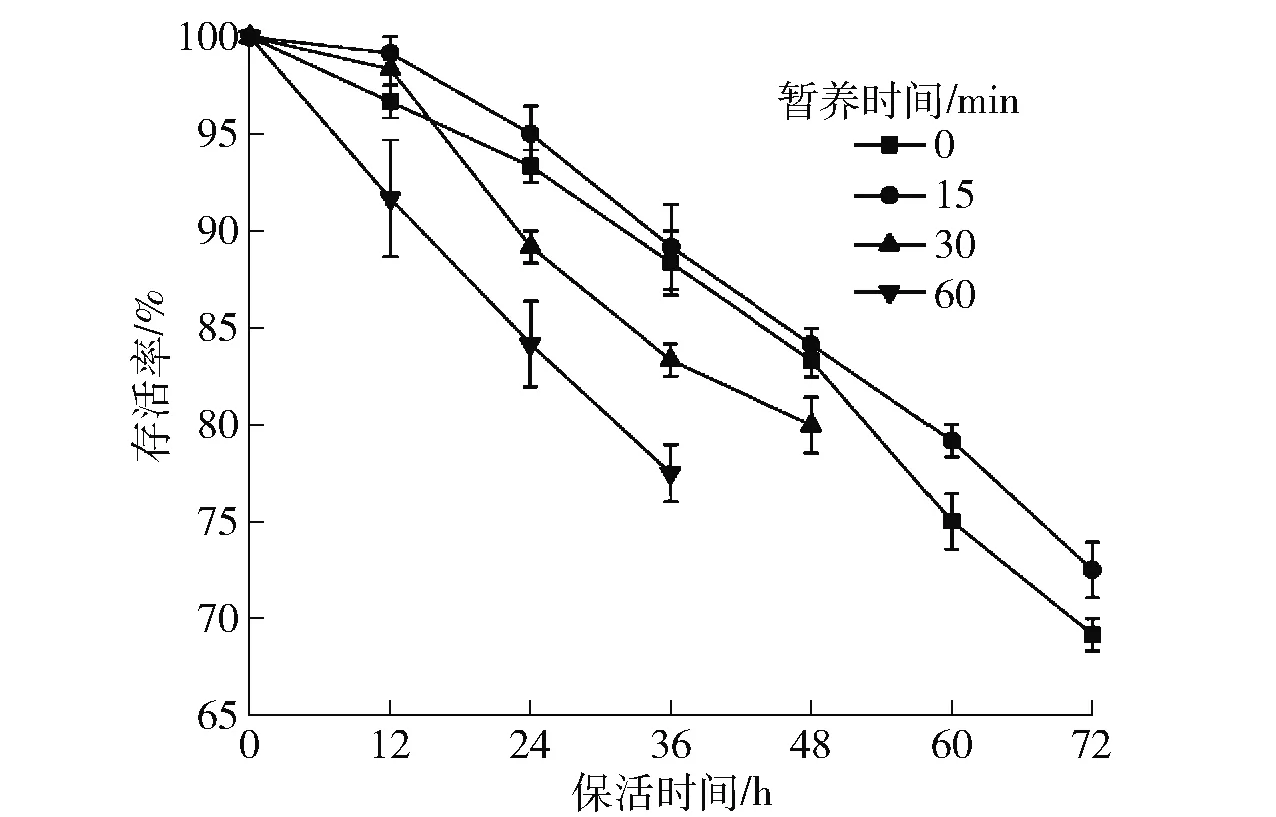
图1 暂养时间对虾夷扇贝存活率的影响Fig.1 Effect of temporary rearing time on survival rate of Patinopecten yessoensis
2.2 湿度对无水保活过程中虾夷扇贝存活率的影响
湿度是贝类无水保活技术中的关键因子,环境中湿度的变化会直接影响扇贝体内的水分含量,从而影响其代谢速率。湿度对无水保活过程中虾夷扇贝存活率的影响见图2。随着保活时间的增加,两组的存活率总体都呈下降趋势。无水保活72 h过程中,保湿组的存活率始终高于未保湿组,且2组扇贝在无水保活36 h时存活率差距达到最大值。因为贝类由暂养环境转入无水保活环境下,未保湿组脱离水环境,自身消耗和体内水分蒸发导致水分含量降低,同时未能得到及时补充,扇贝闭壳以保留水分,进而降低了氧气摄入,最终导致存活率下降[9]。无水保活60 h后,湿纱布水分挥发殆尽,2组存活率差异随之减小。已有研究表明:虾夷扇贝湿藏48 h时,存活率仍为100%,且Glc含量、pH值、三磷酸腺苷含量和核苷酸能荷值虽有所波动但总体趋于稳定,而干露处理的虾夷扇贝失重率增加,且48 h内全部死亡[10]。因此,在低温无水保活过程中,可采取一系列保湿措施来处理虾夷扇贝。
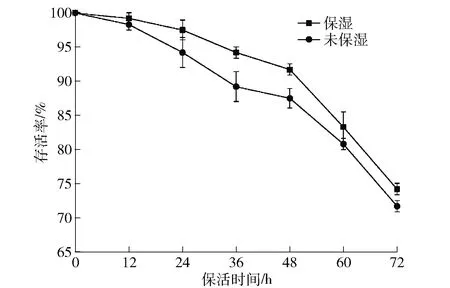
图2 湿度对虾夷扇贝存活率的影响Fig.2 Effect of humidity on survival rate of Patinopectenyessoensis
2.3 氧气对无水保活过程中虾夷扇贝存活率的影响
在水产品的无水保活过程中,氧气不足会导致组织缺氧产生应激胁迫,组织结构、耗氧率、呼吸代谢、个体行为以及免疫应答等多方面发生改变,影响机体各个系统发挥正常功能[11]。氧气对无水保活过程中虾夷扇贝存活率的影响如图3。在无水保活36 h前,未充氧组虾夷扇贝的存活率稍高于充氧组。保活初始阶段,环境中氧气浓度的升高使扇贝处于生命活动旺盛时期,促进其新陈代谢的同时,个体之间也会发生碰撞,导致机械损伤从而降低存活率。无水保活48 h后,充氧组虾夷扇贝的存活率显著高于未充氧组(P<0.05),这是因为袋中氧气逐渐消耗,未充氧组由于个体堆叠导致氧气不足,引起缺氧胁迫,使死亡率升高。已有研究发现:在-2、0、4 ℃条件下,充氧处理的海湾扇贝存活率均高于未充氧组,在保活8 d时其存活率依然达到100%[12]。因此,为了提高存活率,无水保活虾夷扇贝时充氧处理有明显优势。
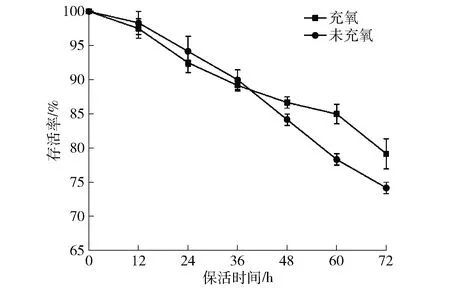
图3 氧气对虾夷扇贝存活率的影响Fig.3 Effect of oxygen on survival rate of Patinopectenyessoensis
2.4 温度对无水保活过程中虾夷扇贝存活率的影响
温度对无水保活过程中虾夷扇贝存活率的影响见图4。随着无水保活时间的延长,不同温度下虾夷扇贝的存活率均逐渐降低。在相同保活时间下,0 ℃保活组的存活率最高,无水保活96 h时仍可达到85%以上。随着温度的升高,虾夷扇贝的存活率逐渐降低。0 ℃接近虾夷扇贝的生态冰温,此时扇贝处于休眠或半休眠状态,代谢活动比较微弱,可以较长时间保持生命活力。曾鹏[13]研究表明:在生态冰温下储藏虾夷扇贝,可使其处于未死亡的休眠状态,最大限度地降低新陈代谢速度并维持活体状态,长期保持其原有的色、香、味和口感。而过高的环境温度会降低贝类的免疫反应,提高被病毒感染的可能性,增加贝类的死亡率[14]。高加龙等[15]在4、10、15 ℃这3个温度下保活香港牡蛎,发现4 ℃下存活率、菌落总数、营养物质均优于其他2个温度。不同物种的生态冰温范围各不相同,例如将保活温度从1 ℃降至0 ℃,鲫鱼无水保活时间得以延长[16];而环境温度低于10 ℃就会加速罗非鱼的死亡[17]。虾夷扇贝在-1 ℃无水保活24 h时,存活率降至84%(图4),说明温度过低会加剧虾夷扇贝的死亡速度,这是因为较低的环境温度会引起贝类机体的应激反应,为了适应环境温度,维持机体温度的正常水平,贝类会进行大量的产能活动,消耗机体内糖原等供能、储能物质,超过贝类生存的极限时,会造成贝类死亡[4]。因此,确定0 ℃为虾夷扇贝的优化无水保活温度。
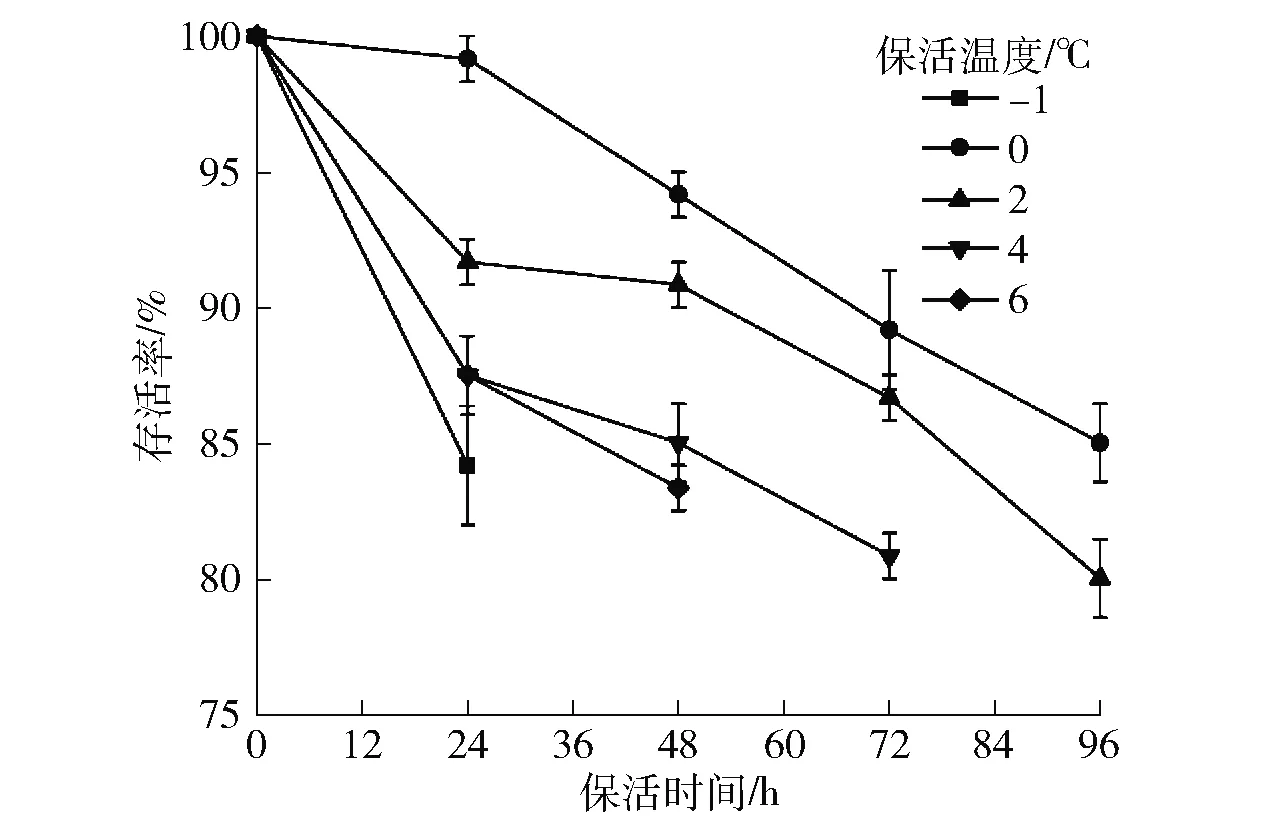
图4 温度对虾夷扇贝存活率的影响Fig.4 Effect of temperature on survival rate of Patinopecten yessoensis
2.5 低温无水保活对虾夷扇贝肌肉品质的影响
2.5.1对虾夷扇贝肌肉质构特性的影响
质构特性是反映水产品新鲜度的品质指标之一,其中,硬度表现为人体的触觉柔软或坚硬,是使虾夷扇贝肌肉组织保持形状的结合力;弹性反映了外力作用时的变形及去力后的回复程度;黏聚性是指肌肉组织的口感和可塑性;咀嚼性是指咀嚼固体食物所需的能量,新鲜的肌肉蛋白质及其水化层形成的网络结构较致密,咀嚼性较高[18]。扇贝在保活和复水过程中硬度、弹性、黏聚性和咀嚼性均有一定改变,结果如表1。随着无水保活时间的延长,硬度、弹性和咀嚼性均呈下降趋势,而黏聚性逐渐增加。复水后各项质构参数均有所恢复,然而,硬度、弹性和咀嚼性在复水8 h后仍显著低于保活前(P<0.05),黏聚性仍显著高于保活前(P<0.05),说明复水后虾夷扇贝的质构特性仍恢复不到初始水平。这可能是由于低温无水保活的虾夷扇贝长时间受到饥饿胁迫,脂质代谢机制发生改变,机体通过促进脂肪组织分解和抑制脂质合成的调控,利用自身的脂质提供能量,以维持正常的生命活动。未进食时间进一步延长,则会转变为依靠消耗肌肉中的蛋白质维持生存[19]。另外,肌肉中糖原分解为葡萄糖,葡萄糖继续分解为水和二氧化碳,使得肌肉中水分增加[20],也会导致虾夷扇贝肌肉的质构特性减弱。
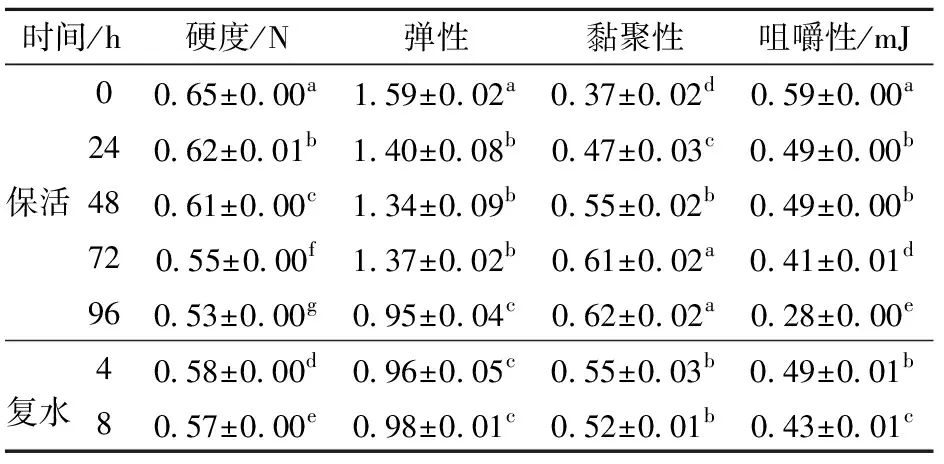
表1 低温无水保活对虾夷扇贝肌肉质构特性的影响Tab.1 Effect of waterless keep-alive at low temperature on muscle texture characteristics of Patinopecten yessoensis
2.5.2对虾夷扇贝肌肉LDH活性和Glc质量比的影响
在无水保活过程中,水产动物依靠自身代谢消耗能量维持正常生理功能,LDH是糖代谢中催化丙酮酸向乳酸转化的酶[21]。低温无水保活对虾夷扇贝肌肉LDH活性的影响见图5,随着保活时间的延长,扇贝肌肉中LDH活性显著上升(P<0.05),尤其在保活后期,96 h时LDH活性比72 h时增加了80.8%。这是因为到无水保活后期,袋中氧气不足,虾夷扇贝主要进行无氧代谢,低氧胁迫下导致LDH活性升高[22]。复水后扇贝肌肉中LDH活性迅速下降,与无水保活96 h时相比,复水4 h时LDH活性下降了83.2%。复水后环境中氧气含量增加,呼吸代谢转变为有氧呼吸,导致LDH活性降低。
Glc是双壳贝类体内主要的能源物质,在摄入的食物无法供应机体能量需求时,Glc会被分解,维持贝体正常新陈代谢。低温无水保活对虾夷扇贝肌肉Glc质量比的影响见图5,与保活前相比,低温无水保活过程中虾夷扇贝肌肉中Glc质量比显著降低(P<0.05)。扇贝在无水保活前期,Glc作为首要供能物质被大量消耗,后期Glc不足,脂肪和蛋白质接替Glc供能,导致肌肉的质构特性变差(表1)。复水后扇贝肌肉中Glc质量比显著升高(P<0.05),这可能是因为复水后大量乳酸在线粒体中发生糖异生反应生成葡萄糖,平衡机体糖原水平从而使Glc质量比升高。丁晨雨[23]在利用二氧化碳麻醉保活鲢鱼中发现,保活15 h时肝糖原含量大幅下降,复水后恢复到正常水平。
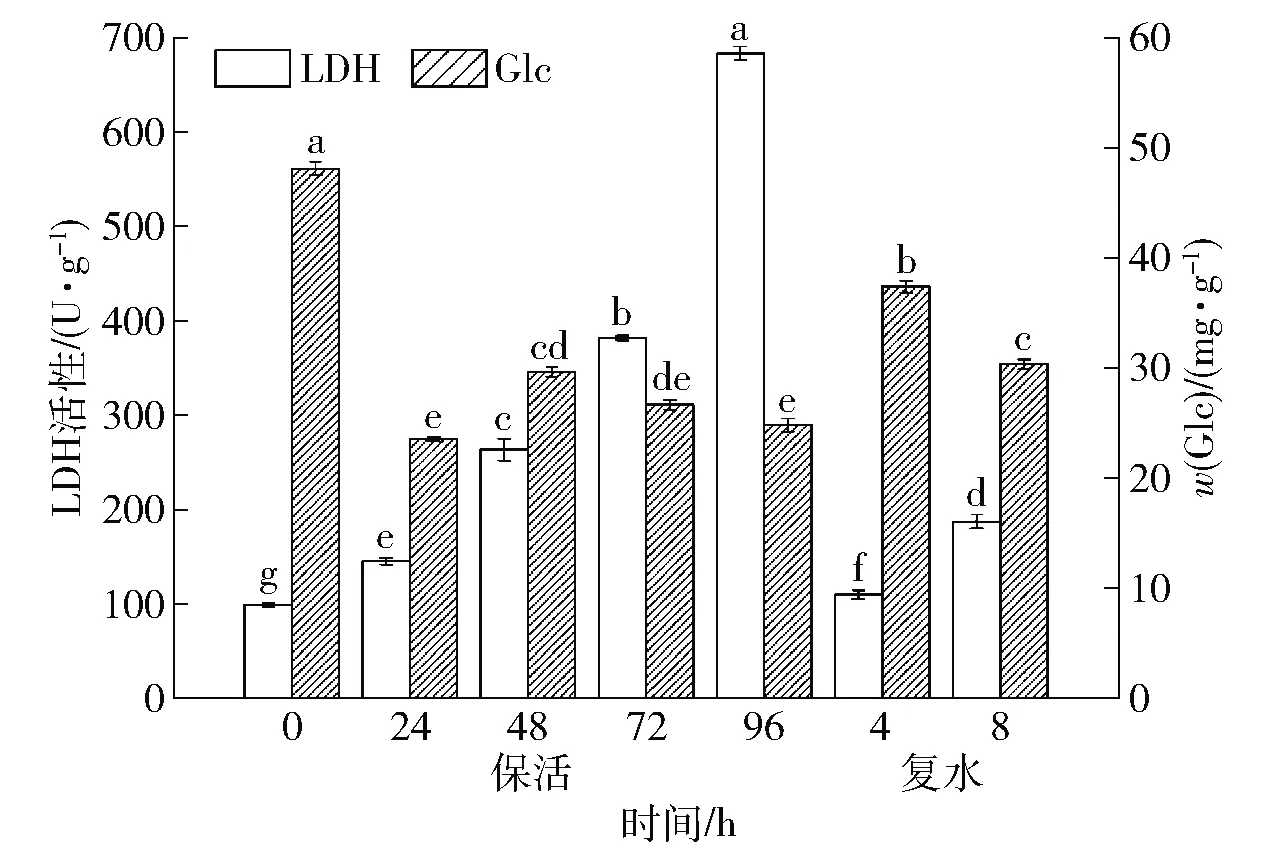
不同小写字母表示组间差异显著(P<0.05)。图5 低温无水保活后虾夷扇贝肌肉LDH活性和 Glc质量比的变化Fig.5 Changes of LDH activity and Glc mass ratio in muscle of Patinopecten yessoensis after waterless keep-alive at low temperature
2.6 低温无水保活对虾夷扇贝肝脏生化特性的影响
2.6.1对虾夷扇贝肝脏SOD和CAT活性的影响
SOD和CAT是肝脏中的免疫相关酶,维持着虾夷扇贝免疫系统的稳定。低温无水保活对虾夷扇贝肝脏SOD和CAT活性的影响见图6。SOD在机体的氧化与抗氧化平衡中起着至关重要的作用,能清除超氧阴离子自由基,使细胞免受损伤。当扇贝受到环境胁迫时,SOD活性的变化在一定程度上可反映机体免疫机能的变化。随着低温无水保活时间的延长,虾夷扇贝肝脏中SOD活性显著上升(P<0.05)。复水后,SOD活性迅速降低,与保活24 h和48 h时无显著性差异(P>0.05),但仍显著高于保活前(P<0.05)。低温逆境导致机体中的超氧阴离子自由基大量增加,免疫系统被激活,机体通过生成大量的SOD来维持抗氧化系统的稳定。然而,随着保活时间的延长,扇贝耗氧量增加,机体自由基代谢紊乱,自由基在体内大量积累,从而损害机体细胞和组织正常的生理机能和免疫防御能力,进而提高对病原微生物的易感性[24]。Wang等[25]研究发现栉孔扇贝在遇到高温胁迫时,体内出现免疫应答,血清中的SOD活性迅速上升。日本囊对虾经历无水胁迫后重新置于海水中,SOD等抗氧化酶活性降低到正常水平,说明抗氧化防御系统经历一定程度的氧化应激后可以恢复[26]。Christophersen等[27]研究表明:贝类在保活后免疫系统的恢复能力会随保活时间的延长而降低,在长时间应急胁迫下复水后的扇贝SOD活力无法恢复到新鲜水平。
内源性抗氧化系统在保护细胞免受氧化应激中发挥重要作用,CAT可将过氧化氢转化成分子氧和水,从而降低过氧化氢在体内的含量,使细胞免受过氧化氢的毒害[28]。由图6可知,无水保活24 h时扇贝肝脏中CAT活性与保活前无显著性差异(P>0.05);随着保活时间的继续延长,CAT活性显著上升(P<0.05),复水后又迅速下降。无水保活过程中SOD活性的升高导致机体产生大量的过氧化氢,从而激活CAT,以清除过氧化氢和由脂质氧化产生的氢过氧化物[29]。这与本研究结果中CAT和SOD活性的变化趋势也是一致的。Xu等[30]研究发现:当环境条件恶化时,南美白对虾体内CAT活性升高,环境得到改善后,机体逐渐适应并得到恢复,这与本实验研究结果一致。
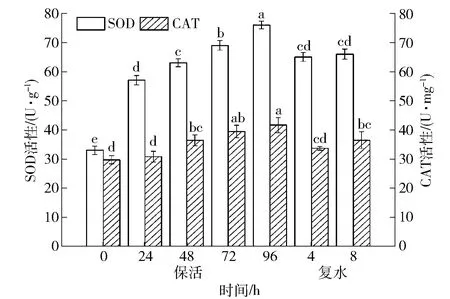
不同小写字母表示组间差异显著(P<0.05)。图6 低温无水保活后虾夷扇贝肝脏SOD和CAT 活性的变化Fig.6 Changes of SOD and CAT activities in liver of Patinopecten yessoensis after waterless keep-alive at low temperature
2.6.2对虾夷扇贝肝脏LZM活性的影响
LZM是贝类非特异性免疫系统中重要的免疫酶之一,是评价贝类生理和免疫状况的重要指标,当虾夷扇贝在保活过程中受到环境胁迫时,自身会通过调节LZM活性来应对环境变化下的免疫功能弱化。低温无水保活对虾夷扇贝肝脏LZM活性的影响见图7。低温无水保活条件下,扇贝肝脏LZM活性显著升高(P<0.05),无水保活96 h时达到最大值,复水后扇贝LZM活性迅速降低至与保活24 h时无显著性差异的水平(P>0.05),但仍显著高于保活前(P<0.05)。环境胁迫会使虾夷扇贝发生氧化应激反应,促使肝脏中SOD、CAT应激酶活性升高,为了维持免疫系统的稳定,LZM发挥了重大功能,其在低温无水保活过程中和复水后的变化趋势与肝脏SOD和CAT的活性变化相同(图6、图7)。由于包装内环境中微生物的变化,保活过程中LZM活性增强有利于保护水产动物免受病原体侵害[31]。复水后虾夷扇贝体内各免疫机制得以恢复,LZM作为细菌抑制剂,其活性随活性氧含量减少而降低,长时间的应激反应超过LZM耐受限度导致活力恢复不到新鲜水平[32]。
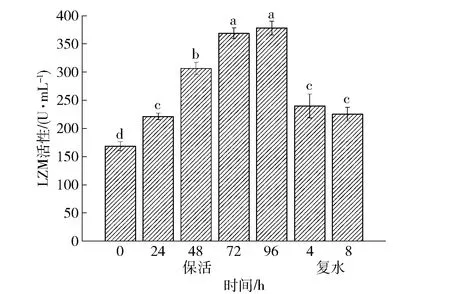
不同小写字母表示组间差异显著(P<0.05)。图7 低温无水保活后虾夷扇贝肝脏LZM活性的变化Fig.7 Changes of LZM activity in liver of Patinopectenyessoensis after waterless keep-alive at low temperature
2.6.3对虾夷扇贝肝脏GOT和GPT活性的影响
GOT和GPT是动物体内重要的氨基酸转移酶,其活性高低是判定肝脏是否受损的重要指标。当肝脏中毒或产生炎症时,GOT和GPT活性迅速增加[33]。低温无水保活对虾夷扇贝肝脏GOT和GPT活性的影响如图8。随着无水保活时间的延长,GOT和GPT活性均逐渐升高,保活96 h时达到最大值。复水后GOT活性恢复到与保活前扇贝无显著性差异的水平(P>0.05)。复水4 h时扇贝肝脏GPT活性与保活24 h时的无显著性差异(P>0.05),复水8 h时GPT活性又显著上升(P<0.05),但与保活48 h时的无显著性差异(P>0.05)。
随着保活时间的延长,扇贝有氧代谢强度降低,体内蛋白质发生变性,这可能也是无水保活96 h时虾夷扇贝存活率迅速降低的原因之一。保活后期扇贝肝细胞受到损伤,组织代谢和免疫功能受到短暂性的紊乱,GOT和GPT被大量释放[34]。复水后抗氧化系统大量清除保活过程中产生的自由基,使得损伤和紊乱快速的恢复,不会对扇贝造成不可逆转的影响。然而,随着复水时间的延长,扇贝代谢强度增加导致水质逐渐恶化,水中又未进行充氧处理,使扇贝再次受到环境胁迫,肝细胞受损[35]。
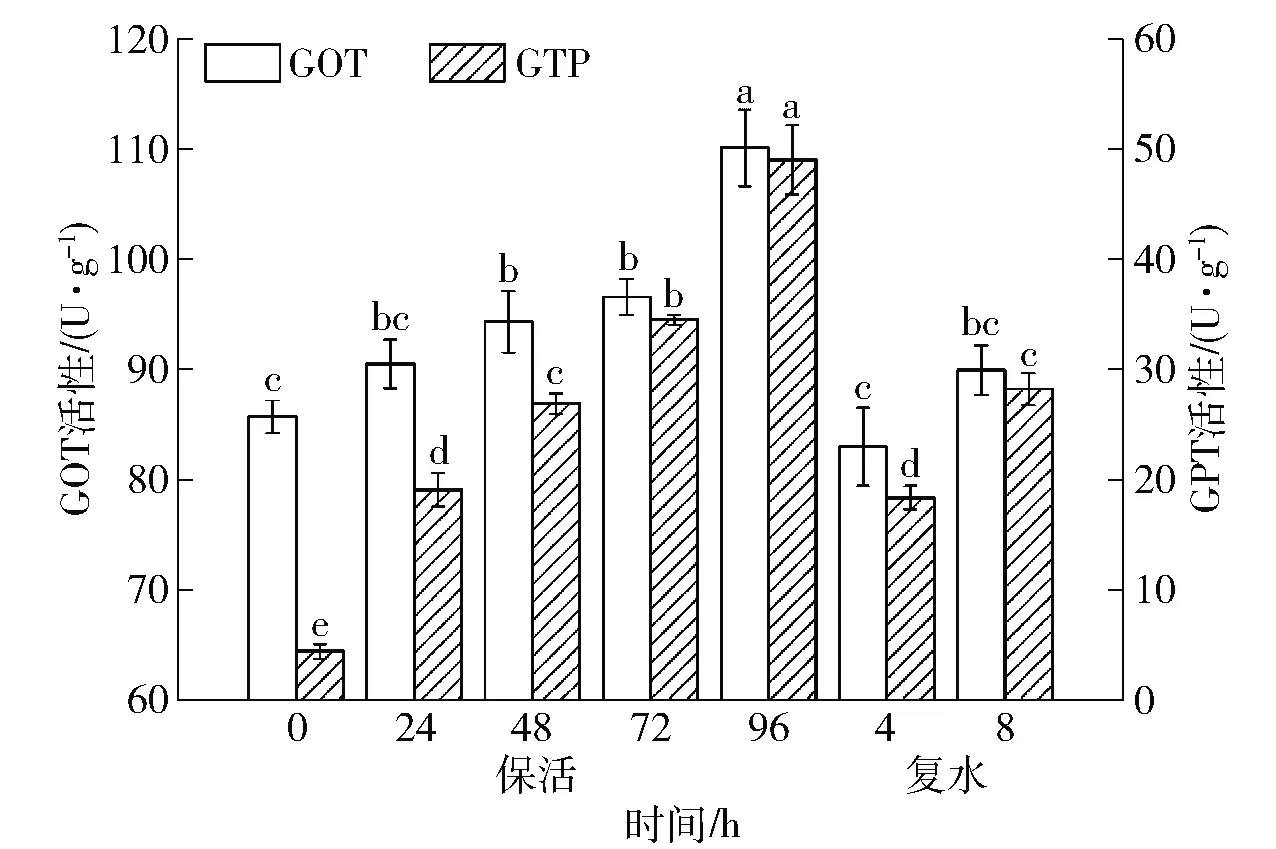
不同小写字母表示组间差异显著(P<0.05)。图8 低温无水保活后虾夷扇贝肝脏GOT和GPT 活性的变化Fig.8 Changes of GOT and GPT activities in liver of Patinopecten yessoensis after waterless keep-alive at low temperature
3 结 论
虾夷扇贝的优化低温无水保活条件为暂养时间15 min、保湿、充氧、保活温度0 ℃,在此条件下无水保活96 h时存活率仍可达85%。随着无水保活时间的延长,扇贝肌肉的硬度、弹性和咀嚼性均呈下降趋势,而黏聚性逐渐增加,复水后各项质构参数均有所恢复。扇贝肌肉中LDH活性逐渐升高,Glc质量比显著降低,复水后又转回有氧呼吸。无水保活过程中扇贝体内自由基代谢发生紊乱,免疫力降低但并未造成不可逆转的损伤。肝脏中的SOD、CAT、GOT、GPT和LZM活性在无水保活过程中显著上升,复水后迅速降低。无水保活状态下,扇贝由有氧呼吸逐渐转变为无氧呼吸。因此,可采用低温、保湿、充氧的方式对虾夷扇贝进行无水保活,保活过程对扇贝肌肉和肝脏造成了一定的损伤,但复水后均有所恢复,仍可保持鲜活虾夷扇贝的品质。本研究分析了虾夷扇贝在低温无水保活过程中肌肉品质和肝脏生化指标的变化,后续将研制相应品质指标和生化指标检测的传感器,旨在为监测和控制无水保活运输过程中贝类品质提供理论基础,从而完善和优化无水保活运输技术。

